La monitorización terapéutica de metotrexato (MTX) es una práctica indicada en el seguimiento del tratamiento de la leucemia linfoblástica aguda para ajustar las dosis de rescate con leucovorina y evitar toxicidad. El objetivo de nuestro trabajo fue evaluar el desempeño de un método bioanalítico por cromatografía líquida en el control de tratamientos pediátricos de leucemia linfoblástica aguda.
Materiales y métodosSe analizó la evolución de la concentración plasmática del fármaco en 61 pacientes, divididos en 2 grupos según el tipo de tratamiento con MTX: infusión de 24h e infusión de 36h. Alícuotas de 250μL de plasma pretratado se analizaron utilizando un método analítico validado, en un cromatógrafo Agilent 1260 con una columna Zorbax Eclipse XDB-C18 (4,6×150mm, 5μm) y fase móvil compuesta por acetonitrilo y solución reguladora de acetato de sodio 0,05mol/L a pH 3,5. La detección se efectuó a 305nm.
ResultadosEl método no presentó interferencias por metabolitos ni otros fármacos. El límite inferior de cuantificación fue de 0,05μmol/L, la precisión y la exactitud inter e intraensayo fueron aceptables en el rango (0,05-5,0μmol/L), verificándose un comportamiento lineal. El 29,4% de los pacientes con infusión de 24h y el 60% de aquellos con infusión de 36h presentaron niveles plasmáticos tóxicos de MTX, por lo que debieron adelantarse y/o reforzarse los rescates con leucovorina.
ConclusionesEl método cromatográfico resultó eficiente y accesible para la monitorización terapéutica de MTX en pacientes pediátricos, permitiendo la toma de decisiones médicas pertinentes en un corto tiempo de análisis.
Therapeutic drug monitoring of methotrexate (MTX) is a practice used during acute lymphoblastic leukaemias treatments in order to adjust the leucovorin rescue dose and avoid toxicity. The aim of this work was to evaluate the performance of a bioanalytical method based on liquid chromatography in the control of paediatric acute lymphoblastic leukaemia treatments.
Materials and methodsMTX plasma concentrations were evaluated in a total of 61 patients, divided in 2 groups according to the treatment: 24h infusion and 36h infusion. The method used 250μL aliquots of pre-processed plasma, using a validated analytical method, in an Agilent 1260 chromatograph with a 5μm Zorbax Eclipse XDB-C18 column (4.6×150mm) and a mobile phase composed of acetonitrile and 0.05mol/L of a sodium acetate buffer solution at pH 3.5. The detection was performed at 305nm.
ResultsThe method did not show interferences by metabolites or other drugs. The lower limit of quantitation was 0.05μmol/L. Inter- and intra-assay precision and accuracy were acceptable in the working range (0.05-5.0μmol/L), and linear behaviour was observed. Toxic plasma levels of MTX were observed in 29.4% and 60% of the patients from 24h infusion and 36h infusion, respectively. Therefore, leucovorin rescue treatment was either applied earlier or reinforced.
ConclusionsThe chromatography method was efficient and accessible for the therapeutic drug monitoring of MTX in paediatric patients, allowing appropriate medical decision making within a short time of analysis.
La leucemia linfoblástica aguda (LLA) es una enfermedad neoplásica que resulta de una proliferación clonal de precursores linfoides que infiltran la médula ósea. Puede comprometer diferentes órganos y sistemas y causa la muerte por hemorragia y/o infección. Es la enfermedad oncológica más frecuente en niños, representando más del 29% de los casos de cáncer en edad pediátrica, con un pico de incidencia entre los 2 y los 5 años1,2. En Argentina, entre los años 2000 y 2013 se registró un promedio de 377 casos al año en menores de 15 años, según el Registro Oncopediátrico Hospitalario Argentino3.
Esquema terapéuticoLos esquemas terapéuticos utilizados en el tratamiento de LLA pediátrica en Argentina están representados en los protocolos del Grupo Argentino de Tratamiento de la Leucemia Aguda, basados en el International BFM Study Group4.
Los pacientes son tratados de acuerdo con el grupo de riesgo al que pertenezcan: riesgo estándar, riesgo intermedio y riesgo alto, definidos según criterios tales como edad, linaje celular comprometido, respuesta inicial al tratamiento y características clínico-biológicas.
Generalmente, el tratamiento abarca 24 meses y comprende 3 fases: inducción, consolidación y mantenimiento. Consiste básicamente en una quimioterapia multifármaco, que incluye principalmente corticoides (prednisona, dexametasona) y antineoplásicos combinados (ciclofosfamida, metotrexato [MTX], citarabina, mercaptopurina, tioguanina, doxorrubicina, daunorrubicina, vincristina, asparaginasa), en dosis definidas en los protocolos según el grupo de riesgo al que pertenezca el paciente; pero puede incluir, además, otros medicamentos que se administran en casos de alteraciones metabólicas, infecciones u otras complicaciones5–7.
MetotrexatoEl MTX es un fármaco citotóxico que se administra para el tratamiento quimioterápico de numerosas neoplasias, entre ellas la LLA. Es administrado por vía intratecal en bajas dosis (<1g/m2), y por infusión venosa en dosis intermedias (2g/m2) o altas (5g/m2), según el riesgo del paciente y la fase del protocolo del tratamiento.
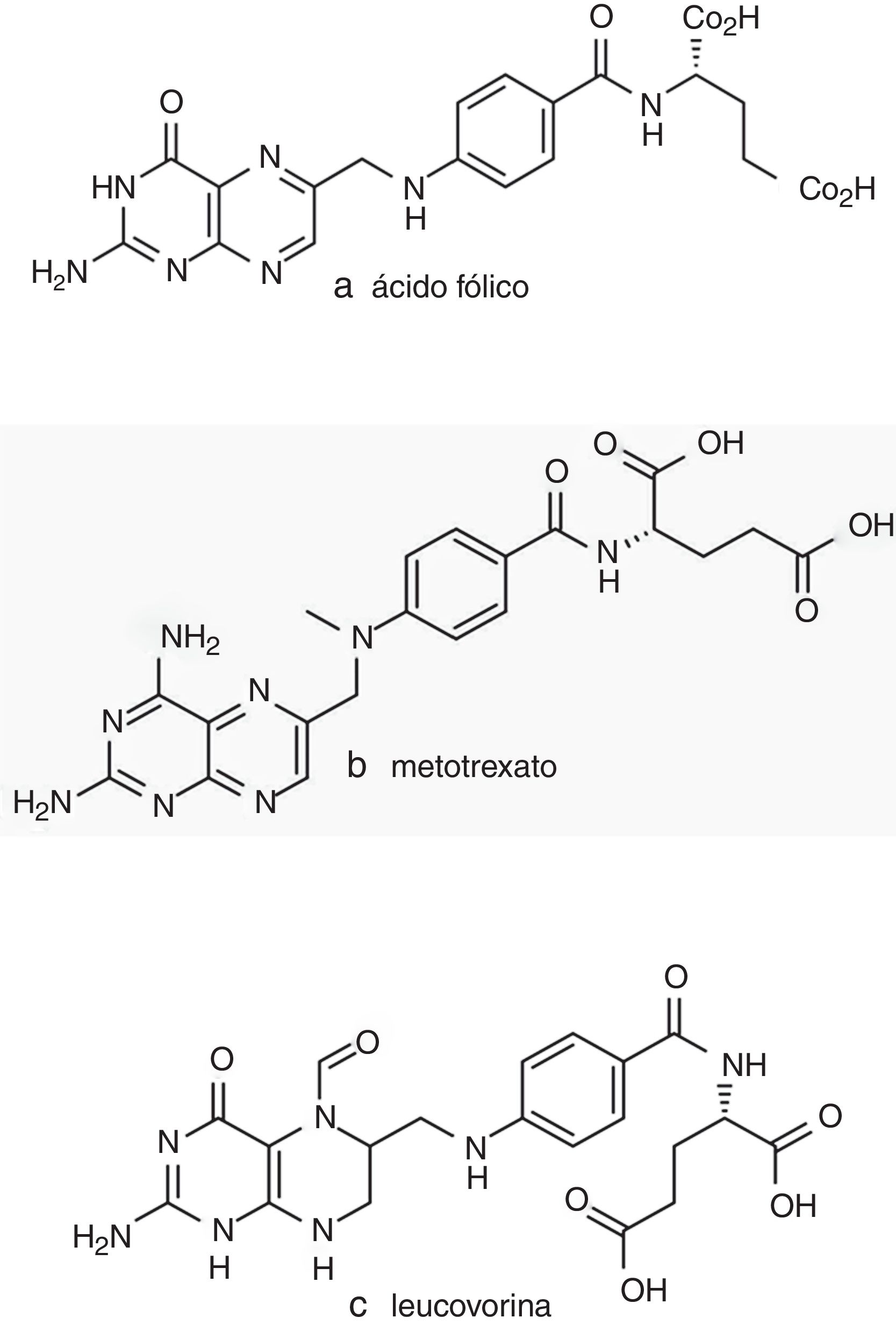
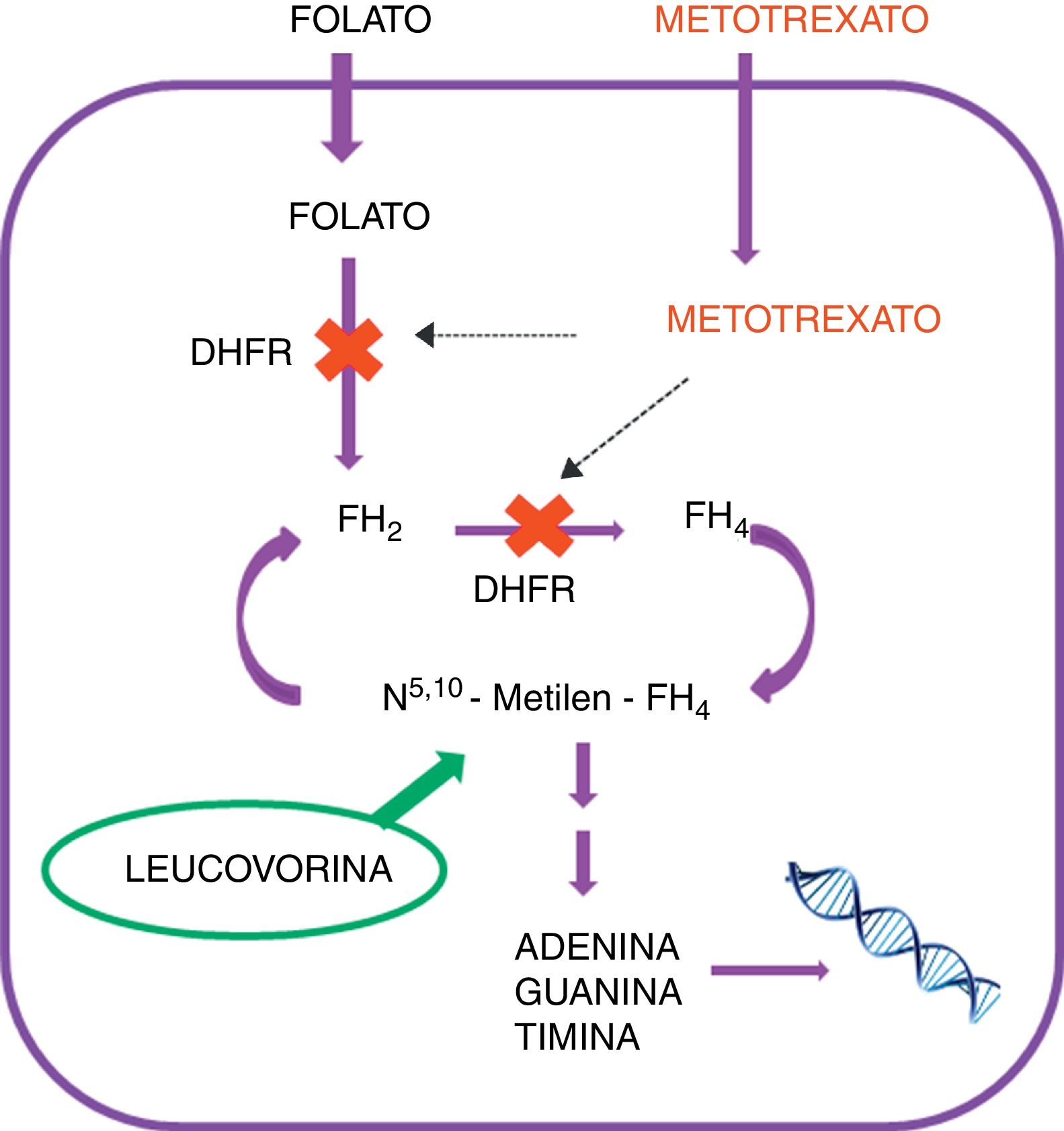
Estructuralmente es un análogo del ácido fólico (fig. 1). Actúa como fármaco antifolínico inhibiendo competitivamente la acción de la dihidrofolato reductasa (DHFR), enzima involucrada en el metabolismo del ácido fólico. En la célula, el ácido fólico es reducido a dihidrofolato (FH2) y este es convertido, por acción de la DHFR, en tetrahidrofolato (FH4), molécula clave en la síntesis de novo de purinas y de timidina. El MTX inhibe la acción de la DHFR, causando una depleción en los niveles de FH4, por lo que se detiene la síntesis de purinas. Esto desencadena un efecto antiproliferativo al bloquear la síntesis de ADN y ARN en la célula8,9. Dado que inhibe esta función celular clave, el MTX ejerce su actividad citotóxica no solo en las células neoplásicas, sino también en otros tejidos sanos, lo que puede provocar depresión medular y alteraciones gastrointestinales severas. Para evitar la toxicidad en células sanas producida por niveles altos de MTX prolongados en el tiempo, se requiere de una estrategia de rescate con otro derivado del ácido fólico, el ácido folínico (fig. 1) o leucovorina (LCV). Este fármaco se administra en tiempos y dosis programadas luego de la infusión intravenosa con MTX. La LCV presenta la misma función metabólica que el ácido fólico, pero a diferencia de este, no requiere de la acción de la enzima DHFR para su reducción, por lo que su función no es afectada por la inhibición ejercida por el MTX (fig. 2)10,11.
Sin embargo, para ser efectivo el MTX necesita mantener niveles terapéuticos en sangre durante un tiempo determinado. Si se comienza el rescate con LCV antes de lo previsto, o a dosis inadecuadamente altas, se contrarresta el efecto antileucémico del MTX, aumentando el riesgo de recaídas. Por otra parte, un retraso en la administración de LCV, o una dosis o un número de administraciones insuficientes, ocasionaría una exposición de las células sanas a niveles tóxicos de MTX durante un tiempo prolongado, lo que podría producir toxicidades importantes y, en ocasiones, irreversibles10.
La principal vía metabólica que permite la eliminación del MTX del organismo es la formación de 7-hidroxi-metotrexato en el hígado. Otra vía de detoxificación natural es la transformación del MTX en ácido 2,4-diamino-N-metilpteroico (DAMPA) por la flora bacteriana intestinal8. Estos metabolitos limitan el efecto citotóxico del fármaco, ya que son mucho menos efectivos en la inhibición de la DHFR. Se ha demostrado que la capacidad de metabolizar y eliminar el MTX es muy variable entre pacientes y depende de múltiples factores, tales como la capacidad de excreción renal, interacciones con fármacos concomitantes, factores genéticos, entre otros12. En algunos pacientes la metabolización es extremadamente lenta, causando nefrotoxicidad. En estos casos la terapia de rescate adicional consiste en administrar carboxipeptidasa G2 (CPDG2), un fármaco que actúa degradando el MTX muy rápidamente a DAMPA13.
Por los motivos expuestos, es sumamente necesario, entonces, realizar al paciente una rigurosa monitorización de la concentración plasmática de MTX durante el tratamiento, permitiendo de este modo un adecuado ajuste personalizado de los rescates rutinarios con LCV y con CPDG2 en los casos particulares14,15.
Monitorización terapéuticaSe han desarrollado numerosos métodos para la determinación de MTX en plasma humano. Por un lado, están los basados en técnicas bioanalíticas que utilizan anticuerpos, tales como radioinmunoanálisis e inmunoanálisis de polarización fluorescente. Estas técnicas son simples y rápidas; sin embargo, poseen una baja especificidad debido a reacciones cruzadas de los anticuerpos, generando a veces una sobreestimación de la concentración de MTX16. Esta falta de especificidad es particularmente problemática en los casos en los que ha debido usarse rescate con CPDG2, ya que las altas concentraciones de DAMPA generadas producen interferencias muy significativas13,17.
Por otro lado, dentro de las técnicas separativas, la cromatografía líquida de alto rendimiento con detector ultravioleta puede ser utilizada para la determinación de MTX con propósitos clínicos, ya que es simple, rápida, de bajo costo y altamente específica. Estas cualidades son imprescindibles en un método bioanalítico aplicado a la monitorización terapéutica de fármacos.
Algunas estrategias basadas en esta técnica han sido publicadas en los últimos años. Las mismas se caracterizan por el uso de un estándar interno y diferentes pretratamientos de muestra, tales como la desproteinización con nitrato de plata18 y la costosa extracción en fase sólida19. En ninguno de estos 2 métodos se demuestra la separación del MTX de sus metabolitos, llamando la atención la no detección del 7-hidroxi-metotrexato.
El objetivo de este trabajo fue desarrollar un método cromatográfico sencillo para la cuantificación de MTX en plasma, validarlo siguiendo guías de la Agencia Europea del Medicamento y analizar la importancia de su aplicación clínica en pacientes pediátricos con LLA en un período de varios años.
Materiales y métodosLos ensayos para el desarrollo y la validación del método cromatográfico para la determinación de MTX, así como las determinaciones analíticas realizadas a las muestras de los pacientes en tratamiento, tuvieron lugar en el Laboratorio de Control de Calidad de Medicamentos de la Facultad de Bioquímica y Ciencias Biológicas de la Universidad Nacional del Litoral. Las muestras sanguíneas de los pacientes fueron obtenidas por personal médico de los centros de salud, siguiendo los protocolos aprobados por los respectivos comités de ética de cada institución particular. Para cada determinación se obtuvo alrededor de 1mL de sangre por punción venosa con una jeringa heparinizada. Esta se refrigeró y se remitió al Laboratorio de Control de Calidad de Medicamentos en el plazo de una hora desde la extracción.
Estándares y reactivosEl MTX como sal disódica fue obtenido de Microsules (Buenos Aires, Argentina). El acetonitrilo grado cromatográfico (ACN) fue suministrado por Sintorgan (Buenos Aires, Argentina); el ácido acético glacial p. a., por Anedra (Buenos Aires, Argentina), el cloroformo p. a., por Cicarelli (San Lorenzo, Argentina), el acetato de sodio trihidrato, por Biopack (Buenos Aires, Argentina), el hidróxido de sodio, por Anedra (Buenos Aires, Argentina) y el agua ultrapura fue obtenida a través de un sistema de purificación Simplicity de Millipore (Milford, EE. UU.).Para el ensayo de interferencia por medicación concomitante se utilizaron diversas presentaciones comerciales de los siguientes fármacos: vincristina, mercaptopurina, LCV, dexametasona, clindamicina, ácido tranexámico, ondansetrón, piperacilina/tazobactam, vancomicina, ampicilina, imatinib, prednisona, ranitidina, daunorrubicina, doxorrubicina, citarabina, anfotericina B y ácido fólico.
Soluciones estándarLa solución estándar stock de MTX se preparó en agua ultrapura en una concentración de 1.250μmol/L. A partir de esta solución se obtuvieron diferentes soluciones estándar intermedias en concentraciones convenientes, por dilución en agua ultrapura.
Muestras, calibradores y muestras controlComo matriz biológica para la preparación de los calibradores y las muestras control se utilizó plasma blanco, constituido por un pool de plasma heparinizado de un grupo sano, libre de fármacos, que fue proporcionado por el Hospital J. M. Iturraspe de la ciudad de Santa Fe (Argentina). Dicho plasma se analizó previamente para comprobar la ausencia de picos de sustancias endógenas interferentes en el análisis cromatográfico.
Los plasmas de los pacientes en tratamiento se obtuvieron en el momento de recibir la muestra, por centrifugación de la sangre heparinizada durante 10min a 2.000rpm.
Los calibradores y las muestras control se obtuvieron por adición de cantidades conocidas de soluciones estándar al plasma blanco.
El pretratamiento de muestras y calibradores se basó en una desproteinización con ACN y reextracción de parte del solvente orgánico y de los lípidos del plasma con cloroformo. Para esto, una alícuota de 250μL de plasma se trasvasó a un tubo Eppendorf y se le agregaron 500μL de ACN, se centrifugó durante 2min a 6.000rpm para separar las proteínas precipitadas y 600μL del sobrenadante se transfirieron a un nuevo tubo Eppendorf. Para la reextracción se adicionaron 600μL de cloroformo, se agitó en vórtex durante 30s y se centrifugó nuevamente para separar las fases. Finalmente, 150μL de la fase acuosa conteniendo el MTX se transfirieron a un vial con inserto de bajo volumen para su inyección en el cromatógrafo.
Instrumentación y condiciones cromatográficasEl sistema cromatográfico utilizado está conformado por una bomba cuaternaria, un inyector automático, un horno de columna y un detector de absorbancia ultravioleta/visible con arreglo de diodos (modelo Agilent 1260). El sistema de adquisición y procesamiento de datos fue el Open Lab (Agilent Technologies).
La separación se realizó a 25°C utilizando una columna Zorbax Eclipse XDB-C18 (4,6×150mm, 5μm, Agilent) y un guardacolumna Zorbax XDB C18 (4×4mm, 5μm, Agilent). La fase móvil estaba compuesta de ACN y una solución reguladora de acetato de sodio 0,05mol/L pH 3,5; y se utilizó un programa de elución en gradiente. El flujo fue de 1,5mL/min y el tiempo total de análisis, de 10min. El MTX fue detectado a una longitud de onda de 305nm.
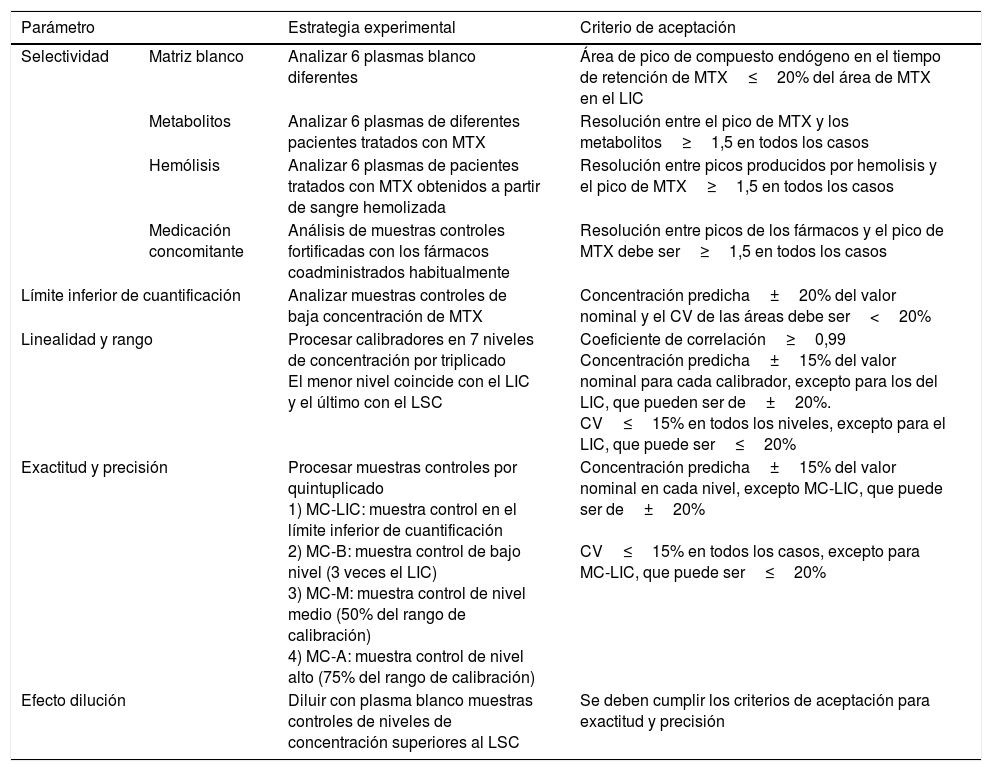
Validación del métodoPara realizar la validación del método se aplicaron las estrategias y se siguieron los criterios de aceptación presentados en la tabla 1.
Estrategias experimentales y criterios de aceptación
| Parámetro | Estrategia experimental | Criterio de aceptación | |
|---|---|---|---|
| Selectividad | Matriz blanco | Analizar 6 plasmas blanco diferentes | Área de pico de compuesto endógeno en el tiempo de retención de MTX≤20% del área de MTX en el LIC |
| Metabolitos | Analizar 6 plasmas de diferentes pacientes tratados con MTX | Resolución entre el pico de MTX y los metabolitos≥1,5 en todos los casos | |
| Hemólisis | Analizar 6 plasmas de pacientes tratados con MTX obtenidos a partir de sangre hemolizada | Resolución entre picos producidos por hemolisis y el pico de MTX≥1,5 en todos los casos | |
| Medicación concomitante | Análisis de muestras controles fortificadas con los fármacos coadministrados habitualmente | Resolución entre picos de los fármacos y el pico de MTX debe ser≥1,5 en todos los casos | |
| Límite inferior de cuantificación | Analizar muestras controles de baja concentración de MTX | Concentración predicha±20% del valor nominal y el CV de las áreas debe ser<20% | |
| Linealidad y rango | Procesar calibradores en 7 niveles de concentración por triplicado El menor nivel coincide con el LIC y el último con el LSC | Coeficiente de correlación≥0,99 Concentración predicha±15% del valor nominal para cada calibrador, excepto para los del LIC, que pueden ser de±20%. CV≤15% en todos los niveles, excepto para el LIC, que puede ser≤20% | |
| Exactitud y precisión | Procesar muestras controles por quintuplicado 1) MC-LIC: muestra control en el límite inferior de cuantificación 2) MC-B: muestra control de bajo nivel (3 veces el LIC) 3) MC-M: muestra control de nivel medio (50% del rango de calibración) 4) MC-A: muestra control de nivel alto (75% del rango de calibración) | Concentración predicha±15% del valor nominal en cada nivel, excepto MC-LIC, que puede ser de±20% CV≤15% en todos los casos, excepto para MC-LIC, que puede ser≤20% | |
| Efecto dilución | Diluir con plasma blanco muestras controles de niveles de concentración superiores al LSC | Se deben cumplir los criterios de aceptación para exactitud y precisión | |
CV: coeficiente de variación; LIC: límite inferior de cuantificación; LSC: límite superior de cuantificación; MC: muestra control; MTX: metotrexato.
Para evaluar la selectividad del método se estudiaron: i) plasmas libres de MTX procedentes de diferentes personas sanas para verificar la señal de los compuestos endógenos; ii) plasmas de personas en tratamiento para verificar la señal de los metabolitos; iii) plasmas obtenidos a partir de sangre entera hemolizadas por congelamiento y descongelamiento, y iv) las posibles interferencias producidas por la administración concomitante de diversos fármacos durante la quimioterapia. Para ello se fortificaron muestras controles con diferentes fármacos utilizados habitualmente de forma simultánea con MTX, se procesaron y se evaluaron las señales producidas.
El límite inferior de cuantificación se estableció mediante el análisis de plasma blanco fortificado con concentraciones pequeñas y crecientes de MTX para evaluar la precisión y la exactitud de los resultados obtenidos. El límite superior de cuantificación se estableció en 5,00μmol/L, para trabajar en un rango de concentraciones acotado que asegure linealidad en la respuesta.
El ensayo de linealidad se realizó mediante la construcción de una curva de calibrado de 7 niveles de concentración (0,05; 0,10; 0,25; 0,50; 1,00; 2,00; 5,00μmol/L), por triplicado cada uno de ellos.
Para los ensayos de exactitud y precisión se procesaron muestras controles en 4 niveles de concentración (0,05; 0,15; 2,50; 3,75μmol/L) y 5 réplicas por nivel, preparadas a partir de una solución estándar stock diferente a la utilizada para la curva de calibrado. Los ensayos se repitieron en 2 días diferentes para el estudio de exactitud y precisión interensayo. La precisión intra e interensayo se expresó como coeficiente de variación para cada muestra control y la exactitud como el porcentaje del valor predicho de concentración de MTX respecto al valor nominal. Por último, se evaluaron el efecto de la dilución sobre 3 muestras controles de concentraciones superiores al límite superior de cuantificación (12,5; 25,0; 62,5μmol/L) y la estabilidad en el tiempo de la solución stock de MTX.
Monitorización en pacientesSe realizó un análisis retrospectivo de la evolución de los niveles plasmáticos de MTX, medidos con el método validado, de 61 pacientes pediátricos con LLA tratados con MTX en centros de salud de la ciudad de Santa Fe (Argentina), en un período de 6 años (2011-2016).
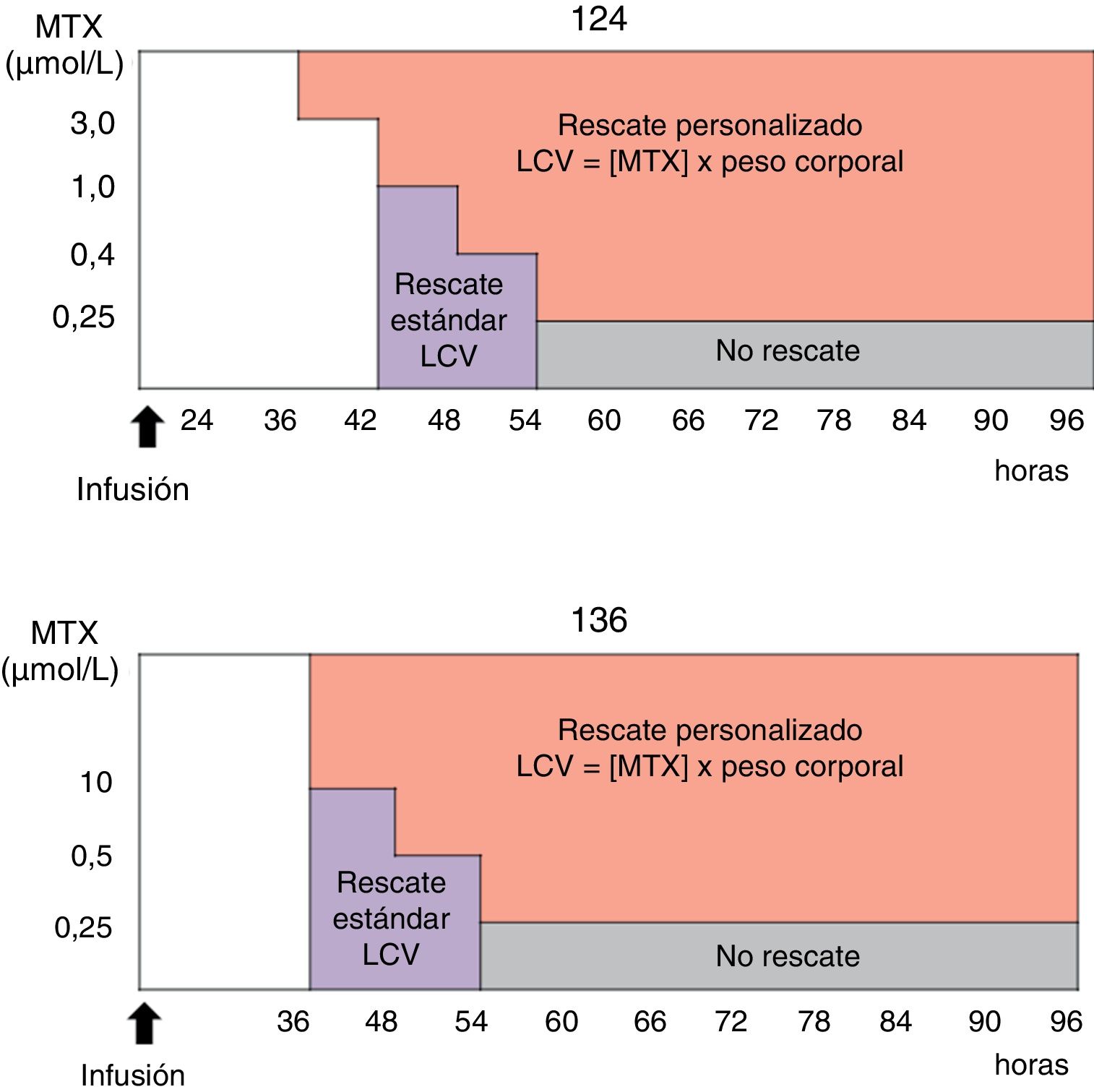
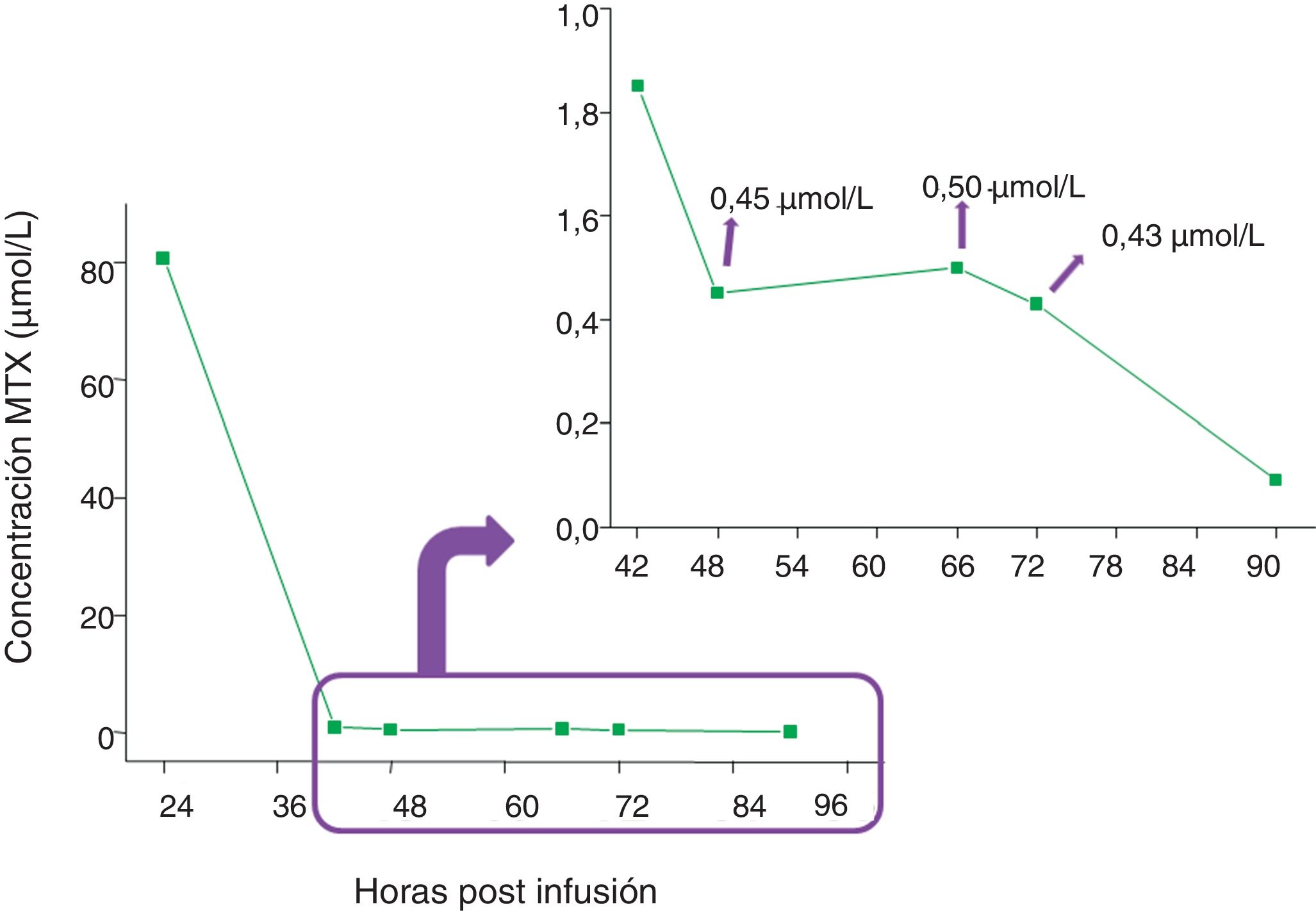
Los pacientes se clasificaron en 2 grupos según el tratamiento recibido. El primer grupo lo integraron los pacientes que recibieron MTX en 24h–I24–en dosis variables entre 2 y 8g/m2 y a los cuales se le realizaron dosajes a las 24, 42 y 48h de iniciada la infusión del fármaco. En el otro grupo se incluyeron aquellos pacientes con recaída de LLA que recibieron infusión de MTX en 36h–I36–a dosis de 1g/m2, a los cuales se les realizaron dosajes a las 36 y 48h tras el comienzo de la infusión. En los casos necesarios se continuó la monitorización cada 6h hasta alcanzar el nivel de corte de 0,25μmol/L. En la figura 3 se esquematizan los protocolos de rescate personalizado con LCV seguidos por el personal médico a cargo del paciente. Como se observa, la dosis de LCV administrada dependió de la concentración plasmática de MTX hallada en función del tiempo transcurrido a partir del inicio de la infusión y del peso corporal del paciente.
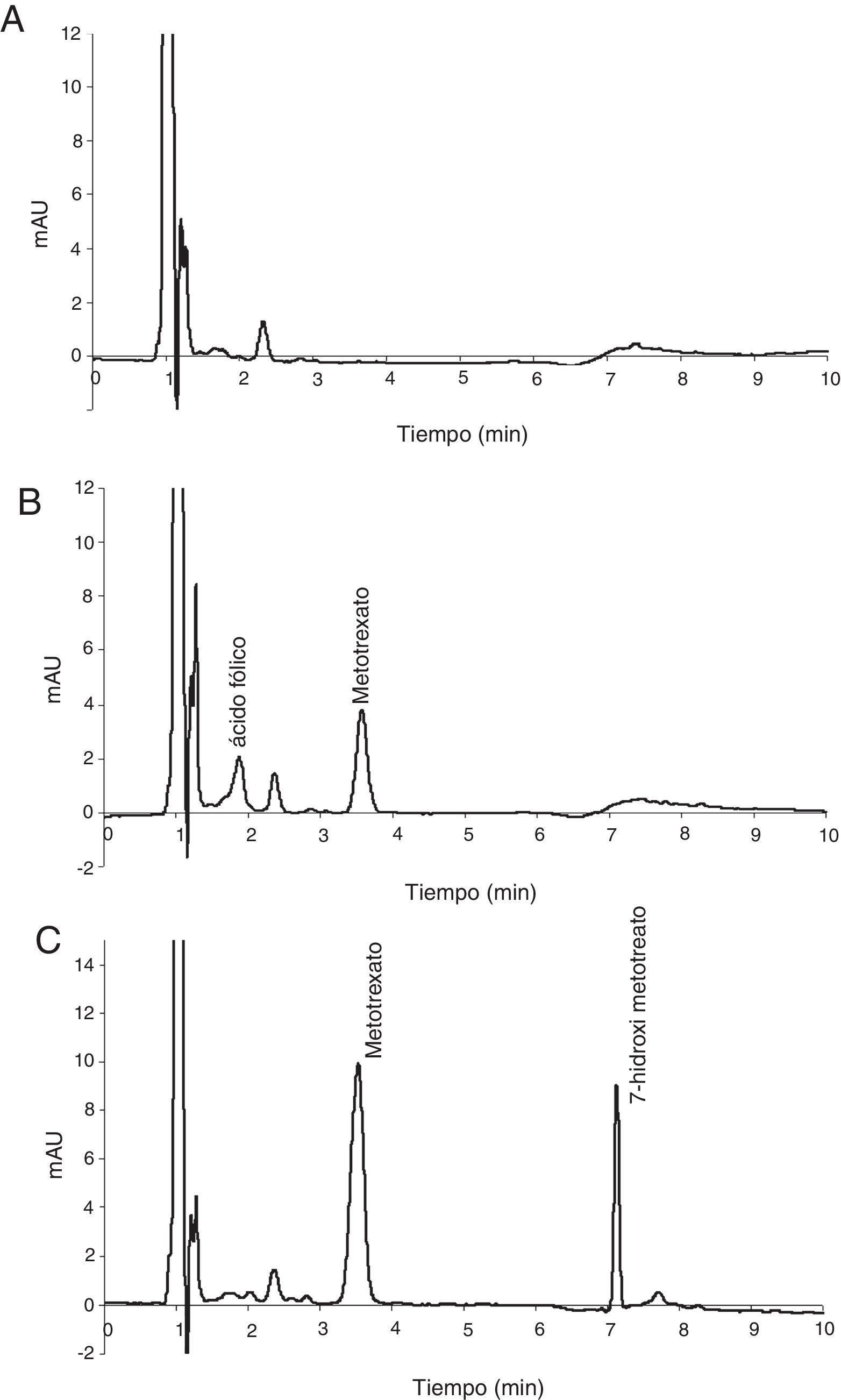
ResultadosValidaciónAl evaluar los plasmas blancos no se observaron interferencias debidas a compuestos endógenos. En las muestras de pacientes en tratamiento no se observó señal del DAMPA, mientras que el 7-hidroxi-metotrexato produjo un pico totalmente resuelto. Tampoco se observaron interferencias producidas por hemólisis o medicación concomitante, solo el ácido fólico mostró un pico cercano al fármaco, pero totalmente resuelto (fig. 4).
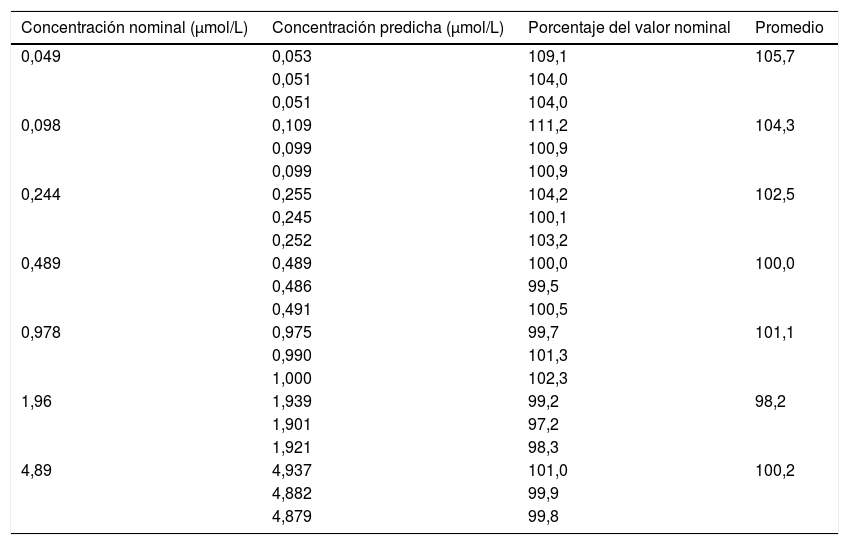
El método desarrollado presentó linealidad en el rango de concentraciones de 0,05-5,00μmol/L, obteniéndose un valor de r2=0,999. La ecuación de la recta obtenida por el método de los cuadrados mínimos fue: y=39,7x+2,1. Todos los calibradores evaluados frente a la curva de calibrado presentaron un porcentaje del valor predicho sobre el nominal mayor del 85% y menor del 115%, incluso en el límite inferior de cuantificación (tabla 2). Este se estableció en 0,05μmol/L, con una precisión del 6%.
Predicciones para las muestras calibradoras
| Concentración nominal (μmol/L) | Concentración predicha (μmol/L) | Porcentaje del valor nominal | Promedio |
|---|---|---|---|
| 0,049 | 0,053 | 109,1 | 105,7 |
| 0,051 | 104,0 | ||
| 0,051 | 104,0 | ||
| 0,098 | 0,109 | 111,2 | 104,3 |
| 0,099 | 100,9 | ||
| 0,099 | 100,9 | ||
| 0,244 | 0,255 | 104,2 | 102,5 |
| 0,245 | 100,1 | ||
| 0,252 | 103,2 | ||
| 0,489 | 0,489 | 100,0 | 100,0 |
| 0,486 | 99,5 | ||
| 0,491 | 100,5 | ||
| 0,978 | 0,975 | 99,7 | 101,1 |
| 0,990 | 101,3 | ||
| 1,000 | 102,3 | ||
| 1,96 | 1,939 | 99,2 | 98,2 |
| 1,901 | 97,2 | ||
| 1,921 | 98,3 | ||
| 4,89 | 4,937 | 101,0 | 100,2 |
| 4,882 | 99,9 | ||
| 4,879 | 99,8 |
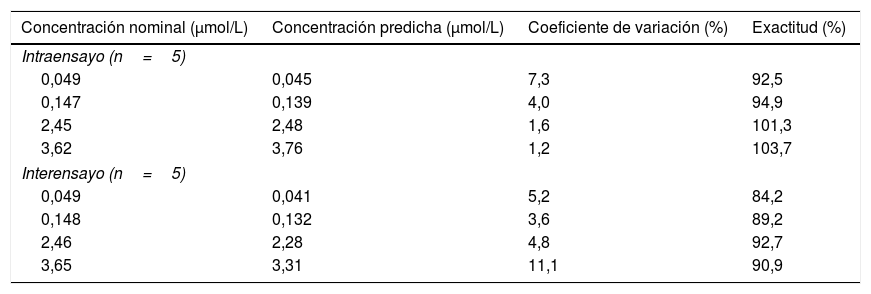
La precisión intraensayo osciló entre 1,2-7,3%, mientras que la precisión interensayo osciló entre 5,2 y 11,1%. También se confirmó una exactitud intra e interensayo dentro de los criterios de aceptación establecidos (tabla 3).
Valores de precisión y exactitud intra e interensayo
| Concentración nominal (μmol/L) | Concentración predicha (μmol/L) | Coeficiente de variación (%) | Exactitud (%) |
|---|---|---|---|
| Intraensayo (n=5) | |||
| 0,049 | 0,045 | 7,3 | 92,5 |
| 0,147 | 0,139 | 4,0 | 94,9 |
| 2,45 | 2,48 | 1,6 | 101,3 |
| 3,62 | 3,76 | 1,2 | 103,7 |
| Interensayo (n=5) | |||
| 0,049 | 0,041 | 5,2 | 84,2 |
| 0,148 | 0,132 | 3,6 | 89,2 |
| 2,46 | 2,28 | 4,8 | 92,7 |
| 3,65 | 3,31 | 11,1 | 90,9 |
El estudio del efecto de la dilución sobre muestras controles concentradas estableció que en el análisis de muestras diluidas se cumplen los criterios de precisión con coeficiente de variación en el rango (0,3-9,0%), y de exactitud con concentraciones predichas en el rango (95,5-114,7%) del valor nominal. La solución stock de MTX demostró ser estable durante 15 días conservada en la oscuridad a 4°C.
Dosajes de metotrexato en pacientesDe los 61 pacientes monitorizados, que recibieron entre uno y 7 ciclos de MTX según criterio médico, el 83,6% recibió el esquema I24 y el 16,4% el esquema I36 (tabla 4). En I24, un 29,4% de los pacientes tuvo valores de MTX por encima de los niveles seguros en alguno de los ciclos, por lo que debieron recibir rescates personalizados con LCV. De los pacientes con I36, el 60% presentó en algún momento niveles de MTX superiores a los valores seguros.
Se observaron 3 casos particulares: i) un paciente debió monitorizarse durante 7 días consecutivos hasta alcanzar el valor de corte; ii) un paciente recibió un total de 7 ciclos con valores de MTX elevados en 4 de ellos, y iii) un paciente debió ser monitorizado durante 90h, observándose en el dosaje de la hora 66 un efecto rebote en la concentración de MTX (fig. 5).
ConclusionesEn este trabajo se ha utilizado un método sencillo y altamente eficiente basado en cromatografía líquida de alta resolución con detección ultravioleta para la determinación de MTX en plasma humano.
Demostró ser selectivo, al no presentar interferencias por componentes del plasma ni de otros fármacos, lo que es fundamental a la hora de medir con certeza los niveles del citostático en pacientes polimedicados. Además, los metabolitos se separaron completamente del MTX en el sistema cromatográfico, por lo que el método es mucho más confiable que los inmunoanálisis que producen sobreestimaciones, sobre todo en los pacientes tratados con CPDG2.
Los ensayos de validación demostraron ampliamente que el método es capaz de obtener resultados con adecuados niveles de sensibilidad, precisión y exactitud, utilizando poco volumen de muestra. Estos atributos se logran, además, sin necesidad de pretratamientos largos o complejos de las muestras y sin utilizar un estándar interno, ni detectores costosos como son los detectores de masa. La prescindencia de estándar interno es una fortaleza del método propuesto en comparación con otros similares18,19, ya que simplifica tanto la etapa preanalítica (al evitarse un paso en la preparación de la muestra) como la analítica (al obtenerse un cromatograma más sencillo) y la postanalítica (al requerir de cálculos más simples que la calibración interna).
La simplicidad y la calidad del método propuesto lo posiciona como una alternativa muy conveniente para los centros de salud que realizan monitorización terapéutica de MTX.
Los dosajes realizados a pacientes pediátricos con LLA, con resultados disponibles en las 2h siguientes a la extracción de la muestra, han sido fundamentales para la toma de decisiones médicas en la individualización del tratamiento, minimizándose notablemente la incidencia de efectos adversos graves relacionados con altas concentraciones del citostático.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónEste trabajo se ha financiado con fondos de la Universidad Nacional del Litoral (Project CAI+D 2011, N.o: PI 50120110100025 LI).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Agradecemos a la Dra. Julieta Bietti, oncohematóloga del Hospital J. M. Iturraspe, por confiar en nuestro trabajo para realizar la monitorización terapéutica de sus pacientes.