La alergia al látex es una respuesta alterada de nuestro organismo al contactar con las proteínas que se encuentran en el látex de caucho natural. Los síntomas de la hipersensibilidad alérgica al látex son bastante parecidos a los de la alergia a los alimentos, siendo menos frecuentes los síntomas digestivos y más típicos los cutáneos tras el uso de guantes de látex, y los nasales y/o el asma tras la inhalación del polvo de los guantes de látex o de los globos.
En caso de pacientes muy sensibles puede provocar reacciones alérgicas graves si entra en contacto con mucosas o cavidades internas. Se da la paradoja de que el medio hospitalario, es el lugar de más riesgo dada la cantidad existente de látex, tanto directo como indirecto.
Las personas alérgicas al látex presentan a menudo reacciones alérgicas cruzadas, a veces graves, tras ingerir determinadas frutas y vegetales. Las reacciones cruzadas se deben a los alérgenos comunes presentes en el látex y en los diferentes alimentos.
Es importante utilizar el análisis molecular de alérgenos para detectar falsos diagnósticos a látex por problemas de reactividad cruzada con proteínas de frutas. Indicamos cómo estas nuevas pruebas han sustituido a análisis menos precisos y eficientes, logrando un considerable ahorro de recursos.
Latex allergy is an altered response of the body on contact with proteins found in natural rubber latex. The symptoms of allergic hypersensitivity to latex are quite similar to those of food allergy, with the gastrointestinal symptoms being less frequent and the cutaneous ones being more typical after the use of latex and nasal gloves and / or the asthma after the inhalation of the dust from latex gloves or balloons.
In the case of very sensitive patients it can cause severe allergic reactions if it comes in contact with mucous membranes or internal cavities. There is a paradox that the hospital environment is the most risky place, given the existing amount of latex in direct and indirect use.
People who are allergic to latex often have cross-allergic reactions, sometimes severe, after eating certain fruits and vegetables. The cross-reactions are due to the common allergens present in latex and in different foods.
It is important to use molecular allergen analysis to detect false latex diagnoses due to problems of cross-reactivity with fruit proteins. It is indicated how these new tests have replaced less accurate and efficient analyses, achieving a considerable saving of resources.
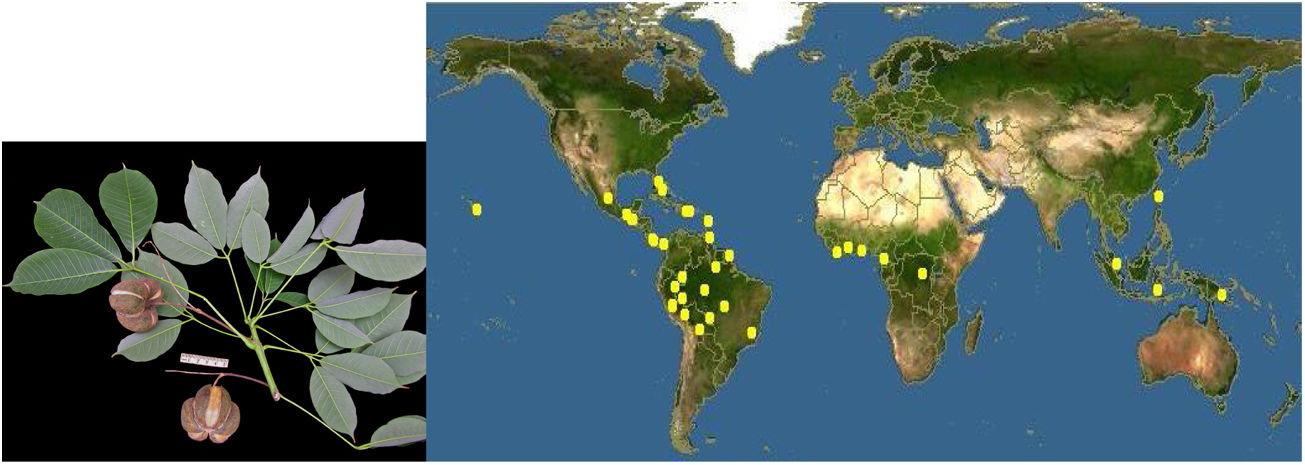
La hipersensibilidad mediada por IgE al látex es un problema sanitario de primer orden1. La prevalencia en la población general es del 1%, pero aumenta en poblaciones de riesgo, siendo del 17% entre trabajadores sanitarios y más del 50% en pacientes multioperados y con espina bífida. El látex (caucho natural), se obtiene de la savia de la Hevea brasiliensis o siringueira. Su origen fue Brasil, pero ahora se cultiva en toda la franja tropical incluyendo África y Oceanía (fig. 1).
La hipersensibilidad alérgica al látex consiste en una respuesta alterada de nuestro organismo al contactar con las proteínas que se encuentran en el látex de caucho natural. Es motivo de sospecha cualquier persona que presenta picor, lagrimeo o enrojecimiento ocular, irritación nasal; enrojecimiento y habones en las manos; dificultad respiratoria; tos seca o sibilancias; opresión torácica o rubor; palpitaciones y mareo después de tener contacto con objetos de látex. Son síntomas parecidos a los de la alergia a alimentos, siendo menos frecuentes los síntomas digestivos y más típicos los cutáneos tras el uso de guantes de látex, y los nasales y/o el asma tras la inhalación del polvo de los guantes de látex o de globos1–4.
Las reacciones pueden ser leves, como erupciones, urticaria, picor, lagrimeo, enrojecimiento ocular, irritación nasal, tos, etc.; o graves como dificultad respiratoria, asma, hipotensión, opresión torácica, palpitaciones o mareo, choque anafiláctico. La gravedad de la reacción inmediata depende del grado de sensibilidad de la persona y de la cantidad de alérgeno de látex que ingrese en su cuerpo3,4.
Cualquier sospecha de alergia debe confirmarla el alergólogo a partir de la historia clínica referida, las pruebas cutáneas, habitualmente prick test y la determinación de IgE específica al látex en sangre. En algunos casos es necesaria una prueba de exposición controlada.
El látex es una sustancia muy frecuente en nuestro entorno. Se calcula que unos 40.000 productos de uso cotidiano contienen látex. Como norma general las formas duras del caucho liberan menos alérgenos que los objetos de material elástico y de paredes finas.
En caso de pacientes muy sensibles puede provocar reacciones alérgicas graves si entra en contacto con mucosas o cavidades internas.
El mayor peligro de una reacción severa se produce cuando objetos de paredes finas y elásticas (guantes, globos, preservativos) entran en contacto con las mucosas corporales (nariz, ojos, vagina, recto, boca), heridas y órganos internos2–4.
Se da la paradoja de que el medio hospitalario es el lugar de más riesgo dada la cantidad existente de látex, tanto directo como indirecto.
Las personas alérgicas al látex presentan a menudo reacciones alérgicas cruzadas, a veces graves, tras ingerir determinadas frutas y vegetales. Así, hasta un tercio de las personas sensibilizadas al látex sufrirán una reacción alérgica de mayor o menor intensidad cuando coman plátano, kiwi, aguacate o castaña. Además, entre el 5% y el 10% pueden sufrir una reacción alérgica al comer frutas de la familia de las rosáceas (melocotón, albaricoque, manzana, pera o cereza) y hortalizas de la familia del tomate y la patata. Estas reacciones cruzadas se deben a los alérgenos comunes presentes en el látex y en los diferentes alimentos citados2–5.
Un mejor conocimiento y diagnóstico de la alergia en la utilización masiva de productos de látex y un descenso en la calidad en los productos sanitarios utilizados para bajar el precio y aumentar la rapidez de producción, son los motivos principales en el aumento de la alergia al látex.
En cuanto a la población de riesgo, aparece recogida en la tabla 1. Es decir, toda persona que esté en contacto con productos de látex de forma habitual.
Diferentes tipos de población en contacto con el látex
| Personas con cirugías o procedimientos médicos tempranos y/o repetidos |
| Trabajadores de la salud |
| Trabajadores que usen guantes de látex (manipuladores de alimentos, peluquería, limpieza, policía, etc.) |
| Trabajadores de la construcción |
| Trabajadores involucrados en la fabricación de caucho, guantes o sondas de látex |
| Amas de casa con dermatitis crónica que usen guantes de goma |
| Pacientes con espina bífida o malformaciones genitourinarias |
| Pacientes atópicos (alérgicos a sustancias comunes presentes en el ambiente) |
| Personas que han tenido reacciones alérgicas graves de causa inexplicada |
| Personas con historia de reacciones frente a ciertas frutas y frutos secos (plátano, castaña, kiwi, aguacate, pistacho) |
Para las personas de los grupos de riesgo descritos, se recomienda adoptar algunas medidas para prevenir su sensibilización al látex. Así, evitar hinchar y jugar con globos en niños atópicos, realizar una asistencia sanitaria libre de látex en pacientes con espina bífida, o usar guantes bajos en alérgenos y sin polvo en personal sanitario son medidas recomendadas por la Alergología6–13.
Una persona ya sensibilizada deberás extremar las medidas preventivas que le eviten sufrir reacciones alérgicas. Dada la amplia distribución de los productos de goma natural, con los cuales estamos en contacto desde la infancia (chupetes, mordedores de dentición, etc.) reconocer el látex resulta una labor muy compleja que obliga a sufrir cambios en el ritmo de vida particular, en el hogar, en la escuela, en el trabajo y por supuesto en la asistencia sanitaria.
Los hospitales, al igual que el resto de los centros de trabajo, tienen la responsabilidad legal de proporcionar un ambiente laboral seguro, debiendo realizar las adaptaciones necesarias para aquellos trabajadores con posibilidad de sensibilizarse al látex.
El primer paso es tomar conciencia del problema. Hoy en día existe ya una vacuna o inmunoterapia frente al látex comercializada en España. Además hay diversos tratamientos farmacológicos para tratar las reacciones una vez que se producen. Pero el mejor tratamiento en la actualidad es la prevención.
Debe desconfiarse de cualquier producto elástico sobre todo si sus paredes son delgadas. También hay otros puntos importantes a tener en cuenta cuando se es alérgico al látex.
Estudiamos la utilidad del análisis molecular de alérgenos para detectar falsos diagnósticos a látex por problemas de reactividad cruzada con proteínas de frutas. Indicamos cómo estas nuevas pruebas han sustituido a análisis menos precisos y eficientes, logrando un considerable ahorro de recursos7–11.
Alergia al látexEn 1927 se describió por primera vez la alergia al látex, pero es a finales de los 80 cuando se comienza a percibir como un problema sanitario grave debido al aumento espectacular de casos descritos2. Esto se asoció a las recomendaciones internacionales para evitar el contagio del VIH y al gran aumento en la utilización de guantes y preservativos de látex. A partir de los años 90 se utilizan de forma masiva guantes y dispositivos de látex en los centros sanitarios, por lo que son necesarios mecanismos de control y aparecen muchos estudios de investigación. Estos estudios concluyeron en que una medida eficaz era eliminar el polvo de almidón que contenían los guantes, pues era el vehículo en el que los alérgenos del látex se dispersaban3.
Esto ocurre de la misma manera en que se dispersan los alérgenos de los pólenes que viajan en gránulos de almidón una vez que el polen, por la humedad, se rompe en la mucosa respiratoria. Las partículas de almidón portando alérgenos son las que llegan a los bronquiolos terminales y son las causantes del asma por látex (fig. 2).
Sin embargo en la actualidad la incidencia de alergia al látex ha vuelto a aumentar y se considera de nuevo un problema serio de salud. En algunas clínicas este repunte de casos puede ser debido a que la disminución de recursos ha hecho que se compren guantes de escasa calidad, que liberan partículas alergénicas más fácilmente. Hay hospitales que como una buena medida de gestión eliminaron los guantes de látex desde hace años. Sin embargo seguimos viendo que no solo ha aumentado la morbilidad sino la gravedad de las reacciones (anafilaxia)12,14–20.
Sería fácil evitar la sensibilización (prevención primaria) y la aparición de síntomas en pacientes sensibilizados (prevención secundaria) si el diagnóstico se efectuara con métodos fiables. Pero existe el problema de la posibilidad de falsos diagnósticos positivos por la reactividad cruzada que existe entre el látex y ciertas frutas (kiwi, plátano, castaña, aguacate). Mientras el diagnóstico no se haga de forma precisa, ante una intervención en un paciente con pruebas positivas a látex, será necesario un quirófano exento de látex. También como medida preventiva en la actualidad, las intervenciones de estos pacientes se realizan a primera hora de la mañana, en algunos casos, desplazando y retrasando intervenciones más grave21–29. El material de quirófano tiene que ser meticulosamente cuidado.
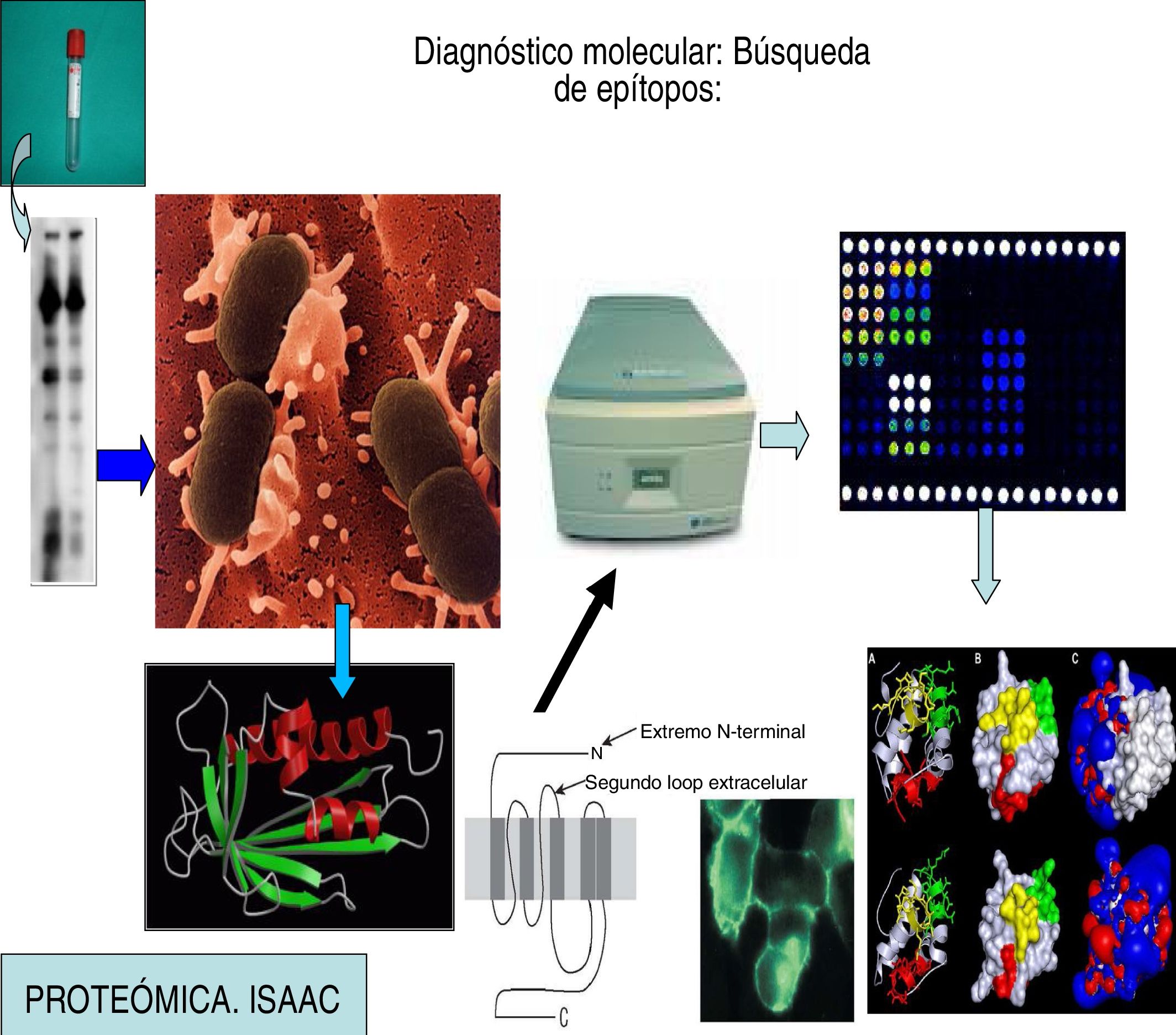
Diagnóstico molecularEn el momento actual la disponibilidad de alérgenos recombinantes y purificados permite determinar la IgE específica frente a diversos componentes alergénicos27. De esta manera es posible diagnosticar el perfil de sensibilización individual de cada paciente. Las técnicas de micromatrices (microarrays) permiten determinar IgE específica frente a múltiples alérgenos al mismo tiempo en un mismo paciente con una mínima cantidad de suero e incluso permite en una misma muestra de suero determinar IgG e IgM frente a los mismos alérgenos. Ya se están desarrollando no solo determinaciones de anticuerpos, sino ensayos de activaciones celulares en micromatrices. Además ayudará a explicar reacciones cruzadas, facilitará realizar una evaluación a sujetos en los que no podemos realizar pruebas cutáneas.
Va a significar un gran impulso en el desarrollo de la inmunoterapia dirigida a las sensibilizaciones de cada paciente, consiguiendo formas especialmente hipoalergénicas con gran poder inmunológico, mejorando la seguridad y la eficacia de la inmunoterapia. Finalmente, estas técnicas van a facilitar la comprensión de la fisiopatología de las enfermedades alérgicas.
Cuando se habla de nuevos métodos de diagnóstico, es importante no perder de vista la perspectiva histórica. Ya en la década de 1930, Francis declaró que «Las pruebas cutáneas son simples y fascinantes»; y las vacunas utilizadas para inmunizar contra las proteínas que parecen ser la causa de los síntomas se hicieron tan populares y universales que se creía que la cura para todas las formas de asma estaba al alcance de la mano. Años más tarde, el descubrimiento de la IgE generó polémica entre los que defendían la fiabilidad de las pruebas cutáneas y los que defendían el diagnostico in vitro, hasta el punto de que un editorial afirmaba que la determinación de IgE específica podría sustituir rápidamente en la práctica clínica a las primitivas pruebas cutáneas27. Tal vez lo mismo sucederá con el diagnostico molecular. Sin embargo, está claro que las medidas adoptadas por Blakely en la investigación de su propia polinosis mediante la realización de una prueba cutánea en su propia piel, o por Kimishige y Teruko Ishizaka por un lado y Johansson por otro en el descubrimiento de la IgE, constituyen hitos en el conocimiento y tratamiento de las enfermedades alérgicas.
A finales de 1980, cuando el primer alérgeno fue clonado28, se abrió una era para la producción de alérgenos recombinantes purificados y su utilización en el diagnóstico y tratamiento de las enfermedades alérgicas29.
Hasta ese momento era posible determinar la fuente alergénica a la que un determinado paciente era sensible. Con la aplicación del diagnóstico molecular o las técnicas de diagnostico por componentes (CCD), es posible definir el perfil de sensibilización de cada individuo, es decir, podemos establecer qué partes del alérgeno son reconocidas por cada paciente individualmente. En los últimos años hemos visto la caracterización y la producción de los más relevantes alérgenos a nivel molecular, y la mayoría se han generado como proteínas recombinantes30. El número de los nuevos alérgenos recombinantes publicados ha aumentado de manera constante, y es casi imposible estudiar todas las familias de recombinantes relacionados con un mismo paciente.
Posteriormente, el esfuerzo se centró y permanece centrado aquí, en la confirmación de que los alérgenos recombinantes disponibles o alérgenos naturales son aquellos reconocidos por la IgE del paciente, y que desencadenan los síntomas. El objetivo es establecer que poseen un perfil de reconocimiento del epítopo IgE similar al de los alérgenos que han sido estudiados hasta la fecha. Además, se están realizando determinaciones para establecer que el panel de alérgenos es representativo de un determinado tipo de sensibilización31.
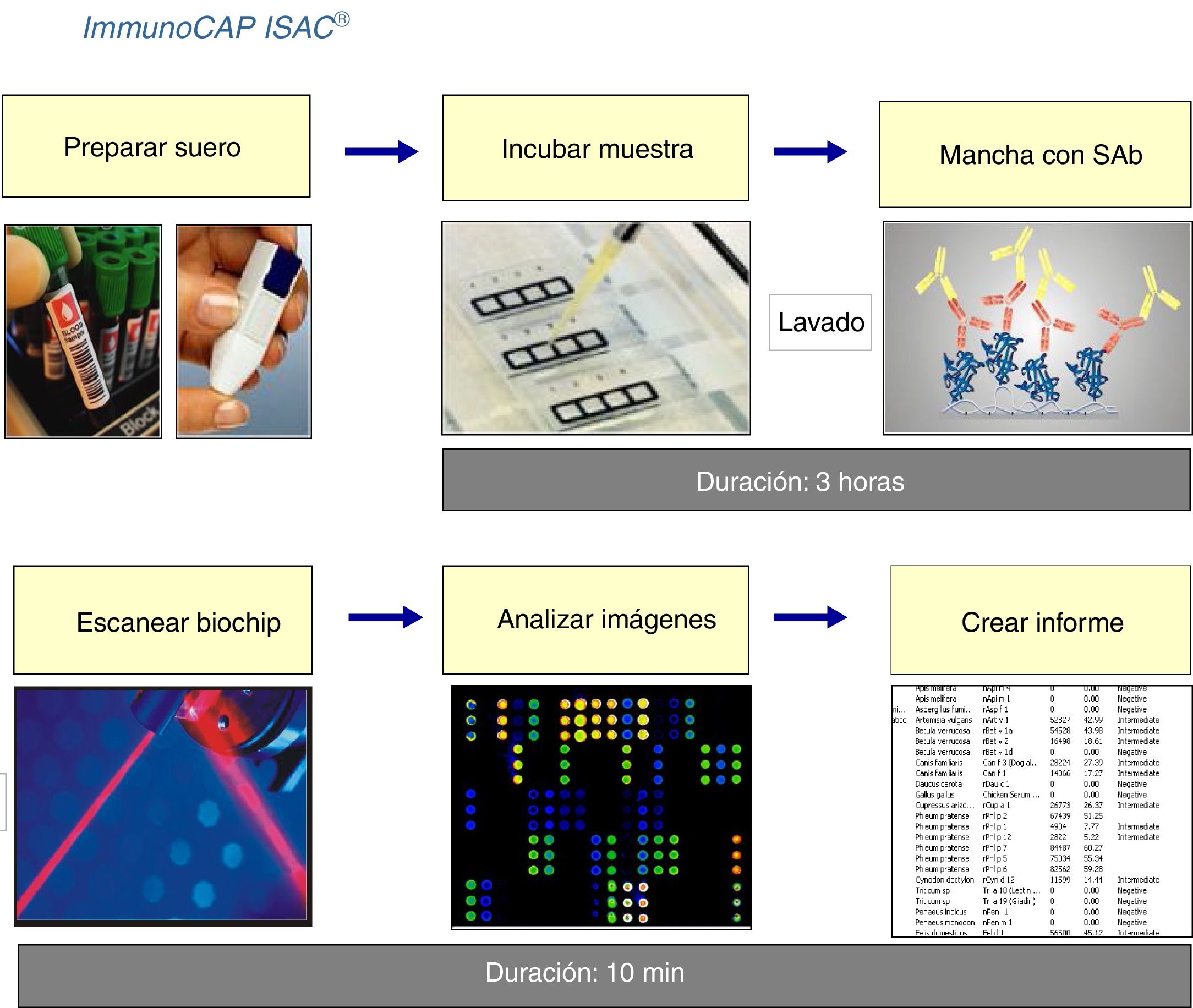
Principio de la técnicaLos microarrays o biochips se han desarrollado como una herramienta para el análisis de la expresión de genes en los genomas. Desde su introducción a principios de 1990, la tecnología de microarrays de ADN se ha aplicado para la determinación de ácido nucléico, y esto a su vez fue seguido del análisis de la expresión de ARN. Se necesitaba este paso entre otras razones porque la exploración de la expresión génica necesita herramientas cada vez más eficaces para el estudio de la expresión de proteína a nivel intracelular. La técnica de microarrays para proteínas se desarrolló así, adoptando la misma tecnología de microarrays utilizada inicialmente en el ADN32.
La tecnología de microarrays es un inmunoanálisis en fase sólida múltiple en la que las proteínas (recombinantes purificada o natural de alérgenos) se inmovilizan en una fase sólida, y con cantidades muy pequeñas de suero y se incuban con estas proteínas en condiciones estandarizadas. Los anticuerpos presentes en el suero son captados por los diferentes alérgenos, y después de un lavado para eliminar las sustancias no unidas, los anticuerpos se detectan por medio de un anticuerpo antiisótopo marcado con fluoresceína o una enzima que se detecta mediante láser o quimioluminiscencia.
Hasta la fecha, la IgE específica se ha determinado en un individuo alérgico por un alérgeno base. Con la técnica de microarrays, en un mismo suero de la muestra se determinan múltiples componentes alergénicos, y también permite determinar en el mismo suero de la muestra y de forma simultánea no solo IgE, sino también IgG, IgM e IgA dirigido a los mismos alérgenos.
Como en el caso de los microarrays de ADN, la técnica se realiza sobre superficies sólidas, como portaobjetos de vidrio de alta calidad, del mismo tipo de los utilizados en la miscroscopia óptica. Para la inmovilización de la proteína en el sistema33,34, la superficie se modifica por ejemplo con nitrocelulosa o estructuras tipo gel. Los diferentes tipos de proteínas (recombinantes, anticuerpos, péptidos o heptámeros) se depositan en espacios micrométricos utilizando la robótica (en la actualidad esto permite depositar hasta 30.000), seguido con la reacción con el ligando. Esta reacción de unión es detectada por anticuerpos marcados con fluoresceína mediante técnicas de teñido o técnicas combinadas. La fluorescencia se detecta habitualmente por láser. Para calcular y analizar los resultados de una manera semicuantitativa, se necesita un software especial que compare la fluorescencia de los alérgenos de estudio con la curva de concentración de una IgE conocida, lo que sirve para extrapolar el resultado de la prueba.
El proceso puede durar hasta 5h. El número de pacientes depende del número de portaobjetos procesados al mismo tiempo. En el caso de IgE específicas, sobre la base de la técnica utilizada por los autores del prototipo VBC-genomics, cada portaobjetos se puede utilizar para estudiar hasta 4 pacientes.
El concepto de una «protein ligand reaction» se publicó por primera vez hace ya casi 2 décadas33. Estas reacciones no se pudieron hacer antes por la dificultad de fijar proteínas en un espacio tan pequeño debido a su tamaño, su carga y su estructura tridimensional. No fue hasta 10 años más tarde cuando el uso de microarrays con alérgeno raw en portaobjetos convencionales fue publicado por primera vez utilizando un amplificador de señal34. Posteriormente, Kim et al. realizaron la técnica utilizando nitrocelulosa como base del chips35. Además, hay que señalar la dificultad que plantea la posible desnaturalización de las proteínas durante el proceso de fijación, y el hecho de que el reconocimiento por la IgE requiere la preservación de la estructura terciaria.
En resumen, la técnica constituye un inmunoanálisis específico indirecto semicuantitativo IgE (EIA). La principal ventaja con respecto a otros métodos es que podemos realizar múltiples determinaciones de IgE específica dirigida en un panel de componentes alergénicos que puede ser ampliado. La técnica reconoce la IgE del paciente por medio de un anticuerpo secundario marcado con fluoresceína. Como se ha comentado anteriormente, un panel de proteínas recombinantes o alérgenos naturales están inmovilizados en un chip con dimensiones que permiten su fácil manejo, cada alérgeno se une al portaobjetos por triplicado, para asegurar la reproducibilidad de la prueba. La cantidad de suero requerida es de 50microlitos, junto con el calibrador. Cada pocillo que contiene el alérgeno está rodeado de teflón a fin de evitar el derramamiento de la muestra. El número promedio de alérgenos que se pueden inmovilizar con esta técnica es prácticamente ilimitado.
Correlación con la determinación de IgEAlgunos estudios han visto la correlación de la técnica de microarrays y los diferentes métodos utilizados hasta la fecha. El primer estudio comparando la técnica de microarrys fue desarrollado por VBC-genomics con el sistema Phadia CAP, para la determinación de IgE específica para 3 alérgenos de gramíneas, abedul y ácaros del polvo, y mostraron una correlación de 0,936. Lebrun et al.37 publicaron los resultados obtenidos con una técnica colorimétrica aplicada a los alérgenos comunes, detectando niveles de IgE específico por debajo del punto de corte aceptado para la técnica convencional (0,35KU/L).
Recientemente, Wöhrl et al.38 publicaron sus resultados comparando microarrays con la versión técnica CRD-50 ISAC de VBC-Genomics y el UniCAP Phadia. El diagnóstico con recombinantes se mostró igual de sensible para el diagnóstico de alérgenos completos que con el UniCAP para pacientes alérgicos a las gramíneas, gatos y abedul. La sensibilidad para con los ácaros del polvo es menor, pero se mantuvo alta (de la misma manera para la especificidad), y fue igualmente menor para la detección de los pacientes a Artemisia.
Los beneficios de la técnica se resumen en la tabla 2. La principal ventaja de la técnica es que permite cientos de alérgenos al mismo tiempo, con una cantidad mínima de muestra (solo 50microlitos de suero) y con un único análisis. En el caso de VCB-genomics, se utilizan 103 alérgenos por chips. La técnica hace que sea posible mostrar el mayor número de epítopos reconocibles de IgE.
La técnica permite analizar diferentes resultados de fluorescencias y en una misma prueba se puede medir IgE e IgG específicas.
Otra ventaja de la técnica es que facilita el diagnóstico basado en componentes39,40. Este hecho favorece una mayor seguridad en establecer qué alérgeno es reconocido por un paciente dado, lo que ayuda a explicar las reacciones cruzadas y resolver enigmas como el de los pacientes con positividad a múltiples pólenes a los que nunca han estado expuestos; la explicación en estos casos sería la sensibilización a panalérgenos. Con los métodos tradicionales sería prácticamente imposible analizar el panel de alérgenos naturales y recombinantes que garanticen la presentación de un número significativo de epítopos. Por otro lado, las moléculas podrían no estar presentes en la misma reacción inmune con los alérgenos naturales completos.
También, otra ventaja importante de esta técnica sería que permite realizar el estudio en individuos en los que las pruebas cutáneas no se pueden hacer, tales como pacientes con dermatitis atópica severa, dermografismo o niños, o en casos en los que la intensidad de la reacción contraindicaría la realización de estas pruebas cutáneas.
En la figura 3 aparece recogido el esquema del procedimiento del ensayo de los microarrays.
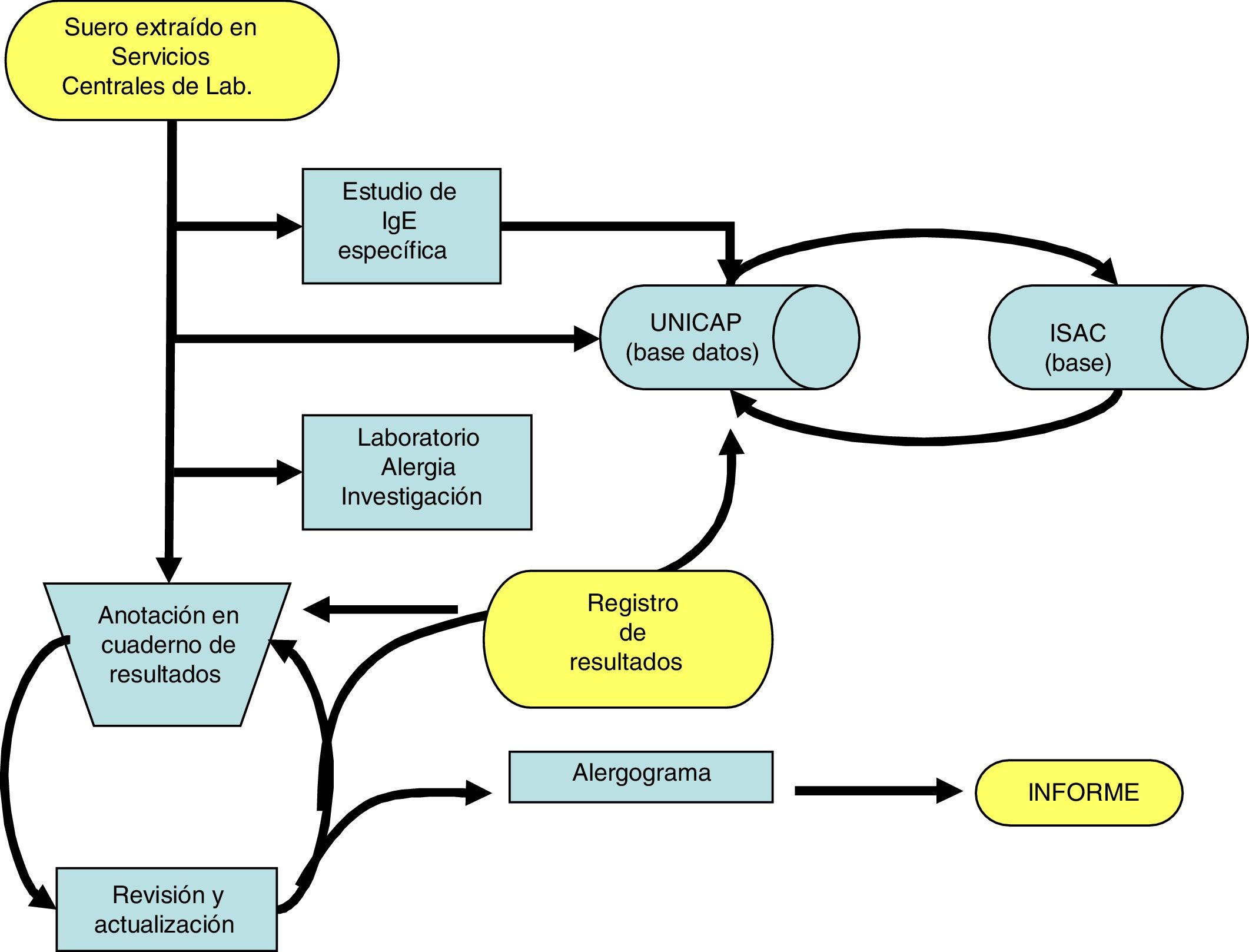
En la figura 4 aparece recogido el algoritmo de trabajo seguido en nuestro centro para el estudio de estos pacientes.
La técnica de microarrays ha sido fundamental y ha contribuido en el desarrollo de la inmunoterapia. Hasta la fecha, la composición de la inmunoterapia ha consistido en la utilización de extractos de alérgenos mezclados con componentes no alergénicos. Estas formulaciones son difíciles de estandarizar y no se adaptan al perfil individual de sensibilización de cada paciente. La inmunoterapia en la actualidad puede contener alérgenos a los que el paciente no es sensible, o pueden contener dosis insuficiente de los alérgenos que son relevantes para el paciente. Más importante aún, la formulación utilizada puede carecer de precisión en esos componentes a los que el paciente está más sensibilizado. Por último, la inmunoterapia con extractos completos posee un potencial alergénico además de inmunogénico lo que entraña un riesgo de reacciones de hipersensibilidad.
Varios estudios han demostrado que la inmunoterapia dirigida a los alérgenos recombinantes es a la vez eficaz y segura41,42, y además, permite el uso especial de formas hipoalergénicas con gran potencial inmunogénico. Como consecuencia, en un futuro próximo la calidad, seguridad y eficacia de la inmunoterapia se verán reforzadas43–46. Adicionalmente, tales procedimientos permitirán explorar el mecanismo de la inmunoterapia.
Falsos positivos a la alergia al látex por reactividad cruzadaLo que existe en común entre estas frutas y el látex son proteínas de resistencia o de estrés, en concreto quitinasas, con alto poder antifúngico, antiparasitario y antibacteriano, cuya función es defender al fruto cuando este va a ser dañado por alguno de estos patógenos. El árbol de la hevea, cada vez más escaso, está sufriendo una explotación excesiva y es muy probable que se defienda ante los excesivos cortes aumentando sus proteínas de resistencia (quitinasas de clase 1), que son a la vez los alérgenos más agresivos responsables de la clínica (figs. 5 y 6)31,43–46.
Es conocido que ciertas sensibilizaciones a aeroalérgenos se asocian significativamente con alergias alimentarias. A algunas de estas asociaciones muy importantes desde el punto de vista clínico se les denomina «síndromes», entre ellas el síndrome de alergia al polen-alimentos, y el síndrome látex-frutas que nos ocupa13.
La base inmunológica de estas asociaciones es la reactividad cruzada o reconocimiento de antígenos de diferentes especies sin relación taxonómica, pero que comparten similitudes y estimulan la síntesis del mismo anticuerpo.
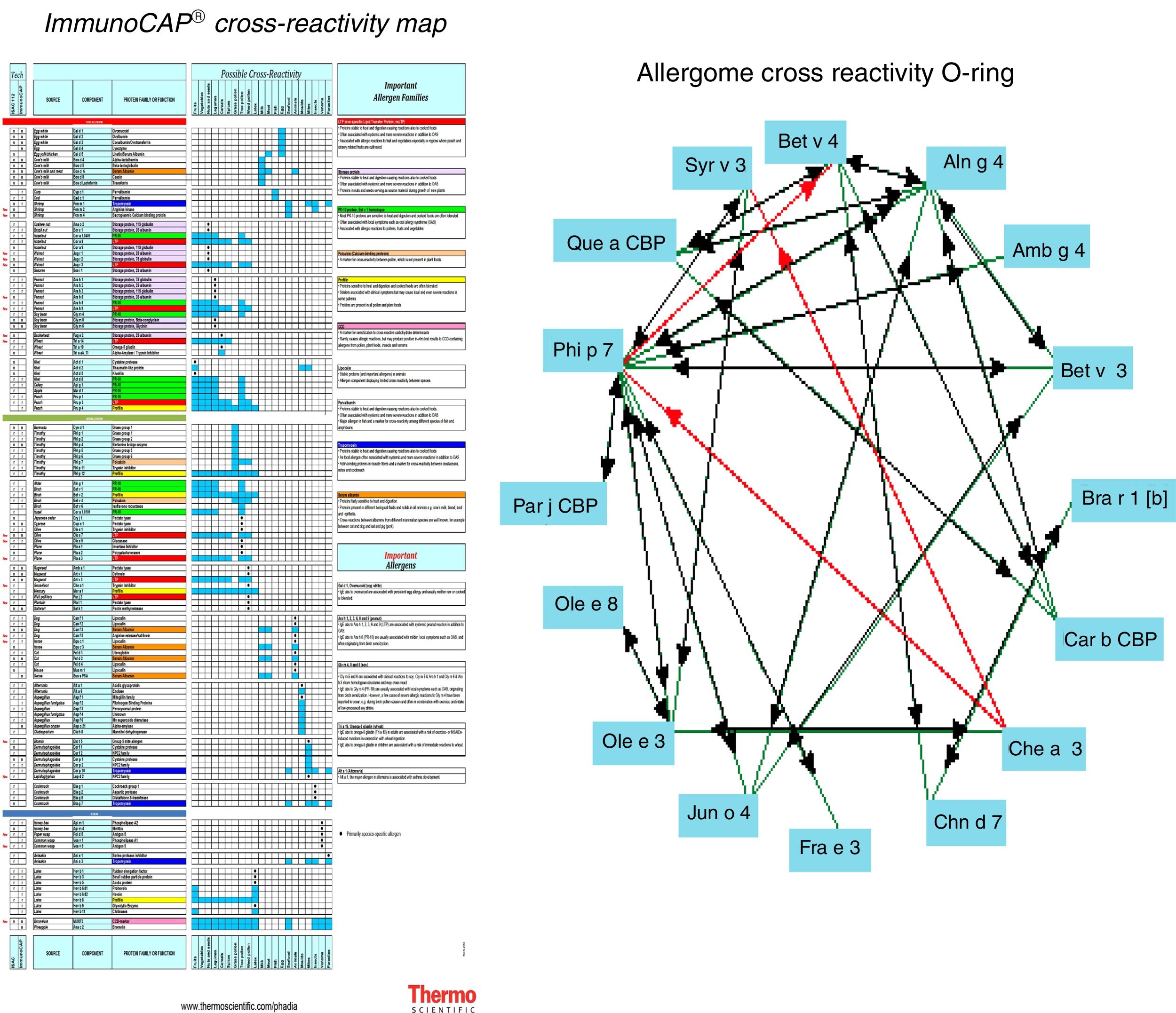
El mapa de las posibles reactividades cruzadas es desalentador para el diagnóstico pero afortunadamente los alérgenos de reactividad cruzada del látex y frutas están muy bien identificados y existen comercializados para análisis molecular como proteínas recombinantes4.
Los alérgenos recombinantes son utilizados tanto para análisis en prueba cutánea como en técnicas de proteómica por método de microarrays8,9.
Esta técnica se basa en detectar primero las diferentes proteínas que pueden causar los síntomas de hipersensibilidad en los pacientes, secuenciarlas, clonarlas, e introducir el ARN que las codifica en el genoma de cultivos de E. coli. Estas bacterias sintentizarán cantidades inmensas de estos epítopos, de una forma reproducible y barata. Estos antígenos así sintetizados se llaman recombinantes y pueden acoplarse a microplacas de sílice que permiten determinar la IgE específica a 112 epítopos diferentes. Logramos con ello un mapa molecular exacto que indica con precisión a que alérgenos y fracciones del mismo (epítopos) está sensibilizada la persona estudiada (figs. 7 y 8)9.
Lo importante de esta técnica es que nos sirve para estudiar las reacciones cruzadas y para saber con seguridad si un paciente es alérgico a una fuente proteica determinada o la IgE se detecta por un fenómeno de reactividad cruzada, en el caso del látex, con una fruta relacionada.
La mayor limitación de esta técnica es su precio, 23 € por paciente. Sin embargo si esta técnica sustituye a otras más caras y menos resolutivas, como ha sido el caso de su aplicación en investigación en nuestro centro, se puede obtener una mayor precisión diagnóstica y un mayor ahorro.
Por tanto, el precio del diagnóstico de rutina utilizando técnicas cutáneas de prick con alérgenos habituales y de determinación de IgE específica asciende a una media aproximada de 40 €/paciente. Si se utilizan alérgenos recombinantes asciende a 44,8 €/paciente.
La determinación de IgE específica por CLA (método usado desde 1992) asciende a un gasto anual de 60.000 € y el mismo análisis molecular sería 61.130 €.
Las subvenciones en proyectos de investigación nos han permitido un importante ahorro de recursos en asistencia de rutina y una resolución de problemas como el de los falsos positivos de alergia al látex.
Como protocolo diagnóstico, podemos decir que convendría realizar en paralelo el diagnóstico de rutina utilizando técnicas cutáneas de prick con alérgenos habituales y de determinación de IgE específica y en los casos negativos recurrir al diagnóstico molecular para evitar las reactividades cruzadas antes comentadas. Esto solo se podría realizar en los hospitales de tercer nivel, ya que es una técnica que no está disponible todavía en muchos laboratorios clínicos y sirve además para poder utilizarla como investigación en otras patologías que requieran diagnóstico molecular. Como ejemplo de otra aplicación, ha sido el diagnóstico de una patología emergente y grave, la esofagitis eosinofílica, que puede derivar en intervención con estudios de arrays con el servicio de digestivo.
ConclusionesLa hipersensibilidad alérgica al látex es un problema sanitario de una magnitud muy importante, ya que afecta a muchos estamentos de la sociedad como personal sanitario, jardinería, construcción, policial, etc. Por lo cual es muy importante sustituir métodos antiguos no precisos por tecnología exacta y actual, manteniendo las premisas de control del gasto e intentando además un ahorro de recursos.
El diagnóstico de los verdaderos pacientes sensibles a látex contribuirá a mejorar su seguridad y a no realizar medidas preventivas ineficaces ni que actúen en detrimento del tratamiento de otros pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.