La infiltración leptomeníngea en el mieloma múltiple es una complicación poco frecuente y grave que se presenta generalmente tras recaídas de la enfermedad. Para establecer un correcto diagnóstico es necesario demostrar por citología la presencia de células plasmáticas clonales en el líquido cefalorraquídeo.
Desde el laboratorio clínico detectamos esta complicación en una paciente diagnosticada de mieloma múltiple refractario, tras analizar una muestra de líquido cefalorraquídeo. La paciente presentaba diversos síntomas neurológicos como incontinencia fecal y disminución de la movilidad en ambas extremidades inferiores. Inicialmente observamos en el líquido pleocitosis, proteinorraquia y niveles elevados de células de alta fluorescencia, asociadas en ocasiones a células malignas. El proteinograma e inmunofijación del líquido confirmó la presencia del componente monoclonal ya detectado en sangre, y tras procesar la muestra por citometría de flujo pudimos confirmar la infiltración de células plasmáticas malignas en el sistema nervioso central.
Nuestro laboratorio desempeñó un papel central y esencial en el diagnóstico de esta infrecuente complicación, mediante el uso combinado del proteinograma, la inmunofijación, la citometría de flujo y el autoanalizador hematológico, incluyendo en este último las células de alta fluorescencia, prometedor biomarcador en el cribado de la presencia de células tumorales en líquidos biológicos.
Leptomeningeal involvement in multiple myeloma is a rare and serious complication that usually occurs after relapses of the disease. To establish a correct diagnosis, it is necessary to demonstrate, by cytology, the presence of clonal plasma cells in the cerebrospinal fluid.
The clinical laboratory detected this complication in a patient diagnosed with refractory multiple myeloma after analysing a cerebrospinal fluid sample. The patient suffered from several neurological symptoms, such as faecal incontinence and lower limb mobility limitation. Pleocytosis and proteinorachia was initially observed, along with high levels of high-fluorescence cells, which are sometimes associated with malignant cells. The protein electrophoresis and immunofixation of the cerebrospinal fluid confirmed the presence of the monoclonal component, already detected in blood. After processing the sample by flow cytometry it was confirmed that there was infiltration of malignant plasma cells in the central nervous system.
This laboratory played a central and essential role in the diagnosis of this uncommon complication, by the combined use of protein electrophoresis, immunofixation, flow cytometry, and the haematology autoanalyser. This latter included the high fluorescence cells as a promising biomarker in the screening for the presence of tumour cells in biological fluids.
Mujer de 56 años diagnosticada en 2015 de mieloma múltiple quiescente tras estudio por elevación de reactantes de fase aguda en una analítica de control. Al diagnóstico se encontraba asintomática con hemograma, creatinina y calcemia dentro de los valores de referencia. Presentaba un componente monoclonal (CM) en sangre de tipo IgG-kappa de 13,75g/l sin proteinuria, con una relación de cadenas ligeras libres kappa/lambda en suero alterada (6,9mg/dl). En el aspirado medular se observó un 22% de células plasmáticas de morfología e inmunofenotipo atípicos y se le practicaron estudios genéticos que mediante hibridación de fluorescencia in situ revelaron la deleción del gen p53 (sonda TP53 [17p13]/SE 17 [Leica BIOSYSTEMS,Wetzlar, Alemania]), monosomía del cromosoma 13 (sonda DLEU1 [13q14]/13qter [Leica BIOSYSTEMS]) y reordenamiento de la región IgH (sonda XL IGH plus [14q32] [MetaSystems, Newton, Massachusetts]).
En febrero de 2017 a raíz de un dolor lumbar fue diagnosticada de mieloma múltiple sintomático en estadio IIIA con presencia de CM tanto en suero como en orina, en este último caso en forma de cadenas ligeras kappa (CLK). Fue tratada con bortezomib, talidomida y dexametasona (VTD) obteniendo una respuesta parcial al inicio, con progresión tras 4 ciclos de quimioterapia. Como segunda línea se trató con daratumumab, lenalidomida y dexametasona (DXD) sin obtener respuesta y a continuación con carfilzomib, lenalidomida y dexametasona (KRD) como tercera línea de tratamiento de nuevo sin respuesta satisfactoria.
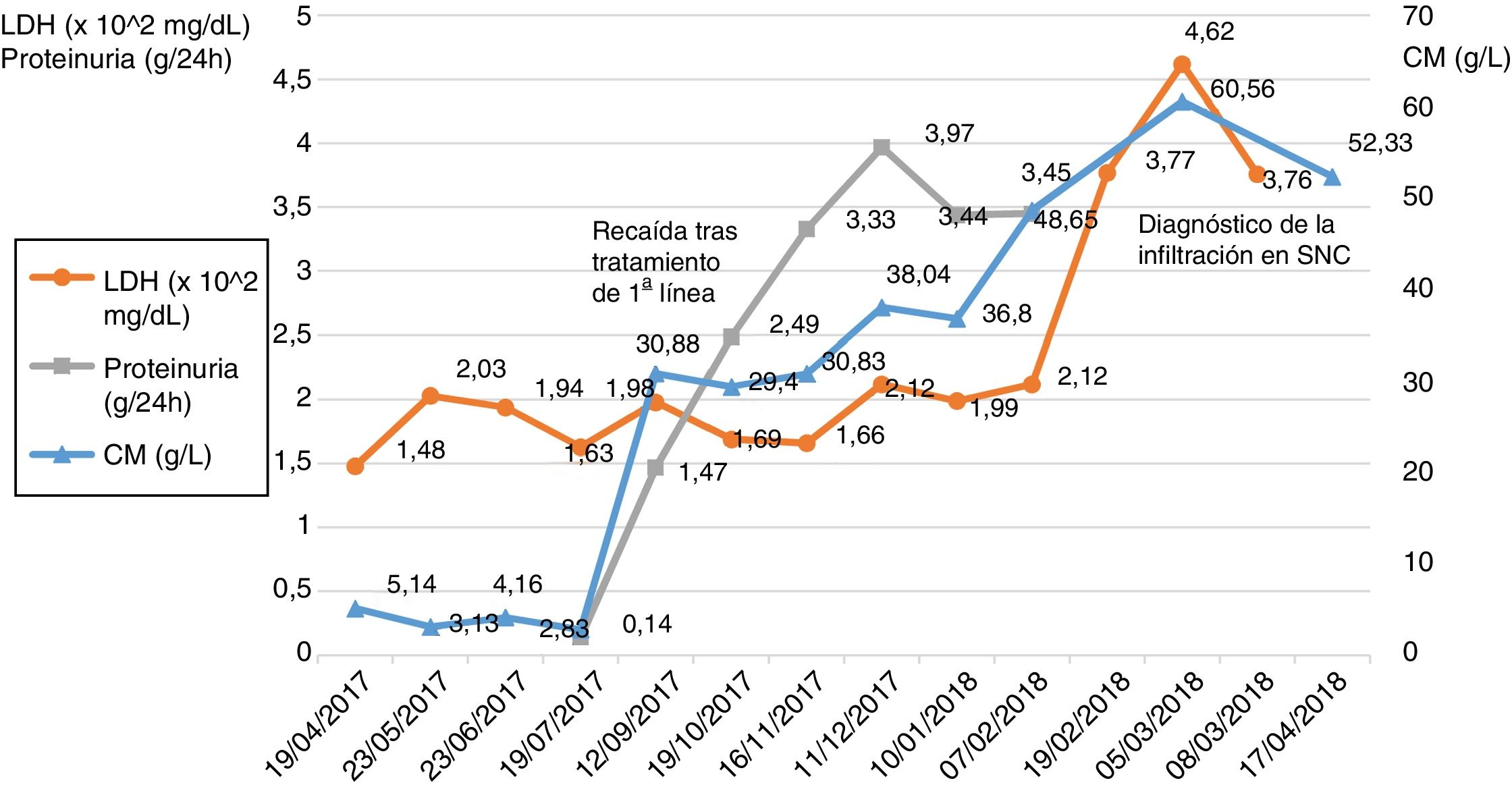
A comienzos de 2018 ingresó en el hospital por agravamiento de su enfermedad donde refirió sintomatología neurológica: incontinencia fecal y urinaria y disminución de la fuerza y movilidad en ambas extremidades inferiores sin alteración de la sensibilidad. Por ello se le practicó una resonancia magnética nuclear (RMN) en la que se observaron lesiones tumorales expansivas intrarraquídeas a nivel lumbar y sacra. En estas fechas el proteinograma (Capillarys2, Sebia, Lisse, Francia) reveló un aumento considerable del pico correspondiente al CM ya descrito (60,56g/l). En consonancia, el análisis bioquímico de la orina reportó una severa proteinuria de 3,45g/24h, muestra que por inmunofijación (Hidrasys, Sebia, Lisse, Francia), además de las CLK en zona beta, mostraba otro CM tipo IgG-kappa en gamma.
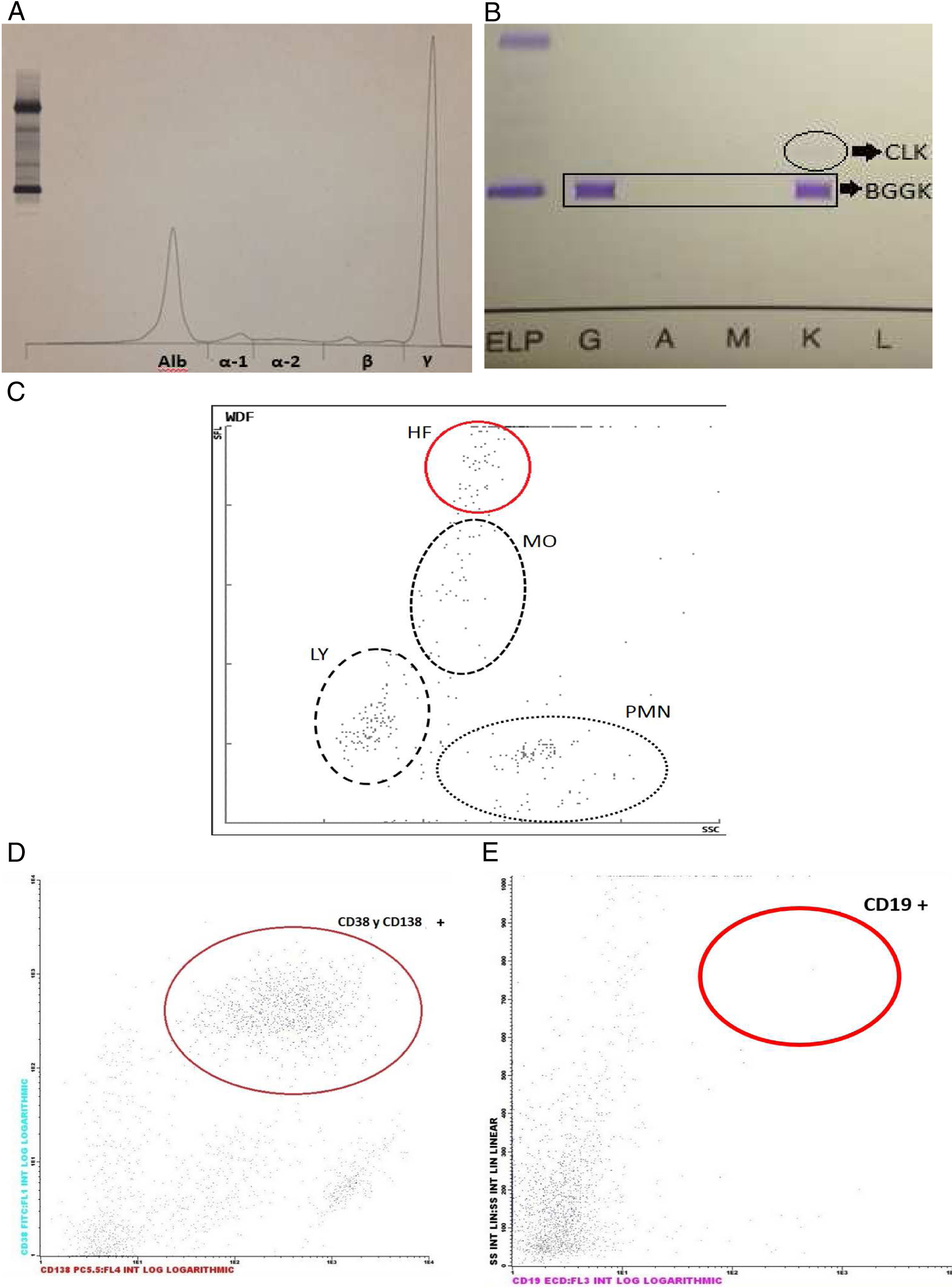
Se analizó una muestra de líquido cefalorraquídeo (LCR) para llevar a cabo estudio bioquímico y citológico (tabla 1). El recuento celular del LCR se realizó en el autoanalizador hematológico Sysmex XN-1000 (Roche Diagnostics, Mannheim, Alemania) que informó además de la presencia de células de alta fluorescencia (HF), las cuales se encuentran en ocasiones asociadas a células malignas. Como resultado del análisis se obtuvieron 30 leucocitos en el líquido con predominio mononuclear. Además, se detectaron 100 células HF por cada 100 leucocitos, lo cual hizo sospechar la infiltración maligna del LCR.
Estudio bioquímico y citológico del LCR
| Parámetro | Resultados | Intervalo de referencia |
|---|---|---|
| Glucosa | 71 mg/dl | 50-80 mg/dl |
| Proteínas | 67,32 g/l | 0,15-0,45 g/l |
| Lecucocitos | 30 leucocitos/μL | ≤ 10 leucocitos/μL |
| Porcentaje MN | 71% | - |
| Porcentaje PMN | 29% | - |
| Células HF | 100% (100 células HF/100 leucocitos) | |
| Proteinograma e inmunofijación | Banda monoclonal IgG-kappa y CLK | - |
| Citometría de flujo | 40% células plasmáticas, todas de fenotipo atípico:CD19 -, CD38+, CD138+, CD56+, CD45 - | - |
CLK:cadenas ligeras kappa; HF:alta fluorescencia; MN:mononucleados; PMN;polimorfonucleados.
El estudio bioquímico (Cobas 6000, Roche Diagnostics, Mannheim, Alemania) reveló la presencia de 67,32g/l de proteínas en el líquido, por lo que se realizó un proteinograma e inmunofijación donde se observaron dos CM: uno de tipo IgG-kappa en zona gamma y otro en zona beta de CLK (fig. 1). Además, se realizó un análisis de las poblaciones leucocitarias por citometría de flujo en el equipo Navios (Beckman Coulter, Brea, California), en el que se observó la presencia de un 40% de células plasmáticas, todas ellas de fenotipo atípico: CD19 -, CD38+, CD138+, CD56+, CD45 -.
Estudio del líquido cefalorraquídeo. A) Proteinograma mediante electroforesis capilar. Se observa una prominente banda monoclonal en la región gamma. Alb: albumina; α-1: alpha-1; α-2: alpha-2; B: beta; γ: gamma. B) Inmunofijación. Se revela la presencia de un componente monoclonal de tipo IgG-kappa y otro menos intenso de cadenas ligeras kappa. C) Citometría de flujo fluorescente. Módulo de líquidos biológicos del autoanalizador hematológico. HF: células de alta fluorescencia; LY: linfocitos; MO: monocitos/macrófagos; PMN: neutrófilos/eosinófilos. D) Citometría de flujo. Marcaje CD38 y CD138. Se observa una gran población de células positivas para estos marcadores. E) Citometría de flujo. Marcaje CD19. Se observa que la población celular es CD19 negativa.
En el momento del diagnóstico de la infiltración en sistema nervioso central los niveles séricos de lactato deshidrogenasa (LDH) se habían duplicado respecto al último mes aumentando hasta 462mg/dl (fig. 2).
A raíz de estos resultados la paciente fue diagnosticada de mieloma múltiple agresivo con afectación intrarraquídea asociado a clínica neurológica aguda. Se instauró un tratamiento de cuarta línea con radioterapia y quimioterapia a base de pomalidomida, dexametasona y tratamiento intratecal sin resultados satisfactorios. Durante las siguientes semanas desarrolló paraplejia y finalmente resultó éxitus.
DiscusiónEl mieloma múltiple (MM) es una enfermedad maligna que se caracteriza por la proliferación clonal de células plasmáticas en la m,dula ósea asociada en la mayoría de casos a la síntesis de una inmunoglobulina clonal conocida como CM. Normalmente las células del mieloma están confinadas en la médula ósea o en los compartimentos vasculares, pero en algunas ocasiones a lo largo de la enfermedad las células tumorales pueden evolucionar adquiriendo la capacidad de sobrevivir en tejidos extramedulares1.
No es infrecuente desarrollar complicaciones neurológicas en pacientes con MM o con linfoma linfoplasmocítico2 debido a desórdenes metabólicos (hipercalcemia, uremia o síndrome de hiperviscosidad), compresión de raíces nerviosas o por toxicidad relativa al tratamiento quimioterápico3. Sin embargo, a diferencia de otras neoplasias hematológicas, la infiltración leptomeníngea en el MM es considerada una complicación muy rara, presente en menos del 1% de los casos. Entre la sintomatología asociada a esta complicación destaca la cefalea, déficit visual, confusión y debilidad en extremidades4, pudiendo desarrollar alguno más grave como la paraplejia, tal y como desarrolló la paciente de este caso.
Tras procesar una muestra de LCR en el autoanalizador Sysmex XN-1000 detectamos la presencia de células HF, las cuales se caracterizan por poseer una elevada relación núcleo-citoplasma y un alto contenido en ácidos nucleicos. Algunos estudios han demostrado que la presencia de estas células es mayor en muestras malignas respecto a las benignas5. En un estudio reportado por nuestro grupo recientemente donde evaluábamos el parámetro HF como marcador de células malignas en los diferentes tipos de líquidos biológicos, obtuvimos que con un cut-off de 16 HF/μl se obtienen una sensibilidad de 92% y un valor predictivo negativo de 96%6. Así, la cuantificación de células HF supone un novedoso y prometedor parámetro de despistaje de células malignas en líquidos biológicos. Sin embargo, su falta de especificidad constituye una clara limitación, pues otros tipos celulares presentes en los líquidos biológicos (mesoteliales, macrófagos y células reactivas) también pueden ser clasificados como células HF. Además para LCR se ha reportado una correlación ligeramente menor que para el resto de líquidos, entre células HF y la presencia de células malignas5.
La pleocitosis del LCR, los niveles extremadamente elevados de proteínas y la catalogación de una gran proporción de células como HF, nos hizo sospechar de la posible infiltración leptomeníngea del mieloma múltiple ya diagnosticado. Aunque nuestro laboratorio no tuvo la oportunidad de disponer de citocentrífuga para este caso, recomendamos realizar el estudio citológico del líquido mediante su uso y tinción de May Grünwald-Giemsa, para valorar la morfología celular al microscopio y así poder evidenciar la presencia de células malignas en la muestra. La citología de LCR en otras neoplasias diferentes a mieloma tiene una limitada sensibilidad en torno al 50-60%, pero excelente especificidad (>95%) cuando es realizada por un observador experimentado7.
Cabe destacar que los niveles sanguíneos de LDH de la paciente se duplicaron tras la aparición de la sintomatología neurológica, hecho ya reportado en la bibliografía como un factor de riesgo para el desarrollo de esta complicación e incluso como un posible factor de mal pronóstico8,9. El proteinograma e inmunofijación del líquido reveló que la mayor parte del contenido proteico de la muestra estaba formado por el CM del paciente. Sin embargo, la mera presencia del CM en LCR no implica la infiltración de las células del mieloma, ya que cambios en la permeabilidad de la barrera hematoencefálica pueden permitir el paso de las inmunoglobulinas al líquido10.
Para realizar un correcto diagnóstico de la infiltración neoplásica en SNC es imprescindible la detección de células plasmáticas clonales en el LCR mediante el estudio inmunofenotípico11. El análisis de la muestra por citometría de flujo reveló la presencia de un 40% de células plasmáticas, todas de fenotipo atípico. Estas células eran CD19 negativas, con CD38 y CD138 positivas, un perfil inmunofenotípico característico de células plasmáticas patológicas y coincidente con el expresado por todos los casos de la serie reportada por Abdallah et al.4. Presentaban el fenotipo CD45 negativo, el cual está asociado a un peor pronóstico12. Sin embargo, el CD56 era positivo, lo cual contrasta con algunas publicaciones que establecen el fenotipo CD56 negativo como un posible predisponente a la infiltración de estas células en LCR8.
Nuestra paciente presentaba algunos marcadores genéticos como la deleción del gen p53, la monosomía del cromosoma 13 y el reordenamiento del gen IGH. Sin embargo, no era portadora de la translocación t (4;14), alteración descrita como factor de riesgo11. En un estudio multicéntrico reportado por Jurczyszyn et al.13, la supervivencia media para 172 pacientes era de 7 meses desde el diagnóstico de la infiltración en SNC. Sin embargo, para aquellos que incluían la presencia de> 1 anormalidad citogenética detectada por hibridación de fluorescencia in situ y al menos 1 previa a la terapia para mieloma, la media de supervivencia disminuía a 2 meses.
El origen de la infiltración leptomeníngea no está claro. Es posible que se produzca tras la destrucción de la trabécula aracnoidea o bien por diseminación hematogénica, siendo una complicación muy poco frecuente en el mieloma4. Sin embargo, algunas publicaciones apuntan a que la introducción de los nuevos agentes quimioterápicos, como la lenalidomida podrían alterar el microambiente tumoral promoviendo las infiltraciones extramedulares14, tal y como ocurrió en nuestra paciente a partir del tratamiento de segunda línea.
El pronóstico de esta complicación es extremadamente adverso, reportándose supervivencias desde el diagnóstico de la infiltración en SNC hasta la muerte de 1,5 a 2 meses10,15, tal como ocurrió en el caso presentado.
ConclusiónLa infiltración leptomeníngea en el MM es una complicación poco frecuente que puede presentarse a lo largo del curso de la enfermedad, generalmente tras recaídas de la misma.
En estos casos, y en el descrito aquí específicamente, el laboratorio ha desarrollado un papel protagonista en la sospecha diagnóstica inicial, con el hallazgo de una marcada proteinuria y proteinorraquia, elevada proporción de células HF, y un CM en gran concentración en LCR del mismo isotipo que el descrito en sangre periférica; así como en el diagnóstico, con la demostración de la presencia en LCR de células plasmáticas clonales de fenotipo atípico por citometría de flujo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.