Los datos epidemiológicos sobre infecciones de transmisión sexual (ITS) no virales en Yucatán son limitados y provienen de pruebas serológicas.
Material y métodosEstudio retrospectivo para estimar la prevalencia de ITS no virales en pacientes de Yucatán utilizando un método molecular. Se tomaron muestras urogenitales en 147 pacientes (53 hombres y 94 mujeres) para la extracción de los ácidos nucleicos. Se utilizó la reacción en cadena de la polimerasa en tiempo real para la detección simultánea de Chlamydia trachomatis, Neisseria gonorrhoeae, Mycoplasma genitalium, Mycoplasma hominis, Ureaplasma urealyticum, Ureaplasma parvum y Trichomonas vaginalis. El análisis estadístico se realizó con el test exacto de Fisher.
ResultadosLa prevalencia de ITS fue de 45,6%. Ureaplasma spp. fue el patógeno más frecuente y el sexo femenino el más afectado (p=0,022). Se detectó un 12,2% de coinfecciones con mayor frecuencia en mujeres (16,0 vs. 3,7%, p=0,035). No se encontraron diferencias significativas entre los pacientes sintomáticos (n=138) con reacción en cadena de la polimerasa positivo (n=64) y negativo (n=74). Las mujeres entre 21-40 años fueron las más expuestas a ITS (p <0,05).
ConclusionesEstos datos confirman la alta prevalencia de ITS no virales en Yucatán, siendo el primer reporte epidemiológico aplicando un método molecular.
Epidemiological data about non-viral sexually transmitted infections (STI) in Yucatan are limited and come from serological methods.
Material and methodsRetrospective study to estimate the prevalence of STI in symptomatic and asymptomatic patients from Yucatan based on a molecular method. The urogenital samples were taken from 147 patients (53 men and 94 women) to extracted nucleic acids. Real-time polymerase chain reaction was used to simultaneous detection of Chlamydia trachomatis, Neisseria gonorrhoeae, Mycoplasma genitalium, Mycoplasma hominis, Ureaplasma urealyticum, Ureaplasma parvum y Trichomonas vaginalis. Statistical analysis was performed with the Fisher's exact test.
ResultsThe prevalence of STIs was 45.6%. Ureaplasma spp. was the pathogen most frequent and the females the most affected (p=.022). It was detected 12.2% of coinfections being more frequent in women (16.0 vs. 3.7%, p=.035). No significant differences were found between symptomatic patients (n=138) with positive polymerase chain reaction (n=64) and negative (n=74). Women 21-40 years were the most exposed to STIs (p<.05).
ConclusionsThese data confirm the high prevalence of non-viral STIs in Yucatán, being the first epidemiological report based on a molecular method.
En México, las infecciones de transmisión sexual (ITS) representan un problema de salud al ubicarse entre las diez primeras causas de morbilidad, con un promedio de más de 220 000 casos anuales en edades entre los 15 y los 44 años1. Son responsables del 25% de los trastornos en la fertilidad; 15% para las mujeres y 10% para los hombres2. En Yucatán, los registros epidemiológicos sobre ITS pudieran estar subestimados porque muchas de estas patologías son asintomáticas, se limitan a infecciones como VIH, Treponema pallidum, Chlamydia trachomatis (C. trachomatis) y Papilomavirus, proceden de grupos poblaciones particulares, y porque no todas las infecciones son de notificación obligatoria a la Secretaria de Salud1–4.
En la actualidad, los micoplasmas y ureaplasmas han adquirido relevancia por su interés médico, quienes son considerados como flora normal del tracto genitourinario, pero cuyas colonizaciones también se asocian a diversos cuadros patológicos incluyendo infertilidad en ambos sexos5. En México se han reportado prevalencias variables del 5 al 30%, siendo Ureaplasma urealyticum (U. urealyticum [UU]) el más diagnosticado6.
La detección de patógenos causantes de ITS es difícil porque los métodos convencionales como el cultivo y la serología no son suficientemente óptimos. En cambio, las técnicas de reacción en cadena de la polimerasa (PCR) han demostrado mayor sensibilidad (90-95%) y especificidad (95%), siendo capaces de detectar entre 15-20% más infecciones que por cultivo, y entre 25-70% más que por serología7–9. Además, ofrecen el diagnóstico en menor tiempo, permiten identificar coinfecciones y discriminar especies como Ureaplasma parvum y UU cuyas patogenicidades varían para algunas condiciones clínicas10,11.
El objetivo de este estudio fue estimar la prevalencia de siete patógenos no virales de transmisión sexual en una muestra de pacientes yucatecos, con base a una prueba molecular.
Material y métodosEstudio retrospectivo en 147 pacientes consecutivos, hombres y mujeres, sintomáticos y asintomáticos, que acudieron al Laboratorio Biomédico de Mérida remitidos de los servicios de Ginecología y Urología de diferentes hospitales de la ciudad de Mérida en Yucatán, entre mayo de 2013 y julio de 2015. Se consideró población sintomática a los pacientes que acudieron a consulta por alguna manifestación clínica genitourinaria (descarga o flujo vaginal anormal, disuria, inflamación pélvica) o patología (infertilidad, aborto recurrente, endometriosis). La población asintomática se definió como todos los pacientes remitidos para chequeo sin presentar signos o síntomas clínicos de infección urogenital. Se excluyeron los pacientes que refirieron haber recibido terapia antimicrobiana tres semanas previas al estudio. Se obtuvo el consentimiento informado por escrito de todos los individuos. El estudio fue aprobado por el Comité de Ética en Investigación del Centro Médico de las Américas de Yucatán.
Se tomaron muestras uretrales y endocervicales con escobillón de poliamida (Industria Ruiz-Sánchez S.A. de CV) y se depositaron en viales conteniendo 1mL de solución buffer fosfato (PBS 1X). Todas las muestras se trasladaron al Departamento de Biología Molecular en cajas isotérmicas y se conservaron a 4°C. El tiempo transcurrido entre la toma de muestra y su procesamiento no excedió las cuatro h. El material genético se obtuvo con un kit comercial (Stratec, Alemania) a partir de 200 uL de muestra previamente homogenizada mediante agitación con vórtex. La identificación de los patógenos se realizó en un termociclador CFX96 (BioRad) empleando una PCR múltiple en tiempo real (Anyplex™ II STI-7 Detection, Seegene) para la detección simultánea de C. trachomatis, Neisseria gonorrhoeae (NG), Mycoplasma genitalium (MG), Mycoplasma hominis (MH), UU, Ureaplasma parvum (UP) y Trichomonas vaginalis. Un control interno en cada PCR permitió monitorear el aislamiento del ácido nucleico y detectar posibles inhibidores.
A 54 pacientes sintomáticos (n=138) se les realizó estudio microbiológico (observación, tinción y cultivo) por indicación médica. Los pacientes con disuria y/o cistitis con cultivo positivo fueron descartados. La detección de micoplasmas y ureaplasmas se realizó únicamente por PCR, al no disponer de técnicas microbiológicas para su identificación.
De cada paciente se registró edad, sexo e impresión diagnóstica. No fue posible evaluar la exposición a factores de riesgo (orientación sexual, estatus marital, número de parejas sexuales, métodos anticonceptivos empleados, adicción a drogas por vía parenteral y antecedente personal de ITS). Todos los sujetos se consideraron étnicamente mestizos, siendo definidos como individuos nacidos en el país con, al menos, un apellido hispano y/o maya, y con antecedentes familiares de ancestría mexicana hasta dos generaciones. Las variables categóricas se reportaron como frecuencias absolutas y porcentajes y la edad como media±desviación estándar. La prevalencia se expresó en porcentaje. La comparación de proporciones se realizó con el test exacto de Fisher. El nivel de significación estadística fue de p<0,05.
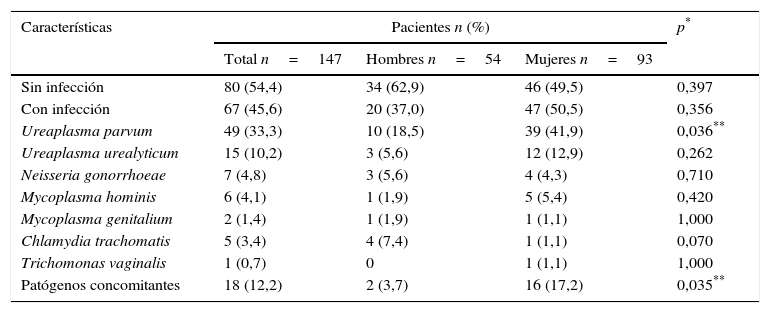
ResultadosSe estudiaron 147 pacientes, 54 hombres (36,7%) y 93 mujeres (63,3%) entre 18 y 63 años. La edad promedio fue de 33,4±8,67 años. De las 147 muestras 67 (45,6%) fueron positivas para, al menos, un microorganismo; de ellas, 47 (70,1%) correspondieron al sexo femenino (p=0,356). El 43,5% de las infecciones fueron causadas por Ureaplasma spp., siendo UP la especie más frecuente (33,3%) y las mujeres las más afectadas (41,9%, p=0,036). Para el resto de los patógenos la prevalencia fue menor al 10% sin diferencia entre sexos (p>0,05). Se encontró un 12,2% (n=18) de coinfecciones con mayor incidencia en el sexo femenino (p=0,035), siendo Ureaplasma spp. y Mycoplasma spp. las más concomitantes (6,4%) (tabla 1). La presencia simultánea de UP y UU solo se detectó en mujeres sintomáticas (3,4%, n=5), en quienes el cultivo microbiológico fue negativo.
Frecuencia de los patógenos identificados por PCR múltiple en tiempo real
| Características | Pacientes n (%) | p* | ||
|---|---|---|---|---|
| Total n=147 | Hombres n=54 | Mujeres n=93 | ||
| Sin infección | 80 (54,4) | 34 (62,9) | 46 (49,5) | 0,397 |
| Con infección | 67 (45,6) | 20 (37,0) | 47 (50,5) | 0,356 |
| Ureaplasma parvum | 49 (33,3) | 10 (18,5) | 39 (41,9) | 0,036** |
| Ureaplasma urealyticum | 15 (10,2) | 3 (5,6) | 12 (12,9) | 0,262 |
| Neisseria gonorrhoeae | 7 (4,8) | 3 (5,6) | 4 (4,3) | 0,710 |
| Mycoplasma hominis | 6 (4,1) | 1 (1,9) | 5 (5,4) | 0,420 |
| Mycoplasma genitalium | 2 (1,4) | 1 (1,9) | 1 (1,1) | 1,000 |
| Chlamydia trachomatis | 5 (3,4) | 4 (7,4) | 1 (1,1) | 0,070 |
| Trichomonas vaginalis | 1 (0,7) | 0 | 1 (1,1) | 1,000 |
| Patógenos concomitantes | 18 (12,2) | 2 (3,7) | 16 (17,2) | 0,035** |
El 46,4% (n=64) de los pacientes con evidencia de infección activa o reciente y el 44,4% (n=4) de los asintomáticos fueron positivos para alguno de los patógenos evaluados (p=1,00); en estos últimos, los microorganismos detectados fueron UP (n=2), MH (n=1) y NG (n=1).
No se encontraron diferencias significativas entre los pacientes sintomáticos (n=138) con PCR positivo (n=64) y negativo (n=74) ni al estratificar por sexos (p>0,05). Se excluyeron del análisis los sujetos asintomáticos debido a su reducido número (n=9).
Entre los sintomáticos con PCR positivo, el 73,4% (47/64) correspondió a UP y el 23,4% (15/64) a UU, de ellos, 57,8% (37/64) y 18,8% (12/64) respectivamente fueron mujeres.
El 56,5% de los pacientes fueron remitidos por probable diagnóstico de ITS sin especificar síntomas o signos. Las manifestaciones clínicas registradas fueron: flujo vaginal (14,3%), enfermedad inflamatoria pélvica (5,4%), disuria (4,1%) y úlcera genital (0,7%). El 4,1% de las mujeres fueron remitidas por infertilidad y el 1,4% por aborto recurrente. El rango de edad de los pacientes con PCR positivo fue de 18 a 53 años, siendo las mujeres de 21-40 años las más afectadas (p<0,05).
De los 54 pacientes sintomáticos con indicación de estudio microbiológico en 13 (24,1%), se identificaron las siguientes especies no asociadas a ITS: Escherichia coli (n=5), Candida albicans (n= 4), Enterococcus faecalis (n=2), Candida glabrata (n=1) y Staphylococcus haemolyticus (n=1). De los 7 pacientes con PCR positivo para NG, tres fueron detectados por microbiología: 2/4 hombres y 1/3 mujeres. Todos estaban sintomáticos excepto uno. No se identificó CT por cultivo.
DiscusiónEn Yucatán, no existen datos sobre la prevalencia de ITS estimada por métodos moleculares, ni se conoce la frecuencia de los micoplasmas urogenitales (MH, MG, UP y UU) y su relación con infecciones genitourinarias de hombres y mujeres. En este estudio se observó una alta prevalencia de Ureaplasma spp. con predominio de UP, siendo el sexo femenino el más afectado (tabla 1). La presencia de Ureaplasma spp. en mujeres ha sido reportada previamente9,11–14, encontrándose en el cérvix y la vagina en el 40-80% de asintomáticas sexualmente activas11–14. Su presencia también se ha asociado con enfermedad inflamatoria pélvica, uretritis, endometritis posparto, mortalidad y morbilidad perinatal13–15, por lo que su papel patogénico permanece sin definir. En este estudio, la tasa de infección por UP fue mayor que por UU en mujeres sintomáticas (p=0,0031). Similar comportamiento fue descrito en jóvenes norteamericanas, reportándose una prevalencia significativamente mayor de UP en sintomáticas (54%) en comparación con las asintomáticas (16%)16. Por el contrario, en población australiana UP y UU se identificaron en el 54,5 y 27% de mujeres sintomáticas y en el 49,5 y 21,9% en las aparentemente sanas respectivamente (p>0,05)14. Por su parte, De Francesco et al.17 encontraron una positividad para UP y UU de 80 y 20% en sintomáticas italianas con respecto al 95 y 5% respectivamente de asintomáticas (p<0,05). Estos autores también reportaron un predominio significativo de las serovariantes UP3 en edades entre 21-25 años y T960 (UU) entre 26-30 años y en mayores de 40. Ambas serovariantes se asociaron con la pérdida de lactobacilos, mientras que UP6 correlacionó con flora vaginal normal (p<0,05). Aunque existen evidencias de una variabilidad en la virulencia de cepas de Ureaplasma spp. con probables consecuencias clínicas18–21, está por definir si estas relaciones se deben a la virulencia bacteriana per se, la respuesta inmune del hospedero, la interacción con factores ambientales o a un efecto combinado. De ser así, la detección más idónea para ureaplasmas debería enfocarse a la identificación de serovariantes de riesgo. Aunque no existe consenso sobre la necesidad del tamizaje rutinario de Ureaplasma spp., algunos autores lo recomiendan durante el embarazo, principalmente en el caso de UU por su asociación con patógenos o por ser cofactor de enfermedades ginecológicas22,23.
Con respecto al género Mycoplasma spp., se detectó una positividad baja (5,5%, n=8) estando en el rango reportado para la población mexicana (5-30%)24–26. La escasa presencia de MG (1,4%, n=2) se ubica en el rango de frecuencia reportada para la mayoría de las poblaciones (1-10%)27,28. La coinfección con Ureaplasma spp. se observó únicamente en 6,4% de las mujeres sintomáticas (flujo vaginal recurrente) entre 24-39 años, siendo MH y UP los patógenos más frecuentes. El hecho de que estas pacientes tuvieran cultivo negativo nos hace sugerir a estos microorganismos como probables causantes de la sintomatología clínica y no simples colonizadores del tracto genital. Un estudio realizado en el Instituto Nacional de Perinatología en México para conocer la prevalencia de MH y UU en población no embarazada, encontró un 3,9% de positividad mixta correspondiente el 64,7% a MH y el 35,3% para UU29. Otros autores han documentado mayor prevalencia de UU con respecto a MH28–31 en portadoras sintomáticas, pero en estos estudios UP no fue incluido en los tamizajes. En la mujer, factores como la edad, alteraciones en la mucosa genital por el uso de antisépticos, toallas sanitarias y tampones, consumo de anticonceptivos orales o intrauterinos, los cambios hormonales, metabólicos y en la respuesta inmune, pueden modificar la flora vaginal haciéndola más susceptible a estos microorganismos31,32.
En nuestro criterio, existen pocos estudios relacionados con la distribución geográfica de Ureaplasma spp. y Mycoplasma spp. El hecho de que estas especies colonicen las mucosas de individuos sanos en diferentes poblaciones trasmitiéndose sexualmente y ocasionando una sintomatología, sugiere, que la variación en su prevalencia pudiera estar asociada no solo con diferencias geográficas, número de parejas y preferencias sexuales, sino también con la predisposición genética, la etnia y/o el estatus inmunológico.
En este estudio CT fue el segundo patógeno más prevalente en hombres aunque con una baja frecuencia (7,5%). Sin embargo, es importante comentar que en determinadas circunstancias puede ser causa de uretritis no gonocócica, epididimitis aguda y prostatitis, pero también puede presentarse de forma subclínica en el 30% de los afectados32,33. En México, son escasos los reportes sobre prevalencia de clamidiasis en hombres en comparación con los estudios en mujeres3. Esto puede deberse a que las consecuencias de la infección son más severas en el sexo femenino (embarazo ectópico, enfermedad pélvica inflamatoria, infertilidad tubárica), mientras que en los hombres no parece provocar secuelas a largo plazo32,33. No obstante, el tamizaje masculino sería beneficioso porque conllevaría a una disminución de la infección en mujeres, en quienes la condición asintomática alcanza entre el 75-85% de los casos34.
En cuanto a la infección por gonococo, la incidencia general fue baja (4,8%, n=7) y similar en ambos sexos (p>0,05). Sin embargo, el porcentaje femenino fue mayor (4,3%) al reportado por Casillas-Vega (2,11%) utilizando PCR en 662 pacientes de Jalisco, Guadalajara35, mientras que Cravioto et al.33 en primigestas del centro del país encontraron una alta frecuencia (10%) de anticuerpos IgA anti-NG (infección probablemente activa). Al comparar con el estimado de la OMS en mujeres americanas (0,8%), la prevalencia en nuestro medio es muy superior36. Es oportuno comentar que los datos epidemiológicos para NG reportados por la OMS, se basan en los métodos de tinción y cultivo, que resultan menos sensibles (> 85%) que las pruebas de amplificación de ácidos nucleicos (90%), por lo que pudiera existir un subregistro de casos positivos37. Con respecto al sexo masculino, la bacteria se detectó en dos de los tres pacientes que refirieron tener clínica compatible con gonococo. Es probable que el paciente asintomático con PCR positivo y cultivo negativo fuera un falso positivo, ya que en los hombres la infección urogenital cursa habitualmente de forma sintomática. En este caso, el diagnóstico de NG es difícil; porque los métodos moleculares pueden ofrecer falsos positivos en poblaciones de bajo riesgo debido a reacciones cruzadas con otras especies de Neisseria no patogénicas37,38, o bien porque se trata de una infección no activa. Por otra parte, solo el 50-70% de los hombres asintomáticos resultan positivos a la tinción de Gram37,38, mientras que por cultivo la sensibilidad disminuye a 67-85%39. Por ello, hay autores que sugieren confirmar estos resultados positivos con la amplificación del gen ARN ribosomal 16S40. Ya existen métodos de amplificación de ácidos nucleicos (denominados V-PCR) que tienen la ventaja de combinar la alta especificidad y sensibilidad de la PCR cuantitativa con la habilidad para discriminar bacterias viables y no viables sin necesidad de recurrir a los laboriosos métodos de cultivo celular. Una PCR de este tipo ya fue validada para CT41. Desde el punto de vista epidemiológico, en poblaciones europeas y asiáticas se ha reportado una alta incidencia (86-89%) de infección gonocócica asintomática en hombres entre 18 y 34 años42, por el contrario, en Estados Unidos (n=16 850) la prevalencia encontrada es baja (0-1,5%)43. Hasta donde sabemos, en México no existen datos para este grupo poblacional.
Con respecto a la edad, la mayor positividad se observó entre los 21-40 años, coincidiendo con la población sexualmente más activa y la más vulnerable a ITS en México (41%)1. El 44,7% de las infecciones en este rango de edad correspondió al sexo femenino. Entre los factores que inciden en este comportamiento están el insuficiente conocimiento sobre los riesgos en cada relación sexual, conductas y actitudes que comprometen la salud de la pareja y la baja frecuencia en el uso del condón35.
La principal limitante de este estudio fue no haber podido relacionar el tipo de patógeno con la condición clínica, debido al escaso número de pacientes remitidos con diagnóstico presuntivo. Tampoco pudo establecerse asociación con factores de riesgo por la dificultad en acceder a información veraz relacionada con los hábitos sexuales de los participantes. Se ha señalado que la declaración voluntaria de conductas y hábitos sexuales no predice satisfactoriamente el riesgo de infección o la clasificación de grupos de riesgo por el tabú que conllevan las enfermedades de transmisión sexual44,45.
ConclusiónLa detección molecular de ITS no virales podría ser adoptada en nuestro medio como una opción diagnóstica porque ofrecería oportunidades terapéuticas más rápidas y eficaces, a la vez que permitiría obtener datos epidemiológicos confiables. Nuestra recomendación a la limitante de los altos costos de los actuales kit comerciales, sería la estandarización de PCR «in house» validados con ensayos de referencia. Este es el primer reporte de prevalencia de ITS no virales en Yucatán obtenido con un método molecular.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
FinanciaciónEste trabajo fue financiado por el Laboratorio Biomédicos de Mérida, Yucatán, México.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.