La monitorización de pacientes con síndrome coronario agudo (SCA) con stent cardíaco, tratados con clopidogrel resulta conveniente, dada la frecuencia con que dichos pacientes no responden adecuadamente al tratamiento. En efecto, según nuestra experiencia, aproximadamente un 30% de casos pueden clasificarse como pacientes no respondedores (NR). No está establecido si pacientes NR presentan, como factor de riesgo, mayor número de microagregados plaquetarios (MAP) que los pacientes respondedores (R). La formación de MAP puede afectar a la microcirculación y es un factor de riesgo de formación de trombos mayores, por lo que su estudio puede resultar de gran interés.
Material y métodosSe han valorado 78 pacientes consecutivos con un stent cardíaco implantado. El tratamiento consiste en un bolo inicial de 300mg de clopidogrel, seguido de una dosis diaria de clopidogrel (75mg) y ácido acetilsalicílico (100mg). Aproximadamente 1 semana después de iniciado el tratamiento, se determina, mediante citometría de flujo (EPICS-XL, Beckman-Coulter, Izasa), el número MAP circulantes y los formados ex vivo por acción del ADP 2,5μM. Para ello, con voluntarios sanos, se selecciona previamente la población plaquetaria, en función del forward y side scatter y por ser eventos CD61-positivos. En esta región se elige la subpoblación que ocupa el 5% superior, en la que, por definición, se encuentran los MAP. Una vez establecido el protocolo de adquisición de datos, se analizan las muestras problema. Los pacientes se clasifican como respondedores o no, en función de la exposición de CD62 plaquetaria inducida por acción de ADP 2,5μM.
ResultadosEl conjunto de 78 pacientes presenta mayor número de MAP circulantes que los controles (167±58/5.000 plaquetas frente a 113±56/5.000 plaquetas; p<0,001). El incremento en el número de MAP por acción de ADP es similar en los 50 controles y en los 51 pacientes que responden adecuadamente al tratamiento. Los 27 pacientes NR presentan mayor respuesta al ADP que los pacientes R, con un incremento en el número de MAP de 251±75/5.000 plaquetas, significativamente mayor que en los pacientes R (196±67/5.000 plaquetas; p<0,001).
ConclusionesLa técnica propuesta posibilita la detección de MAP formados espontáneamente y por acción del ADP, lo que permite monitorizar el tratamiento antiplaquetario en los pacientes SCA con stent implantado.
It is not well established whether non-responder patients(NR) to clopidogrel show, as a risk factor, higher number of platelet microaggregates (PMAs) than responder patients (R). These MAPs can affect the microcirculation and is a risk factor to forming larger thrombi, therefore the present study is interesting from this point of view.
Material and methodsSeventy-eight acute coronary syndrome (ACS) patients (78% male, aged 62.8±12.23 years) were included in this study. These patients underwent coronary stent implantation and treated with routine medication (clopidogrel 75mg/day and aspirin 100mg/day), after a loading bolus of 300mg clopidogrel. The control group was made up of 50 healthy volunteers matched for age and gender who had not been given any pharmacological treatment. Using whole blood flow cytometry, ADP-stimulated and circulating platelet CD62 expression and platelet microaggregates was determined in the entire study population. After a week of treatment the number of circulating platelet microaggregates was evaluated by flow cytometry (EPICS-XL, Beckman-Coulter, Izasa), and the number of MAPs formed ex vivo by ADP 2.5μM activation was also evaluated . With this aim, using healthy individuals, the platelet population was selected by their forward and side scatter values and as CD61-positive events. The subpopulation that occupied the upper 5% in this region where MAPs are detected,was chosen. After the analytical conditions were established, samples were analyzed. Patients were responders, or not, depending on the CD62 expression after being activated with ADP 2.5μM.
ResultsSeventy-eight patients showed a higher number of circulating MAPs than controls (177±75/5000 platelets vs. 121±62/5000 platelets; P<0.001). The increase in the MAPs number by ADP activation is higher in the 50 controls than in the 51 responder patients (79±45% vs. 23±18%; P<0.001). The 27 NR patients reacted to ADP in a similar way than controls, with a increase in the number of MAPs of 62±43%, significantly higher than in R (P<0.001). The findings of this study demonstrate the beneficial effects of clopidogrel in reducing platelet reactivity in 66% of the study patients. These results demonstrate the wide inter-individual variability in ADP response in patients treated with clopidogrel and imply that individualized monitoring of this type of patient is advisable.
ConclusionsThe method described enables us to explore platelet microaggregates formation and may be of great help in monitoring clopidogrel efficacy in ACS patients with stent.
Actualmente está bien establecido que la activación y agregación plaquetarias juegan un papel crítico en la patogénesis de los síndromes coronarios agudos. A pesar de la terapia plaquetaria habitualmente aplicada (clopidogrel 75mg/día+ácido acetil salicílico [AAS] 100mg/día], la incidencia de trombosis en pacientes con un stent implantado continúa siendo del 0,5 al 3,3% de los casos1–5. En la mayoría de éstos la medicación se aplica de forma empírica, sin monitorizar el grado de efectividad antiplaquetaria del tratamiento, por lo que no suelen detectarse los pacientes no respondedores o poco respondedores al tratamiento. Clopidogrel es un profármaco que, después de su metabolización hepática por acción del citocromo P-450 3A4, se transforma en la sustancia activa. Ésta bloquea irreversiblemente el receptor principal del ADP (P2Y12) con lo que se impide el crecimiento y estabilización del agregado plaquetario inicial. La trombosis de stent se asocia con alta morbimortalidad que, dado el papel que juegan las plaquetas en los episodios trombóticos, puede relacionarse con una peor respuesta a la terapia antiplaquetaria aplicada.
La falta de control del tratamiento también significa un coste económico innecesario, al administrar un fármaco que no ejerce la acción prevista. No hay una definición universalmente admitida6–11 de qué se entiende por paciente no respondedor o poco respondedor (NR) frente a los pacientes que responden adecuadamente a la medicación (R). La elevada incidencia de reactividad plaquetaria, pese al tratamiento aplicado, debida al bloqueo incompleto del receptor P2Y12 es un factor de riesgo de trombosis de stent12, por lo tanto, las medidas encaminadas a un mejor bloqueo de dicho receptor, deben conducir a una mejor evolución clínica de los pacientes sometidos al implante de un stent13.
A pesar de que algunos autores sugieren que la baja respuesta al clopidogrel se asocia con un mayor riesgo de trombosis10,14, hasta el momento hay pocos datos acerca de la falta de respuesta al clopidogrel, menos todavía acerca de los posibles mecanismos de tal falta de respuesta y ninguno acerca de la formación de microagregados plaquetarios (MAP) en esta patología. La presencia de estos pequeños agregados plaquetarios puede iniciar la formación de grandes agregados, que pueden producir una oclusión vascular15. Por tanto, la valoración de estos microagregados puede resultar de gran interés para predecir el posible desarrollo de un episodio trombótico16. Los métodos utilizados habitualmente para valorar la terapia antiplaquetaria no permiten obtener información acerca de pequeños, aunque significativos, cambios en el número de MAP formados espontáneamente o por estímulo de agonistas.
La citometría de flujo permite cuantificar rápidamente la expresión de CD62 en la superficie plaquetaria antes y después de estimular con ADP. Simultáneamente permite valorar la presencia de otras subpoblaciones celulares, como los MAP, tanto los formados espontáneamente como los formados por estimulación con ADP. Por estas razones ha sido la técnica analítica elegida para la realización del presente estudio, cuyo principal objetivo es valorar la presencia de tales MAP en pacientes con implante de stent tratados con clopidogrel y relacionar la presencia de dichos microagregados con la respuesta a la medicación.
Material y métodosPacientes y controlesEl grupo objeto de estudio estaba constituido por 78 pacientes admitidos en el Servicio de Cardiología del Hospital Universitario la Fe de Valencia. El reclutamiento se realizó de forma consecutiva entre los pacientes ingresados con el diagnóstico de síndrome coronario agudo (SCA) y que reunían las siguientes características: a) no llevar de forma previa clopidogrel como parte de su tratamiento; b) recibir dosis de carga de clopidogrel según las guías de práctica clínica17, y c) que se les implantara al menos 1 stent coronario. Todos los que no cumplían estas condiciones fueron excluidos. Todos los pacientes reclutados recibieron una dosis inicial de 300mg de clopidogrel. El grupo control estaba constituido por 50 voluntarios sanos, comparables a los pacientes en edad y sexo. Los pacientes y controles se reclutaron para el estudio tras dar su conformidad por escrito, de acuerdo con las normas éticas de nuestro hospital. Todos los pacientes se sometieron al tratamiento antiplaquetario habitual (clopidogrel 75mg+AAS 100mg/ día)18. Los análisis citométricos se realizaron, como mínimo, 5 días después de iniciado el tratamiento, de acuerdo con nuestros resultados preliminares.
Métodos y reactivosLa activación plaquetaria espontánea, la estimulada por ADP y la formación de MAP, se determinaron mediante citometría de flujo (Epics XL-MCL, Beckman-Coulter, FL, USA), de acuerdo con las normas europeas19. La sangre fresca anticoagulada con citrato (129mmol/l; 9:1, v/v) se recogió en tubos siliconados por punción venosa de la vena antecubital, con un mínimo estasis tras 12h de ayuno. Los ensayos se iniciaron dentro de los primeros 30min tras la extracción de la sangre, sin agitar, a temperatura ambiente y en tubos de polipropileno. Las muestras se procesaron por duplicado y los resultados corresponden a la media aritmética±desviación estándar (DE).
Para evaluar la expresión de CD62, 10μl de sangre anticoagulada se diluyó con 100μl tampón HEPES (Hepes 10mM; NaCl 150mM; KCl 5mM; MgSO4 1mM; glucosa 10mM; pH 7,4, 290 mOsm). Se añadieron 5μl de CD62.FITC (Immunotech, Marseille, France), 5μl de CD61.PE (Pharmingen, CA, USA) y 3μl de tampón (para valorar las plaquetas espontáneamente estimuladas) o 3μl de ADP 100 o 200μM (concentración final 2,5μM o 5μM), para medir la reactividad al ADP. La mezcla se incubó en reposo, temperatura ambiente y oscuridad durante 20min. Seguidamente se añadieron 1.000μl de HEPES a cada tubo. Las muestras se evaluaron inmediatamente por citometría de flujo y se analizaron 5.000 eventos CD 61 positivos .
La determinación de MAP se efectuó de acuerdo con la metodología descrita por Matzdorff et al20. Según dichos autores, en la región correspondiente a las plaquetas se crea, con un grupo control, una subregión que incluye al 5% de los eventos con mayor valor de forward scatter que, por tanto, son de mayor tamaño que el resto de células. A los eventos incluidos en esta región se les define como MAP. Una vez fijadas las condiciones de adquisición de datos, se analizan las muestras problema. Los resultados correspondientes indican el número de MAP/5.000 plaquetas.
Los datos fueron adquiridos con el System II software (Beckman-Coulter, FL, USA), y los resultados se refieren a 5.000 plaquetas analizadas. Con los datos de expresión de CD62 inducida por ADP en el grupo control, se obtuvo el valor medio y la DE correspondiente. Con estos datos se calculó a “one tail” el límite inferior de respuesta normal al ADP, con un límite de confianza del 95% (media aritmética –1,29 DE). Los pacientes cuyo porcentaje de plaquetas activadas tras la estimulación con ADP superase este límite inferior de normalidad, fueron clasificados como NR al clopidogrel. El análisis estadístico de los resultados se realizó con el programa SPSS, versión 12.0. Los valores de p<0,05 se consideraron estadísticamente significativos.
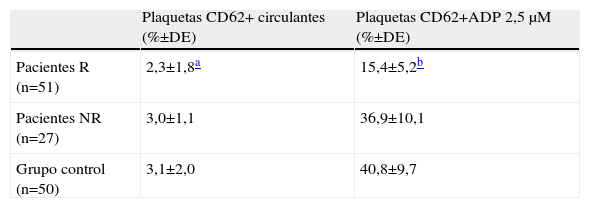
ResultadosEn la tabla 1 se muestran los resultados obtenidos, en la que se indica el porcentaje de plaquetas que expresan CD62 en su membrana, tanto las activadas espontáneamente en la circulación, como las activadas ex vivo con ADP 2,5μM. Como puede observarse, no se aprecian diferencias estadísticamente significativas en el porcentaje de plaquetas activadas espontáneamente entre los pacientes y el grupo control. Tampoco se observa diferencias significativas entre los pacientes NR y el grupo control en lo relativo a su activación con ADP. Por el contrario, los pacientes R, que respondieron adecuadamente al tratamiento con clopidogrel, cuando se activan ex vivo con ADP, sólo se activa el 15,4±5,2% de sus plaquetas, en tanto que en el grupo control se activa el 40,8±9,7% (p<0,001). También puede observarse que en el grupo de pacientes NR, cuando se estimula ex vivo con ADP, se consigue una activación del 36,9±1,1%, similar a la del grupo control. En la tabla 1 se observan unos elevados valores de las DE, lo que sugiere una gran variabilidad interindividuos, tanto entre los pacientes como en los controles, con relación a la expresión plaquetaria de CD62.
Valor medio, desviación estándar y significación estadística de los parámetros indicados en los pacientes con síndrome coronario agudo con stent y el grupo control
| Plaquetas CD62+ circulantes (%±DE) | Plaquetas CD62+ADP 2,5μM (%±DE) | |
| Pacientes R (n=51) | 2,3±1,8a | 15,4±5,2b |
| Pacientes NR (n=27) | 3,0±1,1 | 36,9±10,1 |
| Grupo control (n=50) | 3,1±2,0 | 40,8±9,7 |
NR: pacientes que no responden adecuadamente al clopidogrel; R: pacientes que responden adecuadamente al clopidogrel.
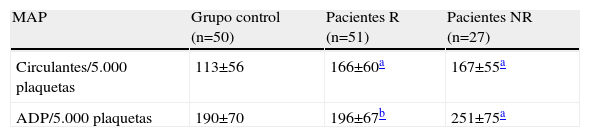
En la tabla 2 se resumen los datos relativos a la formación de MAP/5.000 plaquetas formados espontáneamente y tras estimular con ADP 2,5μM. Se aprecia que los pacientes SCA con stent, con independencia de su respuesta al clopidogrel, presentan un número mayor de MAP circulantes, formados espontáneamente, que el grupo control. Tras estimular con ADP, los pacientes R, que tienen bloqueado por el clopidogrel el receptor del ADP, aumentan muy poco el número de MAP (196±67/5.000 plaquetas), en tanto que los pacientes NR, que no tienen bloqueado dicho receptor, aumentan significativamente el número de dichos MAP (251±75/5.000 plaquetas) respecto al grupo control (190±70/5.000 plaquetas; p<0,001).
Valor medio del número de microagregados plaquetarios (MAP) formados espontáneamente y por acción del ADP en los pacientes con síndrome coronario agudo (SCA) con stent y el grupo control
| MAP | Grupo control (n=50) | Pacientes R (n=51) | Pacientes NR (n=27) |
| Circulantes/5.000 plaquetas | 113±56 | 166±60a | 167±55a |
| ADP/5.000 plaquetas | 190±70 | 196±67b | 251±75a |
NR: pacientes que no responden adecuadamente al clopidogrel; R: pacientes que responden adecuadamente al clopidogrel.
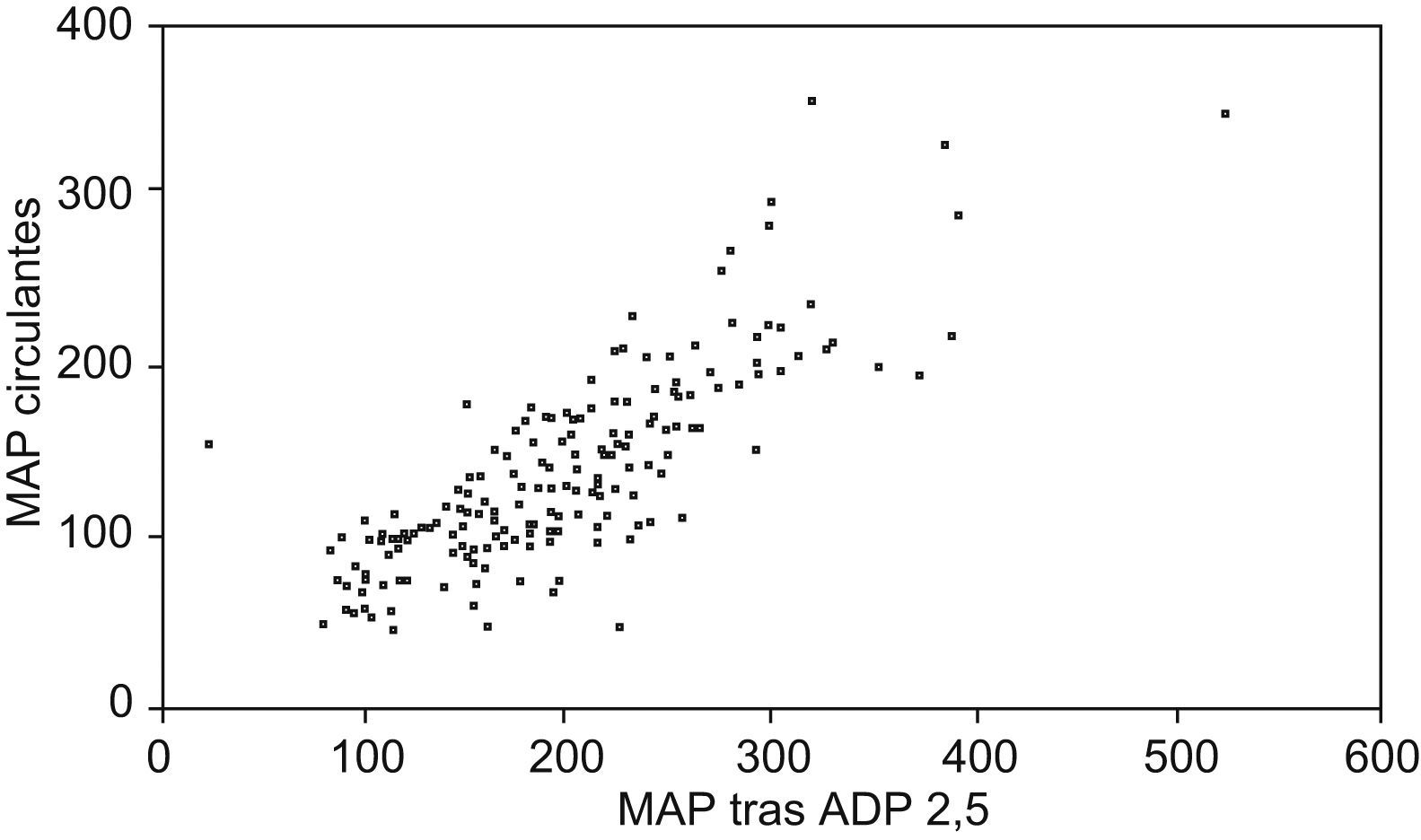
En la figura 1 se observa una buena correlación (r=0,798; p=0,000) entre el número de MAP circulantes, formados espontáneamente, y los formados por estimulación con ADP. Esto sugiere que la medida del número de microagregados circulantes en éste tipo de pacientes, podría ser un buen marcador de riesgo de trombosis de stent.
DiscusiónDe acuerdo con los resultados del presente estudio, los pacientes que responden adecuadamente al tratamiento con clopidogrel muestran una significativa menor respuesta al ADP que los pacientes NR, tal como sugiere la menor expresión de CD62 plaquetaria tras estimular con dicho agonista. En general, esta observación está de acuerdo con lo descrito por otros autores21,22.
Los resultados obtenidos indican que aproximadamente un 34% de los pacientes incluidos en el estudio no responden adecuadamente a la medicación aplicada, lo que resulta comparable a lo comunicado por otros grupos de trabajo22–24.
Aunque el mecanismo por el que determinados pacientes no responden adecuadamente al clopidogrel no han sido bien establecidos, algunos autores lo asocian a variaciones interindividuales en su absorción intestinal25, a variaciones genéticas del citocromo responsable de la metabolización26, a variaciones genéticas del receptor P2Y127 y a la interacción con otros fármacos cuya metabolización también depende del citocromo P450 3A4 (CYP3A4). Esta falta de consenso acerca del mecanismo más probable de la resistencia al clopidogrel, sugiere la necesidad de realizar más amplios estudios multicéntricos.
En cuanto a la formación de MAP, no se pueden comparar los resultados obtenidos en el presente estudio con los de otros grupos de trabajo, dada la falta de referencias bibliográficas relacionadas con el tema. Ya que parece bien establecida la relación entre la presencia de estos pequeños agregados y el riesgo de desarrollar un trombo mayor15,16, parece aconsejable su valoración en pacientes de alto riesgo. Según nuestra experiencia, la determinación de dichos microagregados mediante citometría de flujo es rápida y reproducible, por lo que aconsejamos su realización.
En general, los resultados del presente estudio muestran una gran variabilidad interindividual de respuesta al ADP. Este hecho, que también ha sido puesto de relieve por otros autores10,25, aconseja la monitorización individualizada del tratamiento antiplaquetario, principalmente porque la evaluación de pacientes con baja respuesta al clopidogrel podría ayudar a identificar a los pacientes con mayor riesgo, que podrían beneficiarse de una estrategia antiplaquetaria intensificada28. La metodología utilizada en el presente estudio proporciona al clínico una herramienta útil para decidir qué paciente es susceptible de aumentar la dosis de clopidogrel, cambiar de fármaco (podría recomendarse prasugrel, AZD6140 o cangrelor) o aplicar triple terapia antiplaquetaria. Sería necesario disponer de una técnica analítica consensuada para realizar extensos estudios interhospitalarios, con un tamaño de muestra suficiente, con el fin de establecer conclusiones que relacionasen claramente la respuesta clínica al tratamiento con los datos analíticos obtenidos.
Este trabajo corresponde a una comunicación científica presentada y premiada en el I Congreso Nacional del Laboratorio Clínico celebrado en Sevilla del 17 al 20 de octubre de 2007