Con la evaluación del ensayo de cadenas ligeras libres en suero Kappa y Lambda (FLC), pretendemos colaborar en la imprescindible estandarización internacional de esta técnica. Su utilidad en el diagnóstico y seguimiento de mielomas, gammapatías de significado incierto (MGUS), amiloidosis, plasmocitomas solitarios etc. está ampliamente demostrada en la bibliografía, las guías clínicas internacionales las incluyen para el específico diagnóstico de las discrasias de células plasmáticas.
Material y métodosSe evaluó un nuevo reactivo N-Látex CLL para nefelometría, basado en anticuerpos monoclonales, que lleva adjunto un reactivo suplementario específico, que fue desarrollado con inmunoglobulinas de ratón.
ResultadosLa exactitud y precisión del método evaluadas con controles de 3 niveles de concentración fueron aceptables. Se ha comparado este reactivo con el Freelite®, procesando 30 muestras de pacientes, por el nefelómetro BNII (Siemens), se solventaron los falsos positivos del 2.°. Así mismo, se comparó el método por nefelometría (BN II) frente a turbidimetría (SPA PLUS) los resultados fueron favorables a la nefelometría. En cuanto a sensibilidad y especificidad del método evaluado, se realizaron las curvas ROC, con 60 pacientes y se obtuvieron resultados con una moderada correlación.
DiscusiónConsideramos que la falta de reproductibilidad en la cuantificación de las FLC existente, se debía a los factores: alta variabilidad entre los lotes de reactivos de la misma casa comercial; diferencias en los resultados de las muestras con elevadas concentraciones de FLC por no incluir el chequeo de exceso de antígeno, y diferencias en los principios de medida de los autoanalizadores utilizados.
Evaluation of testing of serum free light chains Kappa and Lambda (FLC), to collaborate on the essential international standardization of this technique. Its usefulness in diagnosis and follow-up of myeloma, Gammapatías of undeterminated significance (MGUS), amyloidosis, solitary plasmocitomas etc. is amply demonstrated in the literature, the international clinical guidelines include them for the specific diagnosis of the discrasias of plasma cells.
Material and methodsWe evaluated a new reagent N-Látex CLL for Nephelometry, based on monoclonal antibodies, which leads attached a supplementary reagent specific, which was developed with mouse immunoglobulins.
ResultsThe accuracy and precision of the method evaluated with 3 levels of concentration controls were acceptable. It has been compared this reagent with the existing 30 samples from patients with the nephelometer BNII (Siemens), false positives of the 2nd were overcome. Likewise compared the method by nephelometry (BN II) against turbidimetry (SPA PLUS) the results were favourable to the nephelometry reference technique. In terms of sensitivity and specificity of the evaluated method, ROC curves, with 60 patients were conducted and results with a moderate correlation.
DiscussionWe believe that the lack of reproducibility in the quantification of the FLC due to factors: high variability between batches of reagents in the same commercial House; differences in the results of the samples with high concentrations of FLC, for not including the checking of antigen excess, and differences in the principles of the used clinical measurement.
Las gammapatías monoclonales han sido diagnosticadas durante años por la aparición de un componente monoclonal (CM) en suero u orina en la electroforesis, y la identificación de su isotipo mediante inmunotipado o inmunofijación. Recientemente el cociente Kappa/Lambda libre se ha incluido en las guías clínicas del International Working Group on Múltiple Myeloma1. Este cociente, aumenta la especificidad del diagnóstico de las discrasias de células plasmáticas, y permite identificar mejor las amiloidosis, plasmocitomas solitarios etc., pues sabemos que las células plasmáticas producen un exceso del 40% de cadenas ligeras, que da lugar a la presencia de cadenas ligeras libres (FLC) en el plasma. El incremento de la producción y la liberación de FLC al plasma es un valioso marcador diagnóstico en los desórdenes de células plasmáticas. Se han desarrollado ensayos específicos en nefelometría, turbidimetría y ELISA. El uso de anticuerpos específicos que reconocen epítopos expresados en las FLC, que están normalmente ocultos en el complejo con las cadenas pesadas, es la clave para obtener la especificidad analítica para la detección de las cadenas ligeras libres, pero no de las ligadas. El desarrollo de estudios específicos para FLC es complicado por el hecho de que solamente unos pocos epítopos de competencia constante están disponibles para el reconocimiento específico de las FLC; la formación de multímeros, especialmente por la FLC Lambda, reduce posteriormente el número de sitios de unión elegibles2.
La cuantificación de FLC monoclonales en suero por métodos inmunoquímicos fue difícil porque no existe un material de referencia internacional disponible. La calibración es generalmente realizada con FLC policlonal, epítopos muy diferentes de los FLC monoclonales, las FLC monoclonales se encuentran en un rango de concentración amplio y pueden polimerizar. También merece especial atención las concentraciones de antígeno que excedían el rango de la curva Heidelberger-Kendall, daban como resultado reacciones antígeno-anticuerpo subóptimas y lecturas falsamente bajas3.
En el año 2001, Bradwell4 puso a punto un método para medir la concentración de cadenas ligeras libres en suero, con adaptación automatizada a nefelometría, que utilizaba como reactivo un Látex con partículas policlonales de oveja, con un calibrador que era un pool de sueros humano con altas concentraciones de FLC policlonales y una sensibilidad de 3,6mg/l para las cadenas ligeras Kappa y 5,6mg/l para las Lambda. En el 2011, Veltthuis2 consiguió otro reactivo de partículas de látex, con anticuerpos monoclonales de ratón, para nefelometría, cuyo calibrador era FLC policlonales purificadas en PBS con un 1% de albúmina, cuya sensibilidad fue de 0,174mg/l para las cadenas ligeras Kappa y 0,47mg/l para las Lambda.
Hemos evaluado este nuevo ensayo inmuno-nefelométrico: N-Látex CCL, Siemens, para la cuantificación de FLC Kappa y Lambda en suero con sistemas BN de Siemens, constituido por anticuerpos monoclonales y que en su protocolo lleva una pre-reacción para el chequeo del exceso de antígeno, que realiza la dilución apropiada de la muestra antes de comenzar su medición, especialmente importante para analitos como las FLC libres. Presenta también una buena consistencia lote a lote, entre diferentes lotes de reactivo, calibradores y reactivo suplementario2.
Materiales y métodosInstrumentación, reactivos, procedimientosEvaluamos un nuevo reactivo: N-Látex CLL Kappa, N FLC Kappa, REF: OPJA (3x1,7ml) y N-Látex CLL Lambda, N FLC Lambda REF: OPJB (3x2,1ml), que llevan un reactivo adicional: reactivo suplementario N CLL REF: OPJC, (Siemens), para nefelometría BN. Se realizó la curva de calibración en el BN II, con el N CLL estándar SL, REF: OPJD, n.° de LOTE: 473406, de concentraciones: Kappa libre: 21,9mg/l, Lambda libre: 30,5mg/l, el N diluyente REF: OUMT, y Cleaner SCS REF: OQUB19.
Controles: N CLL control SL 1 REF: OPJE, LOTE: 473507, concentraciones: Kappa libre: 12,8 (10,2-15,4) mg/l y Lambda libre: 12,0 (9,6-14,4) mg/l y N CLL control SL 2, REF: OPJF, LOTE: 473607, concentraciones: Kappa libre: 32,6 (26,1-39,1) mg/l y Lambda libre: 32,5 (26,0-39,0) mg/l. Consideramos 3 niveles de control: SL1 como nivel medio y SL2 como nivel alto, y obtuvimos el nivel bajo diluyendo el SL1 al ½ con agua destilada, con concentración de Kappa libre: 6,4 (3,8-9) mg/l y Lambda: 6,0 (4,8-8,4) mg/l, adaptándonos a los intervalos de referencia, para CLL Kappa: (6,7-22,4) mg/l y para CLL Lambda: (8,3-27,0) mg/l.
Curva de referencia: las diluciones seriadas de N CLL estándar SL son realizadas automáticamente, utilizando N diluyente, para Kappa: 1/20 a 1/640 y para Lambda: 1/10 a 1/320. Utilizamos el LOTE n.° 473406, los rangos de linealidad fueron para la Kappa de: 0,0342-1,0950mg/l y para la Lambda: 0,0953-3,050mg/l, y valores de Kappa libre=21,9mg/l y Lambda libre=30,5mg/l.
Medición de muestras: el sistema BN diluye las muestras automáticamente a 1:100 con N diluyente para N-Látex CLL Kappa y al 1:20 para N-Látex CLL Lambda.
Prerreacción frente a un exceso de antígeno: al ejecutarla, se evita que las muestras con un alto contenido de antígenos expresen resultados falsamente bajos, ya que la cantidad de anticuerpos presentes no es suficiente para que se unan a todos los antígenos.
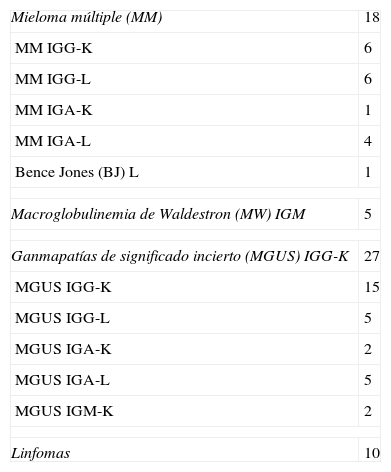
Diseño y población estudiadaUtilizamos para los estudios de correlación de métodos y equipos, 30 sueros de pacientes con discrasia de células plasmáticas de nuestro hospital (tabla 1), y para el estudio con curvas ROC, 60 sueros patológicos (tabla 2).
Pacientes estudiados para la correlación de métodos y equipos
| Mieloma múltiple (MM) | 8 |
| MM IGG-K | 1 |
| MM IGG-L | 4 |
| MM IGA-L | 2 |
| Bence Jones (BJ) 1 | 1 |
| Macroglobulinemia de Waldestron (MW) IGM | 1 |
| Ganmapatías de significado incierto (MGUS) IGG-K | 12 |
| MGUS IGG-K | 4 |
| MGUS IGG-L | 4 |
| MGUS IGA-L | 3 |
| MGUS IGM-K | 1 |
| Linfomas | 9 |
Pacientes estudiados para curvas ROC
| Mieloma múltiple (MM) | 18 |
| MM IGG-K | 6 |
| MM IGG-L | 6 |
| MM IGA-K | 1 |
| MM IGA-L | 4 |
| Bence Jones (BJ) L | 1 |
| Macroglobulinemia de Waldestron (MW) IGM | 5 |
| Ganmapatías de significado incierto (MGUS) IGG-K | 27 |
| MGUS IGG-K | 15 |
| MGUS IGG-L | 5 |
| MGUS IGA-K | 2 |
| MGUS IGA-L | 5 |
| MGUS IGM-K | 2 |
| Linfomas | 10 |
Estos pacientes habían sido diagnosticados por el Servicio de Hematología, tras realizarse en nuestro laboratorio la cuantificación del CM por electroforesis capilar sérica, en el Capillarys 2.0 (SEBIA) y posterior inmunotipado con antisueros (SEBIA), así como la cuantificación de inmunoglobulinas y b2-microglobulina por nefelometría (BN II). Así mismo el CM en orina, en el Hydrasys Focussing (SEBIA), por electroforesis e inmunofijación y cuantificación nefelométrica (BN II), de cadenas ligeras libres (New-Scientific). Estos pacientes se archivaron en un fichero informatizado (File Marker Pro).
Criterios utilizados para su diagnóstico, fueron los de la Fundación Internacional del Mieloma Múltiple5:
- 1.
CM en suero: IgG> 3g/dl, IgA> 2g/dl, IgM>1g/dl y en orina: cadenas ligeras Kappa o Lambda libres<1g/l.
- 2.
Plasmocitosis monoclonal en médula ósea>10% y/o presencia de plasmocitoma biopsiado.
- 3.
Disfunción orgánica relacionada con el mieloma (uno o más criterios):
Calcio sérico>10,5mg/dl
Creatinina>2mg/dl
Hemoglobina<10g/dl
Para la evaluación preliminar del reactivo N-Látex FLC se ha seguido el procedimiento propuesto en la Guía EP10-A3: «Preliminary Evaluation of Quantitatice Clinical Laboratory Measurement Precedures; Aproved Guideline» 3.ª ed. del Clinical and Laboratory Standards Institute (antes NCCLS)6. Empleado en nuestro laboratorio para la evaluación de nuevos métodos, desde su acreditación de calidad, Norma UNE-EN-ISO 15189. Consiste en la repetición de 10 controles (bajo, medio y alto) en 5 días consecutivos, ordenados de la siguiente forma: C medio, C alto, C bajo, C medio, C medio, C bajo, C bajo, C alto, C alto, C medio y la aplicación de un análisis estadístico de regresión múltiple lineal a los datos obtenidos, con lo que se obtiene información sobre la linealidad, sesgo, arrastre e imprecisión del método estudiado7.
Se estudió la imprecisión interdia con controles de la misma casa comercial (Siemens) en 3 niveles, durante 20 días consecutivos y la misma curva de calibración. Se aplicó el CV <6%, aconsejado por la Comisión de Proteínas de la SEQC, que facilitó la bibliografía necesaria8.
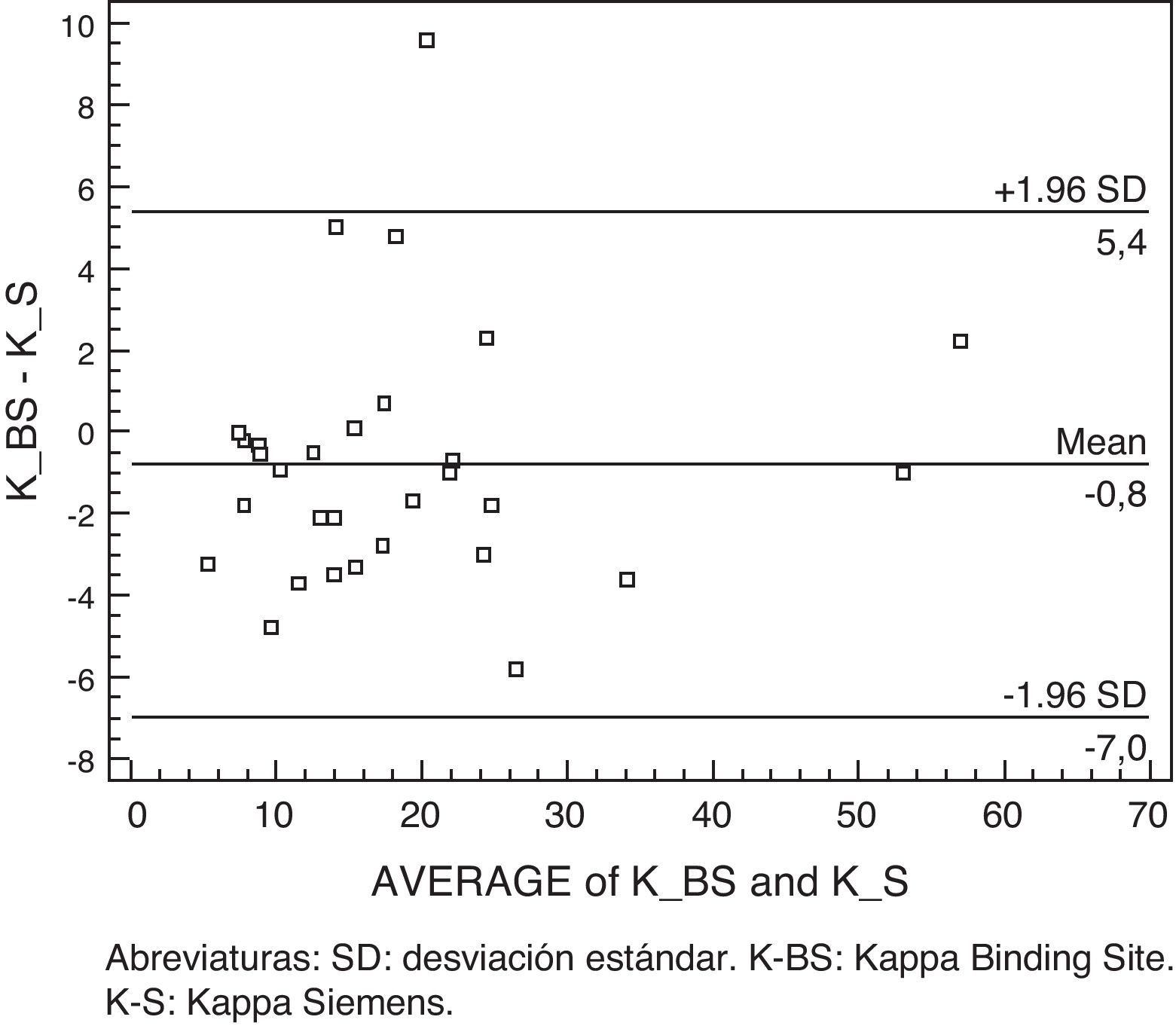
Para comparar los 2 métodos: CCL y Freelite® en el mismo equipo: nefelómetro (BN II), utilizamos el método gráfico de Bland-Altman (fig. 1), que consiste en representar gráficamente el promedio de cada pareja de datos frente a su diferencia, de tal manera que proporciona unos límites de concordancia a partir del intervalo de confianza (1,96 SD) para la diferencia de 2 mediciones9. También evaluamos los datos por Passing y Bablok.
Se estudió la correlación entre los 2 equipos, nefelómetro BN II y turbidímetro SPA PLUS, con el reactivo Freelite®, mediante las mismas gráficas de Bland-Altman y Passing y Bablok.
Se realizaron curvas ROC, con el paquete estadístico SPSS versión 15.0, con los resultados de Kappa, Lambda libre y su cociente, para ver la sensibilidad y especificidad de ambos métodos, en el nefelómetro BN II (Siemens).
Resultados- 1.
Evaluación del nuevo reactivo CCL-Látex para Kappa y Lambda libres por nefelometría: estudio de linealidad, sesgo, arrastre e imprecisión por regresión múltiple.
Como coeficiente de variación (CV) se aceptó <6%, obtenido de la bibliografía8, debido a la ausencia de datos consensuados por otras sociedades científicas.
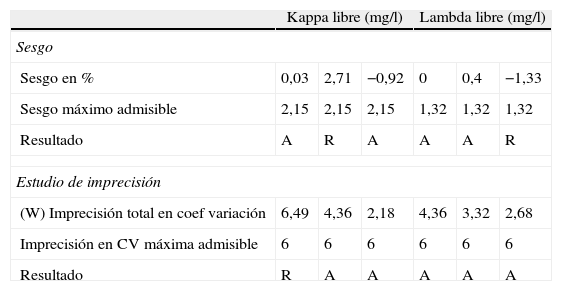
El reactivo Kappa libre CCL presenta los siguientes resultados: los niveles de control bajo y alto, cumplen perfectamente el sesgo máximo admisible, y el nivel medio presenta una ligera desviación, que es poco significativa: 2,71 (sesgo máximo admisible 2,15).
El reactivo de Lambda libre CCL, refleja los resultados siguientes: el programa acepta los controles bajo y medio en cuanto al sesgo, y el nivel alto: 1,33 (sesgo máximo admisible 1,32).
ImprecisiónPara la Kappa libre CCL, los niveles de controles medio y alto cumplen la imprecisión máxima admisible. El nivel bajo: 6,49 (CV<6%) influencia de la dilución.
La Lambda libre CCL: los resultados de imprecisión son aceptados en los 3 niveles de controles.
La tabla 1 recoge los resultados del estudio EP-10 realizado para la Kappa libre y para la Lambda libre, de sesgo e imprecisión.
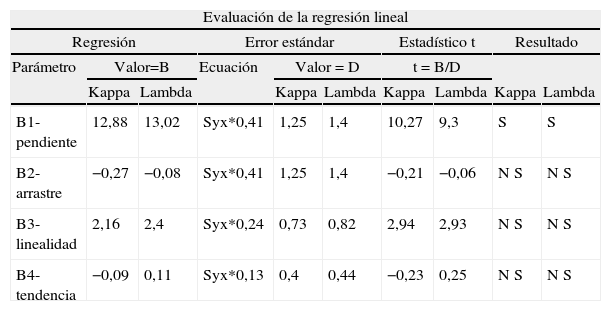
Regresión linealEl reactivo Kappa CCL: cumple los criterios exigidos por la normativa utilizada ya que los parámetros relativos al arrastre, no linealidad y tendencia han resultado con un valor Estadístico t «no significativo» tal y como exige la guía que empleamos6.
El reactivo de Lambda libre CCL: cumple los criterios de aceptación de la recta de regresión lineal y los requisitos exigidos por la Guía que hemos empleado (EP-10 A3)6. La tabla 2 recoge estos resultados.
- 2.
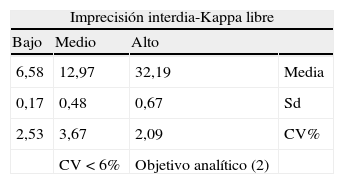
Imprecisión interdia de kappa y lambda libres en suero: con la repetición seriada durante 20 días de los 3 niveles de controles descritos, bajo, medio y alto, comprobamos que para el objetivo analítico fijado: CV<6%, los valores para la Kappa de CV fueron: 2,53, 3,67 y 2,09% y para la Lambda de 1,83, 1,64 y 1,44% respectivamente, cumpliendo dicho requisito (tabla 3).
Tabla 3.Sesgo e imprecisión de Kappa y Lambda libre CCL
Kappa libre (mg/l) Lambda libre (mg/l) Sesgo Sesgo en % 0,03 2,71 −0,92 0 0,4 −1,33 Sesgo máximo admisible 2,15 2,15 2,15 1,32 1,32 1,32 Resultado A R A A A R Estudio de imprecisión (W) Imprecisión total en coef variación 6,49 4,36 2,18 4,36 3,32 2,68 Imprecisión en CV máxima admisible 6 6 6 6 6 6 Resultado R A A A A A A: aceptado; r: rechazado.
- 3.
La comparación del método CCL con el Freelite®, en el mismo equipo: nefelómetro BN II, se realizó con 30 muestras de suero de pacientes hematológicos, anteriormente descritos.
Kappa libre: para dicha comparación se utiliza el método gráfico propuesto por Bland y Altman, que se muestra en la fig. 1, en el que el nivel de concordancia entre ambas mediciones (Freelite® vs CCL) se encuentra en la mayoría de los casos estudiados dentro del intervalo de confianza, lo cual implica que entre ambas mediciones no existen diferencias clínicamente significativas.
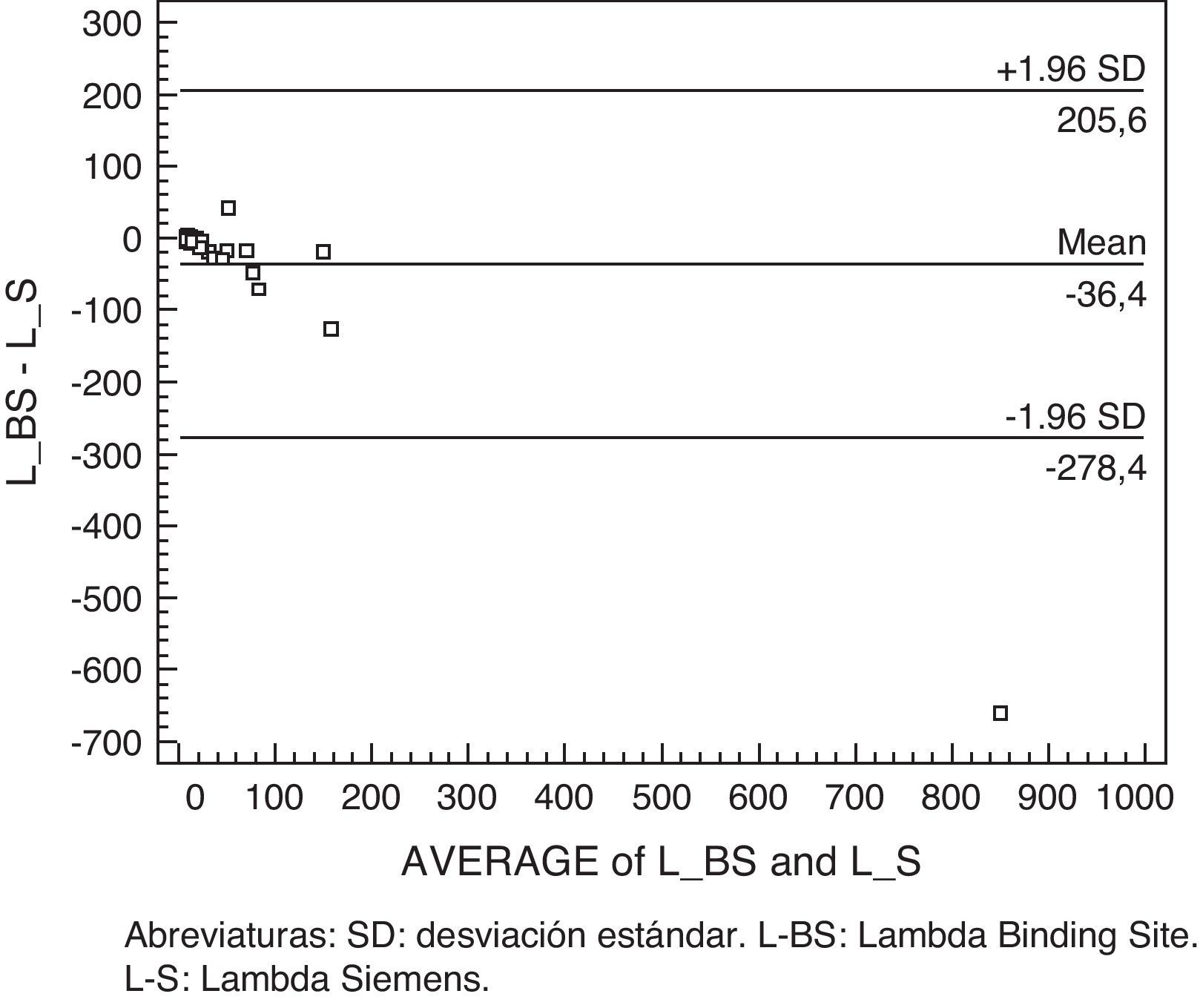
Lambda libre: observamos una discrepancia entre ambos métodos, que sobrepasa el intervalo de confianza (1,96 SD), así observamos 3 casos con concentraciones dispares: 34 vs 23.800, 46,5 vs 118 y 5,9 vs 1.180 (mg/l) Freelite® vs CCL (fig. 2).
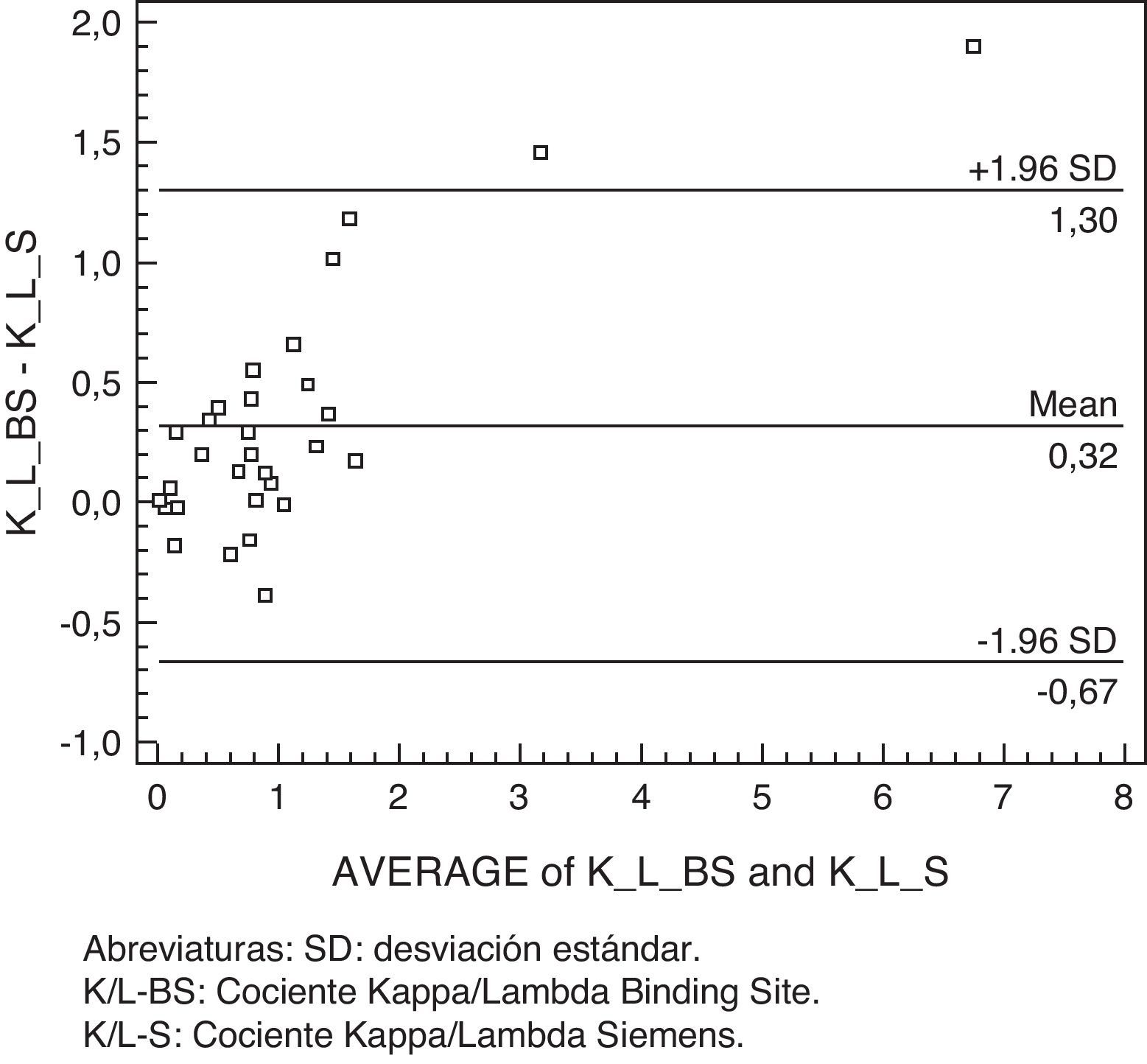
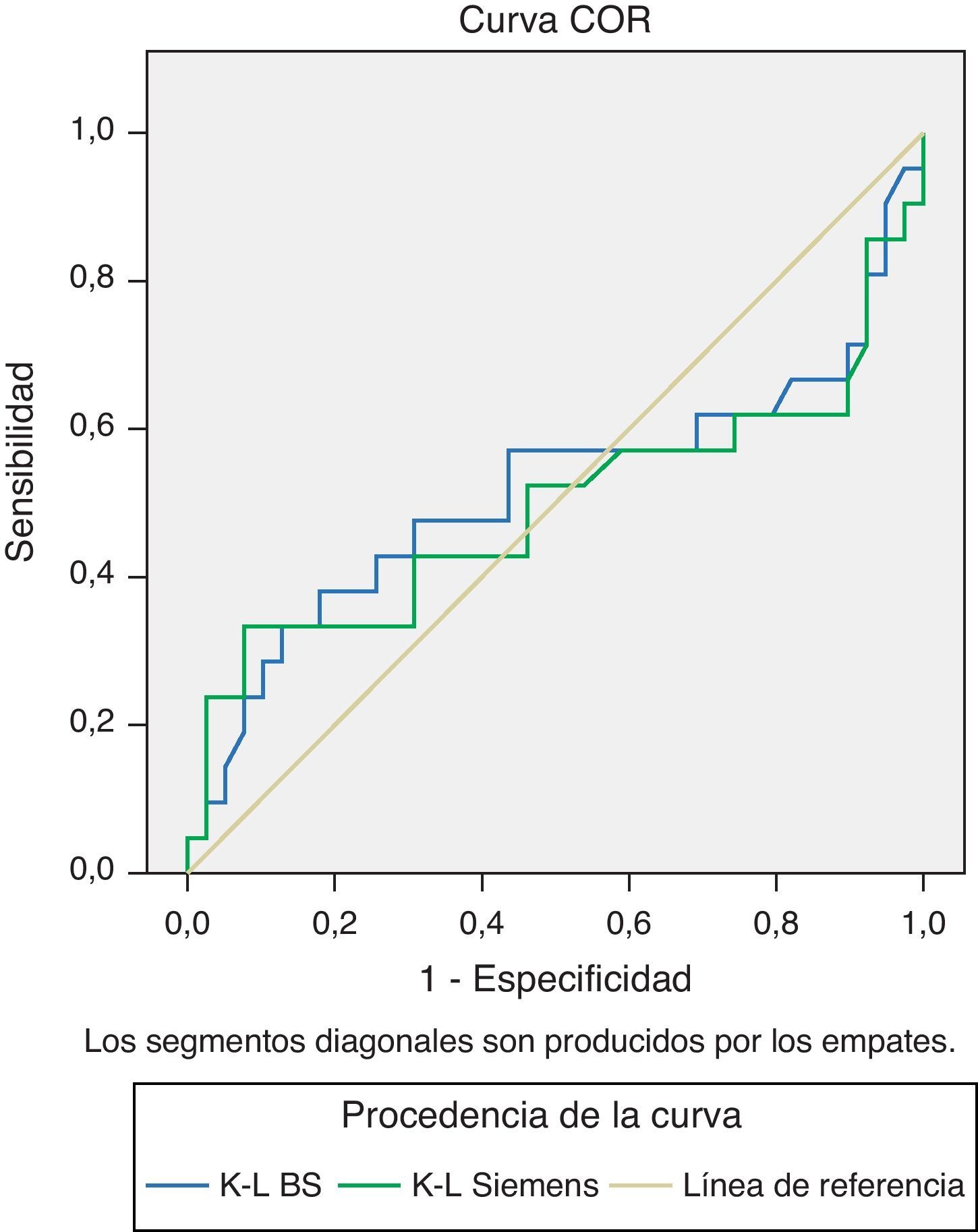
Cociente Kappa/Lambda libre: considerando como rango diagnóstico (100%), clínicamente significativo, para el cociente K/L= 0,26-1,65, observamos buena concordancia a valores normales y alguna discrepancia en valores patológicos(fig. 3).
Estudio de correlación de métodos: Passing Bablok, obtuvimos un coeficiente de correlación r aceptable, entre los 2 métodos a estudio: Freelite® y CLL por nefelometría (BN II) tablas 4 y 5
Tabla 4.Regresión lineal de Kappa y Lambda libre CCL
Evaluación de la regresión lineal Regresión Error estándar Estadístico t Resultado Parámetro Valor=B Ecuación Valor = D t = B/D Kappa Lambda Kappa Lambda Kappa Lambda Kappa Lambda B1-pendiente 12,88 13,02 Syx*0,41 1,25 1,4 10,27 9,3 S S B2-arrastre −0,27 −0,08 Syx*0,41 1,25 1,4 −0,21 −0,06 N S N S B3-linealidad 2,16 2,4 Syx*0,24 0,73 0,82 2,94 2,93 N S N S B4-tendencia −0,09 0,11 Syx*0,13 0,4 0,44 −0,23 0,25 N S N S Tabla 5.Imprecisión interdia (interserie) de la Kappa y Lambda libre CCL
Imprecisión interdia-Kappa libre Bajo Medio Alto 6,58 12,97 32,19 Media 0,17 0,48 0,67 Sd 2,53 3,67 2,09 CV% CV < 6% Objetivo analítico (2) Imprecision interdia-Lambda libre Bajo Medio Alto 6,11 12,03 31,95 Media 0,11 0,20 0,46 Sd 1,83 1,64 1,44 CV% CV < 6% Objetivo analítico (2) Sd: desviación standard; CV: coeficiente de variación.
- 4.
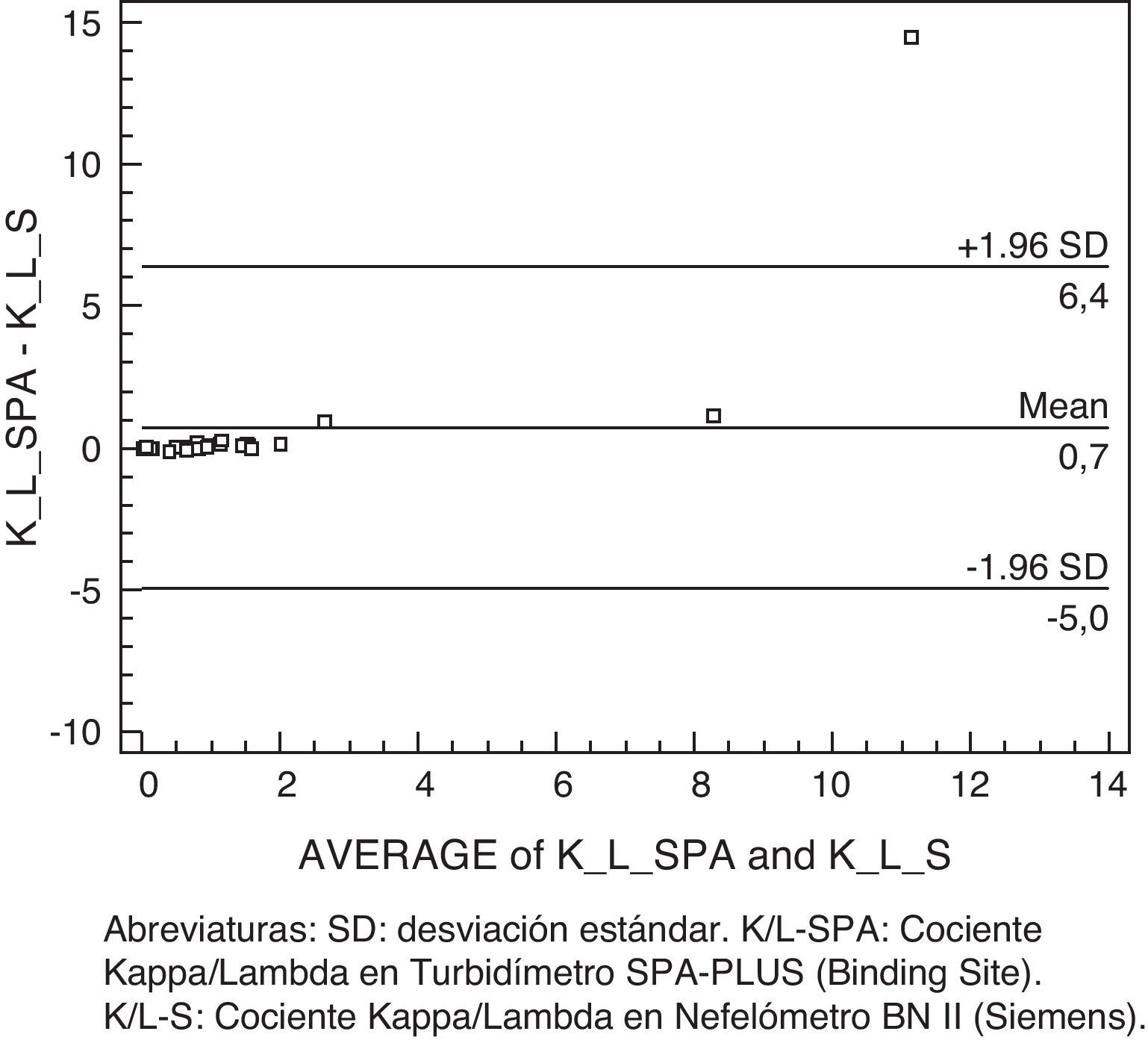
La comparación del nefelómetro (BN II) y turbidímetro (SPA PLUS), con el reactivo Freelite, se realizó también con el método gráfico de Bland-Altman, se encuentra algún caso fuera del intervalo de confianza (fig. 4).
El estudio por Passing y Bablok dio un coeficiente de correlación r entre los 2 equipos más bajo, por tratarse de 2 tecnologías diferentes, siendo la nefelometría técnica de referencia (tabla 6).
- 5.
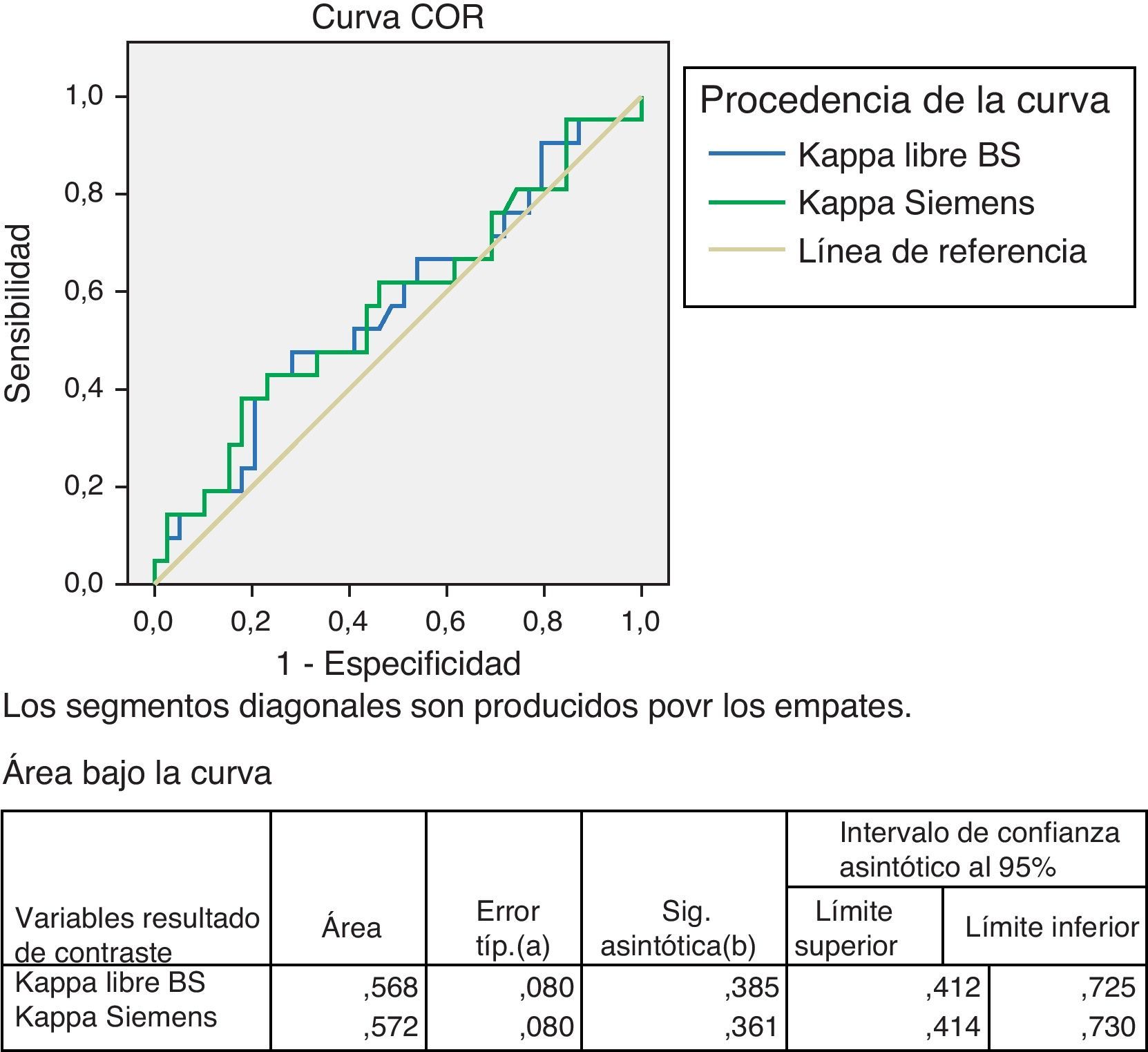
Para el estudio de la especificidad y sensibilidad de los 2 métodos se realizaron las curvas ROC. Se procesaron 60 sueros de pacientes hematológicos ya descritos, en los que cuantificamos Kappa y Lambda libres, así como su cociente, con los reactivos Freelite®, y CCL, en el mismo nefelómetro (BN II). Estudio de Kappa en fig. 5.
Como podemos ver en el cuadro adscrito a la curva ROC, la Kappa con el reactivo CCL el área bajo la curva es de 0,572, superior a la del reactivo Freelite® de 0,568, que indica una ligera superioridad en la sensibilidad y la especificidad para el CCL (tabla 7).
La Lambda libre, ver fig. 6, da una mayor área bajo la curva, favorable al reactivo CCL con un valor de 0,568 frente a 0,511 para el Freelite®.
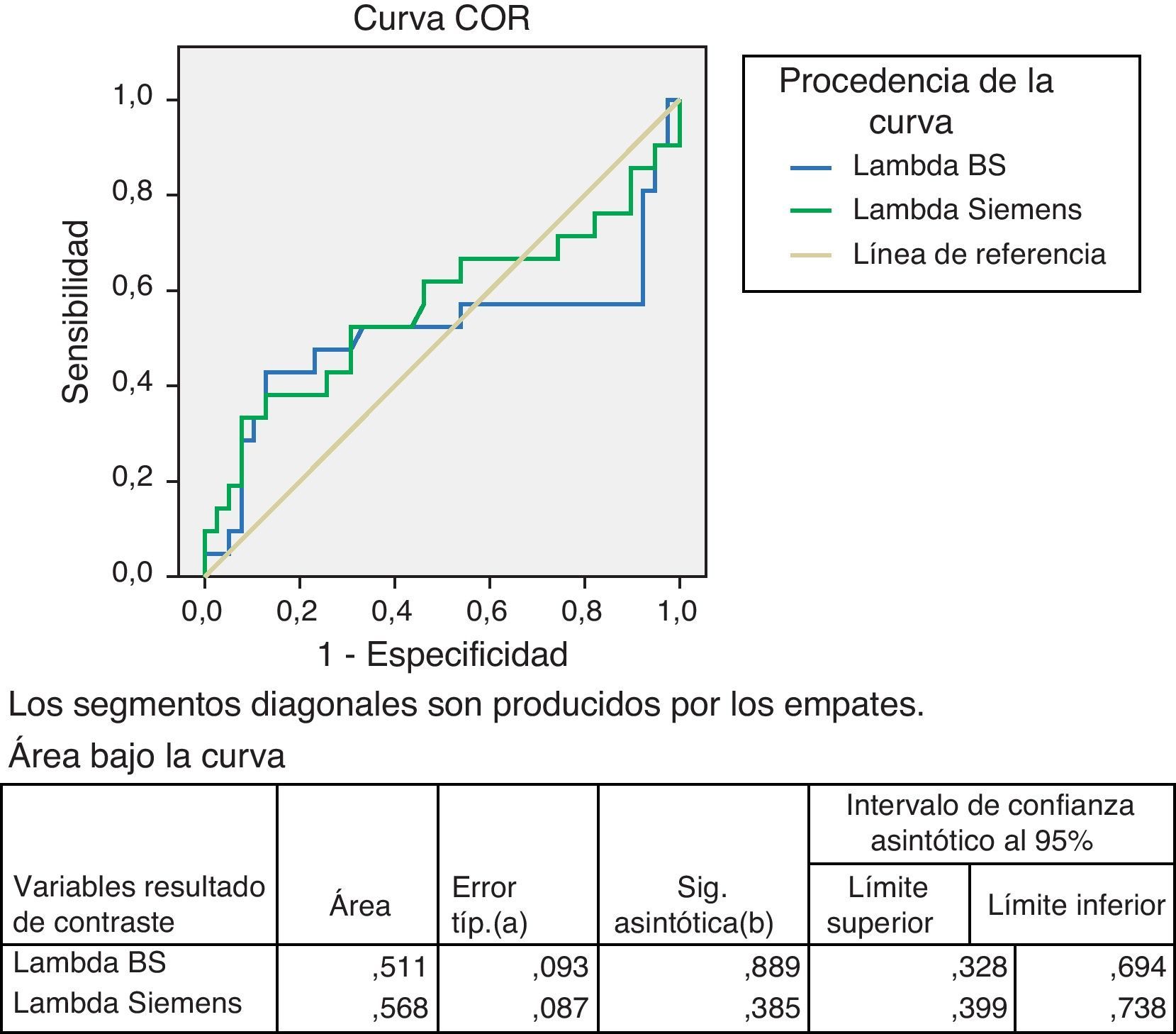
En la curva ROC realizada con el cociente Kappa/Lambda con los 2 reactivos mencionados, los resultados obtenidos en la curva para valores altos tienen mayor sensibilidad y exactitud con el reactivo evaluado CCL de Siemens, para valores bajos es similar (fig. 7).
Descubiertas en el 2001, desde el año 2009, la determinación de las FLC forma parte de las pruebas de cribado oficialmente recomendadas para el mieloma múltiple10. Además, la determinación de las cadenas ligeras libres proporciona un valor pronóstico y ayuda a monitorizar el éxito del tratamiento.
Las recomendaciones internacionales del Myeloma Working Group1 resumen las principales indicaciones de la detección de cadenas ligeras monoclonales en suero, que son:
- 1.
En el diagnóstico de mielomas y MGUS, su empleo permite alcanzar mayor sensibilidad junto con la electroforesis y el inmunotipado.
- 2.
Valor pronóstico en la mayoría de gammapatías monoclonales.
- 3.
Seguimiento objetivo de gammapatías con escasa secreción de proteína monoclonal.
- 4.
En lo mielomas múltiples tratados es necesaria la normalización del cociente Kappa/Lambda para determinar la denominada respuesta completa estricta (cRe).
- 5.
En los MGUS se ha descrito que un cociente k/l sérico alterado constituye un factor de riesgo de progresión hacia malignidad.
Existen también otros estudios que avalan su utilización como screening en pacientes sospechosos de discrasias de células plasmáticas11–13.
La obtención de resultados fiables es un requisito indispensable para lograr una alta sensibilidad y especificidad en el diagnóstico y la detección de cualquier cambio producido durante el seguimiento. Por ello realizamos este estudio, en el que evaluamos un nuevo ensayo para la cuantificación de FLC Kappa y Lambda en suero, diseñado por Siemens para los sistemas BN, en el que la linealidad y especificidad del ensayo fueron mejoradas al añadir posteriormente un reactivo suplementario específico para el ensayo con inmunoglobulinas de ratón2.
Los pacientes con mieloma múltiple requieren una monitorización a largo plazo para evaluar la eficacia de la terapia, descubrir recaídas o la elevación de FLC a un rango que pueda ser nefrotóxico, como dice Kyle R. et al.14. Se demostró la consistencia lote a lote con la variación de 3 lotes independientes de calibrador y reactivo por Henk te Velthuis y su equipo2, lo que es un requerimiento crucial en la monitorización de pacientes a largo plazo y que no cumplían los reactivos Freelite® de Binding Site, como describen en la bibliografía Tate, Mollee y de Briand15–17 y nosotros comprobamos en la rutina del laboratorio.
Nosotros obtuvimos una buena precisión intraserie e interserie en estos ensayos Siemens, con el nefelómetro BN II y habíamos detectado el fallo en concentraciones elevadas de cadenas ligeras, con el reactivo adaptado de Binding Site, al BN II, que daban falsamente bajas, por no realizar la predilución para la detección del exceso de antígeno. Sin embargo, para el chequeo del exceso de antígeno con el nuevo reactivo Siemens en el BN II, se realiza una prerreacción con un pequeño volumen de suero y el reactivo para su determinación y automáticamente empieza con una dilución alta, cuando los valores están fuera de rango.
De acuerdo con Nakano et al.18,19 admitimos que una alta sensibilidad y especificidad puede únicamente ser alcanzada con los reactivos elaborados con anticuerpos monoclonales como el FLC a estudio, en lugar de los anticuerpos policlonales. Ya que de no ser así, los antisueros presentaban una reactividad cruzada con las cadenas pesadas ligadas, inhabilitando el test para distinguir entre FLCmonoclonales y policlonales20.
Pattenden et al.21 establecieron los siguientes factores como principales responsables de la reproductibilidad de la cuantificación de las FLC: alta variabilidad entre kits, diferencias en la dilución de muestras con concentraciones elevadas de FLC, y diferencias entre los analizadores que fueron usados. Un grupo de trabajo de la Federación Internacional de Química Clínica y Laboratorio Médico (IFCC) para proteínas plasmáticas está actualmente revisando los problemas con la cuantificación de FLC, intentando minimizar todas las fuentes de variabilidad22. A la vez, está siendo creado un centro internacional para la medida de FLC séricas. En un futuro próximo, estos intensivos esfuerzos podrían mejorar la comparación de las mediciones interlaboratorio de FLC20.
Obtuvimos unos resultados acordes con la bibliografía anterior, en cuanto a la comparación de métodos, con un buen coeficiente de correlación para el cociente Kappa/Lambda libre, por los 2 métodos, en el mismo equipo BN II y en cambio peor cuando comparamos el método del BNII (nefelómetro) con el del SPA PLUS (turbidímetro).
Creemos que el nuevo reactivo de FLC (Siemens) para el BN II, es un paso adelante en el camino para lograr estandarizar internacionalmente la cuantificación de FLC en suero y queremos colaborar con nuestro trabajo a que esto sea posible a corto plazo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Al equipo de compañeros del Servicio de Análisis Clínicos que colaboraron en este trabajo.