Staphylococcus lugdunensis es un estafilococo coagulasa negativo (SCN) con características microbiológicas, clínicas, de virulencia y de sensibilidad a antimicrobianos que le hacen ser una especie claramente diferente de otras especies de estafilococos coagulasa negativos. Presentamos las características clínico microbiológicas de S.lugdunensis aislados en 27 enfermos de nuestro hospital.
Material y métodosSe estudiaron los aislamientos de Staphylococcus lugdunensis del año 2004 al 2011. La identificación y antibiograma se realizó por el sistema MicroScan (Siemens). Se revisaron las historias clínicas de los pacientes con aislamientos de S. lugdunensis.
ResultadosSe obtuvieron 27 aislamientos de S. lugdunensis procedentes de: abscesos (9), heridas (9), líquido articular (3), sangre (2), líquido peritoneal (1), exudado ótico (1), exudado nasal (1), orina (1). En 20 casos el cultivo fue puro y en 7 mixto. En 8 casos (30%) las muestras procedían de Ginecología, 6 (22%) de Traumatología, 5 (19%) de Cirugía, 3 (11%) de Medicina interna, 2 (7%) de Pediatría, 3 (11%) de otros servicios. En 15 casos (55,5%) existían antecedentes de cirugía o traumatismo reciente. Fueron sensibles a la penicilina 20 (74%) y no hubo ninguna cepa resistente a oxacilina.
ConclusionesS. lugdunensis se ha aislado mayoritariamente en infecciones de piel y tejidos blandos, y en infecciones de heridas post-quirúrgicas. Se ha aislado en cultivo puro en el 74% (20/27) de los casos. Es importante la correcta identificación de S. lugdunensis para evitar que sea descartado como simple estafilococo coagulasa negativo, lo que nos permitirá tener un mejor conocimiento de las infecciones causadas por este microorganismo.
Staphylococcus lugdunensis is a coagulase-negative staphylococcus (CNS) with microbiological characteristics, clinical virulence and antimicrobial susceptibility testing, which makes it a distinctly different species from other coagulase-negative staphylococcus species. We present the microbiological and clinical characteristics of 27 S.lugdunensis isolates in patients of our hospital.
Material and methodsStaphylococcus lugdunensis isolates collected in our hospital from 2004 to 2011 were studied. Identification and susceptibility testing were performed using the MicroScan (Siemens) system. The clinical records of patients with S.lugdunensis were reviewed.
ResultsA total of 27 isolates of S.lugdunensis were obtained from the following sources: abscesses (8), wounds (8), joint fluid (3), blood (2), peritoneal fluid (1), ear exudate (1), nasal discharge (1), and urine (1). In 22 cases the culture was pure and in 5 cases mixed. Samples came from Gynaecology in 8 cases (30%), Traumatology in 6 (22%), Surgery in 5 (19%), Internal Medicine in 3 (11%), Paediatrics in 2 (7%), and 3 (11%) from other departments. Just over half (15 cases, 55.5%) had a history of recent surgery or trauma. A total of 20 (74%) were sensitive to penicillin, and none of the isolates was resistant to oxacillin.
ConclusionsS. lugdunensis has been isolated mainly in skin and soft tissue infections, as well as in surgical wounds. The microorganism was obtained in pure culture in 20 cases (74%). The proper identification of S.lugdunensis is important in order to avoid being ruled out as simple coagulase-negative staphylococci, and to give us a better understanding of infections caused by this microorganism.
Los estafilococos coagulasa negativos (SCN) comprenden un amplio número de especies distintas de Staphylococcus aureus, llamadas así por su incapacidad para coagular el plasma debido a la falta de producción de la enzima coagulasa1. Tradicionalmente se consideraban inocuos o patógenos oportunistas poco virulentos al encontrarse como comensales en la piel, pero con el avance de la medicina y la utilización de métodos diagnósticos y terapéuticos invasivos, los SCN se han convertido en patógenos de primer orden. S. epidermidis, S. haemolyticus, S. lugdunensis, S. saprophyticus son las especies de SCN más frecuentemente asociadas a infección en humanos2. La utilización cada vez más generalizada de sistemas automáticos o semiautomáticos de identificación bacteriana, con un amplio número de pruebas, ha contribuido a que se identifiquen mejor en la práctica diaria de los laboratorios las distintas especies de estafilococos coagulasa negativos, y se conozca mejor su papel en la etiología de diferentes procesos infecciosos. S. lugdunensis es una especie de SCN descrito por primera vez por Freney et al3 en 1988; el término lugdunensis deriva de Lugdunum, nombre latino de Lyon, ciudad donde se aisló por primera vez. S.lugdunensis forma parte de la microbiota de la piel y además es un patógeno humano infrecuente pero no raro. Las especiales características de virulencia, microbiológicas, clínicas y de sensibilidad a antimicrobianos de esta especie la hacen única y diferente de otros SCN. S. lugdunensis se comporta más como S. aureus que como un típico SCN en muchos aspectos, principalmente por su gran virulencia y por su capacidad para producir infecciones supuradas4. Con el objetivo de conocer las características clínico-microbiológicas de los S. lugdunensis aislados en nuestro laboratorio hemos realizado este estudio en el cual se recogen los aislamientos obtenidos durante un periodo de 8 años. Se presentan aquí el número de muestras en las que se han aislado, la procedencia de las mismas, y el tipo de infección. Así mismo, se informa el patrón de sensibilidad antibiótica que presentaron nuestros aislados.
Materiales y métodosSe ha realizado un estudio retrospectivo de los aislamientos de S. lugdunensis obtenidos desde enero de 2004 a diciembre de 2011 de pacientes atendidos en nuestro hospital, tanto en consultas como en hospitalización. El procesamiento de las muestras para cultivo bacteriano se realizó según el protocolo establecido en nuestro laboratorio. En exudados, abscesos y líquidos estériles se realizó cultivo en los siguientes medios: Agar Sangre, Agar Chocolate + Polyvitex en atmósfera de 10% de CO2, Agar Macconkey, caldo cerebro-corazón (BHI) a 35°; y agar Schaedler y Schaedler con Neomicina-Vancomicina 5% de sangre de cordero en atmósfera anaerobia (Biomerieux). Se realizó extensión para observación microscópica con tinción de Gram. Las muestras de sangre se inocularon en frascos de hemocultivo para aerobios y anaerobios (Bactec plus) y se incubaron en el sistema Bactec 9120 (Becton –Dickinson). La resiembra de los frascos positivos se realizó en agar Sangre y agar Chocolate en atmósfera de 10% de CO2 y medios para anaerobios. Las muestras de orina se sembraron con asa calibrada para cultivo semicuantitativo en agar Sangre y agar Cled. Se valoraron para su identificación y antibiograma aquellos estafilococos con posible relación causal con el cuadro infeccioso según criterios microbiológicos: cocos grampositivos, catalasa positivos, con crecimiento abundante en presencia de exudado purulento; todos los aislamientos procedentes de líquidos estériles y los aislados en dos o más muestras en el caso de hemocultivos, con el fin de descartar los posibles contaminantes epiteliales. La identificación bioquímica y el antibiograma se realizó mediante los paneles deshidratados para grampositivos CIM/Combo del Sistema semiautomático MicroScan (Siemens) Estos paneles utilizan pruebas convencionales y cromogénicas. La identificación se basa en la detección de cambios de pH, utilización de sustratos y crecimiento en presencia de agentes antimicrobianos, después de 24 h de incubación a 35°C. Las pruebas de sensibilidad a antimicrobianos que utiliza este sistema son una miniaturización de la prueba de sensibilidad por dilución. Después de inocular y rehidratar con una suspensión estandarizada de microorganismos y de incubar a 35°C, 24 h, se determina la menor concentración antimicrobiana que muestra inhibición del crecimiento bacteriano (CMI). Los aislamientos identificados por el programa Biotype lookup en el programa LabPro Information Manager (Siemens) con un porcentaje de probabilidad ≥90% fueron aceptados como especies correctamente identificadas. Durante los años que comprende el estudio se identificaron por el mismo procedimiento (paneles para Gram Positivos, MicroScan) 3 cepas de S. lugdunensis correspondientes a los controles de calidad externa de la Sociedad Española de Enfermedades infecciosas y Microbiología (control mensual junio 2006, enero 2008 y agosto 2010). En algunos aislamientos se realizó también pruebas rápidas de aglutinación en portaobjetos para determinación del factor de afinidad por el fibrinógeno (Clumping factor), de la proteína A y de polisacáridos capsulares de S. aureus (Pastorex Staph-plus, Bio-Rad). Se revisaron las historias clínicas de los pacientes con aislamientos de S. lugdunensis considerándose los siguientes datos: edad, sexo, tipo de muestra, localización, servicio de procedencia, enfermedad de base, si estaba ingresado o no en el momento de la toma de muestra, y existencia de cirugía previa reciente.
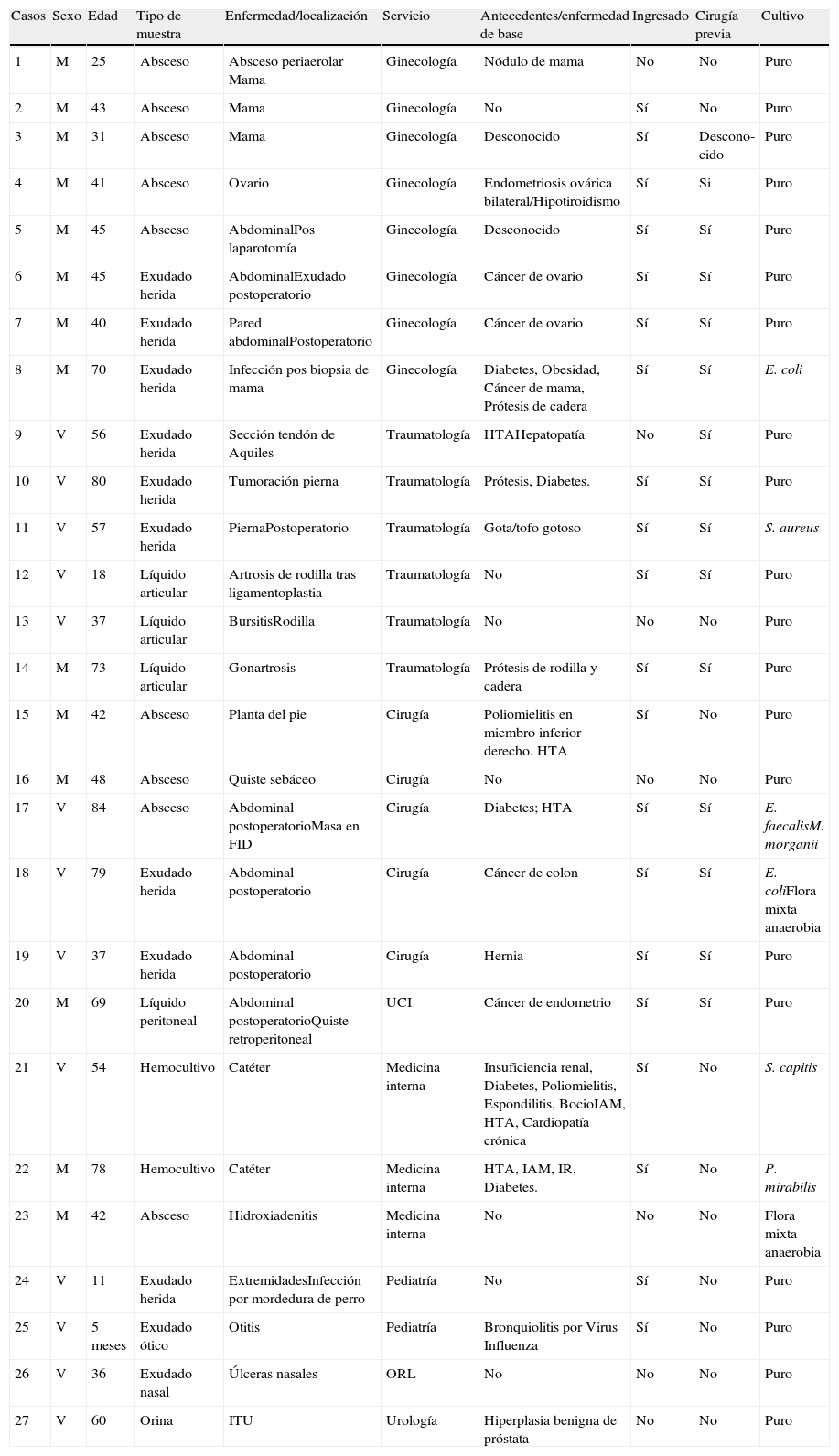
ResultadosDurante el periodo de estudio se obtuvieron 27 aislados de S. lugdunensis de 27 pacientes con edades comprendidas entre 5 meses y 84 años (media de 48 años), 14 fueron mujeres y 13 varones (tabla 1). El 74% de las muestras procedían de pacientes ingresados, y el resto, de pacientes atendidos en consultas externas. Las muestras cultivadas fueron: abscesos9, exudados de herida9, líquido articular3, sangre2, líquido peritoneal1, exudado ótico1, exudado nasal1 y orina1 (tabla 2). En 20 casos (74%) el cultivo fue puro y en 7 casos se aisló junto a otros microorganismos (tabla 1). La procedencia de las muestras por servicios se describe en la tabla 2, destacando que el 71% de las mismas proceden de servicios quirúrgicos (Ginecología, Traumatología y Cirugía). En relación con los antecedentes personales o enfermedades de base, en 15 casos (55,5%) existían antecedentes de cirugía o traumatismo reciente, y en 5 casos procesos tumorales (1 de mama, 3 ginecológicos, y 1 de colon). Los 27 aislamientos procedentes de muestras clínicas, así como los 3 controles de calidad estudiados por los paneles para gram positivos de MicroScan mostraron biotipos acordes con una probabilidad de identificación correcta ≥90%, a pesar de que estos paneles no incluyen la producción de ornitina descarboxilasa (ODC), cuya positividad es característica de esta especie junto con la positividad de la prueba de la pirrolinodil-β-naftilamina (PYR), si incluida en estos paneles, habiendo resultado esta última positiva en el 100% de los aislados. El 100% fermentó el carbohidrato D-trehalosa, el 95% la D-manosa, y el 67% la α-lactosa. En 8 casos se realizó la prueba para detectar el factor de afinidad por el fibrinógeno (clumping factor), resultando positivo débil solo un aislamiento (12,5%). La mayoría de las cepas fueron sensibles a los antibióticos estudiados (tabla 3). En 7 cepas (26%) se observó resistencia a penicilina y ampicilina. No hubo ninguna cepa resistente a oxacilina, fosfomicina, eritromicina, y clindamicina mostraron unos niveles de resistencia de 18,5, 14,8, y 7,4% respectivamente.
Descripción de los 27 casos clínicos con aislamiento de Staphylococcus lugdunensis
| Casos | Sexo | Edad | Tipo de muestra | Enfermedad/localización | Servicio | Antecedentes/enfermedad de base | Ingresado | Cirugía previa | Cultivo |
| 1 | M | 25 | Absceso | Absceso periaerolar Mama | Ginecología | Nódulo de mama | No | No | Puro |
| 2 | M | 43 | Absceso | Mama | Ginecología | No | Sí | No | Puro |
| 3 | M | 31 | Absceso | Mama | Ginecología | Desconocido | Sí | Descono-cido | Puro |
| 4 | M | 41 | Absceso | Ovario | Ginecología | Endometriosis ovárica bilateral/Hipotiroidismo | Sí | Si | Puro |
| 5 | M | 45 | Absceso | AbdominalPos laparotomía | Ginecología | Desconocido | Sí | Sí | Puro |
| 6 | M | 45 | Exudado herida | AbdominalExudado postoperatorio | Ginecología | Cáncer de ovario | Sí | Sí | Puro |
| 7 | M | 40 | Exudado herida | Pared abdominalPostoperatorio | Ginecología | Cáncer de ovario | Sí | Sí | Puro |
| 8 | M | 70 | Exudado herida | Infección pos biopsia de mama | Ginecología | Diabetes, Obesidad, Cáncer de mama, Prótesis de cadera | Sí | Sí | E. coli |
| 9 | V | 56 | Exudado herida | Sección tendón de Aquiles | Traumatología | HTAHepatopatía | No | Sí | Puro |
| 10 | V | 80 | Exudado herida | Tumoración pierna | Traumatología | Prótesis, Diabetes. | Sí | Sí | Puro |
| 11 | V | 57 | Exudado herida | PiernaPostoperatorio | Traumatología | Gota/tofo gotoso | Sí | Sí | S. aureus |
| 12 | V | 18 | Líquido articular | Artrosis de rodilla tras ligamentoplastia | Traumatología | No | Sí | Sí | Puro |
| 13 | V | 37 | Líquido articular | BursitisRodilla | Traumatología | No | No | No | Puro |
| 14 | M | 73 | Líquido articular | Gonartrosis | Traumatología | Prótesis de rodilla y cadera | Sí | Sí | Puro |
| 15 | M | 42 | Absceso | Planta del pie | Cirugía | Poliomielitis en miembro inferior derecho. HTA | Sí | No | Puro |
| 16 | M | 48 | Absceso | Quiste sebáceo | Cirugía | No | No | No | Puro |
| 17 | V | 84 | Absceso | Abdominal postoperatorioMasa en FID | Cirugía | Diabetes; HTA | Sí | Sí | E. faecalisM. morganii |
| 18 | V | 79 | Exudado herida | Abdominal postoperatorio | Cirugía | Cáncer de colon | Sí | Sí | E. coliFlora mixta anaerobia |
| 19 | V | 37 | Exudado herida | Abdominal postoperatorio | Cirugía | Hernia | Sí | Sí | Puro |
| 20 | M | 69 | Líquido peritoneal | Abdominal postoperatorioQuiste retroperitoneal | UCI | Cáncer de endometrio | Sí | Sí | Puro |
| 21 | V | 54 | Hemocultivo | Catéter | Medicina interna | Insuficiencia renal, Diabetes, Poliomielitis, Espondilitis, BocioIAM, HTA, Cardiopatía crónica | Sí | No | S. capitis |
| 22 | M | 78 | Hemocultivo | Catéter | Medicina interna | HTA, IAM, IR, Diabetes. | Sí | No | P. mirabilis |
| 23 | M | 42 | Absceso | Hidroxiadenitis | Medicina interna | No | No | No | Flora mixta anaerobia |
| 24 | V | 11 | Exudado herida | ExtremidadesInfección por mordedura de perro | Pediatría | No | Sí | No | Puro |
| 25 | V | 5 meses | Exudado ótico | Otitis | Pediatría | Bronquiolitis por Virus Influenza | Sí | No | Puro |
| 26 | V | 36 | Exudado nasal | Úlceras nasales | ORL | No | No | No | Puro |
| 27 | V | 60 | Orina | ITU | Urología | Hiperplasia benigna de próstata | No | No | Puro |
FID: fosa iliaca derecha; HTA: hipertensión arterial; IAM: infarto agudo de miocardio; IR: insuficiencia renal; ITU: infección del tracto urinario; M: mujer; ORL: otorrinolaringología; V: Varón; VRS: virus respiratorio sincitial.
Resumen de las características epidemiológicas
| Características | N.° (%) de aislamientos (n= 27) |
| Edad | |
| 0-18 | 3 (11) |
| 19-65 | 17 (63) |
| >65 | 7 (26) |
| Sexo | |
| Mujer | 14 (52) |
| Varón | 13 (48) |
| Procedencia | |
| Ingresados | 20 (74) |
| Consultas externas | 7 (26) |
| Enfermedad de base y otros factores | |
| Cirugía o traumatismo reciente | 15 (55,5) |
| Neoplasias | 5 (18,5) |
| Hipertensión | 5 (18,5) |
| Diabetes | 4 (15) |
| Prótesis | 3 (11) |
| Insuficiencia renal | 2 (7) |
| Otros | 11 (41) |
| Dos o más de los anteriores | 7 (26) |
| Ninguno | 7 (26) |
| Desconocido | 2 (7) |
| Procedencia de los aislamientos | |
| Abscesos | 9 (33) |
| Heridas postquirúrgicas | 9 (33) |
| Líquidos articulares | 3 (11) |
| Sangre | 2 (7) |
| Líquido peritoneal | 1 (4) |
| Orina | 1 (4) |
| Exudado nasal | 1 (4) |
| Exudado ótico | 1 (4) |
| Aislamiento en cultivo puro | 20 (74) |
| Servicios | |
| Ginecología | 8 (30) |
| Traumatología | 6 (22) |
| Cirugía | 5 (19) |
| Medicina interna | 3 (11) |
| Pediatría | 2 (7) |
| Otros | 3 (11) |
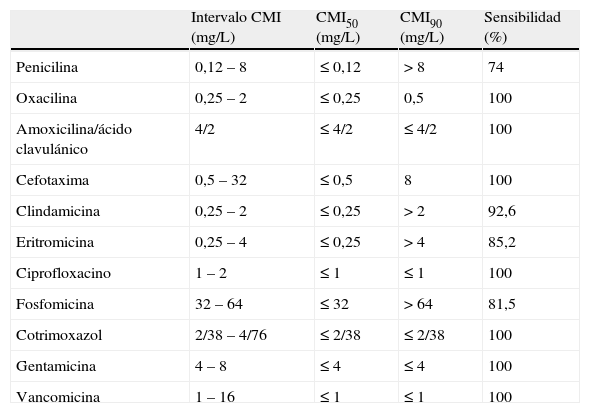
Sensibilidad antibiótica de 27 aislamientos de S. lugdunensis
| Intervalo CMI (mg/L) | CMI50 (mg/L) | CMI90 (mg/L) | Sensibilidad (%) | |
| Penicilina | 0,12 – 8 | ≤ 0,12 | > 8 | 74 |
| Oxacilina | 0,25 – 2 | ≤ 0,25 | 0,5 | 100 |
| Amoxicilina/ácido clavulánico | 4/2 | ≤ 4/2 | ≤ 4/2 | 100 |
| Cefotaxima | 0,5 – 32 | ≤ 0,5 | 8 | 100 |
| Clindamicina | 0,25 – 2 | ≤ 0,25 | > 2 | 92,6 |
| Eritromicina | 0,25 – 4 | ≤ 0,25 | > 4 | 85,2 |
| Ciprofloxacino | 1 – 2 | ≤ 1 | ≤ 1 | 100 |
| Fosfomicina | 32 – 64 | ≤ 32 | > 64 | 81,5 |
| Cotrimoxazol | 2/38 – 4/76 | ≤ 2/38 | ≤ 2/38 | 100 |
| Gentamicina | 4 – 8 | ≤ 4 | ≤ 4 | 100 |
| Vancomicina | 1 – 16 | ≤ 1 | ≤ 1 | 100 |
CMI: concentración mínima inhibitoria (mg/L).
Se han aplicado los criterios del Clinical and Laboratory Standards Institute (CLSI).
S. lugdunensis es más parecido a S. aureus que otros estafilococos coagulasa negativos (SCN) en muchos aspectos incluida su elevada capacidad de virulencia. S. lugdunensis es un comensal de la piel y también un patógeno responsable de infecciones nosocomiales y adquiridas en la comunidad5. Inicialmente fue descrito como agente causal de endocarditis de evolución agresiva y fulminante6–9. Posteriormente se ha observado que produce con más frecuencia infecciones de piel y abscesos5,10–12. En nuestra serie 20/27 (74%) de las infecciones afectaban a piel o tejidos blandos, de las cuales en 15 casos existían antecedentes de cirugía reciente o traumatismo. Esto viene a corroborar el papel de S. lugdunensis como agente causal de patologías relacionadas con la piel y tejidos blandos, siendo la alteración de la barrera natural que constituye la piel, por trauma o cirugía, una de las causas más frecuentes de inicio de la infección. Esta circunstancia ha sido también descrita por otros autores12–15. S. lugdunensis se ha relacionado también con abscesos de mama14,16–18, en nuestro caso hubo 4 abscesos de mama, uno de los cuales se produjo después de haberse realizado una biopsia de mama. Los SCN son la causa principal de bacteriemia adquirida en el hospital, y en la mayoría de los casos el foco de infección es el catéter intravascular2. Esto sucede también en dos de nuestros casos, en los cuales los S. lugdunensis aislados en hemocultivos procedían de dos pacientes ingresados por infarto agudo de miocardio, y en cuyas historias clínicas constaba la presencia de fiebre y hematoma en el punto de inserción del catéter, en ambos casos se retiraron los catéteres pero no se enviaron para el cultivo microbiológico. Uno de ellos evolucionó bien con la retirada del catéter y el tratamiento antibiótico, y en el otro caso se produjo el fallecimiento del paciente atribuible a otras causas. La presencia de bacteriemia por S. lugdunensis asociada a infección de catéter está descrita en otros estudios como el de Ros et al.16 que presentan 5 bacteriemias por S. lugdunensis siendo la infección asociada a catéter la causa más probable de los cinco aislamientos sanguíneos. Ebright et al.19 encuentran que de seis casos de bacteriemia significativa por S. lugdunensis, en 5 casos la causa de la infección fue el catéter (3 hemodiálisis y 2 catéteres intravenosos de larga duración). Se consideran también factores predisponentes para la infección por S. lugdunensis la diabetes, inmunodepresión, neoplasias, insuficiencia renal crónica11–14 En nuestra serie, 5 de los casos (18,5%) tenían neoplasias, otros 5 (18,5%) hipertensión, 4 (15%) diabetes, 3 (11%) prótesis, y 7 (26%) presentaban dos o más de las anteriores. La correcta identificación de S. lugdunensis mediante las pruebas habituales utilizadas en muchos laboratorios no siempre se consigue, debido en parte a la similitud de sus colonias con las de S. aureus y también, por otro lado, a las coincidencias bioquímicas con éste y con otros estafilococos coagulasa negativos. A las 18-24 h de incubación en agar Sangre, S. lugdunensis suele manifestarse como un cultivo generalmente heterogéneo, de diversos tamaños de colonias y diferente expresión de la β-hemólisis; después de 48 h de incubación, se observan colonias mucho más homogéneas, blanco amarillentas, cremosas, con un pequeño halo de β-hemólisis y un fuerte olor. Generalmente la hemolisina actúa de modo sinérgico con la β-lisina de S. aureus y produce una lisis total de los hematíes (sinergia hemolítica)20–22. A diferencia de S. aureus, S. lugdunensis no posee coagulasa libre (prueba de coagulasa en tubo negativa) pero el 60-80% de las cepas producen una forma del enzima ligada a la membrana (clumping factor) que da un resultado positivo en las pruebas rápidas comerciales de aglutinación con látex, lo que puede conducir a errores de identificación. Esta aglutinación suele ser más débil que la que muestra S.aureus4. S. lugdunensis se puede diferenciar de otros SCN por dos pruebas bioquímicas: la producción de ornitina descarboxilasa (ODC), siempre presente en esta especie, y la positividad a la prueba de la pirrolinodil-arilamidasa (PYR). Produce ácido a partir de trehalosa, manosa, maltosa y sacarosa pero no a partir de manitol. La prueba de acidificación de la manosa permite diferenciar esta especie de otras que también son PYR positivas (S. haemolyticus)5. Muchos laboratorios clínicos emplean hoy día equipos comerciales manuales o automáticos para la identificación bacteriana. El Manual of Clinical Microbiology23 indica los sistemas comerciales que incluyen S. lugdunensis en su base de datos, entre los que se encuentra el utilizado en nuestro laboratorio. S. lugdunensis se diferencia también de otros SCN en que permanece susceptible a una amplia variedad de antibióticos incluidas las penicilinas. Se ha comunicado que las tasas de resistencias por producción de betalactamasa oscila entre el 7 y el 24% en Francia, el 15% en Suecia y entre el 12-14% en España, siendo la tasa de resistencia mayor en cepas aisladas en EE. UU. (24-40%)4. En nuestro caso la resistencia a penicilina (26%) es similar a la publicada por otros autores españoles16 e inferior a la publicada recientemente por Batista et al.24 con un 40% de resistencia a penicilina. No hemos tenido ningún aislamiento con resistencia a oxacilina, lo que coincide con otros autores españoles24–26. En resumen, encontramos que S. lugdunensis se ha aislado mayoritariamente de infecciones de piel y tejidos blandos siendo la alteración de la barrera natural que constituye la piel, por trauma o cirugía, una de las causas más frecuentes de inicio de la infección. Aunque mantiene una buena sensibilidad a la mayoría de los antibióticos, su tendencia a producir abscesos y su parecido con S. aureus en muchos aspectos hace necesaria una correcta identificación en el laboratorio.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.