La electroforesis de proteínas séricas (EFs) constituye, por norma general, el primer paso en la búsqueda de componentes monoclonales (CM). Una baja concentración de CM dará lugar a pequeños picos en la EFs que pueden hacer sospechar la existencia de una gammapatía monoclonal de significado incierto (GMSI). Para confirmar estas GMSI se ha utilizado la inmunofijación sérica (IFs) y un cociente de cadenas ligeras libres séricas (CLLs) Kappa (K)/Lambda (λ) alterado.
Materiales y métodosDe 3.683 EFs realizadas en nuestro laboratorio durante los meses de febrero a noviembre de 2011, se observaron 165 con pequeños picos en las fracciones β1, β2 o gamma. La confirmación del CM se realizó mediante la IFs y la existencia de un cociente de CLLs K/ λ alterado.
ResultadosDe las 165 EFs seleccionadas para el estudio, la IFs fue positiva en 82, mientras que un cociente de CLLs K/λ alterado solo se observó en 11 de los 82. El cociente de CLLs K/λ de las 71 EFs restantes con IFs positivas, estuvo dentro del intervalo de normalidad para sujetos sanos (0.25-1.65).
ConclusionesLa EFs constituye el primer paso en la búsqueda del CM, aunque esta interpretación está ligada a un cierto grado de subjetividad cuando estos CM están a baja concentración. Al valorar la utilidad de la IFs frente al cociente de CLLs K/λ en la confirmación de estos CM, se observó que la confirmación debe realizarse por IFs ya que la cuantificación del cociente de CLLs K/λno resultó útil.
Serum protein electrophoresis (SPE) is the first step in the search for a monoclonal component (MC). A low concentration of MC will give small spikes in the SPE, which may lead to the suspicion of a monoclonal gammopathy of undetermined significance (MGUS). To confirm these MGUS, serum immunofixation (sIFE) and abnormal serum free light chains (sFLC) Kappa/Lambda ratio have been used.
Material and methodsOf 3683 SPE carried out in our laboratory during the months from February to November of 2011, we observed 165 small spikes in the SPE in β1, β2 or gamma region. The confirmation of these MGUS was made using sIFE and abnormal sFLC Kappa (K)/Lambda (λ) ratio.
ResultsOf 165 SPE selected for the study, sIFE was positive in 82, while an abnormal sFLC K/λ ratio alone was observed in 11 of the 82. The sFLC K/λ ratio of the 71 SPE remaining with positive sIFE was inside the interval of normality for healthy people (0.25-1.65).
ConclusionSPE is the first step in the search for a MC. When there is a low concentration of MC, this interpretation has a certain grade of subjectivity. When we evaluated the utility of sIFE versus sFLC K/λ ratio in the confirmation of these MC, it was observed that the confirmation should be carried out by means of sIFE since the quantification of the sFLC K/λ ratio was not useful.
Las gammapatías monoclonales (GM) son un grupo de enfermedades caracterizadas por la proliferación de células linfoides B maduras que producen una inmunoglobulina intacta o alguna de sus fracciones. Clonalidad definida también por la expresión de un solo tipo de cadena ligera. Las 2 entidades clínicas sintomáticas más importantes asociadas a trastornos de las células B maduras son el mieloma múltiple (MM) y la macroglobulinemia de Waldenström (MW), pero estas 2 enfermedades representan una proporción relativamente pequeña de todos los componentes monoclonales (CM) detectados1. En contraposición a estos casos existe una serie de GM que cursan de manera asintomática o que son secundarias con una clínica solo relacionada con la propia enfermedad de base. Dentro de este grupo de GM se encuentra la gammapatía monoclonal de significado incierto (GMSI) que corresponde a aquellos procesos con presencia de una concentración de proteína monoclonal<30g/L en suero con carácter estable en el tiempo,<10% de células plasmáticas en la medula ósea y que no producen síntomas clínicos2.
La incidencia del mieloma aumenta con la edad. La media de edad en el momento del diagnóstico es de 68 años. Es un proceso infrecuente por debajo de los 40 años con una incidencia de 4 por 100.000 habitantes3, mientras que la prevalencia de la GMSI es del 3,2 y 5,3% en mayores de 50 años y 70 años, respectivamente4. El 56% de todos los CM detectados en la población son atribuidos a la GMSI en contraste con el 18% que tienen MM5. El riesgo de progresión de GMSI a MM es bajo, de un 1% al año6, y varía en función de la concentración del CM (CM<15g/L presenta bajo riesgo)7. De esta forma el MM puede ser precedido por un desorden celular premaligno, siendo la GMSI la más común8.
La electroforesis sérica (EFs) es el primer paso en la búsqueda del CM. Para confirmar la presencia del CM disponemos de la inmunofijación sérica (IFs) y, en los últimos tiempos, de la cuantificación de cadenas ligeras libres (CLLs). La IFs es el método más extendido entre los laboratorios para la identificación del CM y la técnica convencional más sensible de que se dispone, estando considerada el método «gold standard» para confirmar la presencia de CM9.
La cuantificación de CLLs consiste en una técnica turbidimétrica o nefelométrica que se puede adaptar a muchos autoanalizadores10,11. Tiene la ventaja de ser cuantitativa, caracterizándose por su gran sensibilidad (detecta concentraciones de cadenas ligeras<1mg/L), cualidad de la que carece la IFs12, siendo además una técnica menos laboriosa. La cuantificación de CLLs es una técnica muy importante en pacientes con MM no secretor con IFs sérica y urinaria negativas, en pacientes oligosecretores (segregan pequeñas cantidades de proteínas monoclonales en el suero y la orina)13,14, en el plasmocitoma solitario y en el mieloma asintomático. Un valor anormal puede estar asociado a un alto riesgo de progresión a MM6. También las CLLs están recomendadas en el estudio de pacientes con GMSI15,16.
El objetivo de este estudio fue realizar un cribado de CM de baja concentración (<0,5 g/dL) mediante EFs ya que estos presentan un riesgo de un 14% a los 20 años de progresión a MM6. De los 3.683 proteinogramas revisados se seleccionaron aquellos en los que fueron observados pequeños picos en las fracciones β y gamma. Se evaluó la utilidad de la IFs y de un cociente anormal de CLLs en la identificación y confirmación de estos CM.
Material y métodosPoblación estudiadaSe trata de un estudio descriptivo transversal realizado por el Laboratorio de Análisis Clínicos del Hospital Universitario Infanta Cristina de Badajoz que cumple totalmente con la Declaración de Helsinki.
Durante un periodo de 10 meses en el año 2011 se realizaron 3.683 proteinogramas séricos solicitados en exámenes rutinarios de diferentes pacientes aparentemente normales o durante la evaluación de otros procesos no relacionados con la GM con un rango de edad de 2 a 99 años, de los cuales un 55,3% correspondían a varones y un 44,7% a mujeres. De estos, fueron seleccionados 165 mediante inspección visual por un profesional experto con base en la existencia de pequeños picos en las fracciones β1, β2 y gamma del proteinograma cuyo CM fue cuantificado por espectrofotometría directa en la zona ultravioleta (UV) a 200nm tras una EFs2 (0,28g/dL±0,13g/dL). Aunque la mayoría de las veces no eran característicos de un pico monoclonal (delgado o estrecho de más o menos altura), hacían sospechar la existencia de una GMSI. La interpretación de la EFs por un profesional experto es imprescindible puesto que un porcentaje no despreciable de GM se diagnostica por la detección de un CM en la EFs2. El rango de edad se situó entre 26-99 años (59,8% correspondían a varones y 40,2% a mujeres).
Obtención de las muestrasLa extracción de las muestras se realizó entre las 8-10h de la mañana, obteniéndose el suero por centrifugación a 3.000rpm durante 5min y realizándose la electroforesis de proteínas y la cuantificación de las CLLs en la misma mañana. La IFs fue realizada tras conservar las muestras séricas 24h a 4°C en todos los casos.
Métodos analíticosLa EFs fue realizada usando un sistema de electroforesis capilar: CAPILLARYS 2 (Sebia, Francia).
La IFs se realizó usando el protocolo de trabajo establecido mediante el sistema de electroforesis en gel de agarosa de Sebia (Hydragel 2/4 IF) en el sistema semiautomático HIDRASYS (Sebia, Francia). Se caracterizó la presencia de la GM por la presencia de una banda monoclonal en las pistas correspondientes a los antisueros frente a cadenas pesadas (gamma, alfa o mu) y en la pista frente a cadenas ligeras (K o λ) indistintamente. La banda monoclonal se identificaba por estar bien definida y localizada, además de estar posicionada a la misma altura que la previsible banda monoclonal localizada en la pista de referencia (ELP, solución fijadora).
La concentración de CLLs K y λ fueron medidas por nefelometría en un autoanalizador Siemens (BNA Prospec) usando un inmunoensayo homogéneo altamente sensible (FreeliteTM, The Binding Site, Birminghan, UK)10. Nuestros resultados fueron comparados con los rangos de referencia publicados para las CLLs (K/λ: 0,26-1,65)12, considerando un CM positivo cuando la proporción K/λ fue mayor de 1,65 (CM K) o menor de 0,26 (CM λ), excepto en aquellos casos en los que debido a procesos infecciosos, inflamatorios y/o un aclaramiento renal reducido se ha recomendado un incremento del cociente de hasta 3,117,18.
Métodos estadísticosEl análisis estadístico fue realizado usando la hoja de cálculo Excel (Office software) y el programa estadístico SPSS para Windows.
El análisis descriptivo fue realizado usando como medidas centrales y de dispersión la media y la desviación estándar (DE) después de comprobar la normalidad de los grupos mediante el test de Kolmogorov-Smirnov.
Las correlaciones entre variables fueron evaluadas mediante el coeficiente de correlación de Pearson.
La comparación de medias entre variables fue realizada por el análisis de la varianza ANOVA.
Utilizamos curvas de eficacia diagnóstica receiver-operating characteristic (ROC) para establecer un punto de corte para el cociente de las CLLs K/λ en aquellos pacientes con IFs positiva para un CM K e IFs positiva para un CM λ.
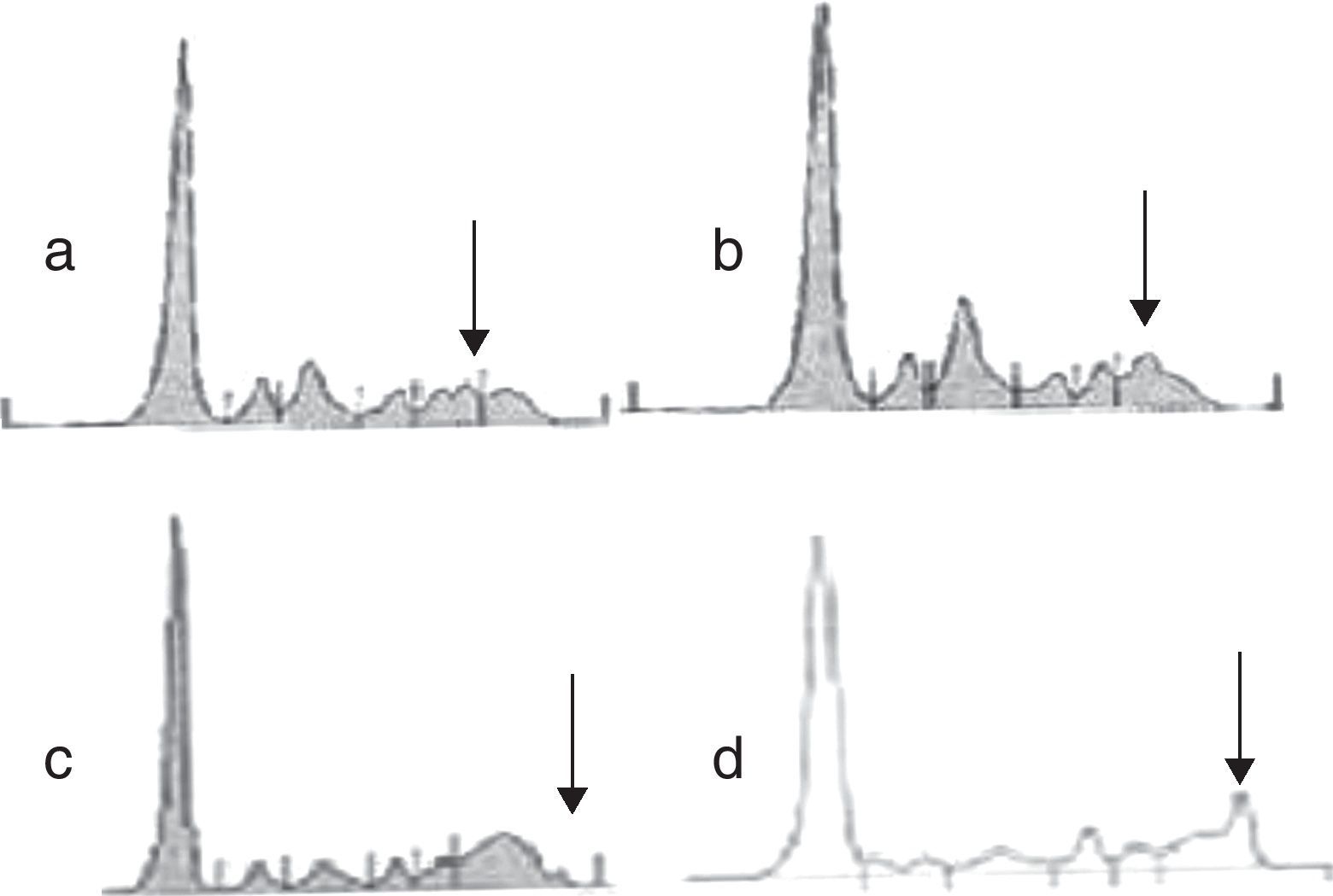
ResultadosLos 165 proteinogramas seleccionados en este estudio presentaban pequeños picos como los mostrados en la figura 1 (a, b, c). No se incluyeron en el estudio los que tenían un evidente carácter monoclonal como en la figura 1 (d). Para confirmar la existencia de un CM se realizó la IFs, revelando la existencia de un CM en 82 de ellos. El tipo de CM y los datos demográficos se muestran en la tabla 1. Los CM objetivables no fueron incluidos en el estudio.
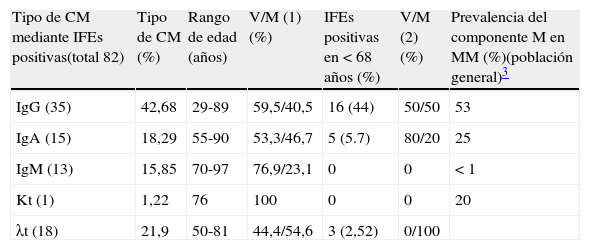
Prevalencia de los 82 CM positivos detectados mediante IFEs respecto a la edad y el sexo
| Tipo de CM mediante IFEs positivas(total 82) | Tipo de CM (%) | Rango de edad (años) | V/M (1) (%) | IFEs positivas en<68 años (%) | V/M (2) (%) | Prevalencia del componente M en MM (%)(población general)3 |
| IgG (35) | 42,68 | 29-89 | 59,5/40,5 | 16 (44) | 50/50 | 53 |
| IgA (15) | 18,29 | 55-90 | 53,3/46,7 | 5 (5.7) | 80/20 | 25 |
| IgM (13) | 15,85 | 70-97 | 76,9/23,1 | 0 | 0 | <1 |
| Kt (1) | 1,22 | 76 | 100 | 0 | 0 | 20 |
| λt (18) | 21,9 | 50-81 | 44,4/54,6 | 3 (2,52) | 0/100 |
CM: componentes monoclonales; IFEs: inmunofijación sérica; MM: mieloma múltiple; M: macroglobulinemia; V/M (1): varón/mujer (% sobre el total de IFEs positivas); V/M (2) varón/mujer (% sobre tipo de CM en<68 años).
De los 82 CM detectados mediante IFs se observó al cuantificar las CLLs que solo 11 de estos tuvieron un cociente de CLLs K/λ>1,65 óo<0,26. De los restantes proteinogramas en los que la IFs resultó negativa (83), el cociente de las CLLs K/λ estaba entre 1,67-2,28 en 10 muestras, de las cuales 7 procedían de enfermos con insuficiencia renal crónica y 3 de pacientes con un aumento de inmunoglobulinas de carácter policlonal.
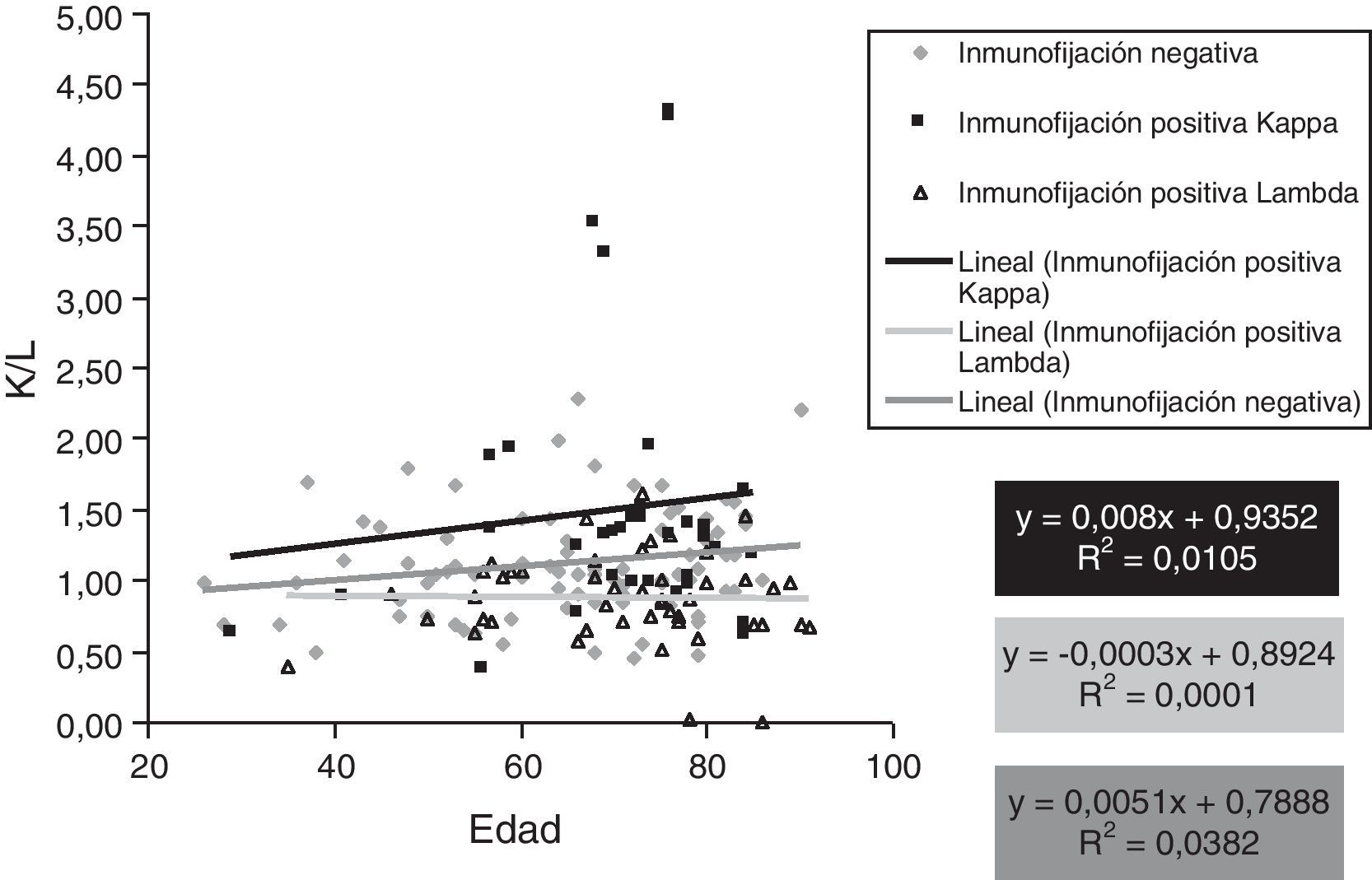
El valor medio del cociente de las CLLs K/λ en los 83 proteinogramas en los que no se detectó ningún CM mediante IFs fue de 1,119±0,384 (media±1DS), en los 35 en los que se detectó mediante IFs un CM K se obtuvo una media de 1,503±0,94 y en los que se descubrió un CM λ se obtuvo una media de 0,874±0,315. Sí se encontraron diferencias estadísticamente significativas entre los valores de estos 3 subgrupos p<0,05 (fig. 2).
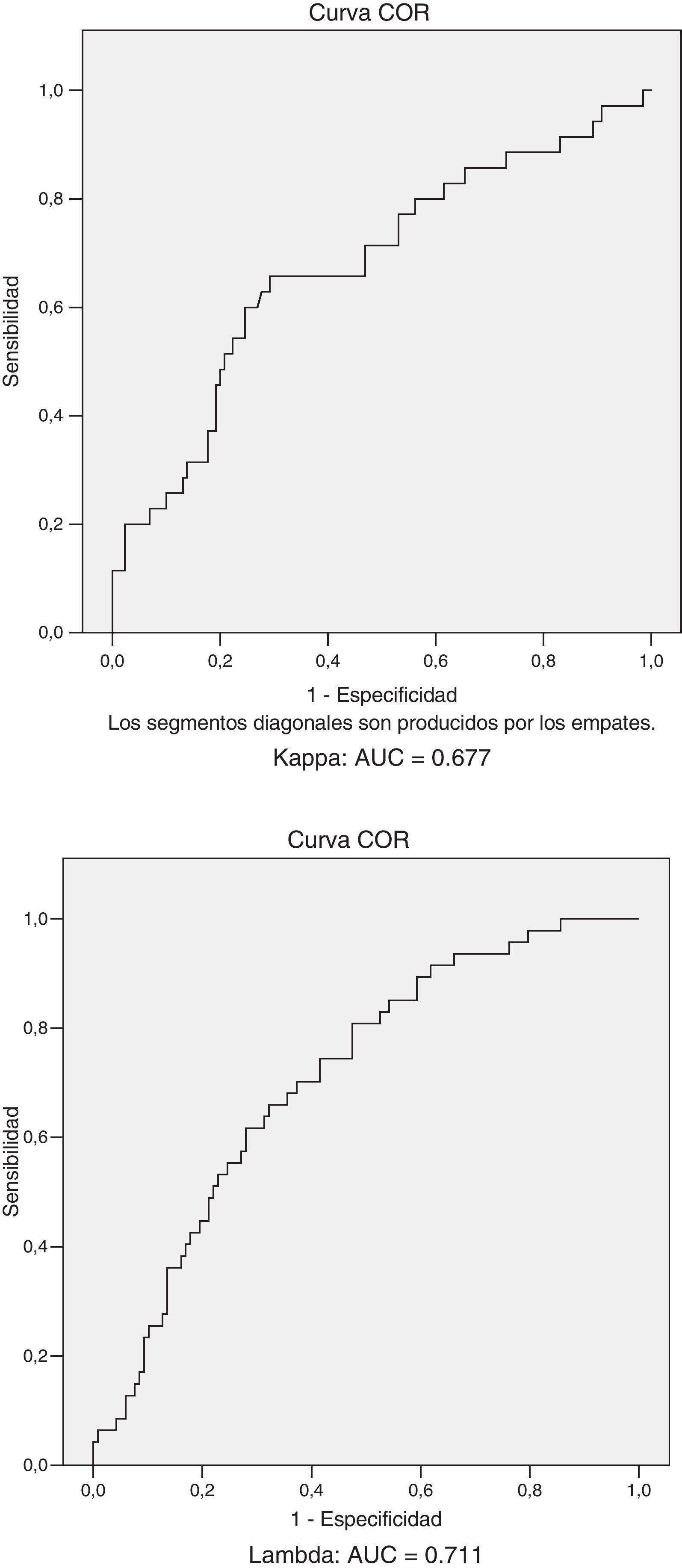
Se calculó la sensibilidad y la especificidad para poder diagnosticar un CM K a partir de un punto de corte de un cociente de las CLLs K/λ de 1,65, obteniéndose una sensibilidad de un 20% y una especificidad del 93,1% [Área bajo la curva (AUC)=0,677]. Para diagnosticar un CM λ con un punto de corte de un cociente de las CLLs K/λ de 0,26 o menor la sensibilidad fue del 4,3% con una especificidad del 100% (AUC=0,711) (fig. 3).
DiscusiónDe los 82 proteinogramas con IFs positiva solo hubo 11 con un cociente de las CLLs K/λ>1,65 o <0,25. De los 83 proteinogramas en los que la IFs fue negativa, 10 tuvieron una pequeña elevación del cociente de las CLLs (1,67-2,28), correspondientes a pacientes con insuficiencia renal crónica o aumento de gammaglobulinas de tipo policlonal, por lo que en estos casos se consideró normal un cociente de hasta 3,117,18. La sensibilidad para poder diagnosticar un CM de tipo K para un punto de corte del cociente de las CLLs K/λ>1,65 (superior al intervalo de referencia) fue de un 20% y para poder diagnosticar un CM de tipo λ con un cociente de las CLLs K/λ<0,25 (inferior al intervalo de referencia) o menor la sensibilidad fue del 4,3%. Cuando se compararon los valores del cociente de las CLLs de los proteinogramas con las IFs negativas con los que tenían IFs positivas para un CM de tipo K o para un CM de tipo λ o de estos últimos entre sí se comprobó que sí había diferencias estadísticamente significativas (p<0,05). No obstante, al encontrarse los valores del cociente de las CLLs K/λ para la mayoría de los sueros con IFs positiva (71), tanto con CM K o λ, dentro de los rangos de referencia publicados (K/λ: 0,26-1,65)12 no se pudo discernir entre proteinogramas con o sin CM mediante este cociente.
Este estudio demuestra que en el cribado de CM a baja concentración mediante EFs y cuyos picos no muestran un claro carácter monoclonal la confirmación debe de realizarse mediante IFs ya que el cociente de las CLLs alterado tiene una sensibilidad muy baja pues la mayoría de los cocientes de las CLLs en los proteinogramas con IFs positiva están dentro del intervalo de referencia para la población normal, sucediendo esto incluso en pacientes con insuficiencia renal crónica. De los 83 proteinogramas con IFs positiva, 22 procedían de pacientes con insuficiencia renal crónica y de estos solo 6 tenían un cociente de las CLLs K/λ alterado. De estos 22, en 8 de ellos el CM era K o λ y de estos 8 solo 3 tenían un cociente de las CLLs K alterado (datos no mostrados).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.