Las terapias con anticuerpos biológicos han supuesto una gran alternativa en el tratamiento de enfermedades inflamatorias crónicas. Su uso abarca muchas enfermedades: en reumatología, artritis reumatoide, espondilitis anquilosante, espondiloartropatías, artritis psoriásica y artritis idiopática juvenil; en gastroenterología, enfermedad de Crohn y colitis ulcerosa; en hematología linfoma no Hodgkin; en dermatología, psoriasis y artritis psoriásica; y en oftalmología, uveítis1–7.
Los fármacos más empleados hoy en día son los inhibidores TNF-α y anti CD20, que pueden inducir la remisión de este tipo de enfermedades y prevenir su evolución. Sin embargo, algunos pacientes no responden satisfactoriamente a este tipo de terapias o muestran una falta de eficacia tras tratamientos prolongados. Esta falta de respuesta se atribuye a su inmunogenicidad5–10 (fig. 1).
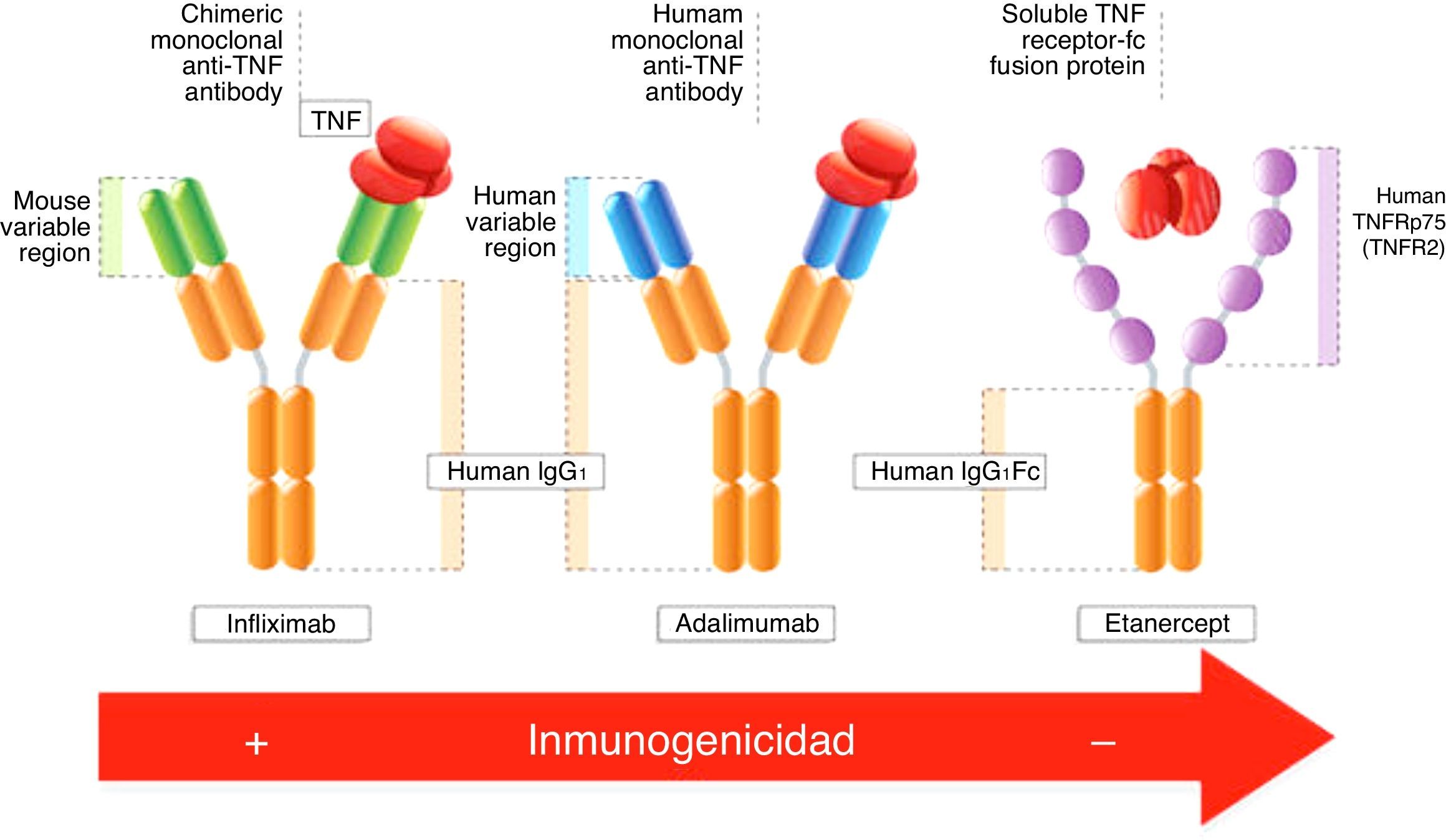
Tres de los fármacos biológicos más empleados son: infliximab, adalimumab y etanercept, aunque se han ido incorporando otros como rituximat. Debido a sus diferencias estructurales, su grado de inmunogenicidad varía. El fenómeno de la inmunogenicidad es reconocido y aceptado como un parámetro esencial en la monitorización de pacientes tratados con cualquier inmunoterapia.
La formación de anticuerpos contra este tipo de fármacos puede llegar a suponer un problema, siendo necesario aumentar las dosis y/o la frecuencia de administración del fármaco, suspender el tratamiento o cambiar a otro tipo de biológico8,10–13.
Las terapias con este tipo de fármacos han supuesto una gran alternativa en el tratamiento de enfermedades inflamatorias crónicas, como la artritis reumatoide, la espondiloartritis, la enfermedad inflamatoria intestinal (enfermedad de Crohn y colitis ulcerosa) y la psoriasis, entre otras1,6,10. Sin embargo, algunos pacientes no responden satisfactoriamente o muestran una falta de eficacia tras tratamientos prolongados. En muchos casos la pérdida de respuesta puede explicarse por la inmunogenicidad del fármaco, es decir, el paciente crea anticuerpos contra el fármaco que neutralizan su efecto. En algunos casos la formación de anticuerpos contra el fármaco conlleva el riesgo de sufrir efectos adversos como reacciones de hipersensibilidad de tipo 3.
La administración de fármacos biológicos debe ir siempre acompañada de un estrecho control de la respuesta del paciente a la terapia, para valorar su eficacia y si fuera necesario modificar la pauta.
En la actualidad la respuesta al tratamiento en enfermedades autoinmunes e inflamatorias se realiza en función de variables clínicas que reflejan aspectos relacionados con el proceso de la enfermedad. En muchos casos los tratamientos actuales hacen un uso ciego y no personalizado de fármacos muy costosos. Los tratamientos pueden ser optimizados, aumentando los beneficios clínicos para el paciente y evitando un uso inútil de fármacos. Por lo tanto, es muy aconsejable incrementar la consistencia y uniformidad de los métodos de evaluación de respuesta para mejorar la validez del sistema predictivo y que se contribuya a una mejora de la eficacia y a una mejor gestión del gasto sanitario en este tipo de fármacos. Para ello, está ampliamente aceptado que es imprescindible la inclusión de variables biológicas como la biodisponibilidad e inmunogenicidad de los medicamentos5–11.
Cualquier fármaco biológico utilizado actualmente es potencialmente inmunogénico. Los anticuerpos monoclonales anti-TNFα que se utilizan rutinariamente para el tratamiento de enfermedades con un claro componente autoinmune e inflamatorio pueden provocar inmunogenicidad. Esto significa que durante el tratamiento el paciente desarrolla anticuerpos contra el fármaco. La principal consecuencia es la pérdida de eficacia, y en algunos casos efectos adversos relacionados con la formación de inmunocomplejos.
De este modo, la naturaleza quimérica del infliximab provoca que sea un fármaco altamente inmunogénico, mientras que anticuerpos humanos como el adalimumab son menos inmunogénicos, y etanercept es el menos inmunogénico de todos ellos.
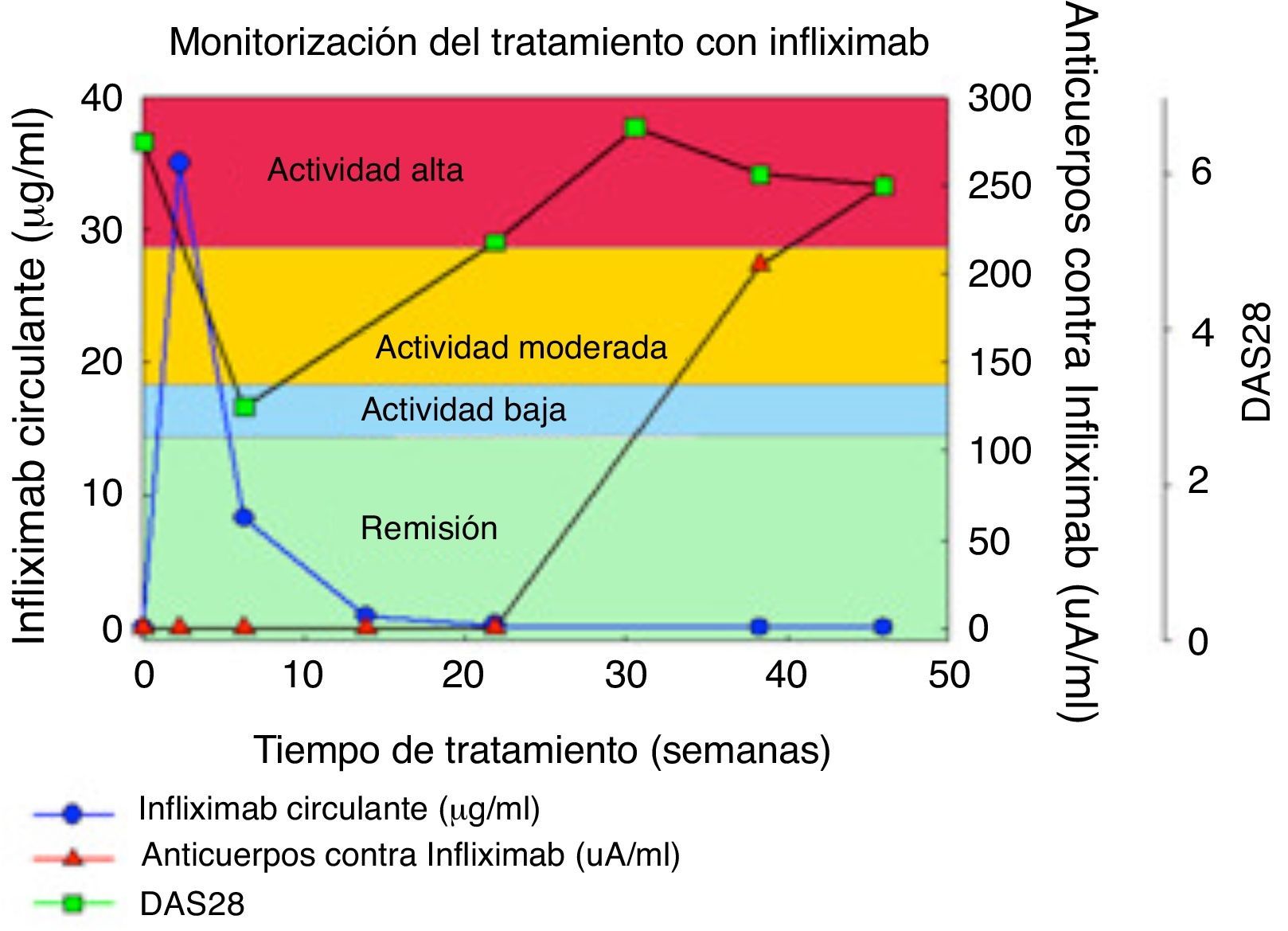
Está ampliamente aceptado que existe una estrecha correlación entre la concentración del fármaco circulante en sangre, el título de anticuerpos contra el fármaco y la respuesta del paciente al tratamiento. El análisis de estos parámetros permite optimizar la evaluación de la respuesta y acelerar la toma de decisiones terapéuticas.
Está demostrado que en un gran porcentaje de los pacientes tratados con infliximab o adalimumab la disminución de los niveles de fármaco circulante en sangre cursa con la aparición de una respuesta inmune en el paciente, responsable de la disminución de la eficacia del tratamiento.
En el caso de artritis reumatoide, si bien el tratamiento es beneficioso en las primeras semanas, el índice de actividad DAS28 (parámetro utilizado en reumatología) aumenta desde el momento en el que se detecta la reacción de inmunogenicidad (aparición de anticuerpos contra infliximab), e infusiones continuadas del fármaco no producen una mejoría clínica. En estos casos cabe considerar una modificación de la terapia.
Las nuevas generaciones de fármacos biológicos anti-TNFα son moléculas de anticuerpos de origen recombinante. Ejercen su acción inmunomoduladora uniéndose al TNFα, evitando así el desencadenamiento de la cascada inflamatoria.
Debido a todo lo comentado anteriormente, el papel del laboratorio clínico es clave en el estudio de este tipo de enfermedades, ya que tiene que medir los niveles de fármaco y el nivel de anticuerpos frente a estos fármacos. Ya se están comercializando y distribuyendo en nuestro país estas técnicas de enzimoinmunoensayo (EIA) Promonitor®14.
Promonitor® ofrece un elevado poder predictivo de cómo un paciente evoluciona y responde al tratamiento. Permite al especialista reconocer de una manera objetiva las pérdidas de respuesta y acelerar la toma de decisiones terapéuticas para cada paciente, asegurando una correcta terapia, ahorrando tiempo y gasto innecesario en terapias ineficaces (fig. 2). Todo ello redundará en una mejor calidad asistencial al paciente.
Por tanto, la monitorización de estos y otros fármacos que vayan saliendo al mercado ahorraría a la administración un considerable volumen de dinero en el tratamiento de estos pacientes y en cambios de medicación.