La gonadotropina coriónica humana (hCG) es producida por el trofoblasto tanto en el embarazo como en la enfermedad trofoblástica gestacional (ETG). La subunidad α de la hCG es idéntica a las subunidades α de otras hormonas, como hormona luteinizante (LH), la hormona folículo estimulante (FSH) y la hormona estimulante de la tiroides (TSH). Una elevación marcada de hCG se asocia a la presencia de complicaciones como la hiperémesis gravídica, el desarrollo precoz de preeclampsia y, ocasionalmente, con el hipertiroidismo. Los procedimientos de laboratorio utilizados para la medición de los niveles de hCG son bastante sensibles y específicos para el estudio de las condiciones del trofoblasto.
Human chorionic gonadotropin (hCG) is produced by trophoblasts in pregnancy as well as in gestational trophoblastic diseases (GTD). The alpha subunit is identical to that for luteinizing hormone (LH), follicle-stimulating hormone (FSH), and thyroid-stimulating hormone (TSH). Elevated serum levels of hCG can lead to complications that include hyperemesis gravidarum, early development of preeclampsia, and occasionally hyperthyroidism. Laboratory test for hCG are very sensitive and specific.
La enfermedad trofoblástica gestacional (ETG) incluye un grupo heterogéneo de patologías secundarias a un desorden proliferativo de las células del trofoblasto. Todas las formas de ETG, como la mola hidatiforme (completa o parcial), la mola invasiva, el coriocarcinoma y los tumores del lecho placentario, se caracterizan por la elevación de un marcador tumoral común, la fracción β de la gonadotropina coriónica humana (β-hCG). La marcada elevación de dicho marcador en suero se asocia al desarrollo de importantes complicaciones, entre las que se encuentran la hiperémesis, la preeclampsia precoz y, ocasionalmente, el hipertiroidismo1–3.
La hCG es un dímero constituido por 2 subunidades α y β codificadas por genes separados en cromosomas diferentes (6 y 19 respectivamente) y unidas de forma no covalente. La subunidad β es específica, mientras que la subunidad α es idéntica a la de la hormona luteinizante, hormona folículo estimulante y la hormona estimulante de la tiroides (TSH)4.
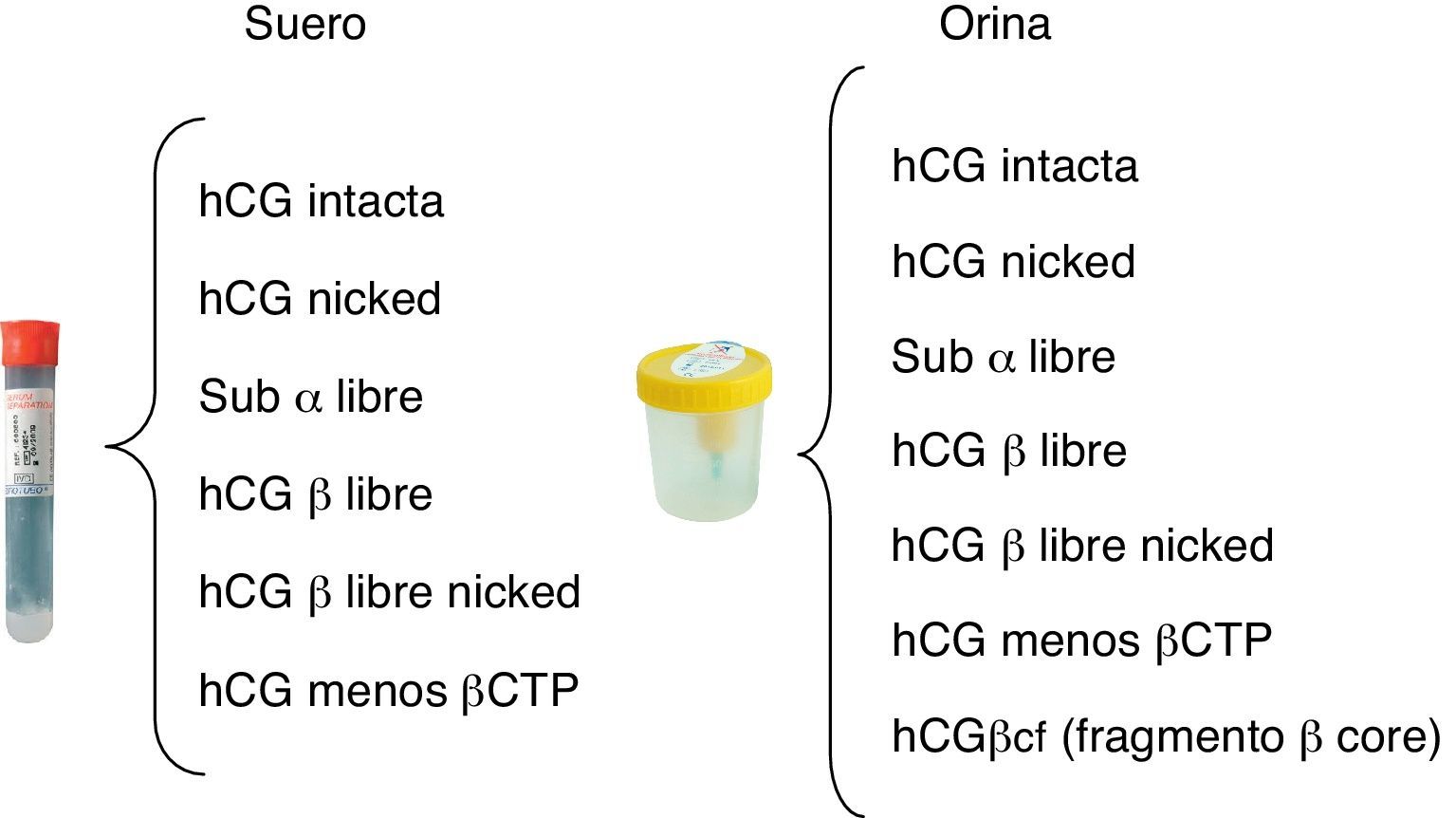
En la circulación existen varias isoformas de hCG, algunas de ellas son sintetizadas y otras son productos de degradación. Las formas más comunes de hCG sintetizadas por las células son la regular o intacta (hCG-I), producida por el sincitiotrofoblasto, y la hiperglucosilada (hCG-H), producida por el citotrofoblasto extravellosos. Los otros 10 tipos de moléculas de hCG que contienen una subunidad β no son sintetizados directamente, sino que son productos de la disociación, escisión o degradación renal de los dímeros de hCG intacta y la β-hCG4,5 (fig. 1).
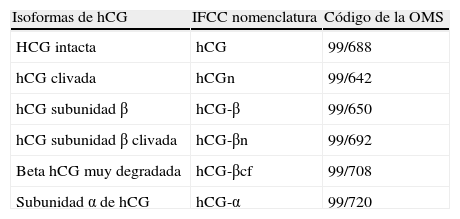
Las pruebas de embarazo actuales emplean anticuerpos monoclonales contra la subunidad β de hCG o contra la molécula intacta. El Grupo de Trabajo de la IFCC para hCG estableció una nomenclatura inequívoca y fácil de usar, que describe la hCG y las 6 isoformas más importantes, y posteriormente preparó la referencia Organización Mundial de la Salud (tabla 1). Aunque todos los ensayos detectan la hCG regular, no todos detectan necesariamente las variantes de hCG. Como mínimo, las pruebas de hCG deben detectar tanto la forma regular como la hiperglucosilada4,6.
Determinaciones de laboratorio realizadas desde el ingreso hasta el alta
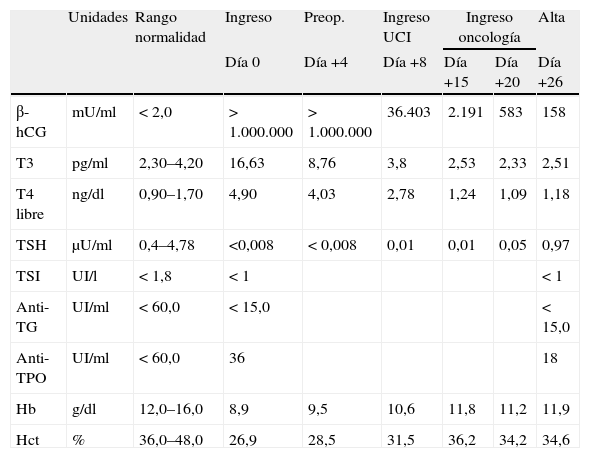
| Unidades | Rango normalidad | Ingreso | Preop. | Ingreso UCI | Ingreso oncología | Alta | ||
| Día 0 | Día +4 | Día +8 | Día +15 | Día +20 | Día +26 | |||
| β-hCG | mU/ml | < 2,0 | > 1.000.000 | > 1.000.000 | 36.403 | 2.191 | 583 | 158 |
| T3 | pg/ml | 2,30–4,20 | 16,63 | 8,76 | 3,8 | 2,53 | 2,33 | 2,51 |
| T4 libre | ng/dl | 0,90–1,70 | 4,90 | 4,03 | 2,78 | 1,24 | 1,09 | 1,18 |
| TSH | μU/ml | 0,4–4,78 | <0,008 | < 0,008 | 0,01 | 0,01 | 0,05 | 0,97 |
| TSI | UI/l | < 1,8 | < 1 | < 1 | ||||
| Anti-TG | UI/ml | < 60,0 | < 15,0 | < 15,0 | ||||
| Anti-TPO | UI/ml | < 60,0 | 36 | 18 | ||||
| Hb | g/dl | 12,0–16,0 | 8,9 | 9,5 | 10,6 | 11,8 | 11,2 | 11,9 |
| Hct | % | 36,0–48,0 | 26,9 | 28,5 | 31,5 | 36,2 | 34,2 | 34,6 |
Mujer de 57 años, refiere enfermedad actual de 3 meses de evolución. Acude inicialmente a urgencias por disuria y tenesmo vesical, detectándose una retención aguda de orina, que se resolvió mediante sondaje.
Posteriormente, asocia disnea de moderados esfuerzos, ortopnea, tos con expectoración amarillenta y algún esputo hemoptoico, concomitante con dolor abdominal generalizado, continuo, sin irradiación, vómitos (3-4 al día) precedidos de náuseas, anorexia y aumento del perímetro abdominal, con pérdida de 3kg de peso, edema progresivo en miembros inferiores y, en los últimos días, la aparición de sangrado vaginal oscuro escaso. Ante el empeoramiento progresivo de su estado general, acude nuevamente a urgencias.
Sin antecedentes personales de interés. Antecedentes ginecológicos: 3 gestaciones, un aborto, un embarazo ectópico y un parto por cesárea. Miomectomía por histeroscopia.
Se realizan las siguientes pruebas complementarias:
- –
Laboratorio (tabla 2).
Tabla 2.Nomenclatura IFCC y códigos de la OMS para las 6 isoformas más importantes de hCG
Isoformas de hCG IFCC nomenclatura Código de la OMS HCG intacta hCG 99/688 hCG clivada hCGn 99/642 hCG subunidad β hCG-β 99/650 hCG subunidad β clivada hCG-βn 99/692 Beta hCG muy degradada hCG-βcf 99/708 Subunidad α de hCG hCG-α 99/720 - –
Ecografía: útero que alcanza nivel umbilical. Formación intracavitaria de 170×109mm, con múltiples formaciones quísticas.
- –
Tomografía computarizada abdómino-pélvica: masa uterina de 16×16cm, que ocupa la cavidad endometrial con áreas quísticas y áreas hipervasculares. Aumento del anejo derecho con dilatación de la vena gonadal. Múltiples nódulos pulmonares de pequeño tamaño en ambos hemitórax, compatibles con metástasis. Derrame pleural bilateral.
Durante su ingreso, la paciente presentó clínica compatible con tirotoxicosis e insuficiencia cardiaca, con anemia progresiva que requirió transfusiones, sin mejoría clínica, decidiéndose realizar histerectomía total simple de forma urgente. El examen histológico de la pieza de histerectomía confirmó el diagnóstico de mola hidatiforme con invasión del miometrio.
Durante el postoperatorio inmediato, la paciente requirió ingreso en la Unidad de Cuidados Intensivos con soporte ventilatorio y farmacológico. Una vez estabilizada, se trasladó al Servicio de Cardiología, con mejoría progresiva y desaparición de los síntomas y signos de congestión pulmonar con tratamiento diurético.
Durante el ingreso, se realizó un ecocardiograma que mostró: acinesia anterior, media y distal. Hipocinesia del resto de segmentos. Función sistólica global: 40%. Posteriormente, se realizó una coronariografía sin evidencia de estenosis.
Tras recibir tratamiento quirúrgico y poliquimioterápico, y una vez normalizadas las hormonas tiroideas con mejoría de la clínica, la paciente fue dada de alta.
DiscusiónLa posibilidad de ETG debe ser considerada en toda mujer mayor de 35 años con sangrado genital anormal. La incidencia de esta patología en Norteamérica y algunas ciudades europeas es de 1 por cada 1.000 a 1.500 gestaciones1,2. Entre los factores de riesgo se encuentran: edad materna (< 20 o>35 años), historia previa de ETG, hábito tabáquico (> 15 cigarrillos/día), grupo sanguíneo (A, B o AB), historia de infertilidad, nuliparidad y uso de anticonceptivos por vía oral1,2,7.
Las manifestaciones clínicas incluyen: sangrado vaginal, crecimiento uterino, presión y dolor pélvico, anemia, hiperémesis gravídica, hipertiroidismo y expulsión vaginal de vesículas hidrópicas1,2.
El hipertiroidismo clínico definido como supresión de TSH con elevados niveles de T3 y/o T4 es más común en la ETG que en las gestaciones normales y lo presentan hasta un 5% de las pacientes, debido a la actividad estimulante del tiroides de la hCG; complicación que solo aparece cuando las cifras de hCG son mayores de 200.000 mIU/ml3,8,9, ya que su actividad sobre los receptores de TSH es 4.000 veces menor en comparación con la TSH3.
Un resultado de hCG total>100.000mUI/ml indica mola hidatiforme completa, aunque el pico de hCG en muchos embarazos normales entre las 8 a 11 semanas de gestación puede alcanzar este nivel (rango de 27.300 a 233.000mUI/ml). El tumor del lecho placentario se asocia a bajos niveles de hCG en relación con el tamaño del tumor debido a la falta de proliferación de células derivadas del sincitiotrofoblasto.
La subunidad β libre de hCG es la principal forma de hCG en estas neoplasias, porque las células tumorales, a diferencia de las células normales trofoblásticas, carecen de la capacidad de combinar de manera eficiente las subunidades β y α4,8,9.
Algunas neoplasias no gestacionales contienen genes para la subunidad β -hCG. La activación de estos genes da como resultado la producción de bajos niveles de la forma libre hiperglucosilada, que puede llegar a ser útil como un marcador o factor pronóstico de estos tumores. Entre estas neoplasias se encuentran el carcinoma de pulmón, el osteosarcoma, el cáncer cervical y el cáncer de páncreas4. La determinación de β-hCG se realiza también como parte del estudio prenatal de anomalías cromosómicas, en combinación con otros marcadores10.
La paciente del caso presentó una verdadera elevación de β-hCG y esta fue tan significativa que produjo una intensa estimulación tiroidea con graves complicaciones. Sin embargo, como toda prueba diagnóstica pueden existir falsos positivos y falsos negativos.
Falsos positivos o gonadotropina coriónica humana fantasmaLos pacientes pueden desarrollar anticuerpos contra proteínas de origen animal Human Anti-Animal Antibodies (HAAA), de ellos el más común es el Human Anti-Mouse Antibodies (HAMA) y además generar anticuerpos antihumanos que pueden dar reacción cruzada, se denominan anticuerpos heterófilos. Las causas que inducen la producción de anticuerpos en los pacientes incluyen: exposición a animales, transfusiones de sangre, factor reumatoide, dietas especiales, enfermedades autoinmunes, entre otras. Aunque puede afectar a varios tipos de ensayos, afecta principalmente a aquellas técnicas que emplean 2 anticuerpos, «tipo sándwich». Cada anticuerpo humano es bivalente, por lo que si un anticuerpo está presente en el suero, se puede unir y enlazar los anticuerpos inmovilizados y anticuerpos trazadores de la prueba, lo que resulta en un falso resultado positivo de hCG. Para evitar falsos positivos, los fabricantes incorporan anticuerpos séricos no específicos de animales, junto con el anticuerpo de captura, anticuerpo marcador y otros componentes. Este exceso de anticuerpos no específicos satura a los anticuerpos heterófilos y HAAA/HAMA en las muestras de suero, y por lo general elimina su interferencia con el ensayo. Otra causa de falsos positivos de hCG es la presencia de enzimas proteolíticas, como la toxina colérica, enzimas bacterianas o proteasas similares a tripsina, que imitan a la subunidad β de la hormona dando bajos niveles de hCG inmunorreactiva en mujeres no embarazadas4,5.
Los falsos positivos o hCG «fantasma» pueden persistir durante muchos años y oscilan en el rango de 10 a 630mUI/ml. Los clínicos han tenido que interpretar estos niveles persistentemente bajos de hCG compatibles con embarazo ectópico o ETG, y algunas pacientes han llegado a ser tratadas con quimioterapia y/o cirugía innecesariamente. La presencia de hCG «fantasma» debe ser considerada como una posible explicación para los niveles persistentemente bajos de la hormona en pacientes sin síntomas de embarazo ni evidencia alguna de patología5. En circunstancias extremas, cualquier prueba disponible en el mercado puede dar un resultado falso positivo. Una verdadera elevación de hCG debe estar presente tanto en el suero como en la orina4,5,11.
Falsos negativosA niveles de hCG por encima de 500.000mUI/ml, puede ocurrir el «efecto gancho», que resulta en un valor artificialmente bajo de hCG. Esto se debe a que el rango de medición de la mayoría de las pruebas de hCG se ha establecido según los valores observados durante el embarazo y, en consecuencia, ante una concentración extremadamente alta de hCG, tanto el anticuerpo de captura como el trazador utilizados en el ensayo inmunorradiométrico se saturan12. Por tanto, todo diagnóstico presuntivo de enfermedad trofoblástica gestacional debe ser comunicado al laboratorio de manera que el ensayo de hCG también se lleve a cabo a una dilución apropiada.
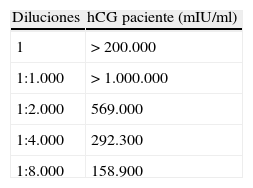
ResultadosAnte las elevadas cifras de hCG que se obtuvieron el día del ingreso, se realizó una dilución seriada del suero de la paciente con el fin de descartar que dicha elevación fuese debida a una interferencia.
El rango del ensayo es de 1–1.000mUI/ml. El autoanalizador utilizado realiza una autodilución de 1:200, por lo que se realizaron de forma manual diluciones seriadas de 1:5, 1:10, 1:20 y 1:40 (equivalentes a una dilución total de 1:1000, 1:2000, 1:4000 y 1:8000) (tabla 3).
La presencia de interferencias se puede corroborar con la modificación de cinética al realizar diluciones de la muestra. A la vista de nuestros resultados, se puede observar una tendencia lineal, por lo que podemos concluir que no se detectan interferencias en el suero de la paciente y, por tanto, la elevación de hCG es debida a la proliferación del tejido trofoblástico, confirmado finalmente con el diagnóstico anatomopatológico de ETG.