La medida de la concentración de las cadenas ligeras libres de inmunoglobulinas en suero proporciona información clínicamente relevante en el diagnóstico, pronóstico y monitorización de pacientes con mieloma múltiple (MM) y con gammapatías monoclonales de significado incierto (GMSI). En este trabajo se ha calculado el valor predictivo negativo (VPN) del cociente kappa/lambda libres (κ/λ) en un suero incluido dentro del rango diagnóstico (0,26-1,65), además de establecer unos nuevos valores discriminantes con un VPN del 100% en el grupo de pacientes estudiado.
Material y métodosLa medida de la concentración de cadenas ligeras libres en suero se realizó por nefelometría en 157 muestras de pacientes diagnosticados de MM o GMSI y se calculó el cociente κ/λ libres.
ResultadosEl área bajo la curva de rendimiento diagnóstico para el cociente κ/λ libres fue de 0,885 en los pacientes con gammapatías con isotipo kappa y 0,879 en pacientes con gammapatías con isotipo lambda. El VPN para un cociente κ/λ libres entre 0,26 y 1,65 fue del 92%. Utilizando un intervalo de 0,36-1,0 se alcanzó un VPN del 100%.
ConclusionesLa modificación del rango diagnóstico de 0,26-1,65 del cociente κ/λ libres por el comprendido entre 0,36 y 1,0, podría ser útil para obviar la realización de un aspirado de médula ósea en pacientes con criterios clínicos y analíticos de GMSI.
Measurement of immunoglobulin free light chains provides relevant clinical information for the diagnosis, prognosis and monitoring of multiple myeloma (MM) and monoclonal gammopathies of undetermined significance (MGUS). We evaluated the negative predictive value (NPV) of a serum free kappa to lambda (κ/λ) ratio included within the described reference range (0.26–1.65) and also set cut-off points for the ratio in order to ensure a 100% NPV.
MethodsSerum concentration of free light chains was measured by nephelometry in 157 individuals diagnosed as having MM or MGUS, and the free κ/λ ratio was calculated.
ResultsThe area under the curve of the free κ/λ ratio was 0.885 in the kappa type gammopathies subgroup, and 0.879 for the lambda subgroup. The NPV for a free κ/λ ratio between 0.26 and 1.65 was 92%. Using cut-off points of 0.36 and 1.0 for the ratio, achieved a 100% NPV.
ConclusionsA change from the cut-off point 0.26–1.65 to 0.36-1.0 for the free κ/λ ratio could be useful in order to avoid performing a bone marrow aspirate in patients with MGUS clinical and laboratory criteria.
Las alteraciones linfoproliferativas monoclonales incluyen un amplio rango de enfermedades. Las gammapatías monoclonales de significado incierto (GMSI o MGUS) son las más frecuentemente diagnosticadas. La detección, identificación y cuantificación de la proteína monoclonal presente en cada una de las alteraciones es fundamental tanto para el diagnóstico como para el pronóstico y monitorización de la enfermedad1.
Diversos estudios han demostrado el potencial de la medida de la concentración de las cadenas ligeras libres kappa y lambda en suero en el manejo de las alteraciones linfoproliferativas, particularmente para la confirmación de la remisión completa estricta en pacientes con mieloma múltiple (MM) y para el pronóstico (cociente kappa/lambda libres) de todas las discrasias de células plasmáticas en el momento del diagnóstico2–8. Así, se han publicado varios trabajos en los que se evalúa la relevancia clínica tanto de la concentración de cadenas ligeras libres en suero como de su cociente (κ/λ) en el diagnóstico de MM juntamente con la electroforesis de proteínas en suero y la inmunofijación (IF), inmunosustracción (IS) o inmunotipado (IT)2,9–13.
El objetivo de este estudio fue evaluar la sensibilidad y especificidad diagnósticas de la medida basal de la concentración de cadenas ligeras libres en suero y de su cociente en el momento de la detección del componente monoclonal en pacientes con GMSI y en pacientes con MM. Así mismo, evaluar el valor predictivo negativo de un cociente κ/λ libres dentro del rango diagnóstico publicado, además de establecer un nuevo rango con un valor predictivo negativo del 100%.
Material y métodosSe incluyeron muestras de suero de pacientes de 6 centros hospitalarios (Hospital Carmen y Severo Ochoa, Cangas de Narcea, Asturias; Hospital Clínico San Carlos, Madrid; Hospital General y Universitario, Elche, Alicante; Hospital Universitario de La Ribera, Alzira, Valencia; Hospital Universitario Doctor Negrín, Las Palmas de Gran Canaria, Las Palmas; Hospital de la Santa Creu i Sant Pau, Barcelona) con diagnóstico de GMSI o MM realizado según criterios clínicos estándar1. Las muestras se congelaron a -20°C y se descongelaron en una sola ocasión para la cuantificación de las cadenas ligeras libres14. El resto de los procedimientos analíticos se realizó previamente a la congelación. El periodo de inclusión fue de 23 meses (febrero 2007 a diciembre 2008).
Para ambos grupos diagnósticos, se incluyeron únicamente nuevos pacientes diagnosticados (sintomáticos o no) antes del inicio de cualquier tratamiento.
En el grupo de GMSI se incluyeron pacientes de al menos un año de evolución desde el diagnóstico en el que no se evidenciaron procesos linfoproliferativos ni componentes monoclonales transitorios o enfermedades autoinmunes o infecciosas asociadas.
En el grupo de MM se excluyeron pacientes con mieloma de cadenas ligeras o mieloma de inmunoglobulinas intactas con presencia de componente monoclonal en suero de cadenas ligeras libres identificado por IF, IS o IT.
La medida de la concentración de las cadenas ligeras libres se centralizó en 3 centros y se realizó mediante nefelometría en un analizador ProSpec (Siemens Healthcare, Marburg, Alemania) utilizando reactivos FreeLite (The Binding Site, Birmingham, Gran Bretaña). Los 3 centros utilizaron los mismos lotes de reactivos, calibradores y controles para minimizar la variabilidad analítica. Así mismo, la calibración, control interno y análisis de las muestras se realizaron el mismo día. Los reactivos, calibradores y controles fueron provistos por The Binding Site.
El análisis de los datos se realizó teniendo en cuenta los valores de referencia recomendados por el fabricante (kappa libre 3,3-19,4mg/L; lambda libre 5,7-26,3mg/L; κ/λ 0,26-1,65) y publicados previamente2.
Se estimó la sensibilidad y especificidad diagnósticas, y el valor predictivo positivo y negativo. Además se estimaron las áreas bajo las curvas de rendimiento diagnóstico (AUC). El análisis estadístico de los datos se realizó mediante el software SPSS 17.0 (Illinois, EE.UU.).
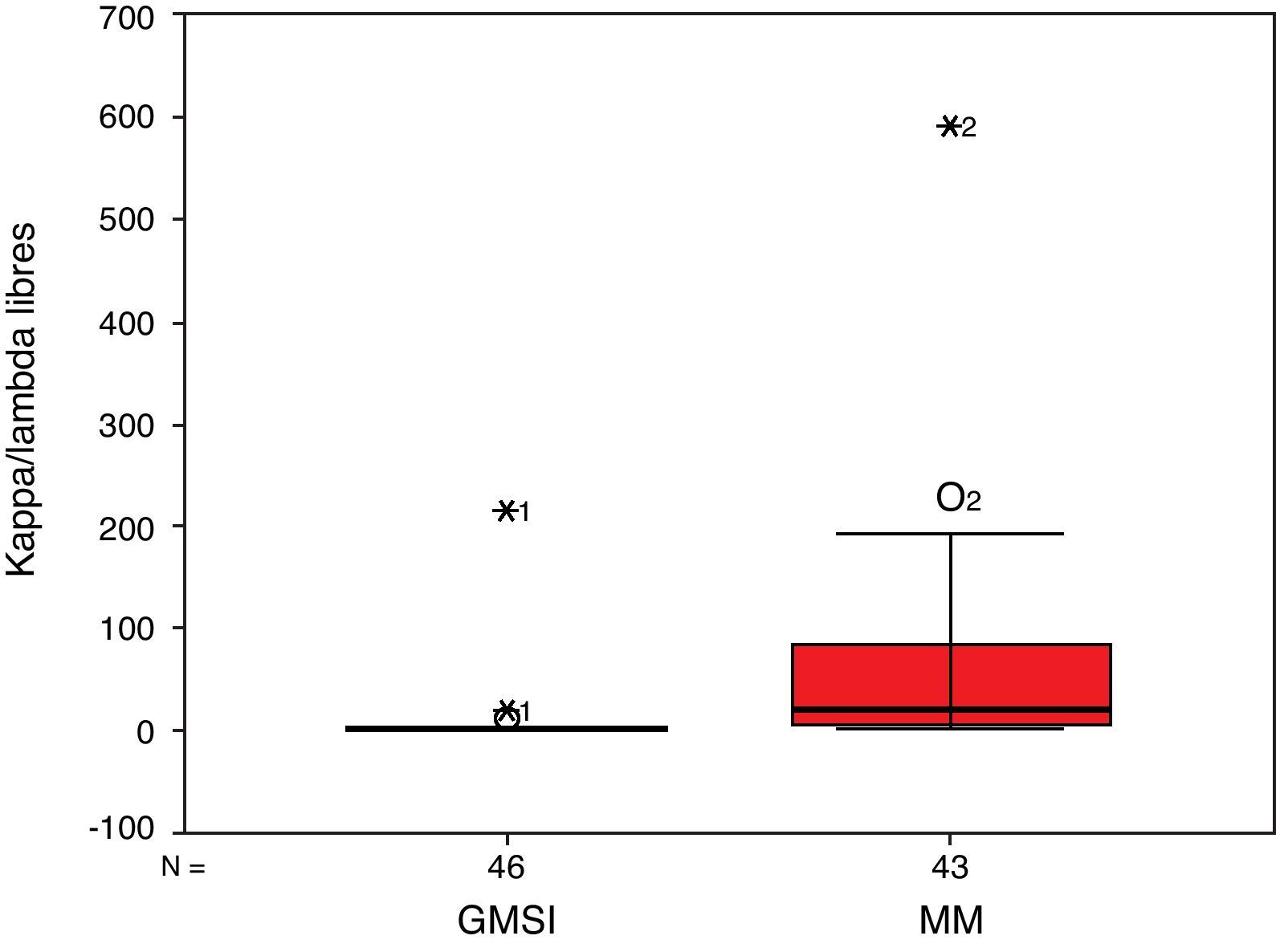
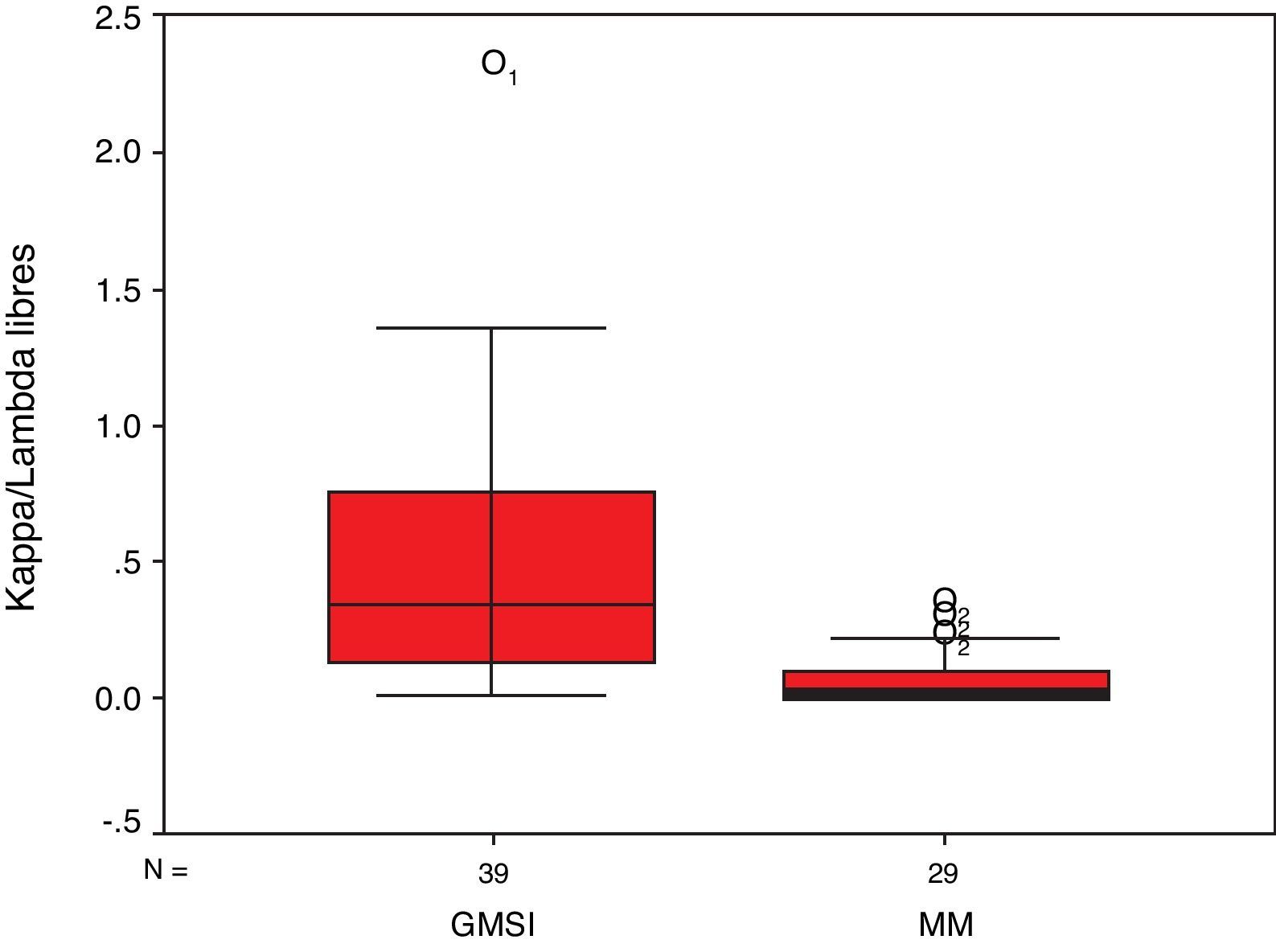
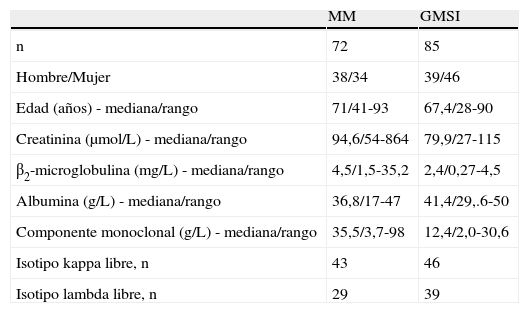
ResultadosCiento ochenta y dos pacientes cumplieron los criterios de inclusión del estudio. Después de la revisión de los datos clínicos y de laboratorio, se excluyeron 25 por falta de algún dato clave quedando una muestra de 157 pacientes. La tabla 1 resume las principales características de los pacientes clasificados según su grupo diagnóstico. No se observaron diferencias en los parámetros estudiados. Las figuras 1 y 2 muestran los diagramas de caja de los cocientes κ/λ libres.
Características demográficas y analíticas de los pacientes incluidos en el estudio
| MM | GMSI | |
| n | 72 | 85 |
| Hombre/Mujer | 38/34 | 39/46 |
| Edad (años) - mediana/rango | 71/41-93 | 67,4/28-90 |
| Creatinina (μmol/L) - mediana/rango | 94,6/54-864 | 79,9/27-115 |
| β2-microglobulina (mg/L) - mediana/rango | 4,5/1,5-35,2 | 2,4/0,27-4,5 |
| Albumina (g/L) - mediana/rango | 36,8/17-47 | 41,4/29,.6-50 |
| Componente monoclonal (g/L) - mediana/rango | 35,5/3,7-98 | 12,4/2,0-30,6 |
| Isotipo kappa libre, n | 43 | 46 |
| Isotipo lambda libre, n | 29 | 39 |
| Isotipo kappa | Isotipo lambda | Isotipo kappa | Isotipo lambda | |
| Kappa libre (mg/L)- mediana/rango | 82,7/13,9-1.870 | 7,7/1,1-64,1 | 28,7/10,1-506 | 11,5/1,1-38,2 |
| Lambda libre (mg/L)–mediana/rango | 6,9/0,28-24,6 | 180/24,1-8530 | 12,8/1,5-85 | 36,5/8,2-1.440 |
| Cociente κ/λ libres–mediana/rango | 19,2/1,01-589,9 | 0,02/0,000-0,36 | 2,4/0,8-216,2 | 0,35/0,01-2,3 |
GMSI;gammapatia monoclonal de significado incierto; MM:mieloma múltiple; n:número de casos.
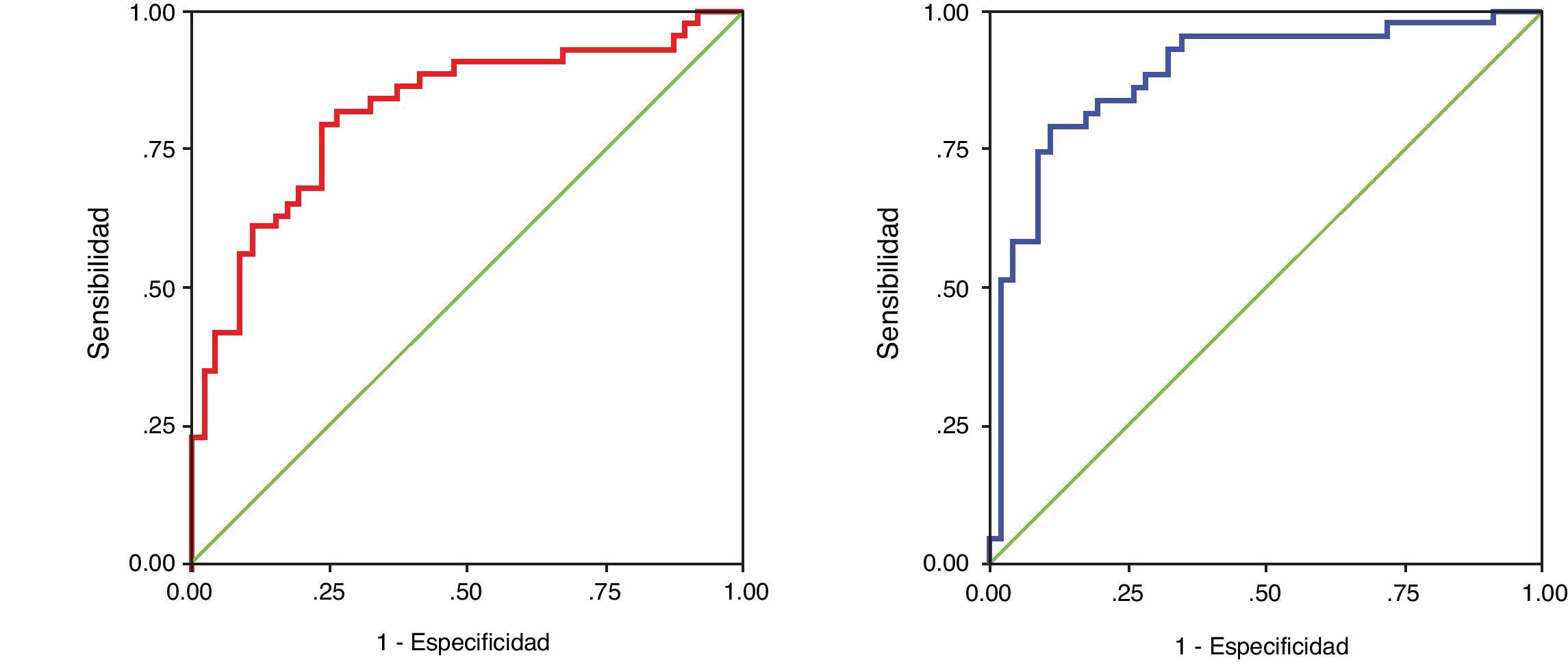
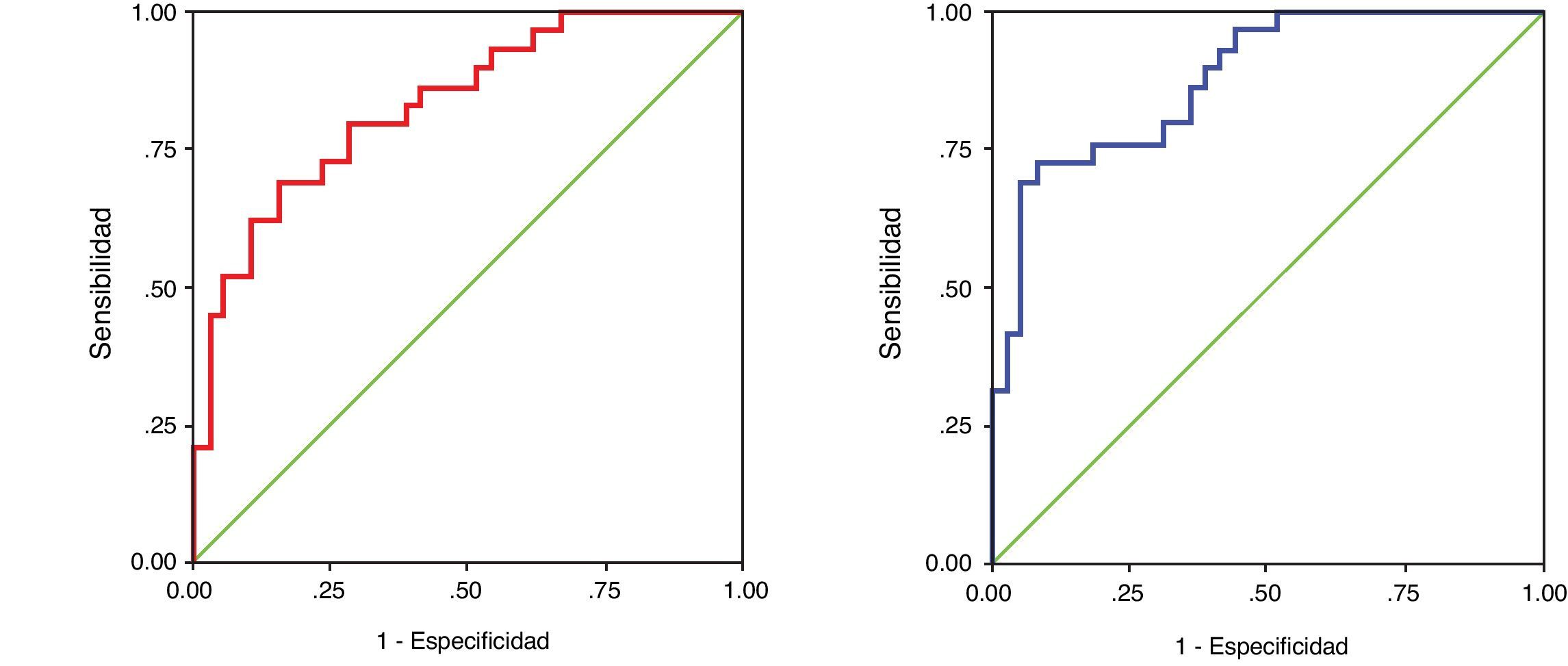
Las características diagnósticas de la medida de la concentración de las cadenas ligeras libres se evaluaron asociando los pacientes según el isotipo de cadena ligera identificada por immunofijación en cada grupo de pacientes (GMSI o MM). En las gammapatías kappa, el AUC fue de 0,816 (IC 95% 0,726 a 0,907) para la concentración sérica de cadenas kappa libres y de 0,885 (IC 95% 0,812 a 0,959) para el cociente κ/λ libres (fig. 3). En las gammapatías lambda, el AUC fue de 0,834 (0,738 a 0,929) para la concentración sérica de cadenas lambda libres y de 0,879 (IC95% 0,799 a 0,958) para el cociente κ/λ libres (fig. 4).
Teniendo en cuenta unos valores discriminantes de 0,26-1,65 para el cociente κ/λ libres, la sensibilidad y especificidad diagnósticas y los valores predictivos positivo y negativo para el conjunto de pacientes fueron respectivamente de 95,8, 42,4, 58,4 y 92%. En el caso de los valores discriminantes 0,36–1,0, estos mismos parámetros fueron 100, 27,0, 53,7 y 100% respectivamente.
DiscusiónEl diagnóstico diferencial entre MM y GMSI raramente ofrece dudas diagnósticas ya que habitualmente el MM presenta signos y síntomas clínicos en el momento de su detección. En el caso de MM asintomático, el diagnóstico se realiza por la confirmación de un infiltrado de células plasmáticas en la médula ósea. Además, en los pacientes sin signos o síntomas clínicos, la concentración sérica del componente monoclonal y la presencia de proteinuria de Bence-Jones ayuda a su diagnóstico diferencial.
El cociente κ/λ libres podría utilizarse como una alternativa diagnóstica al aspirado de médula ósea en gammapatias monoclonales de nuevo diagnóstico juntamente con la electroforesis de proteínas séricas, la IF y la cuantificación del componente monoclonal. Sin embargo, en nuestra serie de pacientes, 3/72 pacientes (4,2%) fueron falsos negativos.
Se ha descrito anteriormente que la medida de la concentración de cadenas ligeras libres en suero y el cálculo del cociente κ/λ tiene valor pronóstico de evolución de GMSI hacia MM (pacientes con cociente κ/λ libres fuera del intervalo 0,26-1,65). El diagnóstico de GMSI necesita demostrar un infiltrado por células plasmáticas en médula ósea inferior al 10%3. Por ello, la confirmación de que la medida de la concentración de cadenas ligeras libres en suero puede identificar estos pacientes supondría la sustitución del aspirado medular, que es una técnica diagnóstica invasiva.
En nuestra serie de pacientes, el valor predictivo negativo del cociente κ/λ libres para el diagnóstico de evolución de GMSI a MM fue del 92%. Con el fin de obtener un valor predictivo negativo del 100%, debería usarse un valor discriminante para el cociente κ/λ libres de 0,36-1,01. Obviamente, la utilización de este intervalo disminuiría la especificidad diagnóstica hasta límites poco razonables (27,0%), aunque para los pacientes con GMSI que presentaran un cociente fuera de del intervalo de referencia (falso positivo) no representaría ninguna variación en la estrategia diagnóstica ya que la realización de aspirado de médula ósea es una práctica habitual. Katzmann et al.14 describieron un valor predictivo negativo idéntico para el intervalo 0,3-1,2, parecido al propuesto en nuestro estudio.
En definitiva, el uso de un cociente κ/λ libres 0,26-1,65 tendría un valor pronóstico en los pacientes con GMSI3, mientras que el empleo de un cociente κ/λ libres de 0,36-1,01 permitiría excluir la realización de un aspirado medular para un significativo número de estos pacientes.
Las conclusiones de este trabajo deberán ser verificadas por nuevos estudios que incluyan un mayor número de pacientes.
FinanciaciónLos envases de reactivos FreeLite fueron cedidos por The Binding Site España (calle Balmes 243, 4° 3a, 08006 Barcelona).
Conflictos de interesesLos autores declaran no tener ningún conflicto de intereses.
The Binding Site España.