Durante la pandemia por SARS-CoV-2, varias pautas de corticoides han sido utilizadas en el tratamiento de la enfermedad, con resultados dispares según fármaco y pauta utilizada. Por este motivo hemos querido analizar diferencias en la mortalidad temprana derivadas del empleo de diferentes pautas de dexametasona y metilprednisolona en infección por SARS-CoV-2 en pacientes graves que requieren ingreso en una unidad de cuidados intensivos (UCI).
MétodoEstudio observacional, analítico y retrospectivo llevado a cabo en una UCI de un hospital universitario de tercer nivel, entre marzo de 2020 y junio de 2021. Se incluyeron pacientes adultos (>18 años) que ingresaron de forma consecutiva debido a una infección confirmada por el virus SARS-CoV-2. Se evaluó la asociación entre diferentes pautas de corticoides utilizadas y la mortalidad en la UCI a los 28 días mediante un modelo de regresión de riesgos proporcionales de Cox.
ResultadosCohorte de 539 pacientes donde la edad de los pacientes mostró una asociación significativa con la mortalidad a los 28 días en la UCI (RR: 1,06; IC 95%: 1,02-1,10; p<0,01). Al analizar las diferentes pautas de corticoides utilizadas, se identificó una posible tendencia en la asociación entre la dosis de dexametasona de 6mg/día y una menor mortalidad a los 28 días en la UCI, con un RR de 0,40 (IC 95%: 0,15-1,02; p=0,05). Por otro lado, las dosis de dexametasona mayores a 6mg/día y las dosis bajas de metilprednisolona mostraron una tendencia a reducir la mortalidad, aunque no alcanzaron significación estadística (RR: 0,54; IC 95%: 0,21-1,37; p=0,19 y RR: 0,51; IC 95%: 0,20-1,27; p=0,15, respectivamente).
ConclusionesEl estudio sugiere que la edad y la dosis de dexametasona de 6mg/día podrían ser factores importantes en la mortalidad a los 28 días en pacientes con infección por SARS-CoV-2 en la UCI.
During the SARS-CoV-2 pandemic, several corticosteroid regimens have been used in the treatment of the disease, with disparate results according to drug and regimen used. For this reason, we wanted to analyze differences in early mortality derived from the use of different regimens of dexamethasone and methylprednisolone in SARS-CoV-2 infection in critically ill patients requiring admission to an ICU.
MethodObservational, analytical and retrospective study, in an intensive care unit of a third-level university hospital (March 2020 and June 2021). Adult patients (>18 years old) who were admitted consecutively for proven SARS-CoV-2 infection were included. The association with mortality in ICU at 28 days, different corticosteroid regimens used, was analyzed using a Cox proportional risk regression model.
ResultsData from a cohort of 539 patients were studied. Patient age (RR: 1.06; 95% CI: 1.02-1.10; P≤0.01) showed a significant association with 28-day mortality in the ICU. In the comparison of the different corticosteroid regimens analyzed, taking as a reference those patients who did not receive corticosteroid treatment, the dose of dexamethasone of 6mg/day showed a clear trend towards statistical significance as a protector of mortality at 28 days in the ICU (RR: 0.40; 95% CI: 0.15-1.02; p=.05). The dose of dexamethasone of 6 mg/day and low doses of methylprednisolone show a similar association with survival at 28 days (OR: 1.19; 95% CI: 0.63-2.26).
ConclusionsThe use of corticosteroids has been associated with better mortality outcomes in severe cases of SARS-CoV-2 infection. However, the therapeutic benefits of corticosteroids are not limited to dexamethasone alone.
Desde el inicio de la pandemia por SARS-CoV-2, los glucocorticoides se han considerado como un tratamiento potencial de la enfermedad, de acuerdo con la experiencia de su uso en el síndrome de distrés respiratorio agudo (SDRA)1, la infección por influenza2 y las infecciones por otros coronavirus similares como el severe acute respiratory syndrome (SARS-CoV) o el Middle East respiratory syndrome (MERS-CoV)3,4. Se ha propuesto su potente acción antiinflamatoria como base de su efecto beneficioso, especialmente en el estado hiperinflamatorio («tormenta de citoquinas»)5.
En este contexto, tras la publicación de los resultados del ensayo RECOVERY, se demostró que el uso de corticosteroides, específicamente la dexametasona a una dosis de 6mg por día, resultó en una reducción significativa del 11% en la mortalidad de pacientes. Como resultado de estos hallazgos, la Organización Mundial de la Salud (OMS) anunció que los corticosteroides se consideran el tratamiento de referencia para abordar casos graves de la enfermedad por SARS-CoV-26,7.
Sin embargo, la metilprednisolona presenta una mayor proporción en tejido pulmonar respecto al plasma, en animales de experimentación, en comparación con la dexametasona, lo que podría indicar una acción diferente en la lesión pulmonar8.
Ante la necesidad de una mayor comprensión sobre los efectos de los corticosteroides en pacientes graves con COVID-19, proporcionar información sobre la eficacia y la seguridad de diferentes corticosteroides en el manejo de pacientes graves con COVID-19, el objetivo de este estudio es analizar el impacto de la terapia con dexametasona y metilprednisolona en la supervivencia a corto plazo (28 días) de los pacientes que requieren ingreso en una unidad de cuidados intensivos (UCI) debido a la infección por SARS-CoV-2.
MétodoEstudio retrospectivo, observacional y analítico en el que fueron incluidos los enfermos adultos que habían ingresado en área-COVID, con diagnóstico confirmado de infección por SARS-CoV-2 mediante reacción en cadena de la polimerasa (PCR) en células del tracto respiratorio, del servicio de medicina intensiva entre marzo de 2020 y junio de 2021.
Los datos fueron obtenidos de la cohorte de enfermos del registro de enfermos COVID del servicio de medicina intensiva, que obtuvo la aceptación por el Comité de Ética de Investigación local (2020.250) y la concesión del consentimiento de los pacientes/representante (escrito y/o telefónico).
Se registraron variables clínico-demográficas de los enfermos: fecha de ingreso en la UCI, edad en años naturales en el momento del ingreso en la UCI, sexo (variable dicotómica varón o mujer), motivo del ingreso clínico principal insuficiencia respiratoria aguda (como Variable dicotómica sí/no); comorbilidades (como Variables dicotómicas sí/no; Hipertensión arterial (HTA): diagnosticada en la historia clínica previo al ingreso actual; Obesidad: índice de masa corporal diagnosticado previamente en la historia clínica o descrito ≥30; Diabetes mellitus: diagnosticada en la historia clínica previo al ingreso actual (no diferenciación en tipo I o II); Dislipemia: diagnosticada en la historia clínica como hipercolesterolemia y/o hipertrigliceridemia previo al ingreso actual; Fumador: diagnosticada en la historia clínica previo al ingreso actual como fumador activo o recogido durante la anamnesis a paciente o familiares); Biomarcadores analizados (primer valor) como variables continuas recogidas en las primeras 24h de ingreso en la UCI: creatincinasa (CK en unidades/litro [U/l], rango de referencia de normalidad: 46-171), dímero-D (DD en ng/m, rango normal de referencia: 0-500); Determinación del cociente presión arterial de oxígeno/fracción inspiratoria de oxígeno (P/F) como variable continua en el momento de ingreso en la UCI; Terapias requeridas durante el ingreso en la UCI como variables dicotómicas sí/no: cánulas nasales de alto flujo (CNAF), ventilación mecánica (VM), dosis de anticoagulación de características profilácticas en función de peso del paciente, empleo de antibioterapia con fines profilácticos, uso de la posición de decúbito prono como medida terapéutica, empleo de corticoides como tratamiento antiviral, necesidad de fármacos vasoactivos y/o inotrópicos por situación de shock séptico, empleo de terapias de remplazo renal continuo (TRRC) por insuficiencia renal, y variables evolutivas: días de ventilación mecánica en días como variable continua, desarrollo de tromboembolismo pulmonar (TEP) confirmado mediante tomografía axial computarizada (TAC) como variable dicotómica sí/no, desarrollo de traqueobronquitis y neumonía asociada a ventilación mecánica (TAVM y NAVM) como variable dicotómica sí/no, necesidad de traqueotomía (según criterio clínico) por prolongación de VM como variable dicotómica sí/no, estancia en la UCI en días como variable continua.
Los pacientes fueron categorizados en 4 grupos: 1) pacientes que no recibieron tratamiento corticoideo durante su estancia en la UCI; 2) pacientes tratados con dexametasona 6mg diarios hasta por 10 días6; 3) pacientes que recibieron dexametasona en dosis superiores a los 6mg diarios9, y 4) pacientes manejados con dosis bajas de metilprednisolona (40-80mg diarios) durante un periodo de 3 a 5 días10,11.
Se realizó un análisis descriptivo de la muestra: Para las variables continuas se aplicó el test Shapiro-Wilk como prueba de normalidad. Las variables continuas con distribución normal se describen como media y su desviación estándar (DE), mientras que las variables continuas con una distribución no normal se expresan como mediana y sus percentiles 25-75 (p25-75). La comparación entre grupos se llevó a cabo mediante el empleo del Chi-cuadrado de Pearson o el test exacto de Fisher para la comparación de proporciones, y mediante la prueba de Kruskal-Wallis para la comparación de variables continuas.
Se utilizó un modelo de regresión de riesgos proporcionales de Cox en el estudio de factores de riesgo para la mortalidad en la UCI a los 28 días, introduciendo las variables con un valor de p<0,1 en el análisis bivariante frente a mortalidad a 28 días. Los resultados se muestran mediante la razón de riesgos (RR) y su intervalo de confianza del 95% (IC 95%) para la regresión de Cox.
El análisis de supervivencia se realizó mediante el método de Kaplan-Meier y las comparaciones se realizaron mediante long-rank test.
Para los cálculos y análisis estadísticos se utilizó el software estadístico MedCalc®, versión 19.5.3 (MedCalc Software Ltd, Ostende, Bélgica; https://www.medcalc.org; 2020).
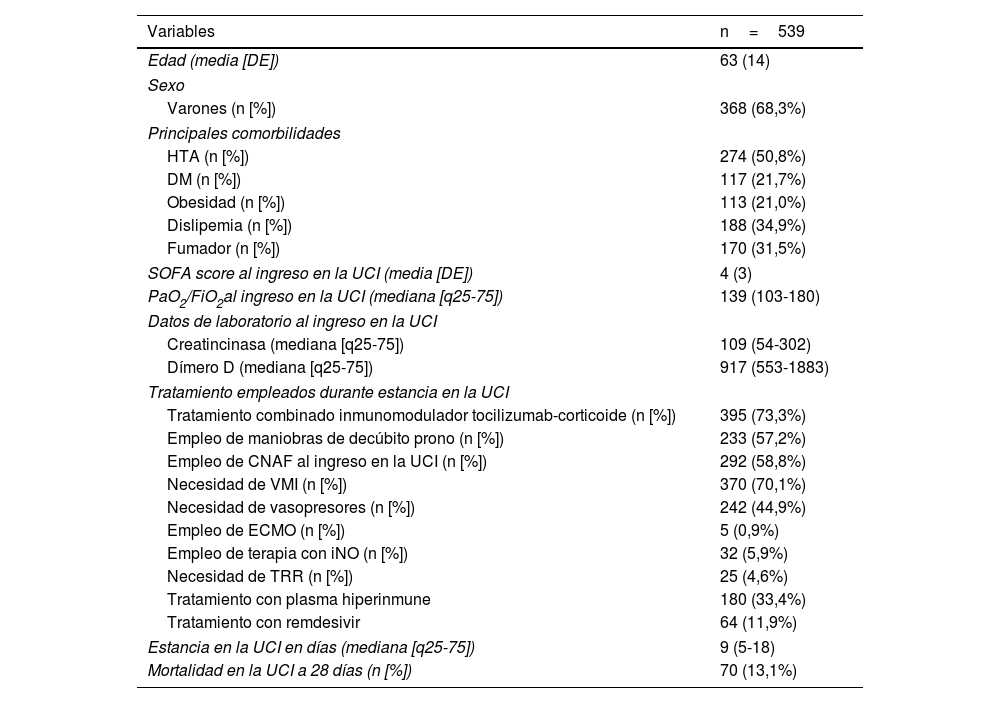
ResultadosDurante el periodo de análisis, 565 pacientes ingresaron en la UCI con el diagnóstico de infección por SARS-CoV-2 o alta sospecha de enfermedad. Fueron excluidos 26 pacientes porque no pudo confirmarse microbiológicamente la infección por SARS-CoV-2. Las principales características basales y clínico-epidemiológicas, de los 539 pacientes restantes se muestran en la tabla 1.
Características basales, clínico-epidemiológicas, de los pacientes ingresados con neumonía por SARS-CoV-2 confirmada
| Variables | n=539 |
|---|---|
| Edad (media [DE]) | 63 (14) |
| Sexo | |
| Varones (n [%]) | 368 (68,3%) |
| Principales comorbilidades | |
| HTA (n [%]) | 274 (50,8%) |
| DM (n [%]) | 117 (21,7%) |
| Obesidad (n [%]) | 113 (21,0%) |
| Dislipemia (n [%]) | 188 (34,9%) |
| Fumador (n [%]) | 170 (31,5%) |
| SOFA score al ingreso en la UCI (media [DE]) | 4 (3) |
| PaO2/FiO2al ingreso en la UCI (mediana [q25-75]) | 139 (103-180) |
| Datos de laboratorio al ingreso en la UCI | |
| Creatincinasa (mediana [q25-75]) | 109 (54-302) |
| Dímero D (mediana [q25-75]) | 917 (553-1883) |
| Tratamiento empleados durante estancia en la UCI | |
| Tratamiento combinado inmunomodulador tocilizumab-corticoide (n [%]) | 395 (73,3%) |
| Empleo de maniobras de decúbito prono (n [%]) | 233 (57,2%) |
| Empleo de CNAF al ingreso en la UCI (n [%]) | 292 (58,8%) |
| Necesidad de VMI (n [%]) | 370 (70,1%) |
| Necesidad de vasopresores (n [%]) | 242 (44,9%) |
| Empleo de ECMO (n [%]) | 5 (0,9%) |
| Empleo de terapia con iNO (n [%]) | 32 (5,9%) |
| Necesidad de TRR (n [%]) | 25 (4,6%) |
| Tratamiento con plasma hiperinmune | 180 (33,4%) |
| Tratamiento con remdesivir | 64 (11,9%) |
| Estancia en la UCI en días (mediana [q25-75]) | 9 (5-18) |
| Mortalidad en la UCI a 28 días (n [%]) | 70 (13,1%) |
CNAF: cánulas nasales de alto flujo; DE: desviación estándar; DM: diabetes mellitus; ECMO: membrana de oxigenación extracorpórea; HTA: hipertensión arterial; iNO: óxido nítrico inhalado; SOFA: Sequential Organ Failure Assessment score; TRR: técnicas de reemplazo renal; UCI: unidad de cuidados intensivos; VMI: ventilación mecánica invasiva.
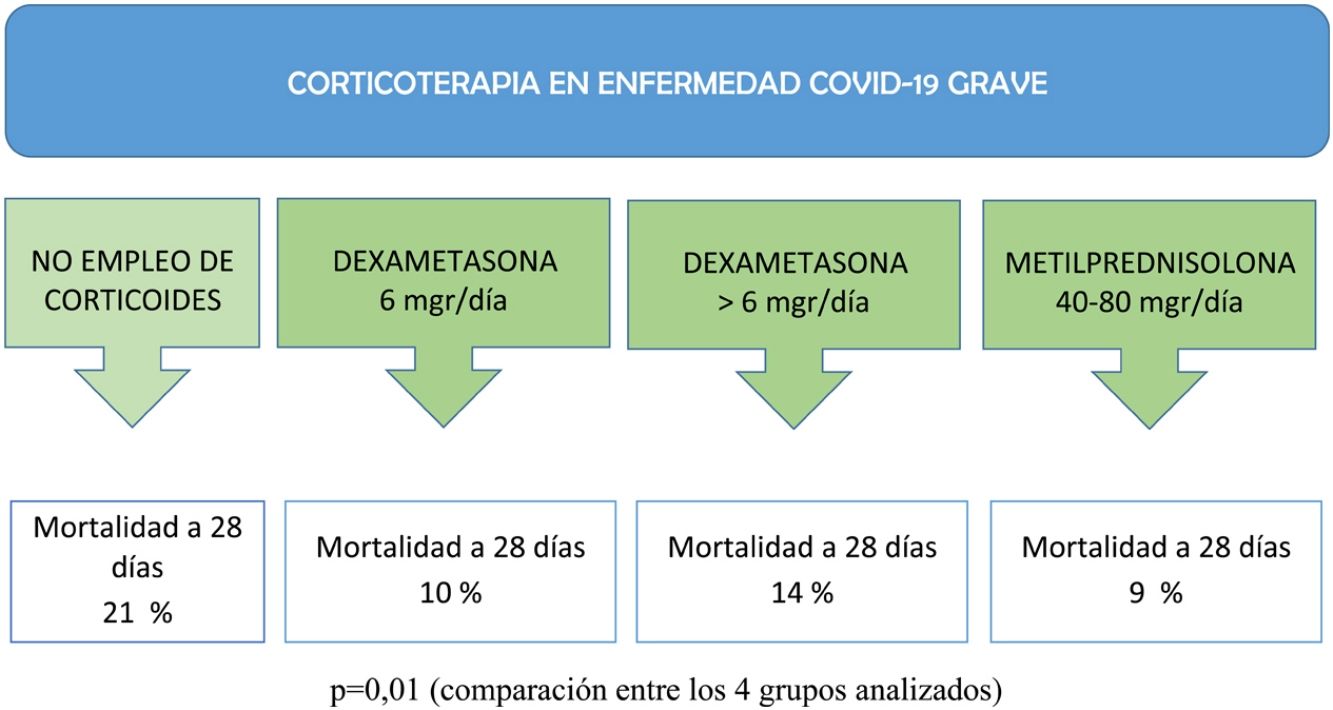
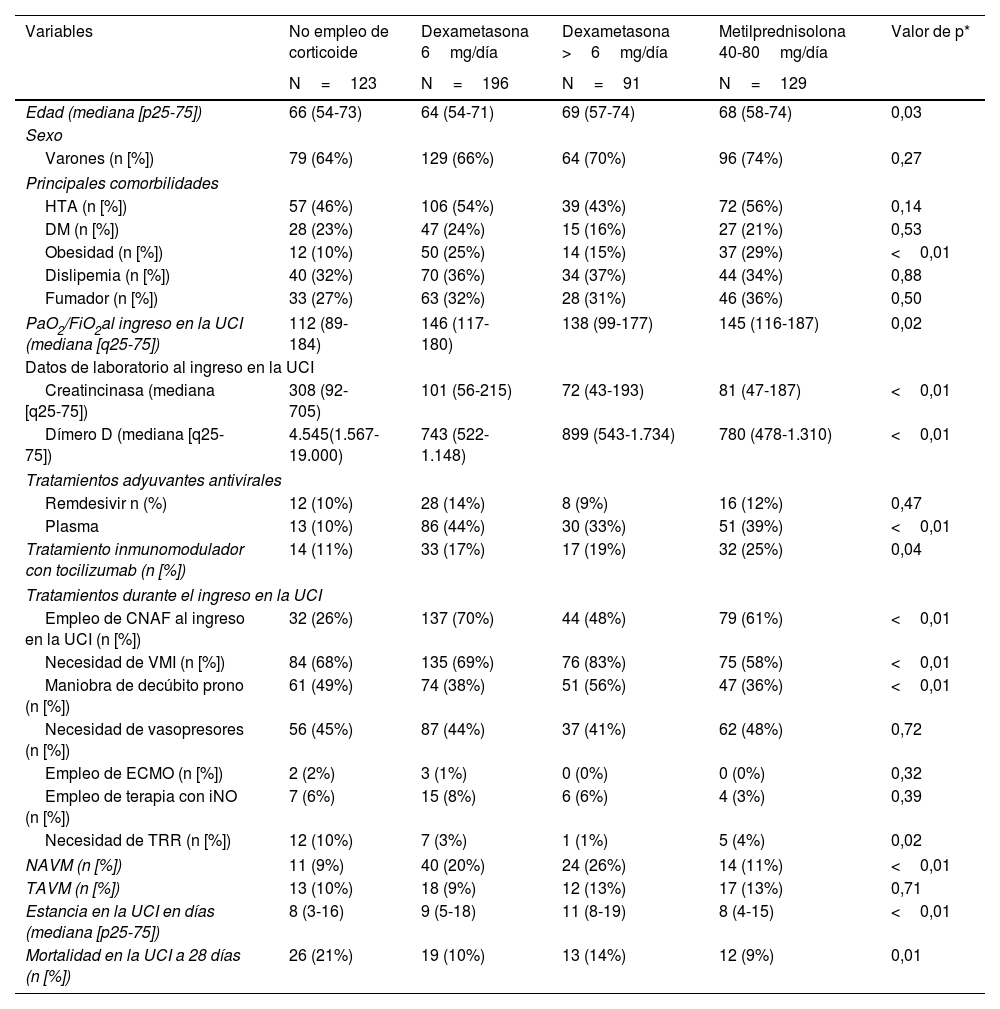
Como se muestra en la tabla 2, la edad mostró una diferencia significativa entre los grupos de tratamiento con corticoides (p=0,03), y no se encontraron diferencias significativas en las principales comorbilidades, excepto en la obesidad (p<0,01). En cuanto a los datos de laboratorio al ingreso en la UCI, se observaron diferencias significativas en los valores de creatincinasa (p<0,01) y dímero D (p<0,01) entre los grupos de tratamiento. Con relación a los tratamientos adyuvantes antivirales y las terapias durante el ingreso en la UCI, se observaron diferencias significativas. El uso de plasma fue más frecuente en el grupo tratado con dexametasona a dosis de 6mg/día (p<0,01), mientras que la necesidad de ventilación mecánica invasiva (VMI) fue más alta en el grupo tratado con metilprednisolona (p<0,01). La estancia en la UCI en días mostró una diferencia significativa entre los grupos de tratamiento (p<0,01). Además, la mortalidad a los 28 días en la UCI fue significativamente menor en los grupos tratados con dexametasona a dosis de 6mg/día (p=0,01) y metilprednisolona (p<0,01) en comparación con el grupo sin empleo de corticoide.
Principales diferencias clínicas básicas entre los cuatro grupos analizados en el estudio
| Variables | No empleo de corticoide | Dexametasona 6mg/día | Dexametasona >6mg/día | Metilprednisolona 40-80mg/día | Valor de p* |
|---|---|---|---|---|---|
| N=123 | N=196 | N=91 | N=129 | ||
| Edad (mediana [p25-75]) | 66 (54-73) | 64 (54-71) | 69 (57-74) | 68 (58-74) | 0,03 |
| Sexo | |||||
| Varones (n [%]) | 79 (64%) | 129 (66%) | 64 (70%) | 96 (74%) | 0,27 |
| Principales comorbilidades | |||||
| HTA (n [%]) | 57 (46%) | 106 (54%) | 39 (43%) | 72 (56%) | 0,14 |
| DM (n [%]) | 28 (23%) | 47 (24%) | 15 (16%) | 27 (21%) | 0,53 |
| Obesidad (n [%]) | 12 (10%) | 50 (25%) | 14 (15%) | 37 (29%) | <0,01 |
| Dislipemia (n [%]) | 40 (32%) | 70 (36%) | 34 (37%) | 44 (34%) | 0,88 |
| Fumador (n [%]) | 33 (27%) | 63 (32%) | 28 (31%) | 46 (36%) | 0,50 |
| PaO2/FiO2al ingreso en la UCI (mediana [q25-75]) | 112 (89-184) | 146 (117-180) | 138 (99-177) | 145 (116-187) | 0,02 |
| Datos de laboratorio al ingreso en la UCI | |||||
| Creatincinasa (mediana [q25-75]) | 308 (92-705) | 101 (56-215) | 72 (43-193) | 81 (47-187) | <0,01 |
| Dímero D (mediana [q25-75]) | 4.545(1.567-19.000) | 743 (522-1.148) | 899 (543-1.734) | 780 (478-1.310) | <0,01 |
| Tratamientos adyuvantes antivirales | |||||
| Remdesivir n (%) | 12 (10%) | 28 (14%) | 8 (9%) | 16 (12%) | 0,47 |
| Plasma | 13 (10%) | 86 (44%) | 30 (33%) | 51 (39%) | <0,01 |
| Tratamiento inmunomodulador con tocilizumab (n [%]) | 14 (11%) | 33 (17%) | 17 (19%) | 32 (25%) | 0,04 |
| Tratamientos durante el ingreso en la UCI | |||||
| Empleo de CNAF al ingreso en la UCI (n [%]) | 32 (26%) | 137 (70%) | 44 (48%) | 79 (61%) | <0,01 |
| Necesidad de VMI (n [%]) | 84 (68%) | 135 (69%) | 76 (83%) | 75 (58%) | <0,01 |
| Maniobra de decúbito prono (n [%]) | 61 (49%) | 74 (38%) | 51 (56%) | 47 (36%) | <0,01 |
| Necesidad de vasopresores (n [%]) | 56 (45%) | 87 (44%) | 37 (41%) | 62 (48%) | 0,72 |
| Empleo de ECMO (n [%]) | 2 (2%) | 3 (1%) | 0 (0%) | 0 (0%) | 0,32 |
| Empleo de terapia con iNO (n [%]) | 7 (6%) | 15 (8%) | 6 (6%) | 4 (3%) | 0,39 |
| Necesidad de TRR (n [%]) | 12 (10%) | 7 (3%) | 1 (1%) | 5 (4%) | 0,02 |
| NAVM (n [%]) | 11 (9%) | 40 (20%) | 24 (26%) | 14 (11%) | <0,01 |
| TAVM (n [%]) | 13 (10%) | 18 (9%) | 12 (13%) | 17 (13%) | 0,71 |
| Estancia en la UCI en días (mediana [p25-75]) | 8 (3-16) | 9 (5-18) | 11 (8-19) | 8 (4-15) | <0,01 |
| Mortalidad en la UCI a 28 días (n [%]) | 26 (21%) | 19 (10%) | 13 (14%) | 12 (9%) | 0,01 |
CNAF: cánulas nasales de alto flujo; DM: diabetes mellitus; ECMO: membrana de oxigenación extracorpórea; HTA: hipertensión arterial; iNO: óxido nítrico inhalado; TAVM/NAVM: traqueobronquitis/neumonía asociada a ventilación mecánica; TRR: técnicas de reemplazo renal; UCI: unidad de cuidados intensivos; VMI: ventilación mecánica invasiva.
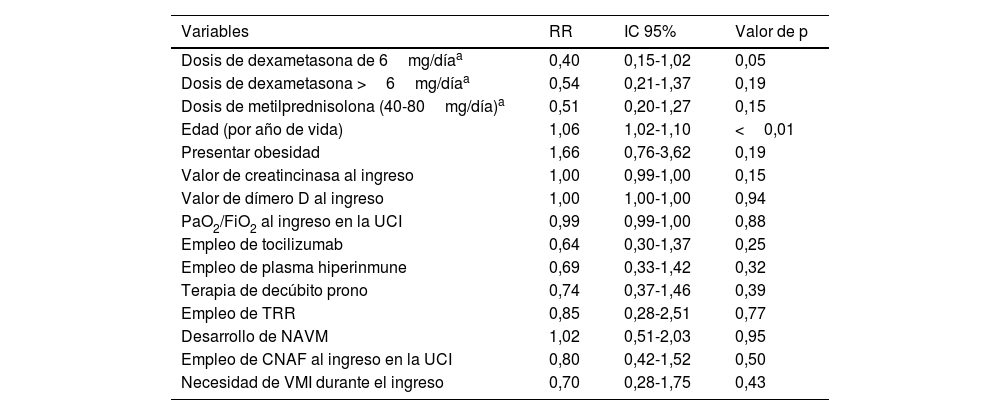
Para la dosis de dexametasona de 6mg/día, se encontró un RR de 0,40 (IC 95%: 0,15-1,02; p=0,05), lo que sugiere una asociación con menor mortalidad a corto plazo. En el caso de la dosis de dexametasona mayor a 6mg/día, el RR fue de 0,54 (IC 95%: 0,21-1,37; p=0,19), indicando una tendencia hacia un efecto beneficioso, aunque no alcanzó significación estadística. Por otro lado, para la dosis de metilprednisolona (40-80mg/día), se obtuvo un RR de 0,51 (IC 95%: 0,20-1,27; p=0,15), también sin alcanzar significación. En cuanto a las características de los pacientes, la edad mostró una asociación significativa con la mortalidad a corto plazo en la UCI (RR: 1,06; IC 95%: 1,02-1,10; p<0,01). Por cada año de vida, se observó un ligero aumento en el riesgo de mortalidad. Por otro lado, la presencia de obesidad no mostró una asociación significativa con la mortalidad (RR: 1,66; IC 95%: 0,76-3,62; p=0,19) (tabla 3).
Datos del modelo de regresión de riesgos proporcionales de Cox en el estudio de factores de riesgo para la mortalidad en la UCI a los 28 días, introduciendo las variables con un valor de p<0,1 en el análisis bivariante frente a mortalidad a 28 días
| Variables | RR | IC 95% | Valor de p |
|---|---|---|---|
| Dosis de dexametasona de 6mg/díaa | 0,40 | 0,15-1,02 | 0,05 |
| Dosis de dexametasona >6mg/díaa | 0,54 | 0,21-1,37 | 0,19 |
| Dosis de metilprednisolona (40-80mg/día)a | 0,51 | 0,20-1,27 | 0,15 |
| Edad (por año de vida) | 1,06 | 1,02-1,10 | <0,01 |
| Presentar obesidad | 1,66 | 0,76-3,62 | 0,19 |
| Valor de creatincinasa al ingreso | 1,00 | 0,99-1,00 | 0,15 |
| Valor de dímero D al ingreso | 1,00 | 1,00-1,00 | 0,94 |
| PaO2/FiO2 al ingreso en la UCI | 0,99 | 0,99-1,00 | 0,88 |
| Empleo de tocilizumab | 0,64 | 0,30-1,37 | 0,25 |
| Empleo de plasma hiperinmune | 0,69 | 0,33-1,42 | 0,32 |
| Terapia de decúbito prono | 0,74 | 0,37-1,46 | 0,39 |
| Empleo de TRR | 0,85 | 0,28-2,51 | 0,77 |
| Desarrollo de NAVM | 1,02 | 0,51-2,03 | 0,95 |
| Empleo de CNAF al ingreso en la UCI | 0,80 | 0,42-1,52 | 0,50 |
| Necesidad de VMI durante el ingreso | 0,70 | 0,28-1,75 | 0,43 |
CNAF: cánulas nasales de alto flujo; IC 95%: intervalo de confianza al 95%; NAVM: neumonía asociada a ventilación mecánica; RR: razón de riesgos; TRR: técnicas de reemplazo renal; UCI: unidad de cuidados intensivos; VMI: ventilación mecánica invasiva.
* Frente al grupo de referencia de pacientes no tratados con corticoides.
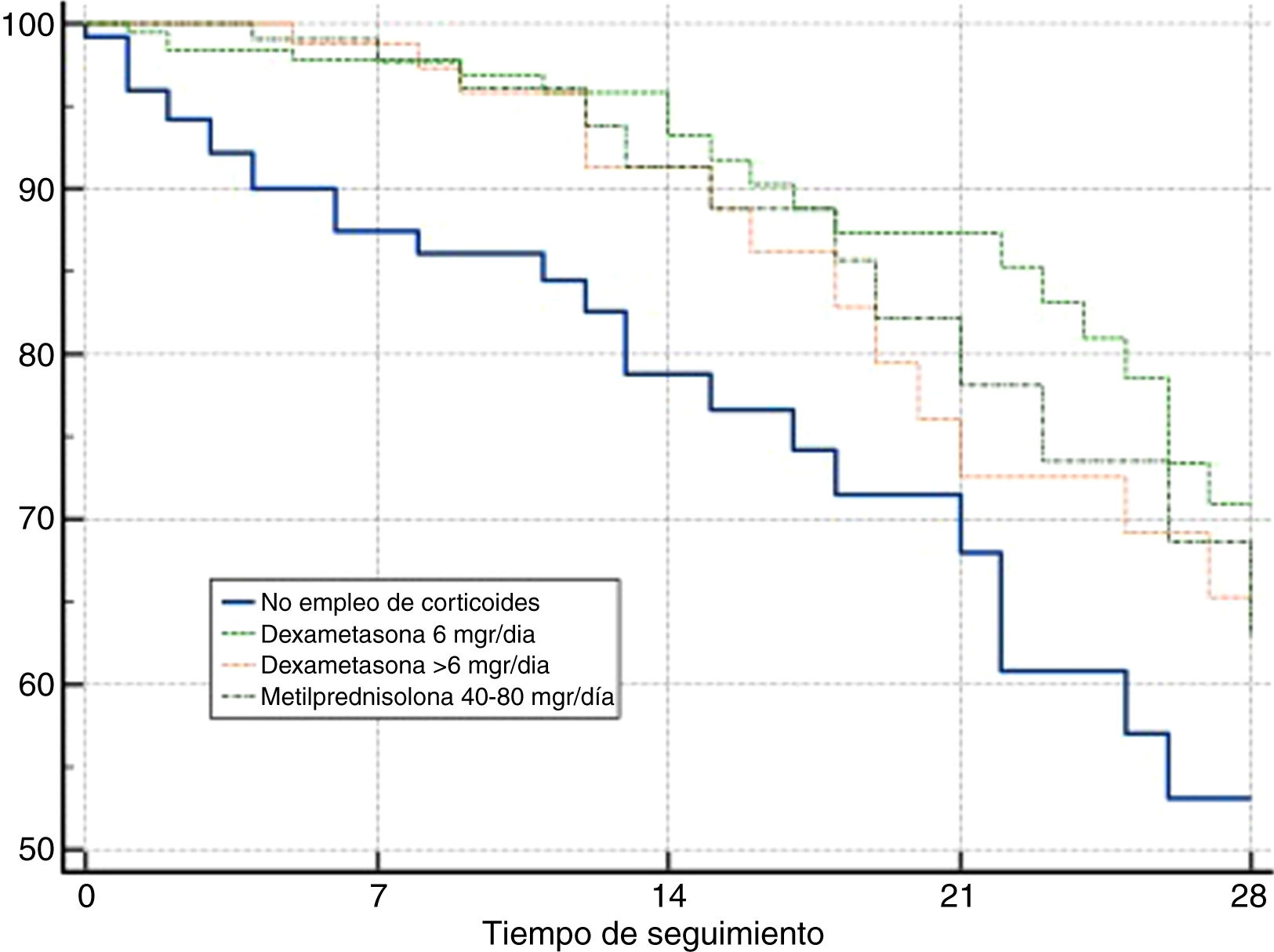
En el análisis de supervivencia, la comparación mediante las curvas de Kaplan-Meier a 28 días de seguimiento, evidenciaron una diferencia entre grupos como se observa en la figura 1 (long-rank test: p≤0,01).
Análisis de supervivencia (Kaplan-Meier) referido a la supervivencia a los 28 días en los 4 grupos establecidos. Curvas de supervivencia a 28 días para pacientes categorizados en 4 grupos: 1) pacientes que no recibieron tratamiento corticoideo durante su estancia en la UCI; 2) pacientes tratados con dexametasona 6mg diarios hasta por 10 días 6; 3) pacientes que recibieron dexametasona en dosis superiores a los 6mg diarios, y 4) pacientes manejados con dosis bajas de metilprednisolona (40 a 80mg diarios) durante un periodo de 3 a 5 días.
En nuestro análisis: 1) los pacientes que recibieron tratamiento corticoideo presentaron una mayor supervivencia a los 28 días frente a los enfermos que no recibieron tratamiento con corticoides, y 2) tanto la dexametasona en dosis de 6mg/día, como la metilprednisolona en dosis bajas parecen ser eficaces en el tratamiento de la enfermedad por SARS-CoV-2 grave que requiere ingreso en la UCI, en términos de mortalidad a 28 días.
No obstante, en nuestro análisis se ha de tener en cuenta que el grupo de pacientes no tratados con corticoides muestran criterios de gravedad significativamente mayores (menores valores en la relación PaO2/FiO2, mayores cifras de CK y DD) al ingreso en la UCI.
Existe heterogeneidad en relación al empleo de glucocorticoides y su efecto sobre la mortalidad en la lesión pulmonar aguda inducida por enfermedades virales12–16. Las dosis altas de glucocorticoides pueden retrasar la eliminación viral y aumentar la mortalidad y el riesgo de infecciones secundarias17,18. Sin embargo, en los pacientes con enfermedad por SARS-CoV-2 grave, pautas de glucocorticoides de corta duración ha resultado beneficioso y seguro, no comportándose como un factor de riesgo independiente de eliminación prolongada de ARN viral19,20.
Después de la publicación del ensayo RECOVERY6, la dexametasona se convirtió mayoritariamente, en el tratamiento estándar en los enfermos más graves. El estudio mostró que el uso de dexametasona conseguía una menor mortalidad entre los pacientes que recibían ventilación mecánica u oxígeno en altas concentraciones, pero no entre los que no recibían apoyo respiratorio.
El efecto de los corticoides en su conjunto fue estudiado con los datos de un metaanálisis prospectivo que reunió datos de 7 ensayos clínicos aleatorios (ECA). En sus resultados, el odds ratio (OR) para la asociación con la mortalidad fue de 0,64 (IC del 95%: 0,50-0,82; p<0,001) para la dexametasona en comparación con la atención habitual o placebo (3 ensayos, 1.282 pacientes y 527 muertes), mientras que fue de 0,69 (IC del 95%: 0,43-1,12; p=0,13) para la hidrocortisona (3 ensayos, 374 pacientes y 94 muertes) y 0,91 (IC del 95%: 0,29-2,87; p=0,87) para la hidrocortisona y la metilprednisolona respectivamente (un ensayo, 47 pacientes y 26 muertes)21.
Posteriormente, un análisis exhaustivo de 11 ECA con 8.019 participantes hospitalizados con COVID-19, se evaluó la eficacia de corticosteroides sistémicos junto con la atención estándar en comparación con solo la atención estándar o con atención estándar más placebo. Se encontró que los corticosteroides sistémicos junto con la atención estándar probablemente reducen ligeramente la mortalidad por todas las causas hasta los 30 días, aunque la evidencia sobre la mortalidad hasta los 120 días fue incierta. Además, los corticosteroides sistémicos parece que aumentan ligeramente la probabilidad de mejora clínica a los 28 días. En cuanto a los eventos adversos graves, infecciones nosocomiales y micosis invasivas, no se obtuvo suficiente evidencia para realizar análisis concluyentes. Cuando se compararon diferentes tipos y dosis de corticosteroides, se encontró que la metilprednisolona en comparación con la dexametasona no mostró diferencias significativas en la mortalidad. La dexametasona en dosis altas (12mg o más) podría reducir la mortalidad hasta los 30 días, pero no se encontró una conclusión clara sobre la mortalidad hasta los 120 días y la mejora clínica a los 28 días. Se realizaron análisis de subgrupos para explorar la equidad en los efectos de los corticosteroides. Se observó que los pacientes menores de 70 años podrían beneficiarse más de los corticosteroides en comparación con los mayores de 70 años 22.
Las limitaciones de nuestro estudio inciden en las propias de los estudios retrospectivos: el infraregistro y la variabilidad de los profesionales. En este aspecto, la falta de alguna variable (especialmente determinaciones analíticas) o una categorización más específica de algunas de ellas (por ejemplo, valores de CK o DD) que pudiera influir en los resultados finales debe considerarse como una limitación del estudio. Además, son datos analizados de un solo centro, con la dificultad en la validación externa de las conclusiones que esto siempre conlleva. Del mismo modo, una limitación relevante de este estudio reside en la ausencia de una consideración explícita respecto al posible impacto del momento temporal de ingreso de los pacientes en relación a los resultados de mortalidad.
En este estudio, se identificaron y analizaron ciertas variables relevantes para el tratamiento con corticosteroides en pacientes hospitalizados con COVID-19. Sin embargo, es posible que otras variables no consideradas en este análisis puedan haber tenido un impacto en los resultados. Algunas de las posibles variables adicionales que podrían haber influido incluyen diferencias en las comorbilidades de los pacientes, la duración y gravedad de la enfermedad, la respuesta individual a los corticosteroides, y la presencia de otras terapias o medicamentos concurrentes. Además, las características genéticas y el acceso a la atención médica también pueden desempeñar un papel en la variabilidad de los resultados.
A fin de mejorar la comprensión y aplicabilidad de estos hallazgos, futuras investigaciones deberían considerar la inclusión de un rango más amplio de variables relevantes y realizar análisis más detallados para comprender mejor el impacto de los corticosteroides en pacientes con COVID-19.
De acuerdo con los datos presentados y el análisis de la bibliografía, podemos concluir que el uso de corticosteroides sistémicos junto con la atención estándar puede tener un efecto beneficioso en la reducción de la mortalidad a corto plazo en pacientes hospitalizados con COVID-19. Sin embargo, los efectos a más largo plazo y los eventos adversos requieren mayor investigación. Además, los resultados pueden variar en diferentes subgrupos de pacientes, lo que enfatiza la importancia de considerar factores de equidad en la toma de decisiones clínicas.
- •
Durante el periodo de pandemia COVID no se ha establecido una pauta estándar/uniforme de corticoide en el tratamiento de los enfermos graves.
- •
La dexametasona y la metilprednisolona han sido los corticoides más utilizados en diferentes pautas.
- •
Los pacientes que recibieron tratamiento corticoideo presentaron una mayor supervivencia a los 28 días frente a los enfermos que no recibieron tratamiento con corticoides
- •
Se sugiere una posible eficacia de tanto la dexametasona en dosis de 6mg/día como la metilprednisolona en dosis bajas en el tratamiento de la enfermedad por SARS-CoV-2 grave que requiere ingreso en UCI, en relación a la mortalidad a 28 días.
El presente manuscrito no ha recibido financiación alguna.
Conflicto de interesesTodos los autores reconocen no presentar conflicto de intereses en la realización del presente trabajo.