Los pacientes con COVID-19 que ingresan en una unidad de cuidados intensivos (UCI), tienen un alto riesgo de desarrollar infecciones secundarias, incluyendo infecciones fúngicas invasivas como aspergilosis pulmonar invasiva (API). El objetivo principal fue el análisis de los casos con sospecha de COVID-19 Associated Pulmonary Aspergillosis (CAPA) en nuestra unidad. En estos pacientes realizamos cultivo micológico en el lavado broncoalveolar como métodos de aislamiento de Aspergillus sp. Se siguió el algoritmo AspICU para establecer el diagnóstico de API probable. Además, considerando también relevante la positividad del antígeno de galactomanano. Se confirmó API probable en 3 de ellos. Los 3 pacientes permanecieron ingresados más de 21 días por SDRA grave, y recibieron corticoterapia (1mg/kg/día). Por tanto, la CAPA se debe considerar de forma sistemática, aunque se necesita un nuevo algoritmo diagnóstico que permita tratamiento precoz por las consecuencias deletéreas que puede implicar en los pacientes críticos.
Patients with COVID-19 who are admitted to intensive care unit (ICU) are at high risk of developing secondary infections, including invasive fungal infections such as invasive pulmonary aspergillosis (IPA). The main purpose was to analyse the putative COVID-19 Associated Pulmonary Aspergillosis (CAPA) patients in our setting. In these patients, we performed mycological culture in bronchoalveolar lavage (BAL) for isolation of Aspergillus sp. We followed the AspICU algorithm to diagnose putative IPA. Moreover, we considered relevant the positivity of galactomannan in BAL. We diagnosed putative IPA in 3 patients. The common features of these 3 patients were: more than 21 days of stay in ICU, severe acute respiratory distress syndrome (ARDS) and treatment with steroids (1mg/kg per day). Therefore, CAPA has to be systematically considered although a new algorithm to diagnose it is needed to treat patients in early stages in order to avoid catastrophic outcomes.
Entre un 5-30% de los pacientes con COVID-19 precisan del ingreso en la unidad de cuidados intensivos (UCI)1, con alto riesgo de desarrollar infecciones secundarias, incluyendo infecciones fúngicas invasivas como aspergilosis pulmonar invasiva (API)2. En 2012, la asociación de infección grave por el virus de la influenza A (H1N1) y API, supuso un aumento de la mortalidad de hasta un 40-60%3. La enfermedad por COVID-19 tiene características similares a las causadas por formas severas a las del virus de la influenza A, por tanto, es razonable sospechar que los pacientes COVID-19 críticos pueden tener susceptibilidad para desarrollar API4. Además, la terapia con corticoides es un factor inmunosupresor relacionado con API, habiéndose usado hasta en un 46% de los pacientes COVID-19 críticos5.
Encontramos en la literatura series de casos que describen la asociación de API y COVID-19, pasando a formar una nueva entidad conocida como COVID-19 Associated Pulmonary Aspergillosis (CAPA). Entre las primeras publicaciones recogidas, encontramos una con 9 pacientes en Francia (33% de los 27 ingresados en la UCI con COVID-19), y otra con 5 en Alemania (26% de los 19 admitidos)2,6; tasas similares a las observadas en la asociación con el virus influenza A3. Esto supuso una alerta para la comunidad médica. Posteriormente se han publicado estudios prospectivos como el desarrollado en Lyon, Francia, donde se han analizado 106 pacientes con COVID-19, y 19 pacientes presentaron API probable (17,9%)7. También, en Bolonia, Italia8, llevan a cabo un estudio prospectivo con un total de 108 pacientes incluidos, con diagnóstico de API probable en 30 pacientes (27,7%), datos en consonancia con los estudios previamente mencionados. En este estudio también se analiza la curva de supervivencia Kaplan-Meier apreciando un aumento de la mortalidad a los 30 días en los pacientes con CAPA probable frente a los que no la tienen (44 vs. 19%; p=0,002). La falta de uniformidad en los criterios diagnósticos de CAPA probable no permite conocer la prevalencia exacta de la enfermedad y, por tanto, de su mortalidad. Sin embargo, datos de la revisión de Pemán J et al.1 señalan que la CAPA podría tener hasta 59,1% de mortalidad y podría justificar la realización de screening en pacientes COVID-19 críticos, con muestras del tracto respiratorio inferior e incluso iniciar tratamiento empírico antes del diagnóstico definitivo5.
Presentamos una serie de 4 pacientes ingresados por COVID-19 en la UCI de Anestesiología del Hospital Universitario Doctor Peset, Valencia, en el periodo comprendido entre el 22 de marzo al 22 de mayo, en los que sospechamos API de un total de 15 pacientes. Nuestro objetivo fue comparar nuestros resultados con lo recogido por la literatura médica.
MétodosTodos los pacientes fueron tratados según protocolo COVID-19 de nuestro hospital; como tratamiento específico, recibieron hidroxicloroquina 200mg/12h y lopinavir/ritonavir 400/100mg/12h (durante los primeros 7 días del ingreso). Además, a los pacientes con neumonía establecida se les asoció ceftriaxona (2g/24h) y azitromicina (500mg/24h). En los pacientes con síndrome de distrés respiratorio (SDRA) moderado-grave se añadió corticoterapia con metilprednisolona intravenosa (0,5mg/kg/12h) durante 5 días. En los pacientes con valores de IL-6 (>40pg/m) se usó terapia inmunosupresora con tocilizumab 600mg (dosis única) y/o anakinra 100mg ante rotura de stock de tocilizumab. El interferón β1b (0,25mg sc/48h) se usó en la sala de neumología.
A los pacientes que presentaban deterioro clínico y radiológico, caracterizado por el aumento de infiltrados alveolares con aparición de fiebre y/o aumento de la insuficiencia respiratoria, a pesar de tratamiento antibiótico de amplio espectro y soporte ventilatorio, les realizamos lavado broncoalveolar (LBA). En las muestras obtenidas, solicitamos cultivo micológico y antígeno (Ag) de galactomanano.
Las muestras respiratorias fueron procesadas para estudio micológico, con siembra en miedo de Sabouraud en placa (Difco® Sabouraud Dextrosa Agar Ref.: 210950) y medio de Sabouraud-Cloranfenicol en tubo (Difco® Sabouraud Dextrosa W/Chlor Ref.: 771212). El método de identificación fue observación macroscópica y microscópica, confirmando el resultado mediante espectrometría de masas (MALDI-TOF MS, Bruker). El Ag de galactomanano se determinó mediante la prueba de Platelia® Aspergillus (Bio-Rad Ref.: 62794), considerando positivo un índice >1.
Para establecer el diagnóstico de API probable, seguimos el algoritmo AspICU9 ya que los pacientes no tenían inmunodeficiencia previa y, por tanto, el algoritmo de la EORT-MSC10 no era aplicable. Consideramos que el reciente algoritmo diagnóstico de IAPA3, extrapolable según los expertos a CAPA, necesita aún de más estudios de validación.
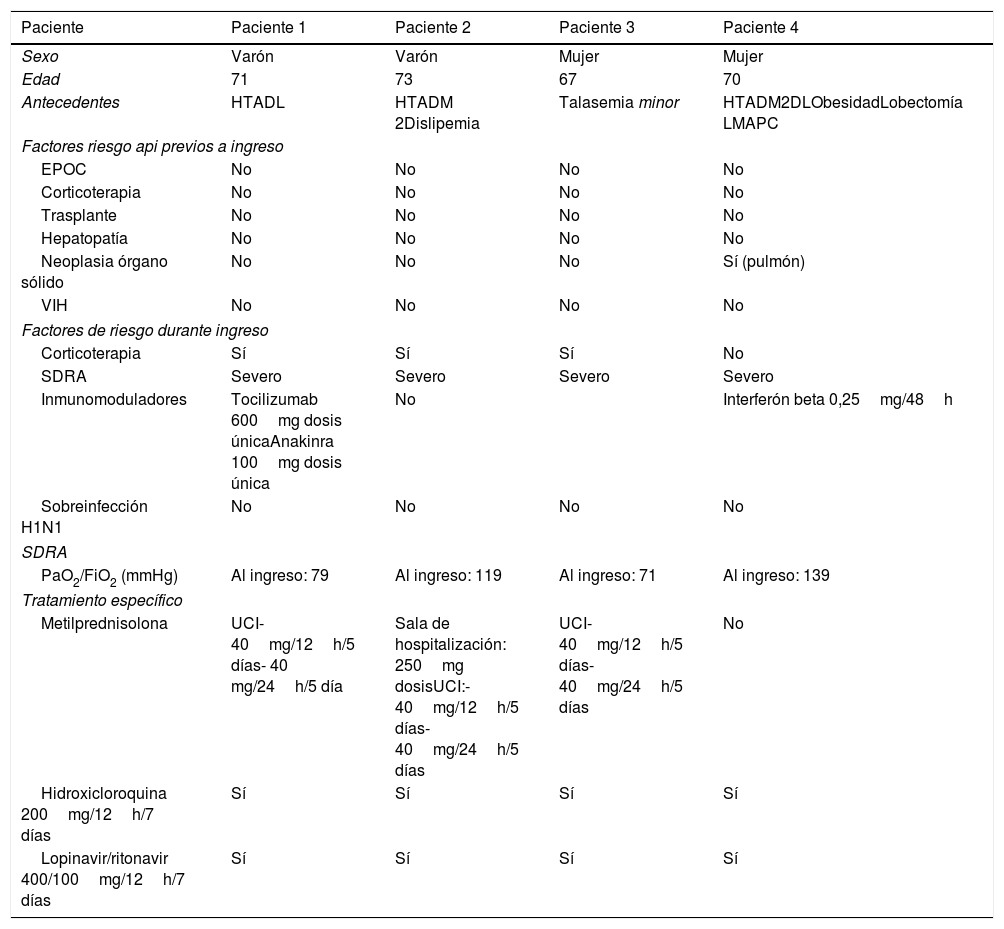
ResultadosEntre los factores de riesgo de API, solo uno de los pacientes de la serie presentaba un factor de riesgo previo asociado a API (antecedente de neoplasia de órgano sólido), todos presentaron SDRA moderado-grave con necesidad de intubación orotraqueal en algún momento de su evolución, 10 recibieron corticoterapia con dosis equivalentes a más de 20mg de prednisona y 2 tratamiento con inmunomoduladores. Ninguno de los pacientes presentó sobreinfección por H1N1.
De un total de 15 pacientes, realizamos LBA a 4 pacientes (2 varones y 2 mujeres con edad media de 67 años) por deterioro de imagen radiológica junto con deterioro clínico. En cuanto a los factores de riesgo cardiovasculares, observamos la presencia de uno o más factores (hipertensión arterial, dislipemia, obesidad y/o diabetes) en 3 de los 4 pacientes. Solo uno de los pacientes (paciente 3) no presentó factores de riesgo cardiovasculares, siendo su único antecedente relevante talasemia minor. Los seleccionados se trataron según protocolo COVID-19 de nuestro hospital. Las características detalladas de los pacientes analizados son descritas en la tabla 1.
Características de los pacientes con sospecha de aspergilosis pulmonar invasiva
| Paciente | Paciente 1 | Paciente 2 | Paciente 3 | Paciente 4 |
|---|---|---|---|---|
| Sexo | Varón | Varón | Mujer | Mujer |
| Edad | 71 | 73 | 67 | 70 |
| Antecedentes | HTADL | HTADM 2Dislipemia | Talasemia minor | HTADM2DLObesidadLobectomía LMAPC |
| Factores riesgo api previos a ingreso | ||||
| EPOC | No | No | No | No |
| Corticoterapia | No | No | No | No |
| Trasplante | No | No | No | No |
| Hepatopatía | No | No | No | No |
| Neoplasia órgano sólido | No | No | No | Sí (pulmón) |
| VIH | No | No | No | No |
| Factores de riesgo durante ingreso | ||||
| Corticoterapia | Sí | Sí | Sí | No |
| SDRA | Severo | Severo | Severo | Severo |
| Inmunomoduladores | Tocilizumab 600mg dosis únicaAnakinra 100mg dosis única | No | Interferón beta 0,25mg/48h | |
| Sobreinfección H1N1 | No | No | No | No |
| SDRA | ||||
| PaO2/FiO2 (mmHg) | Al ingreso: 79 | Al ingreso: 119 | Al ingreso: 71 | Al ingreso: 139 |
| Tratamiento específico | ||||
| Metilprednisolona | UCI- 40mg/12h/5 días- 40 mg/24h/5 día | Sala de hospitalización: 250mg dosisUCI:- 40mg/12h/5 días- 40mg/24h/5 días | UCI- 40mg/12h/5 días- 40mg/24h/5 días | No |
| Hidroxicloroquina 200mg/12h/7 días | Sí | Sí | Sí | Sí |
| Lopinavir/ritonavir 400/100mg/12h/7 días | Sí | Sí | Sí | Sí |
APC: anemia procesos crónicos; DL: dislipemia; DM 2: diabetes mellitus tipo 2; EPOC: enfermedad pulmonar obstructiva crónica; HTA: hipertensión arterial; IFN: interferón; SDRA: síndrome de distrés respiratorio del adulto; UCI: unidad de cuidados intensivos; VIH: virus inmunodeficiencia humana.
La caracterización diagnóstica y terapéutica micológica de los pacientes seleccionados con sospecha de API, se describe en la tabla 2 y a continuación:
- -
Paciente 1: realizamos LBA con obtención de muestras en el día 19 del ingreso en la UCI de anestesiología ante el deterioro clínico y radiológico en el mismo día (nuevos infiltrados bilaterales en radiografía de tórax). El paciente seguía tratamiento con equinocandina (anidulafungina 100mg/día) por sospecha de candidiasis invasora. En las muestras de LBA aislamos Aspergillus fumigatus con un índice del Ag de galactomanano de 1.4. Establecimos el diagnóstico de API probable mediante cumplimiento de 4 criterios putativos. Como tratamiento dirigido iniciamos isavuconazol sulfato (200mg/8h durante 48h y 200mg/día, posteriormente), siendo dado de alta a planta de hospitalización el día 50 del ingreso en la UCI.
- -
Paciente 2: realizamos LBA con obtención de muestras en el día 25 del ingreso en la UCI de anestesiología ante deterioro clínico y radiológico en el mismo día (nuevos infiltrados bilaterales en radiografía de tórax). En las muestras de LBA aislamos Aspergillus fumigatus con un índice del Ag de galactomanano de 1.4. Establecimos el diagnóstico de API probable mediante cumplimiento de 4 criterios putativos. Como tratamiento dirigido iniciamos isavuconazol sulfato, siendo dado de alta a planta de hospitalización el día 38 del ingreso en la UCI.
- -
Paciente 3: realizamos LBA con obtención de muestras en el día 27 del ingreso en la lUCI de anestesiología ante deterioro clínico y radiológico en el día 26 (nuevos infiltrados bilaterales en radiografía de tórax). El paciente seguía tratamiento con anfotericina B liposomal (3mg/kg/día) por candidemia. En las muestras de LBA creció Aspergillus fumigatus con un índice del Ag de galactomanano de 1.5. Establecimos el diagnóstico de API probable mediante cumplimiento de 4 criterios putativos. Decidimos cambiar el tratamiento a isavuconazol sulfato, ante el fracaso terapéutico con anfotericina B liposomal. A pesar de todo, el paciente fue éxitus al día 37 del ingreso en la UCI.
- -
Paciente 4: realizamos LBA con obtención de muestras en el día 27 del ingreso en la UCI de anestesiología ante un deterioro clínico y radiológico en el día 26 (consolidaciones en ambos LII en TAC torácico). El cultivo micológico fue negativo, no estableciéndose el diagnóstico de API. El paciente fue dado de alta a planta de hospitalización el día 60 de ingreso en la UCI.
Caracterización diagnóstica, terapéutica y micológica de los pacientes con sospecha de aspergilosis pulmonar invasiva
| Paciente | Paciente 1 | Paciente 2 | Paciente 3 | Paciente 4 |
|---|---|---|---|---|
| Estudio micológico mediante LBA | ||||
| Día de realización del ingreso en la UCI: | 19° | 25° | 27° | 27° |
| Cultivo fúngico:Siembra Difco® Sabouraud Dextrosa Agar y Difco® Sabouraud Dextrosa W/ChlorConfirmación con MALDI-TOF MS (Bruker) | Aspergillus fumigatus | Aspergillus fumigatus | Aspergillus fumigatus | Negativo |
| Sensibilidad | Multisensible (sensible a voriconazol y anfotericina B) | Multisensible (sensible a voriconazol y anfotericina B) | Multisensible (sensible a voriconazol y anfotericina B) | No procede |
| Ag de galactomanano: prueba Platelia® Aspergillus | Ag de galactomanano+ (Índice 1.4) | Ag de galactomanano+ (Índice 1.4) | Ag de galactomanano+ (Índice 1.5) | Ag de galactomanano− |
| Imagen | ||||
| RxT | Día 19 de ingreso en la UCI: Aparición de nuevos infiltrados bilaterales | Día 25 de ingreso en la UCI: Aparición de nuevos infiltrados bilaterales | Día 26 de ingreso en la UCI: Aparición de nuevos infiltrados bilaterales | Día 26 de ingreso en la UCI: Sin cambios significativos respecto a estudios previos |
| TC | Día 26 de ingreso en la UCI: Consolidaciones en ambos LII | |||
| Diagnóstico API | ||||
| Criterio absoluto | No | No | No | No |
| Criterios putativos | 1. Cultivo positivo2. Signo y síntomas: fiebre, deterioro respiratorio3. Imagen compatible4. Factores de riesgo API: Sí | 1. Cultivo positivo2. Signos y síntomas compatibles: hemoptisis, progresión de deterioro respiratorio, fiebre3. Imagen compatible4. Factores de riesgo API: Sí | 1. Cultivo positivo2. Signos y síntomas: fiebre, hemoptisis, progresión deterioro respiratorio3. Imagen4. Factores de riesgo API: Sí | 1. Cultivo negativo2. Signo y síntomas: progresión deterioro respiratorio, hemoptisis, fiebre3. Imagen compatible4. Factores de riesgo API: No |
| Tratamiento antifúngico | ||||
| Previo al diagnóstico | Anidulafungina (día 1 200mg IV, día 2 y sucesivos 100mg IV) | No | Anfotericina B (3mg/kg/día por evidencia de candidemia) | No |
| Dirigido | Isavuconazol sulfato (200mg/8h durante 48h seguidos de 200mg/días sucesivos) | Isavuconazol sulfato (200mg/8h durante 48h seguidos de 200mg/días sucesivos) | Isavuconazol sulfato (200 mg/8h durante 48h seguidos de 200mg/días sucesivos) | |
| Destino | Alta a planta a los 50 días del ingreso en la UCI | Alta a planta a los 38 días del ingreso en la UCI | Éxitus a los 37 días del ingreso en la UCI | Alta a planta a los 60 días del ingreso en la UCI |
Ag: antígeno; API: aspergilosis pulmonar invasiva; LBA: lavado bronco alveolar; LII: lóbulo inferior izquierdo; RxT: radiografía de tórax; TC: tomografía computarizada; UCI: unidad de cuidados intensivos.
Se diagnosticó API probable en 3 pacientes de la serie (20% del total de 15 pacientes). En ninguno de los pacientes, obtuvimos muestras histopatológicas pulmonares, ni mediante autopsia, ni biopsias pulmonares post mortem.
DiscusiónLa pandemia por SARS-CoV-2 ha puesto en jaque a los sistemas de salud mundiales durante el año 2020. Entorno a un 5-30% de los pacientes con COVID-19 han precisado ingreso en unidades de cuidados críticos1, constituyendo las sobreinfecciones secundarias, como la API, una posible causa de aumento en la morbimortalidad en estos pacientes, especialmente en los subsidiarios de ventilación mecánica invasiva2.
El diagnóstico de CAPA se obtiene de forma variable en la bibliografía publicada, considerando en algunos estudios la COVID-19 como inmunodeficiencia previa y usando el algoritmo de la EORT-MSC10, o siguiendo el algoritmo de AspICU, de mayor complejidad diagnóstica, al necesitar un cultivo positivo de Aspergillus en una muestra del tracto respiratorio inferior como criterio de entrada, hecho realizado en esta publicación mediante LBA9. En relación con esta publicación, hemos llegado al diagnóstico de CAPA siguiendo el algoritmo AspICU en 3 pacientes (20% del total), cifras algo más bajas que la serie de 9 pacientes en Francia (33% del total)2, serie de 5 pacientes en Alemania (26% del total)6 y de los estudios prospectivos, realizados en Italia y Francia, en el cual se obtuvo el diagnóstico en 30 pacientes (27,7% del total) y 19 pacientes (17,9%), respectivamente7,8.
A pesar de las diferencias en la obtención del diagnóstico, la evidencia de que la COVID-19 puede estar asociada a sobreinfecciones nosocomiales graves, como la API, cada vez es mayor1,2,5–8. De la misma forma, hay bibliografía que defienden que el solo aislamiento de Aspergillus en muestras respiratorias en pacientes críticos con COVID-19, debería considerarse como aspergilosis probable, siendo recomendado el inicio del tratamiento antifúngico1. Es por tanto una necesidad la realización de despistaje sistemático de sobreinfecciones fúngicas en los pacientes ingresados por COVID-19 en las UCI, en aras de reducir las consecuencias deletéreas de las mismas.
La principal limitación de esta publicación radica en el escaso tamaño muestral y la no realización inicial de LBA por riesgo de aerosolización y escasez de material de protección durante la pandemia. De la misma forma, el seguimiento estricto del algoritmo diagnóstico AspICU y la alta mortalidad precoz de la serie ha podido infraestimar la presencia de CAPA.
ConclusiónLa sobreinfección por API se debe considerar de forma sistemática en pacientes con necesidad de tratamiento en las UCI por COVID-19. El diagnóstico de esta entidad según los algoritmos diagnósticos tradicionales puede hacerse difícil, siendo recomendable adaptar un nuevo algoritmo común para los casos de CAPA que permita un diagnóstico precoz y, por tanto, un tratamiento precoz por las consecuencias deletéreas que puede implicar la sobreinfección por Aspergillus en pacientes críticos con SARS-CoV-2.
Este estudio tiene la aprobación del Comité Ético del Hospital Universitario Doctor Peset (código CEIm: 144/20).
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
AutoríasTodos los autores han tenido una contribución significativa en el diseño, elaboración y revisión de este estudio.
Conflicto de interesesLos autores declaran no tener conflictos de intereses para el presente manuscrito.