El síndrome de encefalopatía posterior reversible es un trastorno neurológico agudo caracterizado por una sintomatología variable e imágenes radiológicas características de edema vasogénico parietooccipital. Está asociado a condiciones clínicas como hipertensión arterial, infección/sepsis o fármacos citotóxicos/inmunosupresores, entre otros. Se caracteriza fisiopatológicamente por daño endotelial con rotura de la barrera hematoencefálica, hipoperfusión cerebral y edema vasogénico.
Presentamos 2 casos de pacientes críticos COVID-19 que ingresaron por neumonía con necesidad de ventilación mecánica y que tras retirar la sedación desarrollaron clínica neurológica aguda y reversible consistente en epilepsia y encefalopatía, asociada a lesiones subcorticales hiperintensas en la resonancia magnética cerebral compatibles con síndrome de encefalopatía posterior reversible.
El coronavirus SARS-CoV-2 activaría una respuesta inflamatoria que produciría daño en el endotelio cerebral. Este último podría ser desencadenado por la liberación de citocinas, así como por una lesión viral directa, dado que el endotelio expresa receptores ACE2. Esto podría explicar la posible asociación entre el síndrome de encefalopatía posterior reversible y la COVID-19.
Posterior reversible encephalopathy syndrome is an acute neurological disorder characterized by variable symptoms and radiological images characteristic of vasogenic parietal-occipital edema. It is associated with clinical conditions such as high blood pressure, infection/sepsis, or cytotoxic/immunosuppressive drugs, among others. It is characterized pathophysiologically by endothelial damage with breakdown of blood-brain barrier, cerebral hypoperfusion, and vasogenic edema.
The cases are presented on 2 critical COVID-19 patients who were admitted to pneumonia requiring mechanical ventilation and who, after removing sedation, developed acute and reversible neurological symptoms consisting of epilepsy and encephalopathy, associated with hyperintense subcortical lesions on brain magnetic resonance imaging compatible with posterior reversible encephalopathy syndrome.
SARS-CoV-2 coronavirus would activate an inflammatory response that would damage brain endothelium. It could be triggered by cytokine release, as well as by direct viral injury, given that endothelium expresses ACE2 receptors. It could explain the possible association between posterior reversible encephalopathy syndrome and COVID-19.
El síndrome de encefalopatía posterior reversible (PRES) es una entidad clínica y radiológica descrita por primera vez por Hinchey et al. en 1996 en la que hasta un 40% de los casos precisan cuidados críticos debido a complicaciones graves como estatus epiléptico, accidente cerebrovascular o hipertensión intracraneal1,2.
Este síndrome se caracteriza clínicamente por cefalea, disminución del nivel de conciencia, convulsiones, trastornos visuales y déficits neurológicos. A nivel radiológico presenta edema cerebral vasogénico predominante en la sustancia blanca de regiones parietooccipitales1,2. Además, en el 15-20% de los casos asocian complicaciones hemorrágicas, como hemorragias petequiales y hematomas intraparenquimatosos3.
El PRES está asociado a diversas condiciones clínicas, como insuficiencia renal, hipertensión arterial (HTA), infección/sepsis, preeclampsia/eclampsia, enfermedades autoinmunes o fármacos citotóxicos/inmunosupresores, entre otros. Se caracteriza fisiopatológicamente por daño endotelial agudo con rotura de la barrera hematoencefálica y edema cerebral vasogénico, aunque su patogénesis no se comprende completamente4,5.
Fugate et al. plantearon como criterios diagnósticos la asociación de síntomas neurológicos agudos, imagen de edema cerebral vasogénico focal y reversibilidad de los hallazgos6.
Las pruebas de imagen son importantes en el diagnóstico diferencial, que incluye la leucoencefalopatía multifocal progresiva, la arteriopatía cerebral autosómica dominante con infartos subcorticales y leucoencefalopatía (CADASIL), encefalitis, encefalopatía mitocondrial con acidosis láctica y episodios similares a un accidente cerebrovascular (MELAS), entre otros. La resonancia magnética (RM) es más precisa que la tomografía axial computarizada (TAC) para el diagnóstico1,2.
El tratamiento es sintomático. Se requiere el empleo de antihipertensivos y/o anticonvulsivantes y la eliminación de la causa subyacente. Si no aparecen complicaciones graves, el pronóstico es favorable1,2.
Presentación de casosCaso 1Se trata de un varón de 66 años, con antecedentes de HTA y dislipidemia, que ingresó en la Unidad de Cuidados Intensivos del Servicio de Anestesiología con una neumonía por coronavirus SARV-CoV-2 que requirió ventilación mecánica.
Durante los primeros días de ingreso, el paciente presentó un síndrome de disfunción multiorgánica que precisó el uso de aminas vasoactivas junto con técnicas de depuración extrarrenal y hemofiltración venovenosa continua por fracaso renal agudo anúrico con valores de creatinina pico de 2,5mg/dl. Desde el punto de vista respiratorio, fueron necesarias varias sesiones de decúbito prono en los primeros 10 días y se realizó una traqueotomía para avanzar en el destete respiratorio.
De acuerdo con el protocolo de la unidad, se le administró lopinavir-ritonavir, hidroxicloroquina, ceftriaxona y levofloxacino durante 5 días, además de dexametasona durante 10 días y heparina de bajo peso molecular a dosis anticoagulantes por cifras máximas de Dímero D de 5.630ng/ml. Entre el primer día de ingreso y el séptimo recibió tratamiento inmunomodulador con tocilizumab, baricitinib e interferón beta, con valores de ferritina de 3.485ng/ml, IL-6 de 413pg/ml, PCR de 138mg/dl y linfocitos de 120U/mm3.
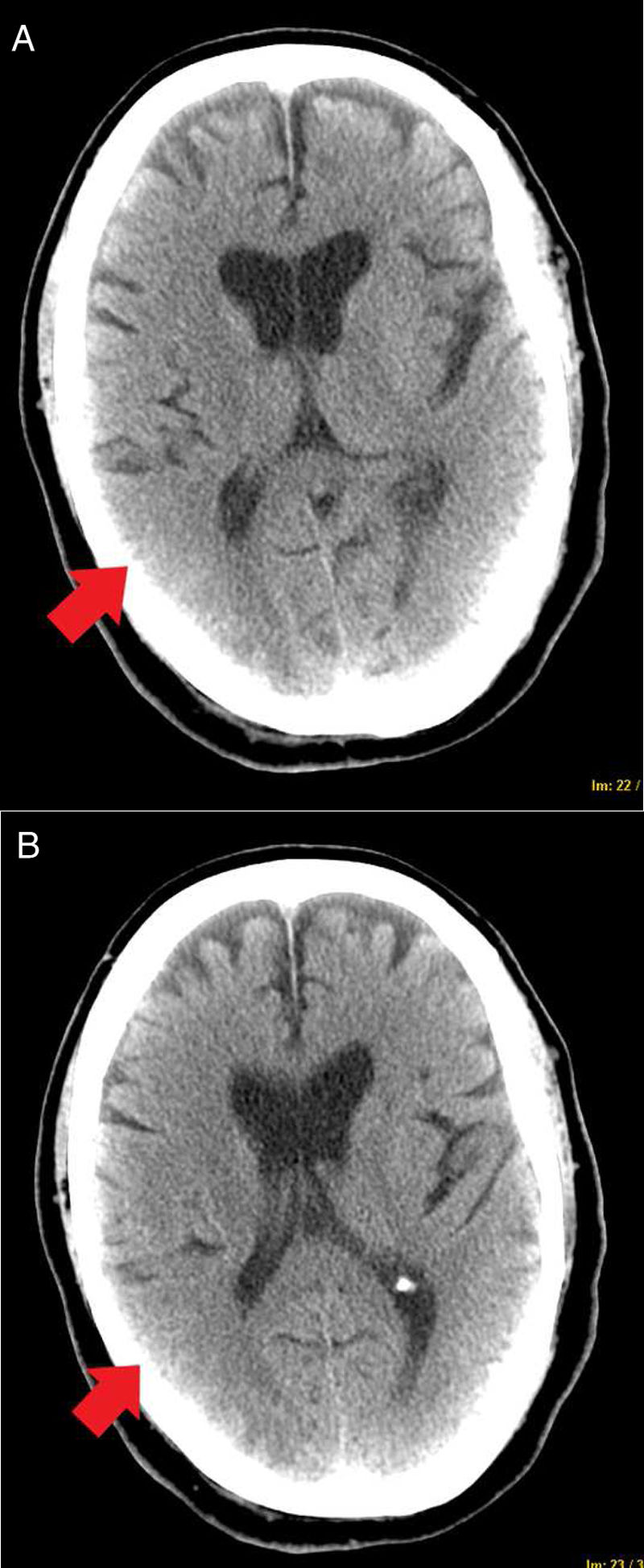
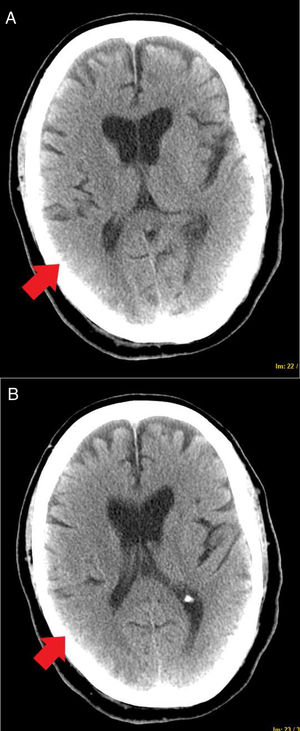
Precisó sedoanalgesia con midazolam a dosis de 20mg/h, fentanilo 100μg/h y propofol 150mg/h. Debido a la mejoría respiratoria, el día 13 de evolución se retiró la sedación y durante las siguientes 24-48h persistió un bajo nivel de conciencia con un Glasgow Coma Scale (GCS) de 9, por lo que se solicitó un electroencefalograma que informó de encefalopatía leve. El paciente evolucionó favorablemente, con mejoría del nivel de conciencia y un GCS de 14. Sin embargo, a los 16 días de ingreso comenzó con clínica de crisis epilépticas focales hemisféricas derechas caracterizadas por clonías hemifaciales izquierdas con generalización secundaria, que cedieron con diazepam 10mg y levetiracetam 1,5g iv cada 12h. Tras la estabilización se realizó una TAC, que informó de lesiones hipodensas subcorticales parietooccipitales bilaterales, de predominio derecho (fig. 1). Se planteó el diagnóstico diferencial entre lesiones isquémicas por bajo gasto y un PRES, motivo por el cual se solicitó una angio-TAC de troncos supraaórticos y una RM.
A las 24h repitió la misma clínica neurológica, por lo que precisó nueva dosis de diazepam, a la que se añadió lacosamida 200mg iv cada 12h.
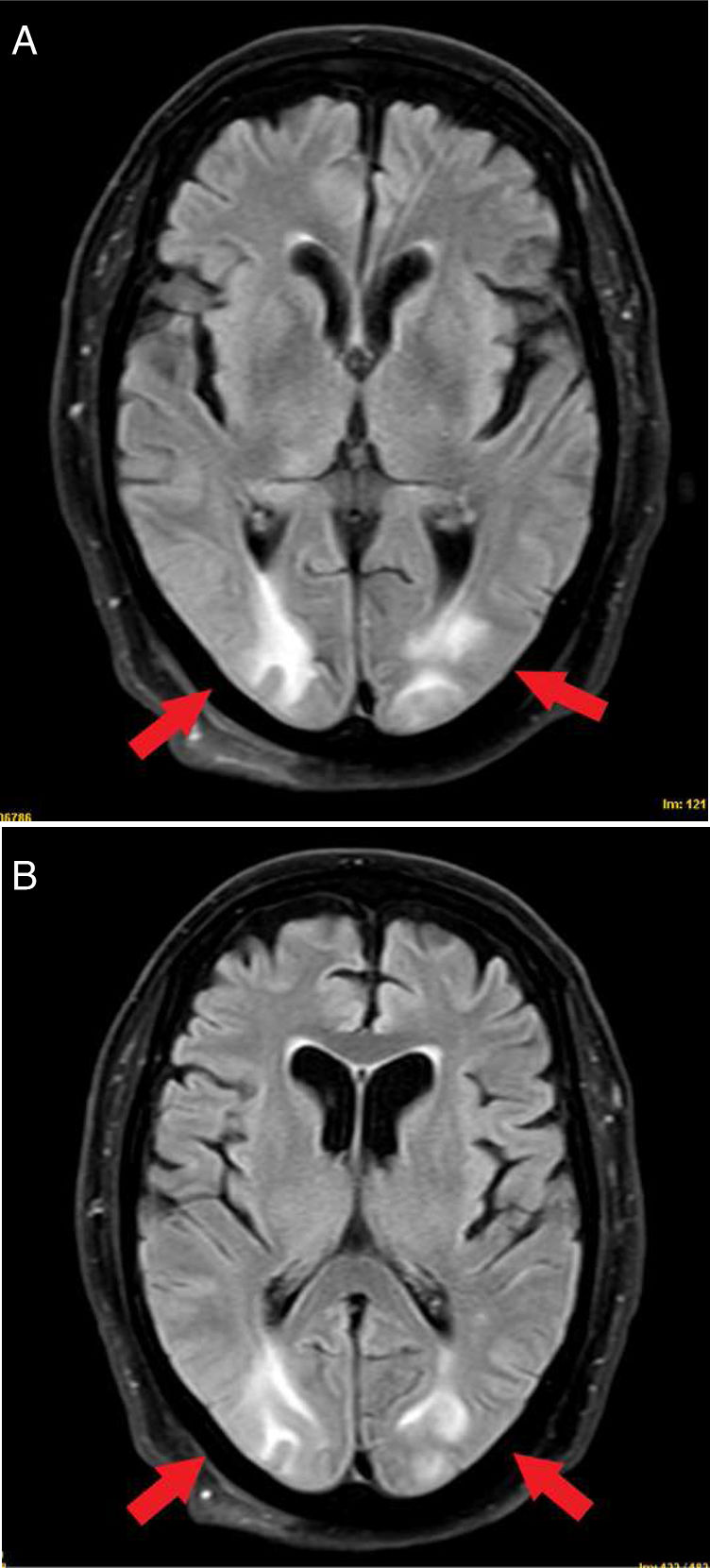
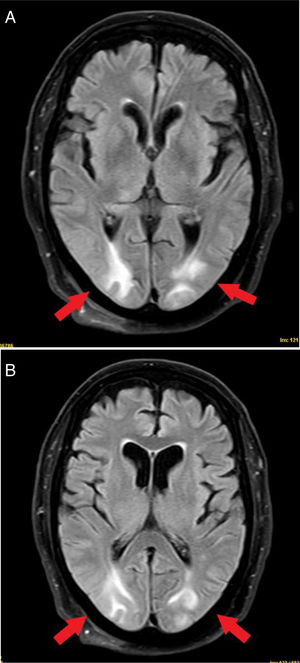
En los electroencefalogramas se informó de anomalías focales intercríticas que originaban crisis parciales complejas localizadas en el hemisferio derecho. La angio-TAC fue normal y la RM describió lesiones hiperintensas en T2 subcorticales en territorio frontera parietooccipitales. Se planteó, como primera posibilidad, el diagnóstico de PRES (fig. 2) en el contexto de infección grave por COVID-19.
Tras la asociación de antiepilépticos y la mejoría del cuadro infeccioso vírico, no aparecieron nuevas crisis. El paciente evolucionó satisfactoriamente, con bradipsiquia leve y tendencia a la desviación ocular izquierda que se resolvieron progresivamente, sin otra focalidad neurológica.
Caso 2Se trata de un varón de 64 años, hipertenso y dislipidémico, que ingresó en la Unidad de Cuidados Intensivos debido a neumonía por COVID-19. En los primeros días evolucionó a un síndrome de disfunción multiorgánica que requirió ventilación mecánica, perfusión de noradrenalina y dobutamina, además de tratamiento con hemofiltración venovenosa continua por fracaso renal anúrico con cifras de creatinina máxima de 2,7mg/dl.
Se le administró tratamiento con lopinavir-ritonavir, hidroxicloroquina, ceftriaxona y levofloxacino durante 5 días, además de dexametasona durante 10 días y heparina de bajo peso molecular a dosis anticoagulantes por cifras pico de Dímero D de 5.666ng/ml, además de tratamiento inmunomodulador con tocilizumab, baricitinib e interferón beta. En la analítica sanguínea destacaba ferritina de 4.483ng/ml, PCR de 180mg/dl y linfocitos de 70U/mm3.
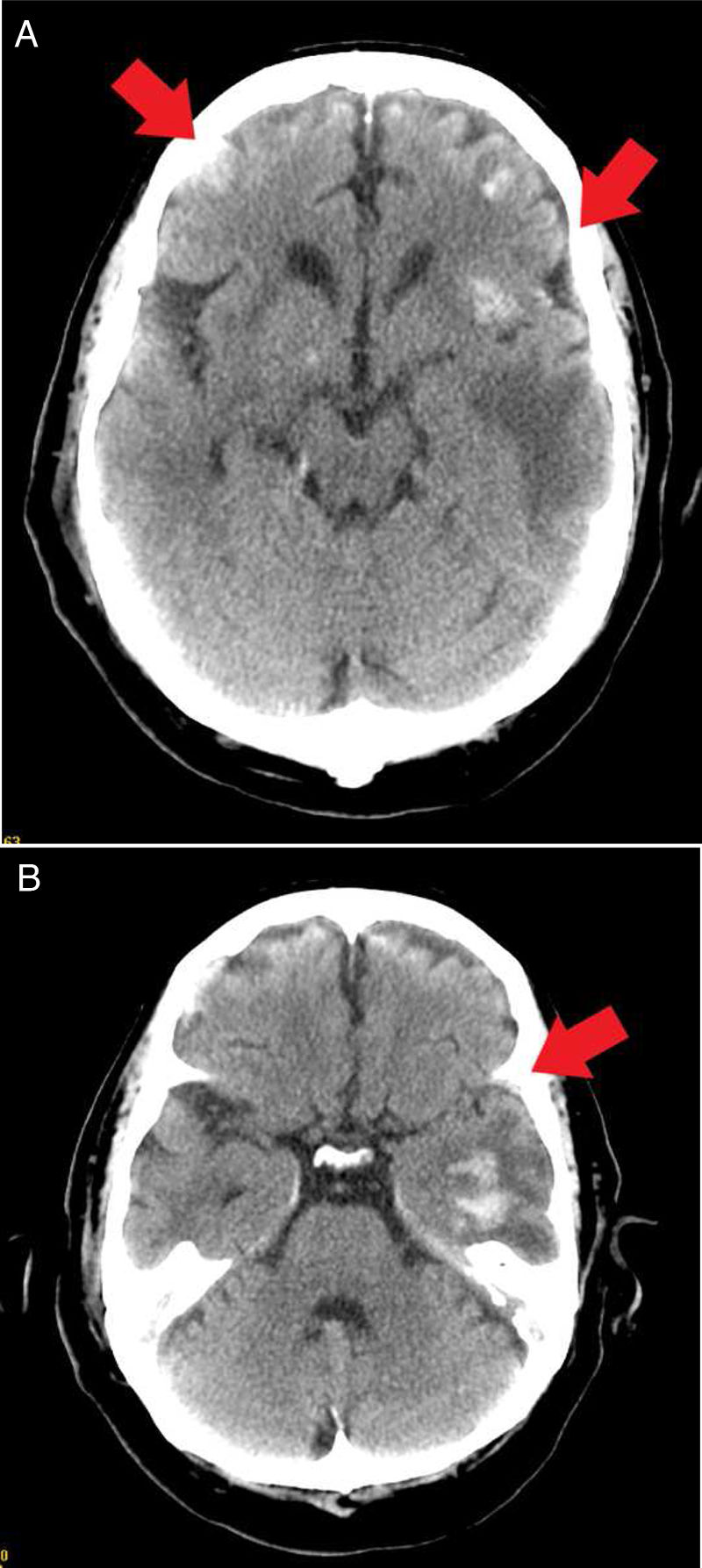
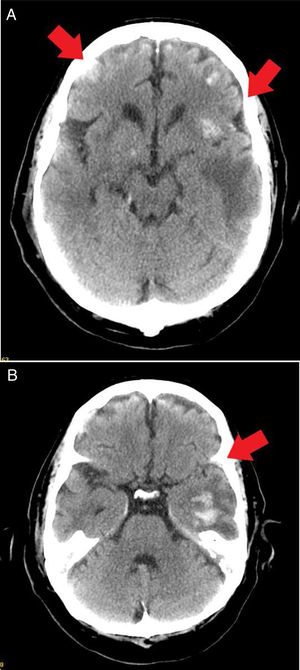
Recibió sedoanalgesia con midazolam a dosis de 20mg/h y fentanilo 100μg/h durante 13 días. El día 14 de evolución había mejorado del cuadro respiratorio y hemodinámico, por lo que se retiró la sedación y de forma progresiva presentó tendencia a HTA con cifras máximas de presión arterial de 170/100mmHg, asociada a clínica de disminución del nivel de conciencia con un GCS de 5. Se solicitó un electroencefalograma que descartó estatus epiléptico, confirmando una encefalopatía severa. Se realizó una TAC cerebral, que informó de hematomas parenquimatosos supratentoriales bilaterales con edema perilesional, y áreas de hemorragias subaracnoidea y petequiales de predominio perivascular (fig. 3). Por parte de neurocirugía se desestimó tratamiento quirúrgico.
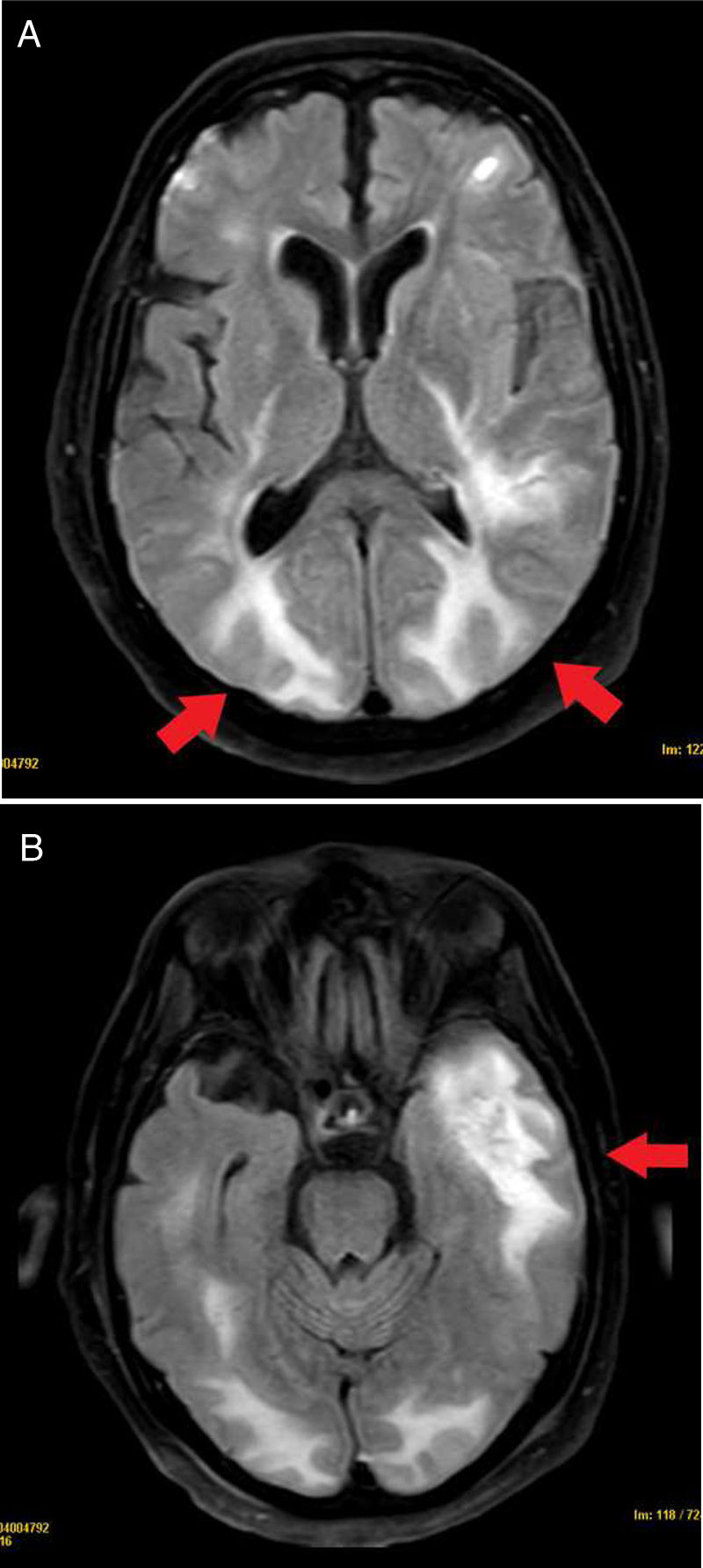
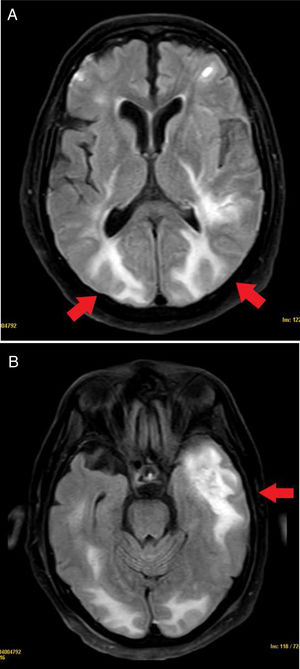
Se completó el estudio con una RM, en la que se observaron lesiones bilaterales supratentoriales con edema vasogénico, principalmente en la región occipital bilateral y temporal izquierda, indicativas de PRES (fig. 4). Además, las lesiones presentaban un componente hemorrágico y necrosante, que no permitía descartar encefalitis necrosante.
En los días siguientes, la evolución fue favorable con tratamiento de soporte y control de la HTA con labetalol iv y posteriormente con losartán oral. Fue dado de alta con un GCS de 15 y sin déficits neurológicos. En la RM de control no se detectó afectación de la sustancia blanca con patrón PRES.
DiscusiónSe han propuesto diversas teorías etiopatogénicas para este síndrome. La más aceptada propone que el aumento en la presión sanguínea provoca una alteración de la autorregulación cerebral. No obstante, el 30% de los casos presentan valores de presión arterial normales o levemente elevados que no exceden el límite autorregulador. Otra teoría formula que toxinas circulantes endógenas, propias de la preeclampsia/eclampsia o la infección/sepsis, o exógenas, como los fármacos citotóxicos/inmunosupresores y las citocinas proinflamatorias causan una disfunción endotelial2.
Varios mecanismos fisiopatológicos desencadenados por el coronavirus podrían explicar la disfunción endotelial asociada al PRES. Esta última podría ser provocada por la liberación de citocinas con el desarrollo de una respuesta sistémica exagerada, así como por una lesión viral directa por SARS-CoV-2, dado que el endotelio del sistema nervioso expresa receptores ACE23,7.
En un estudio reciente sobre hallazgos precoces en RM cerebral post mortem en COVID-19, se visualizaron cambios edematosos subcorticales indicativos de PRES en un paciente8.
Otros virus, como el parainfluenza o el coronavirus del síndrome respiratorio de Oriente Medio, se han asociado con el desarrollo de PRES1,3. El PRES en la infección por SARS-CoV-2 aún no se ha descrito bien, aunque parece que la COVID-19 está asociada con múltiples factores de riesgo que se han observado en esta entidad3,7.
En nuestros casos, las características reversibles clínicas y radiológicas apoyaron el diagnóstico de PRES. Sabemos que la propia infección por SARS-CoV-2 puede producir daño endotelial en el sistema nervioso central, sin embargo, no podemos descartar la contribución de otras condiciones clínicas presentes en pacientes críticos COVID-19, como la insuficiencia renal aguda, el síndrome de disfunción multiorgánica y el tratamiento inmunomodulador, entre ellos el tocilizumab, que ha sido relacionado con el síndrome9.
En el primer caso se descartó etiología isquémica del cuadro con una angio-TAC, y la encefalopatía hipertensiva, dado que el paciente mantenía la presión sanguínea estable.
Sin embargo, en el segundo sí se registraron fluctuaciones con picos de HTA, que podrían haber actuado como factor de riesgo de PRES asociados a complicaciones hemorrágicas, a lo que se suma la posible contribución del tratamiento con heparina de bajo peso molecular a dosis anticoagulantes en estos pacientes10. Desestimamos el diagnóstico de encefalitis necrosante dado el carácter reversible de las lesiones y el patrón radiológico en la RM sin afectación de los tálamos.
Como conclusión, el PRES probablemente fue de causa multifactorial: insuficiencia renal, infección grave por SARS-CoV-2, inmunosupresión y/o fármacos citotóxicos. Son necesarios más estudios para determinar la posible relación del cuadro con la COVID-19. Recomendamos tenerlo presente como causa de clínica neurológica aguda en estos pacientes para detectarlo de forma precoz, dado su carácter reversible.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.