La asociación independiente de la vancomicina con la lesión renal aguda (LRA) en el paciente crítico con sepsis o shock séptico es controvertida.
El objetivo de este estudio es evaluar la incidencia de LRA en una cohorte de pacientes con sepsis o shock séptico que recibieron vancomicina con ajuste de dosis de acuerdo a criterios farmacocinéticos/farmacodinámicos, como el área bajo la curva de concentración-tiempo en relación a la concentración mínima inhibitoria en las primeras 24h (AUC0-24/CMI ratio).
Material y métodosCohorte retrospectiva de 106 pacientes ingresados en la UCI con diagnóstico de sepsis o shock séptico con tratamiento de vancomicina, de forma consecutiva desde enero de 2017 a diciembre de 2019.
La LRA se definió según criterios de Kidney Disease Improving Global Outcomes. Se determinaron los factores de riesgo asociados a LRA mediante análisis de regresión logística multivariable.
El ajuste de la dosis de vancomicina se hizo guiado mediante la monitorización farmacocinética para conseguir el objetivo de AUC0-24/CMI> 400mg x h /L.
ResultadosEn nuestra cohorte, 28 pacientes de los 106 (26%) desarrollaron LRA. La mortalidad en UCI y a los 30 días fue de 18% y 22% respectivamente. Tras el análisis multivariable ajustado mediante regresión logística, la enfermedad hepática crónica se asoció a LRA.
ConclusiónEn nuestra cohorte retrospectiva en pacientes críticos con sepsis o shock séptico, tratados mediante vancomicina con ajuste de la dosis mediante la monitorización farmacocinética/farmacodinámica para conseguir la AUC0-24/CMI objetivo, la incidencia de LRA ha sido del 26%.
The independent association of vancomycin with Acute Kidney Injury (AKI) in the critically ill patient with sepsis or septic Shock is controversial.
The aim of this study was to evaluate the incidence of AKI in a cohort of patients with sepsis or septic Shock with an adequate and strict monitoring of vancomycin, guided by the area under the concentration-time curve in relation to the minimum inhibitory concentration (AUC/MIC ratio).
Material and methodsRetrospective cohort study on 106 patients admitted to the ICU with a diagnosis of sepsis or septic shock with vancomycin treatment, consecutively from January 2017 to December 2019.
AKI was defined according to Kidney Disease Improving Global Outcomes criteria. Risk factors associated with AKI were determined by multivariable logistic regression analysis.
ResultsIn our cohort, 28 patients out of 106 (26%) developed AKI. ICU and 30-day mortality were 18% and 22%, respectively. After multivariable logistic regression adjusted analysis, chronic liver disease was associated with AKI.
ConclusionIn our retrospective cohort study on critical patients with sepsis and septic shock, treated with vancomycin adjusting the dose guided by a pharmacokinetic/pharmacodynamic monitoring to achieve the target AUC0-24/CMI ratio, the incidence of AKI was 26%.
- -
La asociación entre el uso de vancomicina y LRA en pacientes con sepsis/shock séptico es controvertida.
- -
En nuestra cohorte retrospectiva en pacientes críticos con sepsis o shock séptico, tratados mediante vancomicina con ajuste de la dosis mediante la monitorización farmacocinética/farmacodinámica para conseguir la AUC0-24/CMI objetivo, la incidencia de LRA ha sido del 26%.
El uso de la vancomicina en pacientes ingresados en Unidades de Cuidados Intensivos (UCI) para tratar infecciones graves es muy frecuente debido a su efectividad, coste y facilidad de administración. Sin embargo, a pesar de ser un antibiótico de probada eficacia como primera línea en el tratamiento de la sepsis por Staphylococcus aureus (S. aureus) resistente a meticilina (MRSA), sigue siendo controvertida su posible asociación con la lesión renal aguda (LRA)1,2. Desde su origen y en la actualidad la nefrotoxicidad es considerada la complicación más temida con el uso de vancomicina, especialmente en tratamientos prolongados realizados de forma inadecuada. Más aún en subpoblaciones de riesgo como el paciente crítico donde existen otros factores que pueden provocar LRA como la sepsis3.
Se han descrito numerosos mecanismos fisiopatológicos de LRA asociada a sepsis («Sepsis induced-AKI»/«LRA-AS»): inmunomodulación, inflamación renal y sistémica, activación del complemento, desregulación del sistema renina angiotensina aldosterona (RAAS), disfunción mitocondrial, reprogramación metabólica, alteración macrocirculatoria y microcirculatoria, nefrotóxicos, hipercloremia e hipertensión intraabdominal4.
Las últimas recomendaciones para el uso de vancomicina se han publicado en 2020 en las guías de práctica clínica de la «Infectious Diseases Society of America (IDSA)»4. A pesar de ser un antibiótico de probada eficacia y considerado de primera línea en el tratamiento de la sepsis por MRSA5, persiste la controversia en su uso y en la estrategia de monitorización debido al potencial riesgo de nefrotoxicidad.
Además, los factores de riesgo conocidos de LRA-AS son la presencia de shock séptico, el uso de vasopresores y de ventilación mecánica, la bacteriemia por gramnegativos, el uso de inhibidores del sistema renina-angiotensina-aldosterona, la presencia de hepatopatía crónica y de enfermedad renal crónica, hipertensión arterial y diabetes preexistentes y tabaquismo3.
La posible asociación de LRA con el uso de vancomicina en pacientes cuyos niveles séricos son adecuadamente monitorizados es controvertida6–8.
La recomendación para ajustar la dosis de vancomicina con el objetivo de AUC0-24/CMI> 400mg x h / L, se basa en que, aunque la eficacia de la vancomicina, primordialmente se considera que es dependiente de tiempo, la ratio del área bajo la curva de concentración y tiempo en 1as 24 horas en relación con la CMI (AUC0-24/CMI ratio) ≥ 400mg x h/L se ha establecido como el criterio farmacocinético/farmacodinámico (PK/PD) más predictivo de buen resultado en infecciones invasivas con S. aureus resistente a meticilina6.
La estrategia de ajuste de la dosis de vancomicina con objetivo PK/PD de AUC0-24/CMI ratio se ha asociado con menor incidencia de LRA, comparado con la estrategia de guiarse mediante niveles valle de vancomicina9.
No obstante, en un metaanálisis de 8 estudios de cohortes observacionales con 2491 pacientes se ha observado que el uso de AUC0-24/CMI ratios más altas se ha asociado a mayor LRA, comparado con AUC0-24/CMI ratios más bajas. Además, se ha observado que el tener una AUC0-24/CMI ratio mayor de 650mg x h/l se asoció con mayor incidencia de LRA10.
Por tanto, planteamos este estudio observacional retrospectivo para determinar la incidencia de LRA en una cohorte de pacientes con sepsis y shock séptico ingresados en nuestra UCI, tratados con vancomicina, con dosis ajustadas mediante monitorización farmacocinética/farmacodinámica (PK/PD).
Material y métodosSe realizó un estudio observacional retrospectivo con pacientes con sepsis o shock séptico en los cuales se inició tratamiento con vancomicina en la UCI de la Clínica Universidad de Navarra, recogidos de forma consecutiva, durante el periodo de enero de 2017 a diciembre de 2019.
Este estudio contó con la aprobación del Comité de Ética de Investigación de la Clínica Universidad de Navarra, que concedió la exención del consentimiento informado por el tipo de estudio planteado. Se usó la definición de sepsis y shock séptico del consenso Sepsis-311. El Sequential Organ Failure Assessment Score (SOFA) usado para el diagnóstico de sepsis, no incluía los puntos de función renal mediante el análisis de la creatinina, dado que se excluyeron los pacientes con creatinina elevada previamente al inicio del tratamiento con vancomicina (n=25).
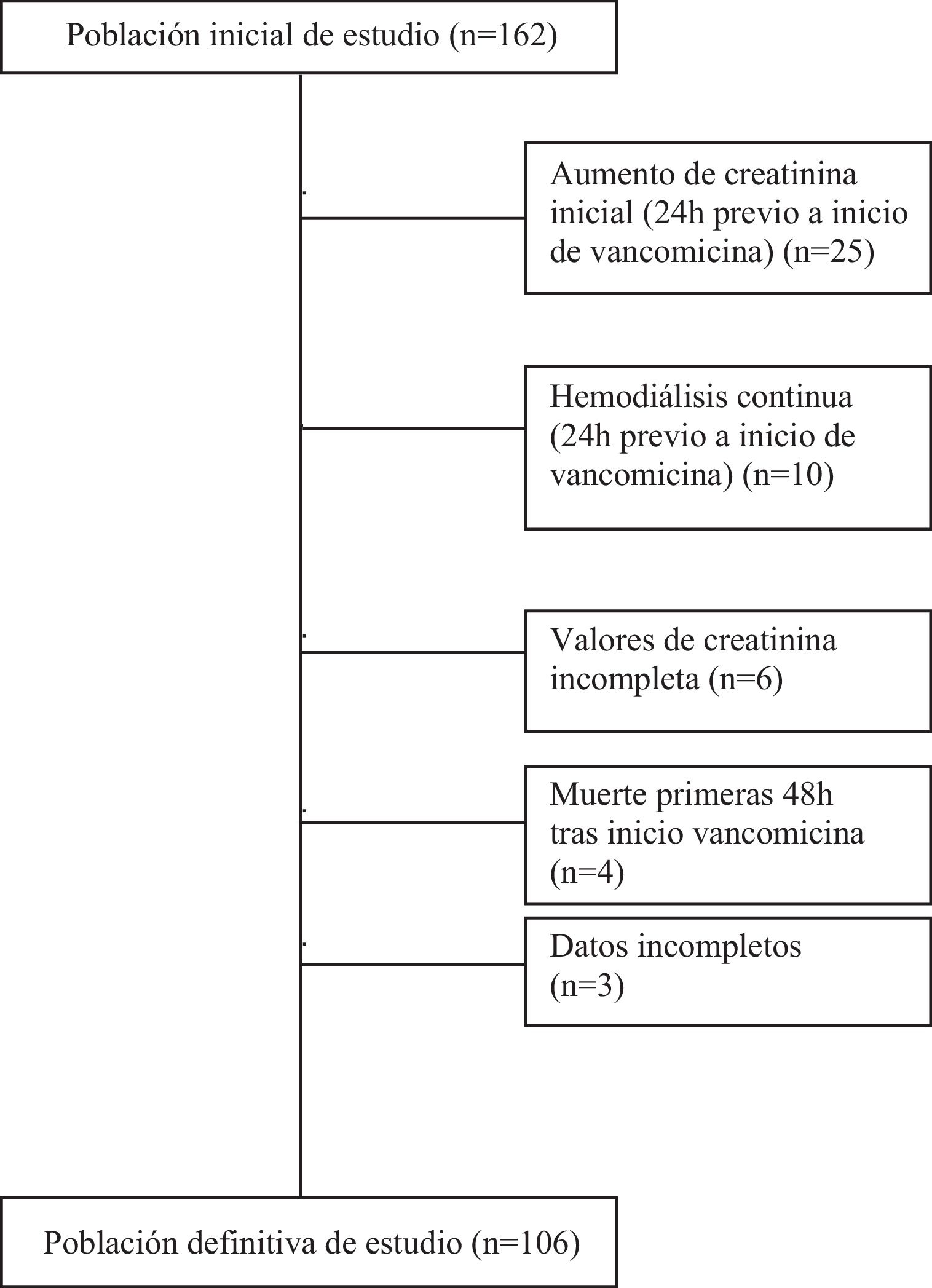
Se dispuso de las variables farmacocinéticas y farmacodinámicas (PK/PD) de vancomicina obtenidas durante la monitorización terapéutica del fármaco (MTD). Los criterios de inclusión fueron: pacientes>18 años con sepsis o shock séptico en tratamiento con vancomicina en la UCI. Se excluyeron los pacientes con daño renal crónico en hemodiálisis, LRA antes del inicio de la vancomicina, pacientes que fallecieron en las primeras 48 horas, con datos incompletos y los que recibieron tratamiento con vancomicina ≤ 2 días (fig. 1).
El objetivo principal fue determinar la incidencia de LRA y su magnitud (mediante el estadio KDIGO=«Kidney Disease: Improving Global Outcomes») en pacientes tratados con vancomicina donde se usó la estrategia de ajuste de dosis guiado mediante criterios PK/PD con objetivo de AUC0-24/CMI> 400mg xh / L, e intentando no superar 600mg x h / L.
Como objetivos secundarios se evaluaron potenciales factores de riesgo asociados a LRA, incluidos niveles valle o niveles de AUC0-24/CMI ratio de vancomicina. También se analizó la mortalidad en UCI y a los 30 días.
Una vez obtenida la incidencia de LRA, se estudió su relación con las principales variables farmacocinéticas registradas como la concentración mínima (Cmín.) o valle de vancomicina, el área bajo la curva de concentración-tiempo (AUC) y el cociente entre el AUC y la concentración mínima inhibitoria (CMI) del organismo diana (AUC/CMI). Se definió LRA con sus estadios según las guías KDIGO12.
El tamaño muestral fue consecuencia de la recogida de pacientes consecutivos durante el periodo de enero de 2017 a diciembre de 2019, con un número de pacientes incluidos similar al de un estudio relevante publicado previamente1. Dado que el número de eventos de LRA es de 78, tenemos una ratio o relación entre el número de eventos y las variables independientes o variables de exposición <10, en el modelo de análisis multivariable de regresión logística ajustada por 6 variables.
La normalidad de la distribución se comprobó mediante la prueba de Kolmogorov-Smirnov. Se realizó un análisis univariante mediante la prueba de Chi cuadrado y prueba exacta de Fischer para las variables categóricas paramétricas y no paramétricas, respectivamente. Además, se realizó la prueba suma de rangos de Wilcoxon y la prueba t de Student para las variables continuas no paramétricas y paramétricas, respectivamente.
Además, se realizó un análisis no ajustado de regresión logística y un análisis multivariable ajustado de regresión logística para evaluar la asociación entre los niveles valle y el AUC0-24/CMI ratio de vancomicina y la incidencia de LRA.
En el modelo de regresión logística ajustado añadimos las siguientes variables: edad, sexo, concentraciones séricas valle iniciales de vancomicina, los niveles de AUC0-24/CMI ratio de vancomicina, enfermedad hepática y uso de vasopresores. Los resultados se observan a p <0,05, para la significación. El análisis estadístico se realizó utilizando STATA 16.0.
Técnica de monitorización de vancomicinaLos pacientes recibieron una dosis inicial, en 2 horas, de vancomicina de 25mg/kg, o 20mg/kg en obesos (IMC>30), según el peso corporal total. La dosis de mantenimiento se estimó inicialmente considerando la tasa de filtración glomerular mediante la ecuación CKD-EPI13, ajustando por la albúmina plasmática. En todos los pacientes, la monitorización se programó entre la tercera y cuarta dosis de mantenimiento con la extracción de una concentración mínima (Cmín.) o valle, es decir previa a la dosis y se estimaron los parámetros farmacocinéticos individuales mediante metodología bayesiana, ajustando de forma más precisa la dosis de mantenimiento.
La cuantificación de la concentración sérica de vancomicina se realizó por la técnica «particle-enhanced turbidimetric inhibition immunoassay (PETINIA)» implantada en el módulo C del autoanalizador Alinity de Abbott Scientific.
Para la estimación bayesiana de los parámetros farmacocinéticos del antibiótico, se utilizó el software PKS v1.10 (Abbottbase Pharmacokinetics System) de Abbott Laboratories®. Como modelo farmacocinético poblacional se empleó el modelo bicompartimental lineal de Rodvold implantado en dicho software.
En los pacientes en los que se sospechó un aclaramiento de vancomicina inestable se programó una nueva monitorización a las 24 o 48h. La evolución clínica del paciente determinó la frecuencia posterior de las monitorizaciones farmacocinéticas.
El ajuste de la dosis de vancomicina se estimó para conseguir el objetivo PK/PD de AUC0-24/CMI> 400mg x h /L, intentando evitar alcanzar los 600mg x h /L.
ResultadosIdentificamos 162 pacientes ingresados en UCI con sepsis o shock séptico que recibieron tratamiento intravenoso con vancomicina y monitorización de sus niveles séricos durante el periodo establecido. Un total de 56 pacientes fueron excluidos del estudio por las siguientes causas: aumento de creatinina antes de las 24h de inicio del tratamiento (n=25), LRA KDIGO III dentro de las 24h de tratamiento (n=10), hemodiálisis previa (n=8), ausencia de algún valor de creatinina durante el estudio (n=6), muerte antes de las 48h de tratamiento (n=4) y datos clínicos incompletos (n=3).
Finalmente 106 pacientes cumplieron todos los criterios de inclusión (sepsis 61% y shock séptico 39%) y fueron incluidos para su estudio y análisis (fig. 1).
Del total de 106 pacientes, 28 pacientes desarrollaron LRA (26,4%) y 3 pacientes requirieron terapia de reemplazo renal continuo (TRRC) (2,8%). La mayoría de LRA fueron KDIGO I (16/28, 67%). Los casos de KDIGO II y III fueron 25% y 7,1% respectivamente.
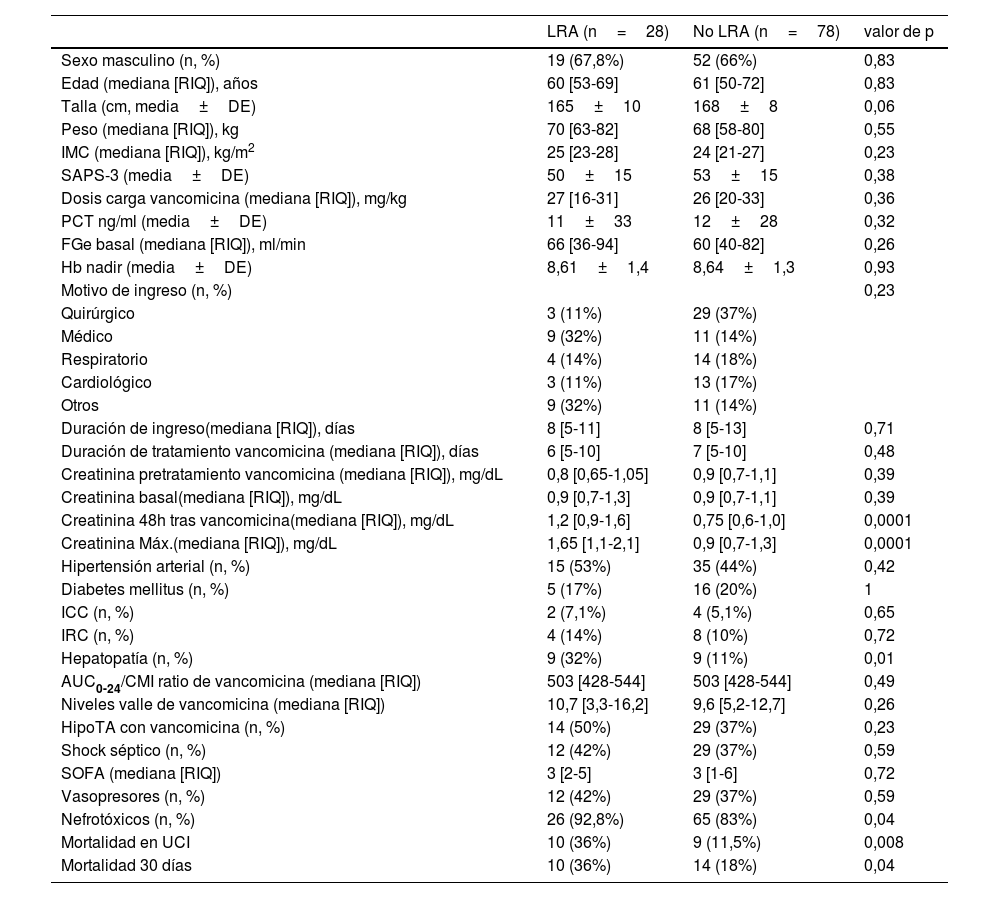
Observamos que el grupo con LRA presentaba mayor porcentaje de mujeres, con motivo de ingreso médico no quirúrgico, con mayor duración de su ingreso en UCI, con hipertensión arterial (HTA), enfermedad hepática crónica, insuficiencia cardiaca o renal crónica (ICC, IRC), shock séptico, mayor uso de AINE y de contraste (tabla 1).
Características demográficas, antropométricas, clínicas y analíticas
| LRA (n=28) | No LRA (n=78) | valor de p | |
|---|---|---|---|
| Sexo masculino (n, %) | 19 (67,8%) | 52 (66%) | 0,83 |
| Edad (mediana [RIQ]), años | 60 [53-69] | 61 [50-72] | 0,83 |
| Talla (cm, media±DE) | 165±10 | 168±8 | 0,06 |
| Peso (mediana [RIQ]), kg | 70 [63-82] | 68 [58-80] | 0,55 |
| IMC (mediana [RIQ]), kg/m2 | 25 [23-28] | 24 [21-27] | 0,23 |
| SAPS-3 (media±DE) | 50±15 | 53±15 | 0,38 |
| Dosis carga vancomicina (mediana [RIQ]), mg/kg | 27 [16-31] | 26 [20-33] | 0,36 |
| PCT ng/ml (media±DE) | 11±33 | 12±28 | 0,32 |
| FGe basal (mediana [RIQ]), ml/min | 66 [36-94] | 60 [40-82] | 0,26 |
| Hb nadir (media±DE) | 8,61±1,4 | 8,64±1,3 | 0,93 |
| Motivo de ingreso (n, %) | 0,23 | ||
| Quirúrgico | 3 (11%) | 29 (37%) | |
| Médico | 9 (32%) | 11 (14%) | |
| Respiratorio | 4 (14%) | 14 (18%) | |
| Cardiológico | 3 (11%) | 13 (17%) | |
| Otros | 9 (32%) | 11 (14%) | |
| Duración de ingreso(mediana [RIQ]), días | 8 [5-11] | 8 [5-13] | 0,71 |
| Duración de tratamiento vancomicina (mediana [RIQ]), días | 6 [5-10] | 7 [5-10] | 0,48 |
| Creatinina pretratamiento vancomicina (mediana [RIQ]), mg/dL | 0,8 [0,65-1,05] | 0,9 [0,7-1,1] | 0,39 |
| Creatinina basal(mediana [RIQ]), mg/dL | 0,9 [0,7-1,3] | 0,9 [0,7-1,1] | 0,39 |
| Creatinina 48h tras vancomicina(mediana [RIQ]), mg/dL | 1,2 [0,9-1,6] | 0,75 [0,6-1,0] | 0,0001 |
| Creatinina Máx.(mediana [RIQ]), mg/dL | 1,65 [1,1-2,1] | 0,9 [0,7-1,3] | 0,0001 |
| Hipertensión arterial (n, %) | 15 (53%) | 35 (44%) | 0,42 |
| Diabetes mellitus (n, %) | 5 (17%) | 16 (20%) | 1 |
| ICC (n, %) | 2 (7,1%) | 4 (5,1%) | 0,65 |
| IRC (n, %) | 4 (14%) | 8 (10%) | 0,72 |
| Hepatopatía (n, %) | 9 (32%) | 9 (11%) | 0,01 |
| AUC0-24/CMI ratio de vancomicina (mediana [RIQ]) | 503 [428-544] | 503 [428-544] | 0,49 |
| Niveles valle de vancomicina (mediana [RIQ]) | 10,7 [3,3-16,2] | 9,6 [5,2-12,7] | 0,26 |
| HipoTA con vancomicina (n, %) | 14 (50%) | 29 (37%) | 0,23 |
| Shock séptico (n, %) | 12 (42%) | 29 (37%) | 0,59 |
| SOFA (mediana [RIQ]) | 3 [2-5] | 3 [1-6] | 0,72 |
| Vasopresores (n, %) | 12 (42%) | 29 (37%) | 0,59 |
| Nefrotóxicos (n, %) | 26 (92,8%) | 65 (83%) | 0,04 |
| Mortalidad en UCI | 10 (36%) | 9 (11,5%) | 0,008 |
| Mortalidad 30 días | 10 (36%) | 14 (18%) | 0,04 |
DE:desviación estándar; FGe:filtrado glomerular estimado; Hb:hemoglobina; Hb nadir:hemoglobina mínima durante tratamiento con vancomicina; HipoTA: hipotensión arterial; ICC:insuficiencia cardiaca congestiva; IMC: índice masa corporal; IRC:insuficiencia renal crónica; LRA: lesión renal aguda; PCT:procalcitonina; RIQ:rango intercuartílico; SAPS-3: Simplified Acute Physiologic Score; SOFA: Sequential Organ Failure Assessment score.
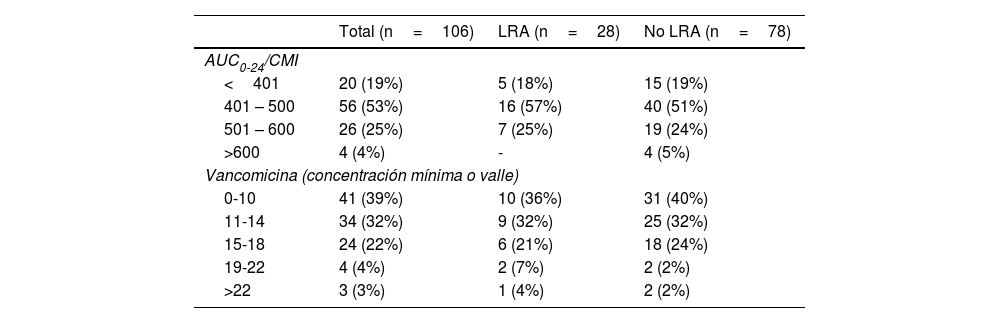
Respecto a los datos farmacocinéticos, la gran mayoría de los pacientes tenían niveles valle entre 11-18mg/L (58/106, 54,7%) o por debajo de 10mg/L (41/106, 38,7%), y un rango de AUC0-24/CMI entre 401-600mg x h/L (78%) (tabla 2).
Características farmacológicas
| Total (n=106) | LRA (n=28) | No LRA (n=78) | |
|---|---|---|---|
| AUC0-24/CMI | |||
| <401 | 20 (19%) | 5 (18%) | 15 (19%) |
| 401 – 500 | 56 (53%) | 16 (57%) | 40 (51%) |
| 501 – 600 | 26 (25%) | 7 (25%) | 19 (24%) |
| >600 | 4 (4%) | - | 4 (5%) |
| Vancomicina (concentración mínima o valle) | |||
| 0-10 | 41 (39%) | 10 (36%) | 31 (40%) |
| 11-14 | 34 (32%) | 9 (32%) | 25 (32%) |
| 15-18 | 24 (22%) | 6 (21%) | 18 (24%) |
| 19-22 | 4 (4%) | 2 (7%) | 2 (2%) |
| >22 | 3 (3%) | 1 (4%) | 2 (2%) |
AUC/CMI: área bajo la curva respecto a concentración mínima inhibitoria; LRA: lesión renal aguda.
La mortalidad global en UCI y a los 30 días fue de 18% y 22%, respectivamente y fue mayor en el grupo con LRA que en el grupo sin LRA (36% vs. 12% y 36% vs. 18%, respectivamente) (tabla 3).
Análisis descriptivo en relación con la gravedad de la LRA según KDIGO
| KDIGO 0 (n=78) | KDIGO I (n=19) | KDIGO II-III (n=9) | Total (n=106) | |
|---|---|---|---|---|
| Foco sospechado (n, %) | 52 (76%) | 9 (47%) | 3 (33,3%) | 64 (60%) |
| Foco evidenciado (n, %) | 40 (51%) | 11 (58%) | 5 (55,5%) | 56 (53%) |
| Aminoglucósidos (AMG) (n, %) | 26 (33%) | 3 (16%) | 3 (43%) | 32 (30%) |
| AINE (n, %) | 32 (41%) | 11 (58%) | 3 (43%) | 46 (43%) |
| Contraste (n, %) | 11 (14%) | 4 (21%) | 1 (14%) | 16 (15%) |
| Diuréticos (n, %) | 57 (73%) | 13 (68%) | 8 (88,8%) | 78 (74%) |
| Aislamiento (n, %) | 50 (64%) | 15 (79%) | 8 (88,8%) | 73 (69%) |
| Muerte UCI (n, %) | 9 (12%) | 7 (37%) | 3 (33,3%) | 19 (18%) |
| Muerte 30 días (n, %) | 14 (18%) | 7 (37%) | 3 (33,3%) | 24 (22%) |
| N.° Nefrotóxicos | ||||
| 0 (n, %) | 10 (12%) | - | - | 10 (9%) |
| 1 (n, %) | 49 (63%) | 17 (89%) | 7 (77,7%) | 73 (69%) |
| 2 (n, %) | 16 (21%) | 2 (11%) | 2 (22,2%) | 20 (19%) |
| 3 (n, %) | 2 (3%) | - | - | 2 (2%) |
| 4 (n, %) | 1 (1%) | - | - | 1 (1%) |
| Fármaco nefrotóxicos | ||||
| Sí | 68 (88%) | 19 (100%) | 9 (100%) | 96 (91%) |
AINE: antiinflamatorios no esteroideos; KDIGO: criterios de la Kidney Diasease Improving Global Outcomes; LRA: lesión renal aguda; UCI: Unidad de Cuidados Intensivos.
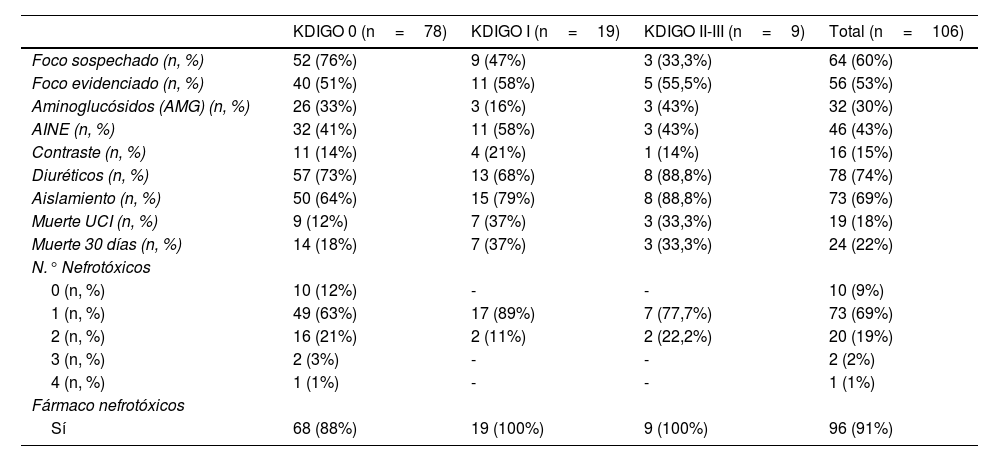
La mayoría recibió diuréticos intravenosos (78/106, 74%), sin observar diferencias entre el grupo de LRA vs. no-LRA (75% vs. 73%). El grupo de LRA recibió más nefrotóxicos (100% vs. 87%) (tabla 3).
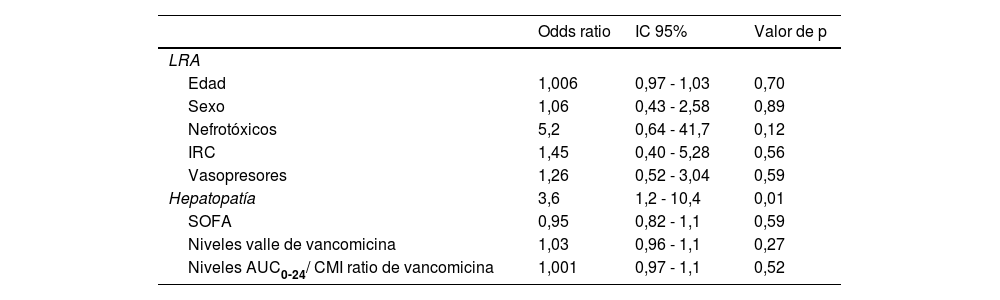
En el análisis de regresión logística no ajustado se observó asociación entre hepatopatía y LRA (OR 3,6; IC 95% 1,2-10,4, p=0,01) (tabla 4).
Análisis no ajustado de regresión logística para LRA
| Odds ratio | IC 95% | Valor de p | |
|---|---|---|---|
| LRA | |||
| Edad | 1,006 | 0,97 - 1,03 | 0,70 |
| Sexo | 1,06 | 0,43 - 2,58 | 0,89 |
| Nefrotóxicos | 5,2 | 0,64 - 41,7 | 0,12 |
| IRC | 1,45 | 0,40 - 5,28 | 0,56 |
| Vasopresores | 1,26 | 0,52 - 3,04 | 0,59 |
| Hepatopatía | 3,6 | 1,2 - 10,4 | 0,01 |
| SOFA | 0,95 | 0,82 - 1,1 | 0,59 |
| Niveles valle de vancomicina | 1,03 | 0,96 - 1,1 | 0,27 |
| Niveles AUC0-24/ CMI ratio de vancomicina | 1,001 | 0,97 - 1,1 | 0,52 |
AUC0-24/CMI: área bajo la curva respecto a concentración mínima inhibitoria; IRC:insuficiencia renal crónica; LRA: lesión renal aguda; SOFA: Simplified Acute Physiologic Score.
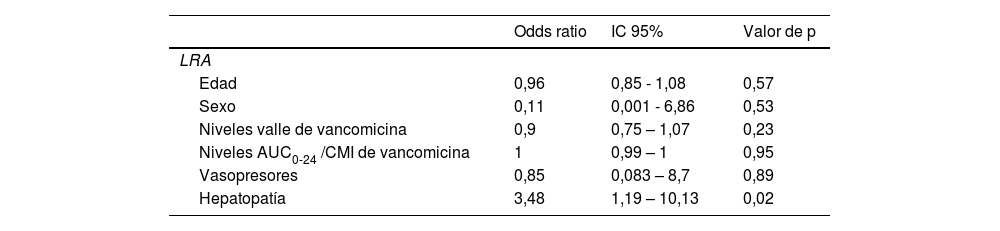
En el análisis multivariable de regresión logística ajustado se observó una asociación entre enfermedad hepática crónica y LRA (OR 3,48, IC 95% 1,19 – 10,13, p=0,02). Los pacientes con hepatopatía crónica tenían 3,48 veces más riesgo de desarrollar LRA, comparado con los pacientes sin hepatopatía.
No se observaron diferencias entre el uso de vasopresores con LRA. Además, los niveles valle y la AUC0-24/CMI ratio de vancomicina tampoco se asociaron con LRA (tabla 5).
Análisis multivariable ajustado de regresión logística para LRA
| Odds ratio | IC 95% | Valor de p | |
|---|---|---|---|
| LRA | |||
| Edad | 0,96 | 0,85 - 1,08 | 0,57 |
| Sexo | 0,11 | 0,001 - 6,86 | 0,53 |
| Niveles valle de vancomicina | 0,9 | 0,75 – 1,07 | 0,23 |
| Niveles AUC0-24 /CMI de vancomicina | 1 | 0,99 – 1 | 0,95 |
| Vasopresores | 0,85 | 0,083 – 8,7 | 0,89 |
| Hepatopatía | 3,48 | 1,19 – 10,13 | 0,02 |
AUC0-24/CMI: área bajo la curva respecto a concentración mínima inhibitoria; LRA: lesión renal aguda.
No se observó multicolinealidad de las variables independientes del modelo de regresión logística mediante el factor de inflación de varianza (VIF) y mediante la observación de la matriz de correlación de las variables. Los VIF de las variables fue desde 1,05 a máximo 1,5. El coeficiente de correlación de la matriz de correlación de las variables era en todas las variables de <0,4.
DiscusiónEn nuestra cohorte retrospectiva observamos una incidencia de LRA del 26% y una mortalidad en UCI del 18% y a los 30 días del 22%. Esta mortalidad está por debajo de la descrita en una población con sepsis o shock séptico con un SAPS-3 de 52+/- 12 que supone una mortalidad hospitalaria esperada del 22%14.
Nuestra incidencia de LRA y mortalidad en UCI son menores de los esperables en base a un metaanálisis publicado en 2020 de estudios observacionales de sepsis y shock séptico3. Datos de este metaanálisis muestran una incidencia de LRA de 42% entre los 22 estudios observacionales en pacientes con sepsis (AKI, n=16399/39067, 42%) y una incidencia de LRA de 60,47% entre los 12 estudios observacionales en pacientes con shock séptico (AKI, n=12678/20965, 60,47%). Además, datos del metaanálisis muestran una mortalidad hospitalaria de 42% y 55% en pacientes con sepsis y shock séptico, respectivamente3. Una plausible explicación de nuestra baja incidencia de LRA es un óptimo empleo de la vancomicina, ya que, el 78% de los pacientes de nuestra cohorte cumplían el criterio PK/PD recomendado (AUC0-24/CMI 400-600mg x h/L).
De acuerdo con estudios recientes, la LRA en relación al uso de vancomicina puede variar desde un 5% a un 50%, y es considerada de causa multifactorial, donde el mecanismo exacto sigue siendo desconocido1,2 y atribuido a inflamación, daño oxidativo por radicales libres con disfunción mitocondrial y apoptosis celular. El tipo de lesión renal más común es la toxicidad tubular directa, seguido de la nefritis intersticial15,16. Otros mecanismos propuestos serían la disfunción lisosomal por acumulación de la vancomicina en la célula tubular, la formación de cilindros tubulares relacionado al fármaco y los efectos en el flujo sanguíneo renal17.
Debido a que hasta un 40% de la creatinina excretada por orina lo hace por secreción tubular proximal mediante transportadores de aniones orgánicos (OAT1 y OAT3) y de gP-p (ABCB1), se ha postulado que la vancomicina podría inhibir este mecanismo tubular y provocar un aumento ficticio de la creatinina plasmática o «pseudotoxicidad» ya que la filtración tubular se encuentra inalterada, y lo mismo ocurriría con el uso de la piperacilina-tazobactam (P-T)18. En pacientes con sepsis o shock séptico la vancomicina se asocia frecuentemente con antibióticos de amplio espectro tales como carbapenémicos o P-T, siendo esta última la más utilizada19. Numerosas publicaciones advierten un riesgo aumentado de LRA al utilizar la combinación de vancomicina con P-T, no así con carbapenémicos20,21. No obstante, un estudio reciente no evidencia un deterioro renal, peor pronóstico o mayor mortalidad, sugiriendo que el aumento de la creatinina en plasma o suero no representa una verdadera toxicidad en sí mismo22. Dichos autores recomiendan el uso de biomarcadores más fiables como la cistatina o el KIM-1 (Kidney Injury Molecule-1), para objetivar dicha LRA23.
Para alcanzar este objetivo cuando las CMI son ≥1,0mg/l, la dosificación debe estar en el rango superior. Rybak et al., en 2009 en el consenso sobre monitorización terapéutica (TDM) de vancomicina, propusieron que para conseguir la exposición diana era necesario obtener concentraciones valles elevadas (15-20mg/l)24. Sin embargo, tras la advertencia de numerosos profesionales sobre el aumento de deterioro renal en EE. UU. motivado por el aumento en el empleo de elevadas dosis de vancomicina, publicaron un nuevo consenso en 2020 en el que dejaban de recomendar la búsqueda de dichas concentraciones de forma rutinaria4. Esta recomendación está de acuerdo con nuestra experiencia clínica, en el que habitualmente la exposición de 400 mcg x h/L se alcanza con concentraciones valle entre 11 y 12mg/L.
Un estudio observacional retrospectivo con el uso de vancomicina intravenosa de forma continua y buscando niveles valles elevados (20-30mg/L), mostró una incidencia de LRA de 29% y asociación de LRA con niveles pico> de 40mg/L1.
En nuestra cohorte observamos una diferencia entre pacientes con niveles valle o basal>19mg/L (LRA 7%) vs. <19mg/L (LRA 4%) (tabla 2), sin alcanzar significación estadística debido al bajo número de pacientes con niveles valle>19mg/L (n=7, 6,6%), de los cuales 3 (2,8%), tenían niveles>22mg/L. Un estudio más reciente en Japón con mayor número de pacientes (n=346) encontró una incidencia de LRA del 11% pero en pacientes de menor gravedad clínica ya que solo el 14% estaban ingresados en UCI25.
Se sabe que hasta un 60% de los pacientes hospitalizados por cualquier causa reciben antibióticos19 con una incidencia de LRA de causa medicamentosa tan alta como un 60%, especialmente en ancianos. El tipo de LRA asociada a antibióticos es variable, desde una nefritis intersticial por betalactámicos hasta la necrosis tubular aguda por aminoglucósidos26.
Todos nuestros pacientes presentaron valores estables de creatinina en plasma antes de iniciar tratamiento antibiótico y todos recibieron vancomicina en combinación con otros antibióticos. La combinación más frecuente fue con meropenem (60%), seguido de piperacilina tazobactam (30%), aminoglucósidos (5%), y otros en 5%.
Las últimas recomendaciones de la guía IDSA 2020 destacan la necesidad de la monitorización terapéutica de los niveles de vancomicina en pacientes graves, incluyendo pacientes críticos, para optimizar la eficacia y minimizar la toxicidad6. También sugieren como objetivos farmacocinéticos, obtener niveles valles de 15-20mg/l en el tratamiento de la infección por gérmenes grampositivos, aumentando este rango de niveles en infecciones más graves. Todo esto podría explicar una mayor incidencia de toxicidad asociada a vancomicina observada en decenas de estudios en los últimos años, incluyendo metaanálisis y que condiciona el empleo de este antibiótico26,27.
Un problema con el empleo de vancomicina es la necesidad de utilizar dosis de carga ya que de no hacerlo se retrasa la consecución del objetivo terapéutico, lo que afecta negativamente al resultado, siendo especialmente negativo en pacientes críticos con sepsis. Además, si el objetivo buscado es excesivo (concentraciones basales superiores a 15mg/L) el empleo de dosis de carga no garantiza su consecución, tal y como se mostró en un estudio prospectivo llevado a cabo en dos hospitales noruegos en el que se observó que solo el 40% de los pacientes alcanzaron en las primeras 72h niveles terapéuticos (considerado Cmín.>15mg/L) a pesar de dosis de carga y mantenimiento28. Nuestra opinión es que estos rangos de niveles valle, recomendados para alcanzar eficacia, son innecesariamente elevados.
Aunque la eficacia de la vancomicina, primordialmente se considera que es dependiente de tiempo, la ratio del área bajo la curva de concentración y tiempo en 1as 24 horas en relación con la CMI (AUC0-24/CMI ratio) ≥ 400mg x h/L se ha establecido como el criterio PK/PD más predictivo de buen resultado en infecciones invasivas con estafilococo aureus meticilin-resistente6.
En este sentido, tampoco hay ninguna evidencia definida a excepción de la expuesta en los primeros trabajos del grupo de Schentag sobre neumonía29. Precisamente por el comportamiento farmacodinámico de la vancomicina, estos autores consideran el AUC0-24/CMI como el parámetro más idóneo para asegurar eficacia y definir metas terapéuticas28.
El riesgo de LRA varía ampliamente dependiendo de los niveles de concentración del fármaco, de su comportamiento y de la población estudiada.
El uso de vancomicina se asocia en nuestra cohorte a la posible nefropatía inducida por la sepsis (SI-AKI), lo que dificulta establecer claramente una relación causal entre el uso de vancomicina y la LRA.
En nuestra opinión no se ha observado asociación entre AUC/CMI ratio de vancomicina y LRA en nuestra cohorte, porque el 78% de los pacientes de la cohorte tenían una AUC/CMI ratio entre 400-600mg x h/L, buscada como objetivo.
Las limitaciones de nuestro estudio son las siguientes: a) es una cohorte con un tamaño muestral limitado de 106 pacientes; b) se trata de un estudio retrospectivo y unicéntrico, sin grupo de pacientes control, y por último, c) hay variables clínicamente importantes que no están analizadas, como el uso de ventilación mecánica. No obstante, aunque el tamaño muestral es limitado, dado que el número de eventos de LRA es de 78, tenemos una relación número de eventos:variable independiente adecuado (< 10), en el modelo de análisis multivariable de regresión logística ajustada por 6 variables.
Nuestra cohorte destaca por el uso de la metodología bayesiana para la estimación de los parámetros farmacocinéticos individuales y por la estricta monitorización no solo de los niveles valle, sino también del cociente AUC0-24/CMI. La metodología bayesiana es considerada hasta la fecha la mejor forma de estimar la dosificación de vancomicina, al proporcionar menor sesgo y error total en las predicciones que otros métodos, dada la limitación de muestras por paciente que se dispone en la práctica clínica. Un reciente trabajo demostró que utilizando la estrategia bayesiana para ajustar dosis junto con la monitorización de vancomicina en pacientes con deterioro renal agudo (sepsis solo en un 19%) produjo una tasa significativamente menor de nefrotoxicidad en relación con el grupo control (LRA según criterio RIFLE, 8% vs. 21% p=0,03)8.
Otra fortaleza de nuestro estudio es el uso de una estricta monitorización no solo de los niveles valle, sino también del cociente AUC0-24/CMI, acorde con las últimas guías IDSA que recomiendan monitorizar utilizando análisis de modelos farmacocinéticos en subpoblaciones consideradas de elevado riesgo de LRA, tales como paciente crítico, ancianos y pediátricos, obesos y los que tienen deterioro renal previo6.
En conclusión, en nuestra cohorte retrospectiva en pacientes críticos con sepsis o shock séptico, tratados mediante vancomicina con ajuste de la dosis guiados mediante la monitorización farmacocinética para conseguir la AUC0-24/CMI ratio objetivo, la incidencia de LRA fue del 26%, menor de la descrita en estudios previos realizados en la misma población.
AutoríaPM, AA y ADG: conceptualización, metodología.
MV: análisis de datos, preparación manuscrito original.
PM, AA y MV: supervisión, revisión.
FinanciaciónEl presente trabajo no ha sido financiado.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.