La osteonecrosis de los maxilares ha sido descrita en pacientes que toman bifosfonatos y han sido sometidos a cirugía dentoalveolar. Actualmente, la terapia con bifosfonatos e implantes dentales es un tratamiento muy común en adultos.
ObjetivosEvaluar, a través de una revisión de la literatura, si la osteointegración del implante dental podría disminuir en pacientes que toman bifosfonatos orales o intravenosos. Además, se analiza el riesgo que tienen estos pacientes de desarrollar osteonecrosis de los maxilares.
Material y métodosSe realizó una búsqueda a través de la base de datos Medline (PubMed) de los artículos publicados en inglés en los últimos 15 años que incluyeran las palabras clave «bisphosphonates and dental implants», «bisphosphonates and orthopaedic implants» y «osteonecrosis of the jaws and dental implants».
ConclusionesEl tratamiento con bifosfonatos no disminuye la osteointegración del implante dental, aunque estos resultados se han obtenido en base a estudios retrospectivos en humanos. Se han descrito casos de osteonecrosis de los maxilares relacionada con bifosfonatos en estos pacientes, sobre todo tras tratamiento prolongado.
At present, treatment with bisphosphonates and dental implant therapy are frequently used in adults. Bisphosphonate-related osteonecrosis of the jaws has been described in patients with bisphosphonate medication who underwent dentoalveolar surgery.
ObjectivesThe aim of this study was to evaluate, through a literature review, whether osseointegration of dental implants could decrease in patients on intravenous or oral bisphosphonates. The risk of developing bisphosphonate-related osteonecrosis of the jaws in these patients was also analysed.
Material and methodsA search was performed to find the most recent scientific literature (the last 15 years) using PubMed database, with the keywords «bisphosphonates and dental implants», «bisphosphonates and orthopaedic implants» and «osteonecrosis of the jaws and dental implants».
ConclusionsBased on the current literature, it is concluded that bisphosphonate treatment does not decrease osseointegration of dental implants. Nevertheless, these results have been obtained in a retrospective in humans. Bisphosphonate-related osteonecrosis of the jaws has been described in patients on prolonged treatment.
Los bifosfonatos (BF) son potentes inhibidores de los osteoclastos y se utilizan como terapia de primera elección en enfermedades que afectan al metabolismo óseo, como la osteoporosis o la enfermedad de Paget, así como en pacientes oncológicos con hipercalcemia maligna, mieloma múltiple o en aquellos con metástasis óseas procedentes de cáncer de próstata o de mama. Actualmente, se estima en más de 190 millones la cantidad de viales de BF prescritos al año en todo el mundo1.
Los BF, erróneamente llamados difosfonatos en el siglo pasado, han sido empleados desde la segunda mitad del siglo xix. Los primeros registros apuntan a 1865 en Alemania, donde fueron utilizados por la industria química como anticorrosivos debido a su capacidad para evitar la formación de depósitos de calcio en las superficies. Los primeros trabajos sobre BF para el tratamiento en humanos pueden atribuirse al grupo de Fleisch et al.2 en 1966, quienes demostraron el papel de estos como inhibidores de los osteoclastos. En esa misma época, Francis et al. describieron la inhibición de la cristalización del fosfato cálcico in vitro con 2 BF3. Ya en la década de los 90, la U. S. Food and Drug Administration aprobó el uso de distintos BF, como el pamidronato intravenoso (Aredia®) para el tratamiento de las metástasis óseas, o el alendronato (Fosamax®) para la prevención y el tratamiento de la osteoporosis posmenopáusica4. Berenson et al.5 observaron que el uso de pamidronato mejoraba la supervivencia y disminuía las complicaciones óseas. Este y otros estudios llevaron a propugnar el uso de estos fármacos de forma indefinida5–7. La composición química de los BF determina la potencia del fármaco. Los BF presentan en su composición química 2 átomos de fósforo unidos a un átomo de carbono (P-C-P) y 2 enlaces carbono-fosfato. El aumento de un grupo amino al final de la cadena incrementa el potencial del fármaco. Su acción principal consiste en inhibir la reabsorción ósea mediante la supresión de la actividad de los osteoclastos, induciendo la apoptosis de los mismos. En función de la presencia o no de nitrógeno en su molécula se pueden distinguir BF no nitrogenados y BF nitrogenados que, además de inhibir los osteoclastos, inhiben la proliferación celular y la angiogénesis8–10.
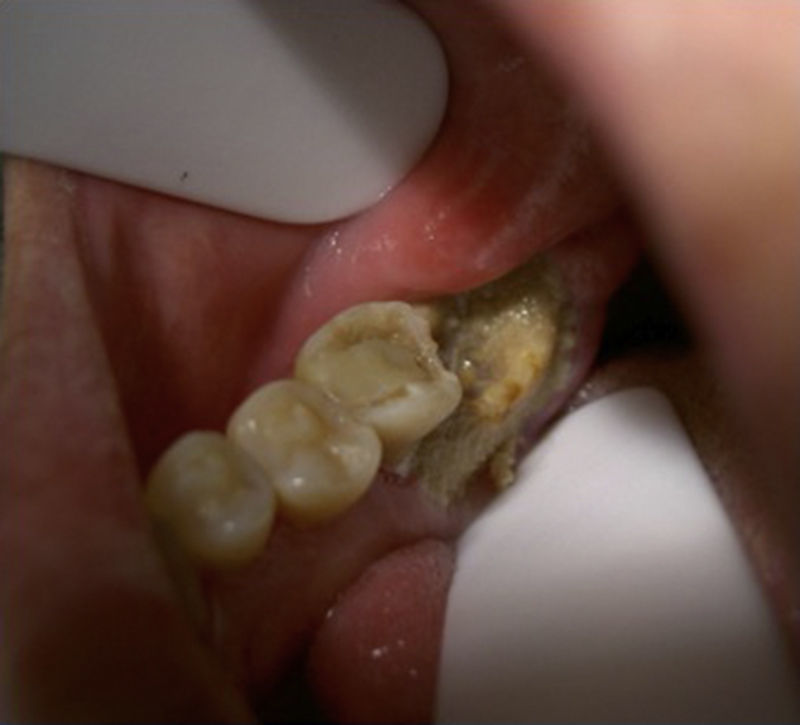
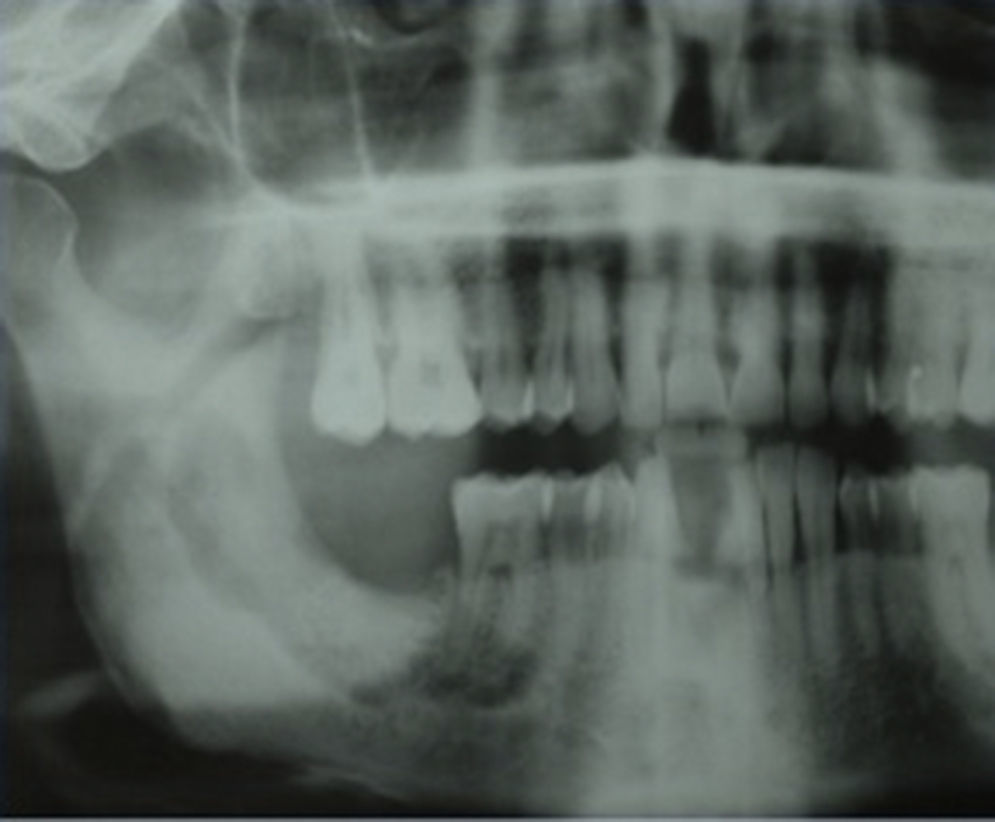
La principal complicación observada es la necrosis ósea de los maxilares (figs. 1 y 2), que depende en gran medida de la potencia y de la vida media de los BF. Los más potentes son el ácido zoledrónico y el pamidronato utilizados por vía intravenosa, mientras que los administrados por vía oral para el tratamiento de enfermedades óseas no malignas (osteoporosis o la enfermedad de Paget), como el alendronato, son menos potentes y lesivos. Los primeros casos de osteonecrosis de los maxilares relacionada con bifosfonatos (OMRB) fueron descritos por Marx en 2003 en una serie de 36 casos11.
Actualmente, la rehabilitación de pacientes con implantes dentales es una alternativa atractiva y eficiente frente a las prótesis dentales fijas o removibles. La necesidad de conseguir una mayor y más rápida fijación del implante al hueso ha motivado el desarrollo de métodos para aumentar la osteointegración. Para ello, se han empleado fármacos y sustancias como factores de crecimiento, proteínas morfogénicas óseas o plasma rico en plaquetas (Zechner et al., 2003)12–14. La utilización de BF para el tratamiento de enfermedades óseas ha suscitado un gran número de estudios en relación con la osteointegración del implante15–17.
Debido a que los implantes dentales y la terapia con BF son un tratamiento muy común en adultos, existe gran interés en conocer si estos pacientes tienen riesgo de desarrollar osteonecrosis o mayor probabilidad de pérdida del implante dental por realizar tratamiento con BF. En el presente trabajo, se evalúa si en los pacientes que toman BF orales o intravenosos podría disminuir la osteointegración del implante dental. Además, se analiza el riesgo que tienen estos pacientes de desarrollar osteonecrosis de los maxilares.
Material y métodosSe realiza una búsqueda bibliográfica a través de la base de datos Medline (PubMed) de artículos publicados en inglés desde 1999 hasta 2013, empleando los siguientes criterios de inclusión:
- -
Artículos en los que el título incluía las palabras clave «bisphosphonates and dental implants», «bisphosphonates and orthopaedic implants» y «osteonecrosis of the jaws and dental implants».
Fueron incluidos estudios experimentales en animales, estudios longitudinales, un ensayo clínico en humanos y una revisión sistemática.
Quedaron excluidos los siguientes estudios:
- -
Estudios con pacientes que desarrollaron osteonecrosis de los maxilares como consecuencia del tratamiento con radioterapia.
- -
Cartas al editor, revisiones históricas y «case reports».
El total de artículos incluidos en la búsqueda inicial fue de 141. Tras analizar los artículos y referencias más relevantes, y teniendo en cuenta los criterios de inclusión, se seleccionaron 39 artículos: 15 estudios experimentales en animales, 22 estudios longitudinales, un ensayo clínico en humanos y una revisión sistemática.
Bifosfonatos e implantes en cirugía ortopédicaLa administración sistémica de BF ha sido estudiada en cirugía ortopédica con el propósito de incrementar la osteointegración de implantes. Varios estudios muestran cómo los BF aumentan la densidad ósea alrededor del implante y la fuerza necesaria para retirar el mismo. Sin embargo, estos resultados solo se consiguen aplicando altas dosis de BF.
Skoglund et al.18 realizaron un estudio sobre pacientes en tratamiento con ibandronato local y sistémico en los que se llevó a cabo la colocación de prótesis ortopédica. Los resultados del estudio confirmaron la capacidad de los BF para incrementar significativamente la densidad ósea y la fuerza necesaria para retirar el implante. Toksvig-Larsen y Aspenberg19 analizaron una serie de 20 pacientes sometidos a la implantación de varios pines en la tibia, de los cuales uno estaba cubierto con BF. Concluyeron que los implantes cubiertos con BF podrían ser usados con éxito en la metáfisis tibial, donde habitualmente los implantes muestran un alto índice de pérdida.
Prieto-Alhambra et al. estudiaron una serie de pacientes sometidos a artroplastia de cadera y obtuvieron una mayor supervivencia del implante en los pacientes en tratamiento con BF20.
Sin embargo, recientemente la U. S. Food and Drug Administration, tras varios estudios21,22, expone el creciente riesgo de sufrir fracturas atípicas de fémur (localizadas justo debajo de las subtrocantéreas) en aquellos pacientes en tratamiento prolongado con BF.
Bifosfonatos e implantes dentalesBifosfonatos administrados localmente y osteointegración del implante dental en estudios con animalesEn recientes estudios con animales se ha demostrado la existencia de un efecto positivo de los BF en la calidad del hueso periimplante23,24. Wermelin et al. observaron que una vez liberado el BF de la superficie del implante, este reducía la actividad osteoclástica, cambiando el recambio óseo en favor de la formación ósea y consiguiendo una ganancia neta en la densidad ósea local25.
Meraw y Reeve26 evaluaron el efecto producido tras la liberación local de alendronato periimplante en un modelo canino, utilizando una combinación de implantes de titanio y de hidroxiapatita cubiertos con o sin alendronato. El examen, realizado mediante histomorfometría, mostró un aumento de densidad ósea. Otro tipo de BF administrados localmente han sido también testados. Ganguli et al.27 investigaron los efectos producidos por implantes de hidroxiapatita recubiertos con pamidronato, clodronato y etidronato. Los autores concluyeron que la unión de hidroxiapatita con los BF incrementaba la síntesis de osteoblastos, estimulando la osteointegración del implante.
Bifosfonatos administrados local o sistémicamente y osteointegración del implante dental en estudios con animalesOtros autores han tratado de comparar los efectos producidos por los BF en función de la vía de administración. Abtahi et al.28, en un estudio sobre ratas, analizaron cómo afectaba el tratamiento con BF orales y sistémicos a la fijación del implante dental. Realizaron 4 grupos en función del tratamiento recibido: dexametasona subcutánea, dexametasona y alendronato de forma sistémica, zoledronato de forma local en el implante y dexametasona, y un grupo control, que no recibió tratamiento. Los 10 animales que recibieron tratamiento con BF sistémicos desarrollaron lesiones necróticas óseas adyacentes al implante. Tras el análisis mediante micro-TC, 9 de las 10 ratas desarrollaron mayor reabsorción ósea periimplante, mientras que el grupo tratado con BF de forma local mostró una mayor densidad ósea en la vecindad del implante. Ayan et al.29 analizaron la osteointegración de los implantes en tibias de conejos tras la administración sistémica de ácido zoledrónico durante el procedimiento quirúrgico. Obtuvieron un aumento de formación ósea periimplante a las 2 semanas con respecto al grupo control, y un incremento a las 4 semanas. Existen otros estudios en concordancia con el referido, en los que se demuestra un efecto positivo en la osteointegración del implante con la utilización de ácido zoledrónico durante la cirugía30–36.
Qi et al.37 analizaron los efectos que producía la osteoporosis inducida en conejos mediante ovariectomía sobre el injerto de hueso autógeno (cresta iliaca), y cómo afectaba a la osteointegración del implante de titanio sobre dicho injerto. Evaluaron si el ácido zoledrónico podía revertir el efecto negativo de la osteoporosis e, incluso, aumentar la fijación del implante en el injerto autógeno sobre la tibia de dichos lepóridos. La muestra fue dividida en 5 grupos en función del tratamiento. Se analizaron parámetros como el porcentaje de contacto implante-hueso, obteniéndose mejores resultados en el grupo tratado con ácido zoledrónico local y sistémicamente y en el grupo no ovariectomizado, mientras que los pertenecientes al grupo doblemente ovariectomizado y no tratados mostraron tasas de osteointegración más bajas. Confirmaron mediante test biomecánico que la fuerza requerida para la retirada del implante era mayor en el grupo tratado con BF de forma combinada.
Bifosfonatos y osteointegración del implante dental en estudios con humanosLa utilización de implantes dentales cubiertos con BF ha sido probada con éxito en ensayos clínicos aleatorizados con humanos. Sin embargo, se ha evidenciado que podría aumentar el riesgo de osteonecrosis, al menos en la vecindad del implante. El estudio llevado a cabo por Abtahi et al.38, donde los implantes cubiertos de pamidronato e ibandronato fueron insertados en el maxilar humano, demostró que la estabilidad del implante dental era mayor con respecto al grupo control, y que empeoraba en los pacientes tratados con BF de forma sistémica. No obtuvieron complicaciones. McKenzie et al.24 observaron que el zoledronato permanecía adyacente al implante, con mínima distribución sistémica.
La asociación entre la ingesta de BF orales y el fracaso del implante dental no ha quedado suficientemente demostrada. Distintos estudios analizaron en profundidad lo planteado anteriormente (tabla 1).
Resumen de estudios seleccionados sobre supervivencia del implante dental en pacientes tomadores y no tomadores de bifosfonatos
| Autor | Número de pacientes | Bifosfonato empleado | Rango de supervivencia, % | ||
|---|---|---|---|---|---|
| BF | No BF | BF | No BF | ||
| Koka et al.39 | 55 | 82 | No mencionado | 99,17 | 98,19 |
| Kasai et al.40 | 11 | 54 | Oral, alendronato | 86 | 95 |
| Grant et al.41 | 89 | 343 | Oral, alendronato, risedronato, ibandronato | 99,5 | 99 |
| Bell y Bell42 | 42 | ? | Oral, alendronato, risedronato, ibandronato | 95 | 96,5 |
| Jeffcoat43 | 25 | 25 | Oral, alendronato, risedronato | 100 | 99,22 |
Koka et al. llevaron a cabo un interesante estudio sobre una muestra de mujeres posmenopáusicas en tratamiento con BF en las que se realizó rehabilitación con implantes dentales. Observaron que la supervivencia del implante en pacientes en tratamiento con BF (99,1%) y sin tratamiento con BF (98,1%) era similar39. Kasai et al. reportaron un 86% de éxito en la supervivencia del implante en pacientes en tratamiento con BF frente al 95% de éxito en los pacientes no sometidos a ninguna terapia. Aunque ninguno de los pacientes desarrolló osteonecrosis, se observó menor osteointegración en pacientes con BF40. Grant et al.41 concluyeron que la terapia con BF no parece afectar significativamente a la supervivencia del implante dental. Similar resultado obtuvieron Bell y Bell en su estudio, donde los pacientes que tomaron BF no desarrollaron un mayor riesgo de fracaso del implante (95 vs. 96,5%)42. Finalmente, el estudio longitudinal llevado a cabo por Jeffcoat reveló que la supervivencia del implante dental en un grupo de pacientes en tratamiento con BF después de 3 años era de un 100%, similar a la supervivencia del implante mostrada por el grupo de pacientes que no recibió tratamiento43.
Sin embargo, Yip et al.44 analizaron en una muestra de 337 mujeres la asociación entre la toma de BF orales y el fracaso del implante dental. Concluyeron que la toma de BF se asociaba con un aumento de fracaso del implante dental, que además era mayor en el maxilar que en la mandíbula. Estos resultados están en concordancia con los obtenidos por el grupo de Kasai et al.40
Osteonecrosis de los maxilares en pacientes sometidos a terapia con bifosfonatos orales e implantes dentalesStarck y Epker45 (1995) publicaron el primer caso de OMRB en un paciente sometido a terapia con implantes dentales. Desde entonces se han descrito un mayor número de casos. En 2007 Yarom et al.46 describieron 3 casos de OMRB en una serie de 11 mujeres que estaban en tratamiento con alendronato. Lazarovici et al.47 aportaron una serie de 27 pacientes en tratamiento con BF que desarrollaron OMRB tras terapia con implantes dentales, 11 de los cuales eran pacientes en tratamiento con BF de larga duración. Kwon et al.48, en un estudio reciente, estudiaron una serie de 19 pacientes en tratamiento con BF (15 de ellos con BF orales) que desarrollaron OMRB tras rehabilitación con implantes dentales. Aunque en este estudio los autores consideraron solo 3 casos desencadenados por la propia cirugía. Jacobsen et al.49 estudiaron una serie de 14 pacientes que desarrollaron OMRB tras tratamiento con implantes dentales; 5 de ellos estaban en tratamiento con BF orales por osteoporosis. Los autores observaron que los implantes dentales localizados en la región posterior de la mandíbula y en el maxilar tenían un mayor riesgo de desarrollar OMRB. Además, en este estudio los autores encontraron inflamación aguda y crónica con presencia de Actinomyces tras analizar histológicamente las áreas de exposición ósea y de infección periimplante. Esta correlación entre OMRB e infección por Actinomyces también ha sido demostrada recientemente por Arranz Caso et al.50 tras analizar una serie de 11 pacientes en tratamiento con BF orales o intravenosos, en los que se halló invasión ósea por bacteria del género Actinomyces. En 6 de los pacientes se consiguió la curación (recubrimiento total de hueso denudado por mucosa adyacente), y en 3, una evolución favorable (recubrimiento parcial) tras tratamiento prolongado con amoxicilina.
López-Cedrún et al.51, en un estudio multicéntrico reciente, aportaron una serie de 9 pacientes en tratamiento con BF orales para la osteoporosis, que desarrollaron OMRB tras realizar terapia con implantes dentales. En concordancia con el estudio de Jacobsen et al.49, la mayoría de las lesiones aparecieron en el sector posterior mandibular y alrededor del implante. El período medio de aparición de las lesiones desde el inicio del tratamiento con BF orales fue de 5 años. Los autores concluyeron que la OMRB en pacientes sometidos a implantes dentales es una complicación que puede aparecer de forma precoz o tardía, sobre todo en pacientes en tratamiento con BF de forma prolongada.
Sin embargo, estudios con grandes series de pacientes demostraron que la incidencia de OMRB en aquellos sometidos a implantes dentales parece ser baja. Goss et al.52 aportaron la información de 46 dentistas de Australia sobre 28.000 implantes en 16.000 pacientes, estimando una prevalencia de OMRB en estos de un 0,89%.
Otros autores ya comentados anteriormente, como Grant et al.41 en una serie de 115 pacientes o como Bell y Bell42 en otra de 42, no reportaron ningún caso de OMRB en pacientes tratados con implantes dentales.
«Drug holiday» en pacientes sometidos a terapia con bifosfonatos orales e implantes dentalesLa Asociación Americana de Cirujanos Orales y Maxilofaciales divide a los pacientes que toman BF en 2 grupos: uno formado por aquellos que han tomado BF orales durante un período inferior a 3 años, quienes serían idóneos para tratamiento con implantes dentales, y un segundo grupo formado por pacientes que han tomado BF orales durante más de 3 años, o por un período inferior a 3 años junto con corticoides. En estos, se recomienda un período de descanso para dicho tratamiento durante 3 meses antes y después de la colocación del implante dental para evitar la osteonecrosis, siempre que el estado general del paciente lo permita1.
Por otra parte, la Asociación Canadiense de Cirujanos Orales y Maxilofaciales recomienda un período de descanso comprendido entre 3 y 6 meses previo a la cirugía y hasta que la curación de la herida quirúrgica intraoral se haya logrado53.
Otros autores son contrarios a detener el tratamiento con BF previo a la cirugía. Khosla et al.54 señalaron que no existe evidencia de que la interrupción del tratamiento con BF orales mejore los resultados, y además, apuntaron que sería bastante improbable que ocurriese un efecto adverso. Koka et al.39 llevaron a cabo un estudio retrospectivo de 82 mujeres posmenopáusicas en tratamiento con BF y 55 sin tratamiento con BF. No observaron signos de OMRB en ninguna de las pacientes. Concluyeron que la «drug holiday» no estaría indicada.
Aunque la indicación de descanso de tratamiento con BF no está clara, algunos autores defienden esta práctica basándose en la determinación de niveles en sangre de telopéptido C-terminal (TCT) para evaluar el riesgo del paciente de desarrollar osteonecrosis, como propusieron Marx et al. en 200755, pues sus niveles en suero son proporcionales a la actividad osteoclástica. Valores normales en pacientes en tratamiento con BF serían de alrededor de 150pg/ml, comparados con los de pacientes osteoporóticos que no toman BF (400pg/ml). Marx et al. recomiendan realizar el test de TCT a los pacientes que vayan a recibir un implante dental y hayan realizado tratamiento con BF durante más de 3 años o menos de 3 años junto con corticoides o quimioterapia. Si el valor es inferior a 150pg/ml, los autores recomiendan diferir la cirugía y parar el tratamiento con BF. Esta correlación entre el TCT y el número y tamaño de áreas necróticas de hueso expuesto ya fue demostrada por Bagan et al. en un grupo de 15 pacientes en tratamiento con zoledronato intravenoso56.
Sin embargo, O’Connell et al.57 consideran que los resultados del test de TCT no son predictivos para el desarrollo de OMRB tras la cirugía oral. Los autores recomiendan no utilizar de forma aislada este test para detener o iniciar el tratamiento en pacientes expuestos a BF.
DiscusiónLos BF son fármacos utilizados con relativa frecuencia para el tratamiento de la osteoporosis o en pacientes con determinados tumores. Inhiben la reabsorción ósea y la angiogénesis, disminuyendo la capacidad reparativa ósea. La cantidad y calidad de este hueso puede disminuir e influir en la osteointegración del implante dental. En estudios experimentales con animales23–27 se ha demostrado un aumento de osteointegración tras tratar localmente con BF los implantes dentales. Sin embargo, si tenemos en cuenta los niveles de evidencia científica, podemos observar que corresponden a un nivel de evidencia muy bajo, por lo que los resultados habría que tomarlos con cautela. En humanos, Abtahi et al.38 obtienen unos resultados similares, que podemos tener en cuenta al tener una mayor fuerza de evidencia científica. Otros autores analizaron la supervivencia del implante en pacientes en tratamiento con BF orales. En estos estudios39–44, a excepción de los resultados obtenidos por Kasai et al.40, la supervivencia del implante osciló entre el 95 y el 100% en el caso de los pacientes en tratamiento con BF, y entre el 96 y el 99% en los pacientes no sometidos a ninguna terapia. Sin embargo, existen varias limitaciones en estos estudios, como son el corto período de seguimiento, de alrededor de 3 años en la mayoría de los estudios, o el limitado número de pacientes en los grupos de tratamiento con BF (oscilando entre los 11 pacientes en el estudio de Kasai et al.40 y los 89 en el de Grant et al.41).
En relación con la aparición de OMRB, se han asociado distintos factores de riesgo. Saldanha et al.58 destacan los relacionados con la potencia de los BF (zoledronato>pamidronato>alendronato>clodronato) y las distintas vías de administración (intravenosa>oral). Si analizamos los factores locales de riesgo, se ha asociado la OMRB sobre todo a la cirugía dentoalveolar (extracción dental), al microtrauma repetido en el hueso y a la enfermedad periodontal. Se han considerado factores de riesgo sistémicos la quimioterapia, la terapia estrogénica y la diabetes mellitus8,58. Existen pocas series publicadas en la literatura reflejando casos de OMRB desencadenados por la colocación de un implante dental. La mayoría son «case reports» o series con escaso número de pacientes (3 casos reportados por Yarom et al.46, Kwon et al.48 publicaron una serie de 19 pacientes o los 27 pacientes aportados por Lazarovici et al.47). Estos estudios tienen una fuerza de evidencia limitada y débil. Un hallazgo común es la localización de la exposición ósea en el sector posterior mandibular (López-Cedrún et al.51, Jacobsen et al.49). Un hallazgo interesante encontrado en esta revisión fue la relación establecida por varios autores entre OMRB e infección por Actinomyces, tras el estudio histológico de las áreas de exposición ósea (14 pacientes en el estudio de Jacobsen et al.49, 11 pacientes en el estudio de Arranz Caso et al.50).
ConclusionesTras realizar esta revisión es posible concluir que, en cuanto a osteointegración, los BF administrados de forma local podrían aumentar la osteointegración del implante dental, con un nivel bajo de evidencia científica, ya que estos resultados se han obtenido en estudios experimentales con animales y en otros campos como la cirugía ortopédica. La mayoría de los estudios llevados a cabo en humanos con resultados similares son retrospectivos y con un período de seguimiento limitado (3 años).
En relación con el desarrollo de osteonecrosis de los maxilares en pacientes sometidos a terapia con BF e implantes dentales, se han referido algunos casos tras tratamiento con BF por vía intravenosa u oral, sobre todo si este se mantuvo de forma prolongada. Otros factores, como la infección por Actinomyces o el tratamiento asociado de corticoides, podrían estar involucrados.
Son necesarios estudios bien diseñados, con un nivel de evidencia científica alto y un número elevado de pacientes para determinar con claridad la influencia de la administración de BF en pacientes sometidos a colocación de implantes dentales, en relación con las tasas de osteointegración y, en mayor medida, con el desarrollo de osteonecrosis de los maxilares.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónLos autores declaran que este trabajo no ha tenido fuentes de financiación.
Conflicto de interesesLos autores declaran que no tienen conflictos de intereses.