Realizar una revisión de la situación actual en el tratamiento del melanoma de mucosa oral (MMO).
Describir el protocolo de tratamiento que haya demostrado mejores resultados dada la experiencia y los estudios realizados por la institución de referencia.
Material y métodosLos autores realizan una amplia revisión de la literatura abordando las nuevas líneas terapéuticas de investigación.
ResultadosDescripción del protocolo de tratamiento que siguen en uno de los centros con mayor cáustica en la literatura internacional.
ConclusionesEl MMO es una neoplasia maligna poco frecuente, con etiología y patogenia desconocida y un pronóstico infausto. El tratamiento debe basarse en un diagnóstico temprano y un abordaje multidisciplinar.
To review the current situation in the treatment of oral mucosal melanoma. To describe the treatment protocol that has shown better results, given the experience and studies by the reference institution.
MethodsThe authors conducted an extensive review of the literature addressing the new lines of therapeutic research.
ResultsDescription of the treatment regimen followed at one of the most experienced centers in the international literature.
ConclusionsOral mucosal melanoma is a rare malignancy with an unknown etiology and pathogenesis and poor prognosis. Treatment should be centered on early diagnosis and a multidisciplinary approach.
El melanoma de mucosa oral (MMO) es una neoplasia maligna poco frecuente derivada de los melanocitos del epitelio de la mucosa de la cavidad oral. Su etiología y patogenia no está clara, lo que unido a su mal pronóstico (la tasa de supervivencia a los 5 años se sitúa en torno al 10-25%)1–3, hacen que el tratamiento de esta enfermedad siga siendo un gran reto.
El carácter pernicioso se debe principalmente al curso insidioso de la enfermedad en estadios tempranos, presentándose como una lesión asintomática de localización poco accesible a la exploración directa. De esta forma, cuando el tumor se diagnostica suele ser al producir dolor local, hemorragia o movilidad dental, momento en el que la enfermedad se encuentra en estadios avanzados con metástasis locorregionales o a distancia.
Dado que la lámina propia de la mucosa oral carece de los límites histológicos de la dermis papilar y reticular utilizados por el sistema de clasificación de Breslow y de Clark para definir la invasión en profundidad del melanoma cutáneo3, hasta hace muy poco se carecía de un sistema de estadiaje del melanoma de mucosa intraoral.
Muy recientemente, el American Joint Committee on Cancer (AJCC), publicó el sistema TNM de estadiaje de estos tumores (tabla 1)4, haciendo posible el establecimiento de criterios pronóstico de la enfermedad que permitirán en los próximos años definir un protocolo de tratamiento internacional.
Clasificación TNM del melanoma de mucosa intraoral de la AJCC
| Primary tumor | |
| T3 | Ucosal disease |
| T4a | Oderately advanced disease. Tumor involving deep soft tissue, cartilage, one, or overlying skin |
| T4b | Very advanced disease. Tumor involving brain, dura, skull base, lower cranial nerves (ix, x, xi, xii), masticator space, carotid artery, prevertebral space, or mediastinal structures |
| Regional lymph nodes | |
| NX | Regional lymph nodes cannot be assessed |
| N0 | or regional lymph node metastases |
| N1 | Regional lymph node metastases present |
| Distant metastasis | |
| M0 | o distant metastasis |
| M1 | istant metastasis present |
| Clinical stage | |
| Stage | II T3 N0 M0 |
| Stage | VA T4a N0 M0 |
| T3-T4a N1 M0 | |
| Stage IVB | 4b Any N M0 |
| Stage IVC | Any T Any N M1 |
La cirugía ha sido hasta el momento el principal tratamiento para el MMO con resección radical tumoral con un amplio margen. La inclusión de otras modalidades de tratamiento adyuvante como la quimioterapia, la radioterapia, las vacunas, y la inmunoterapia (interleukina-2 e interferón), suponen un intento de mejora de hasta un 10% en la tasa de supervivencia global5 y del tiempo libre de enfermedad ante el mal pronóstico en la enfermedad.
A pesar de la modificación de los protocolos de tratamiento con el fin de mejorar el pronóstico de los pacientes MMO, algunas cuestiones del tratamiento siguen siendo objeto de debate.
Material y métodosLos autores realizan una amplia revisión de la literatura abordando las nuevas líneas terapéuticas de investigación, y describen el protocolo de tratamiento que sigue el departamento de cirugía oncológica de cabeza y cuello del Ninth People Hospital de Shangai, en base a su experiencia y los estudios realizados en dicho centro hospitalario.
DiscusiónEl MMO supone el 0,2-8% de todos los melanomas y el 0,26-0,5% de los cánceres orales1–3.
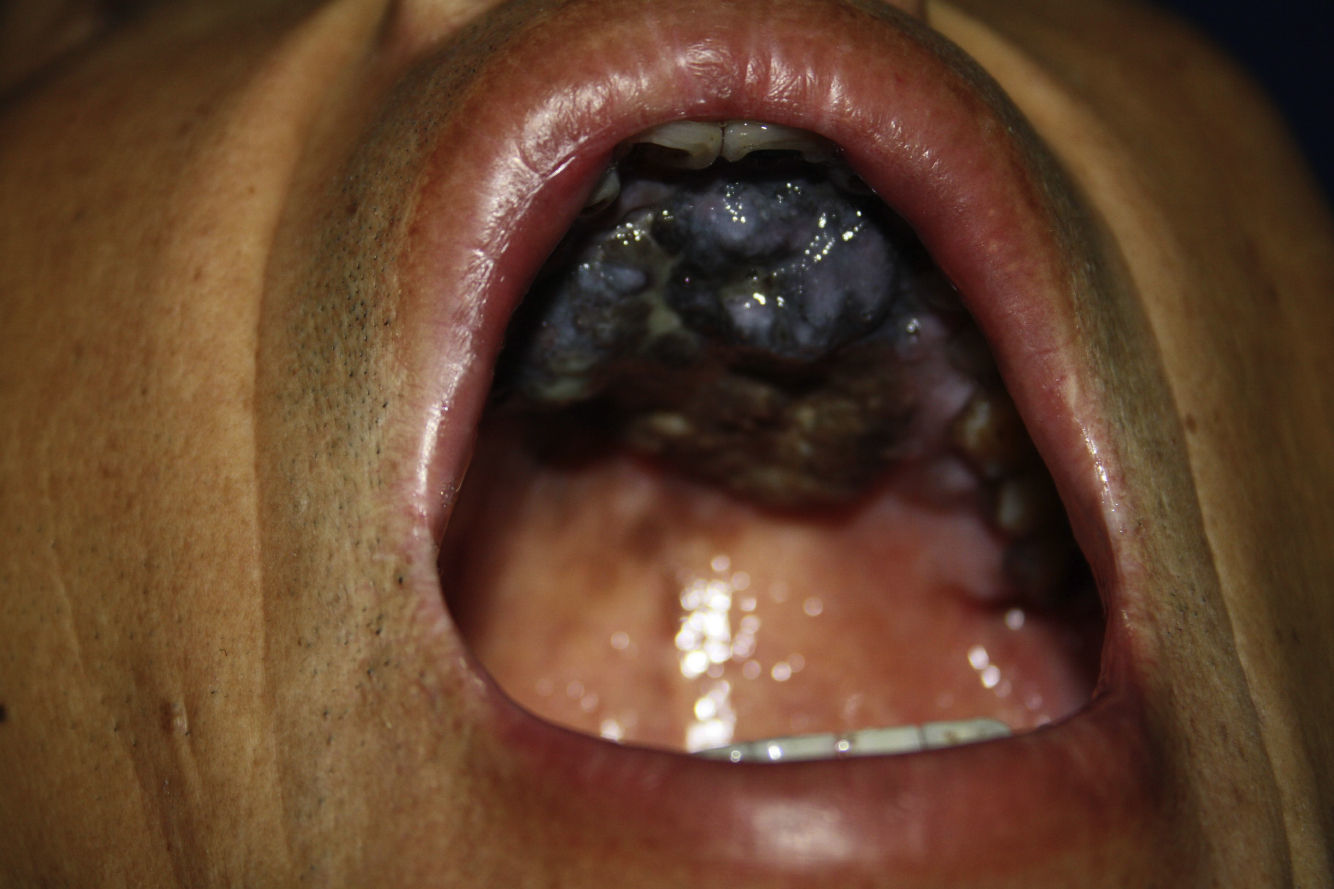
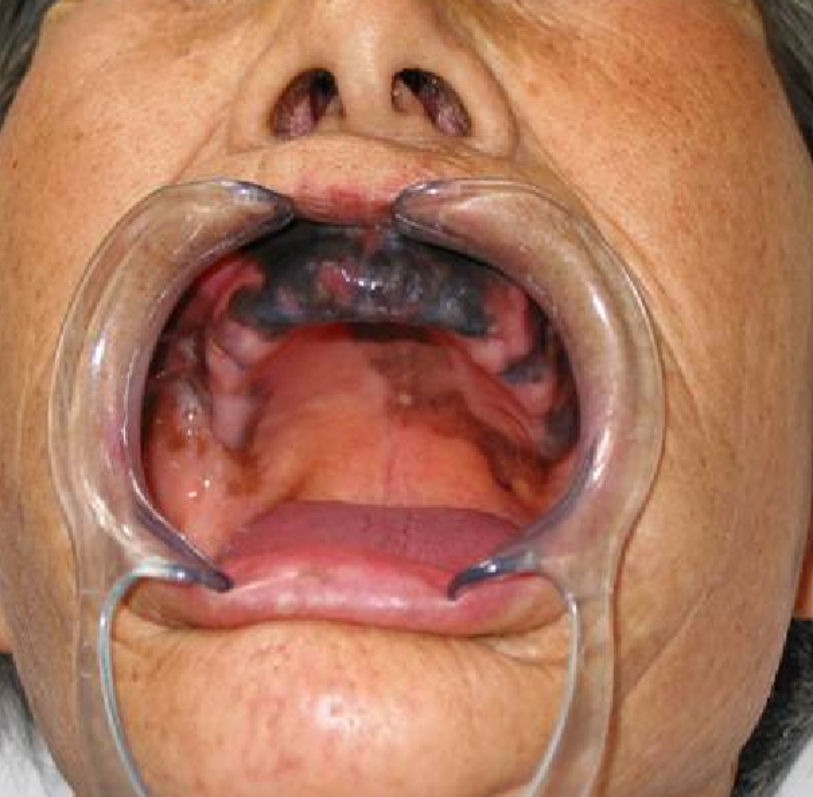
En un informe de la base de datos del Comité de Tumores del Colegio de Médicos de Cirujanos Americanos (National Cancer Database of the Commission on Cancer of the American College of Surgeons) que incluía a 84.836 casos de melanoma cutáneo y no cutáneo de todas las regiones anatómicas, solo 1,3% correspondía a melanoma de mucosas, con un 55% de estos localizados en cabeza y cuello6. Dentro del melanoma de mucosas de cabeza y cuello, la nariz y senos paranasales son los lugares de origen más comunes, seguido de la cavidad oral3, siendo la localización más común en esta última el paladar duro (47%) (fig. 1) y la encía superior (28%) (fig. 2).
Existe discrepancia entre autores respecto a la preferencia de sexo. El pico de incidencia se sitúa en torno a los 60-70 años, pero se han diagnosticado casos incluso en la infancia7.
Clínicamente, el MMO se puede presentar como una lesión macular o nodular con superficie de color de grisáceo, pardo o negro-violáceo, pero el color varía en una amplia gama pudiendo incluso presentarse como una lesión despigmentada.
López et al.8 describen 5 tipos de melanoma intraoral en base al aspecto clínico: melanoma nodular pigmentado, nodular no pigmentado, macular pigmentado, melanoma pigmentado mixto, melanoma no pigmentado mixto.
La característica clínica que suele ser común a todos ellos es que la lesión inicial se encuentra rodeada por lesiones satélite.
Cabe destacar también que el MMO debe diferenciarse en la exploración física de la melanosis o pigmentación mucosa que comúnmente presenta la población de raza negra.
Para poder considerar una lesión como melanoma maligno primario de cavidad oral, el tumor debe evidenciarse clínica e histológicamente, así como debe demostrarse la ausencia de tumor primario en otro lugar (la exclusión de melanoma metastásico es de suma importancia para el abordaje terapéutico y para el pronóstico)9.
Las metástasis a ganglios linfáticos y las metástasis a distancia se presentan con frecuencia en estos pacientes, siendo la diseminación a distancia la principal causa de muerte3.
Muchos estudios2,10–13 afirman de que la escisión quirúrgica con amplios márgenes como tratamiento primario ofrece las mejores posibilidades de obtener un correcto control local y supervivencia. La diferencia entre las tasas de supervivencia para los pacientes con melanoma, tanto cutáneo como el melanoma de mucosas, se relaciona estrechamente con los márgenes quirúrgicos.
La disección del cuello está indicada en pacientes con MMO y adenopatías cervicales14, puesto que la diseminación linfática se correlaciona significativamente con la tasa de supervivencia en este tipo de cáncer12. Sin embargo, todavía existe cierta controversia sobre la disección cervical en cuellos clínicamente negativos.
El objetivo de los estudios realizados con la técnica de biopsia del ganglio centinela (BGC) ha sido identificar a los pacientes en estadío N0 en el momento del diagnóstico, que se beneficiarían de la disección cervical, disminuyendo a la vez el coste sanitario y la morbilidad de los sujetos con MMO que no precisan del vaciamiento ganglionar al obtener una biopsia negativa. Pero el drenaje linfático ambiguo de esta región plantean dificultades singulares para realizar el procedimiento de biopsia de ganglio centinela (BGC) en cabeza y el cuello.
Dos grandes series han demostrado elevadas tasas de recurrencia en ganglios linfáticos previamente mapeados como negativos en la región de cabeza y cuello en relación con otras regiones anatómicas, lo que sugiere una menor especificidad de la técnica15,16. Por otra parte, en las series publicadas de melanoma de cabeza y cuello, no existe una correlación entre la realización de BGC y la supervivencia global17–19.
Considerando que el objetivo de la BGC es disminuir la morbilidad de la intervención, un factor importante a tener en cuenta a la hora de decidir realizarla o no, es si el centro dispone de un análisis intraoperatorio del ganglio centinela por medio de la cuantificación «a tiempo real» de la reacción en cadena de la polimerasa-transcriptasa inversa (reverse transcriptase–polymerase chain reaction [qRT-PCR]). Este procedimiento solventaría el problema de tener que someter al paciente a un segundo procedimiento quirúrgico en el caso de un resultado positivo de la biopsia.
Por lo tanto, a pesar de la adopción general de BGC para el melanoma de las extremidades y el melanoma cutáneo del tronco, sigue habiendo debate en torno a la precisión y el valor pronóstico de la técnica del ganglio centinela en la región de cabeza y cuello.
Llegados a este punto, los autores concluyen que, con respecto al tratamiento de la enfermedad a nivel de los ganglios cervicales y en base a i) la dificultad anatómica del área intraoral para obtener amplios márgenes quirúrgicos libres de tumor, ii) la influencia de las metástasis cervicales en la tasa de supervivencia14, iii) el mal pronóstico de la enfermedad con un alto porcentaje de pacientes en estadios avanzados, y iv) la ausencia de consenso con respecto a la eficacia de BGC en melanoma de cabeza y cuello, parece razonable en el momento actual, someter a los pacientes afectos por melanoma de mucosa intraoral a disección cervical de forma estandarizada.
Los autores, apoyando las conclusiones del estudio de Yang et al.10, abogan por la disección funcional en pacientes con cuello negativo en el momento de presentación y por disección cervical radical en pacientes con cuello positivo.
La cirugía ha sido hasta el momento el principal tratamiento para el MMO, con resección radical tumoral con un amplio margen. Debido al mal pronóstico en la enfermedad avanzada, los cuidados paliativos pueden ser la única opción en estos casos.
La cirugía, que a menudo se encuentra limitada por consideraciones anatómicas y funcionales, no puede en todos los casos llevarse a cabo con amplios márgenes (especialmente para los pacientes con tumores nasosinusales). En esta situación la radioterapia postoperatoria podría ser útil12.
Owens, et al.20 realizaron un estudio en el que demostraron que de 44 pacientes con melanoma de mucosa en región de cabeza y cuello, la adición de radioterapia en aquellos con estadio avanzado (diseminación linfática cervical o metástasis a distancia en el momento del diagnóstico), redujo la tasa de recurrencia local de la enfermedad (p = 0,13), pero no mejoró significativamente la supervivencia (p = 0,73).
Aunque la quimioterapia se utiliza comúnmente en el tratamiento de tumores malignos, el valor terapéutico de la quimioterapia en el melanoma no se ha conseguido clarificar21.
La quimioterapia se ha utilizado desde hace décadas para los pacientes con MMO, con muchos tipos diferentes de agentes quimioterapéuticos tales como dacarbazina, cisplatino, vincristina, nimustina, temozolomida, tamoxifeno22. La combinación de los agentes quimioterápicos como dacarbazina y cisplatino se ha documentado en varios estudios10,22, obteniendo en todos ellos un período de supervivencia significativamente mayor en los pacientes con quimioterapia postoperatoria que en aquellos que no la recibían.
En los pacientes con melanoma cutáneo y de mucosa intraoral en estadio T4N0M0 (estadio iiB de la American Joint Committee on Cancer [AJCC]) y T1-4N1M0 (estadio iii AJCC)4 la enfermedad se encuentran en alto riesgo de recurrencia tras la resección quirúrgica (incluso con amplios márgenes libres de tumor). Estos pacientes, así como los pacientes con recidivas ganglionares regionales, son candidatos para la terapia adyuvante, y en ellos se centró el estudio E1684 realizado por el Eastern Cooperative Oncology Group (ECOG) junto con el Southwest Oncology Group (SOG)23.
El E1684 demostró que la terapia adyuvante con dosis altas de interferón alfa-2b por vía intravenosa (i.v.) durante 4 semanas y por vía subcutánea (s.c.) durante 48 semanas, prolonga significativamente la supervivencia libre de recaída y la supervivencia global en comparación con la observación en pacientes con melanoma de alto riesgo (estadio iiB y iii). En vista de estos datos, altas dosis de IFN alfa-2b fueron aprobados como terapia adyuvante para el melanoma de alto riesgo por la Food and Drug Administration (FDA) en 1995, siendo este régimen administrado actualmente como tratamiento adyuvante de pacientes con melanoma de alto riesgo y es el estándar de referencia para la evaluación de la eficacia de modalidades terapéuticas alternativas.
Pero el mayor impedimento para el uso más generalizado de altas dosis de IFN alfa-2b sigue siendo la aceptación de la tolerancia del paciente. La toxicidad asociada con altas dosis de IFN alfa-2b (principalmente la neurotoxicidad) es lo que ha llevado al desarrollo de terapias inmunológicas alternativas que, por el momento, no han conseguido superar los beneficios del interferón.
Las últimas investigaciones en terapias diana a partir del estudio genético, han demostrado como aproximadamente el 50% de los melanomas presentan mutación del gen que codifica la protein-cinasa B-RAF (BRAF). Este subgrupo de melanomas con la mutación BRAF V600E, activan la vía de la protein-cinasa MAPK que promueve la proliferación celular y previene la apoptosis. Vemurafenib (PLX4032) ha demostrado ser un potente inhibidor protein-cinasa, con especificidad por las células cancerígenas con mutación del BRAF V600E. Este inhibidor oral ha conseguido la regresión tumoral en pacientes con melanoma metastásico y mutación V600 BRAF, en estudios de fase clínica 1, así como un aumento de la supervivencia global en estudios en fase clínica 3 (30).
Por tanto la terapia diana centrada en el oncogén BRAF V600 supone un gran avance y abre nuevas rutas de investigación, al inducir respuesta en la mitad de los pacientes que padecen melanoma metastásico, con una supervivencia media de 16 meses24.
Propuesta de protocolo de tratamientoConsiderando las líneas de investigación establecidas hasta el momento y en función del estadiaje de estos tumores, los autores describen un protocolo de tratamiento basado en la experiencia del Ninth People¿s Hospital de Shanghai, una de las instituciones a nivel internacional, con una casuística de 11-15 pacientes al año con melanoma de mucosa intraoral10.
EstadiajeSegún la clasificación TNM-AJCC 20104, en el melanoma intraoral se omite el tamaño tumoral T1 y T2 y los estadios i y ii al tratarse de un tumor de alta agresividad.
T3: son las lesiones localizadas en epitelio o submucosa, pero por tanto confinadas aún al plano mucoso.
T4a: el tumor se localiza en tejidos blandos de plano profundos, cartílago, hueso o piel.
T4b: invasión de duramadre, base de cráneo, pares craneales, espacio masticador, arteria carótida, espacio prevertebral, estructuras mediastínicas, cartílago, hueso o músculo esquelético.
Tratamiento localResección quirúrgica con 2cm de margen libre.
En tumores de paladar duro y encía superior:
- •
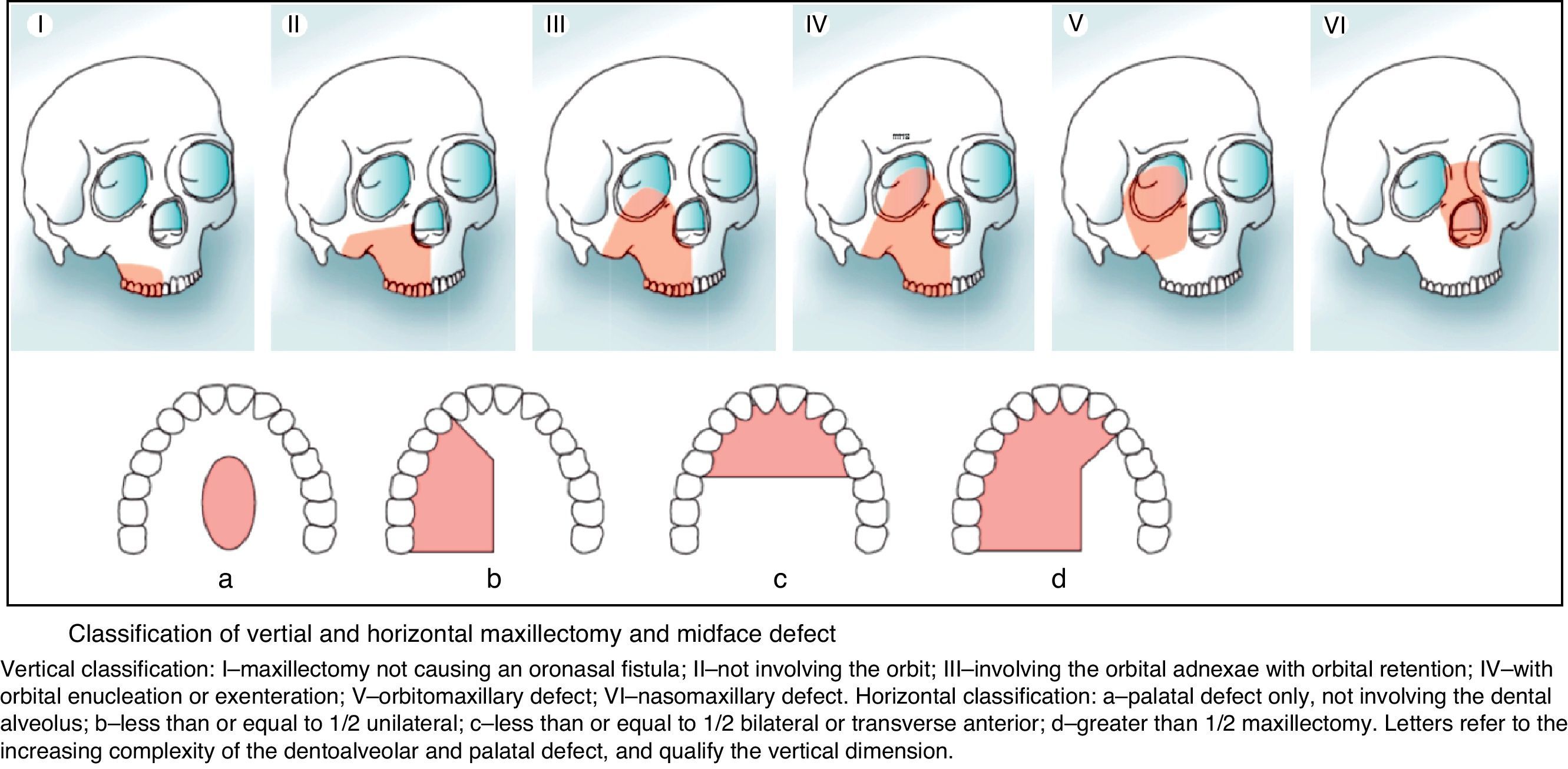
Melanoma T3: realizar maxilectomía subtotal tipo ii, según la clasificación de Brown (fig. 3)25.
- •
Melanoma T4: realizar maxilectomía tipo iii.
En tumores de encía mandibular:
- •
Melanoma T3: mandibulectomía marginal.
- •
Melanoma T4: mandibulectomía segmentaria.
En tumores con cuello clínicamente negativo (N0), disección cervical funcional.
En tumores con cuello clínicamente positivo (N+), disección cervical radical.
Inmunoterapia: en todos los pacientes tras el tratamiento quirúrgico, salvo contraindicación.
HDI (high-dose interferón alfa-2b) en estadios iiB-iii.
IFN alfa-2b; administración intravenosa (i.v.) durante 4 semanas seguido de administración subcutánea (s.c.) durante 48 semanas.
HDI implica 20 megaunidades (MU)/m2/día i.v. 5 días a la semana, durante 4 semanas, seguido de 10 MU/m2 s.c. 3 veces por semana durante 48 semanas.
Se contraindica en pacientes que hayan recibido previa terapia adyuvante con radioterapia, quimioterapia o inmunoterapia (dado el incremento de efectos secundarios y la toxicidad asociada), pacientes menores de 18 años y mujeres embarazadas o en periodo de lactancia.
RadioterapiaLa radioterapia postoperatoria se recomienda en tumores irresecable o en recidivas de pacientes tratados únicamente con cirugía (en este caso la recidiva se tratará con resección quirúrgica más radioterapia). En estos pacientes, la radioterapia aislada no ha demostrado mejoría de la supervivencia ni del tiempo libre de enfermedad por lo que deberá asociarse en todos ellos quimioterapia.
QuimioterapiaEn todos los casos en los que se asocie radioterapia.
Quimioterapia posquirúrgica con el protocolo dacarbazina más cisplatino10:
80mg/m2 de cisplatino el primer día más 250mg/m2 de dacarbazina desde el primer día al quinto día. Tras 2 semanas, el paciente recibe un segundo ciclo (cada ciclo de 21 días).
Se recomienda entre 2-4 ciclos.
SeguimientoEn melanomas de piel y mucosas el seguimiento se realizará
- -
El primer año: cada 2-4 meses.
- -
El segundo año: cada 4-6 meses.
- -
A partir del tercer año: cada 6 meses.
Además de la exhaustiva exploración física, se realizará TC de cabeza y cuello y torácico cada 6 meses. En casos de sospecha de metástasis en pulmón, cerebro o hueso solicitar PET-TC.
ConclusionesEl melanoma de mucosa oral es un tumor de alta agresividad que debe ser considerado como enfermedad sistémica en el momento del diagnóstico dado el alto porcentaje de pacientes que presentan recurrencia locorregional y/o a distancia a corto plazo. Por ello, pese a obtener amplios márgenes quirúrgicos de resección, la disección cervical estandarizada, junto a la adición de terapias adyuvantes, se consideraría una postura terapéutica razonable.
El diagnóstico y tratamiento precoz es la clave para mejorar el pronóstico, de manera que toda lesión macular o nodular que aparezca sobre todo en paladar duro y encía, especialmente en pacientes mayores de 60 años, deberá biopsiarse de forma rutinaria.
La terapia genética, línea de investigación actual, supone un gran avance en la mejora de la supervivencia de la enfermedad.
Derecho a la privacidad y consentimiento informado. Los autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Confidencialidad de los datos. Los autores declaran que en este artículo no aparecen datos de pacientes.
Protección de personas y animales. Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.