La regeneración periodontal es la reproducción o reconstitución de una parte perdida o dañada del periodonto con el fin de restaurar su arquitectura y función. En los últimos años se ha puesto de manifiesto el papel clave que juegan las plaquetas en la regeneración tisular, acelerando la cicatrización tanto de tejidos blandos como duros, mediada por la liberación de citocinas y factores de crecimiento durante un tiempo prolongado. La fibrina rica en plaquetas y leucocitos utilizada por primera vez por Choukroun en el 2001 es un concentrado de plaquetas de segunda generación que se obtiene a partir de la propia sangre del paciente, sin el empleo de aditivos, con el fin de conseguir una malla de fibrina que sirva de andamiaje para las sustancias implicadas en la regeneración. El objetivo de este trabajo es el de realizar una revisión y puesta al día en el uso de esta técnica.
Periodontal regeneration is the reproduction or re-enactment of an injured, or lost, part of the periodontium, with the aim of repairing its architecture and main function. The key role of platelets in tissue regeneration has been demonstrated in the last few years. They accelerate healing in both the soft and hard tissues due to the liberation of cytokines and growth factors over a long period. Leucocyte-rich platelet-rich fibrin, used for the first time by Choukroun in 2001, is a second generation platelets extract that is obtained from the patient's own blood, without the need of additives. Its purpose is to attain an autologous fibrin mesh to be used for as a framework for the substances involved in bone regeneration. The purpose of this work is to present a review and an update on the use of this technique.
Las enfermedades periodontales son muy frecuentes en la población general y se consideran afecciones complejas y de etiología multifactorial que se caracterizan por la alteración y destrucción de los tejidos periodontales1. El término regeneración periodontal se define como la reproducción o reconstitución de una parte perdida o dañada del periodonto con el fin de restaurar su arquitectura y función2,3. Dentro de las investigaciones que buscan comprender los fenómenos de destrucción de los tejidos y la recuperación de los mismos, se empezó a estudiar y utilizar el plasma rico en plaquetas (que a su vez es rico en factores de crecimiento derivados de las plaquetas) por sus propiedades moduladoras y estimuladoras de la proliferación de las células derivadas de células madre de origen mesenquimal. Así, comenzó a usarse para mejorar la regeneración tisular en ciertas especialidades quirúrgicas, para mejorar la curación de las heridas iatrogénicas. Sin embargo, sus aplicaciones actuales se extienden a diversas ramas de la Odontología y la Medicina. Un paso más, con vistas a simplificar la técnica, mejorar los resultados y minimizar los inconvenientes, es la utilización de fibrina rica en plaquetas y leucocitos (L-PRF).
Durante más de 10 años existió una falta de unificación en los términos empleados para definir los concentrados de plaquetas. Dohan-Ehrenfest et al. (2009) realizaron una clasificación de los distintos derivados de plaquetas y los dividieron en 4 familias, dependiendo de su contenido en leucocitos y de su arquitectura de fibrina: plasma rico en plaquetas puro, plasma rico en plaquetas y leucocitos, fibrina rica en plaquetas pura y fibrina rica en plaquetas y leucocitos.
El plasma rico en plaquetas puro (P-PRP) y el plasma rico en plaquetas y leucocitos (L-PRP) son suspensiones de plaquetas líquidas, sin y con leucocitos, respectivamente. Se usan como suspensiones inyectables. Después de su activación (con trombina, cloruro cálcico, batroxobina u otros agentes) se convierten en geles de fibrina con una arquitectura sésil de fibrina.
Por otro lado, la fibrina rica en plaquetas pura (P-PRF) y la L-PRF son biomateriales de fibrina sólidos, sin y con leucocitos, respectivamente. Puede ser natural (L-PRF) o artificial (P-PRF), pero en ambas técnicas la activación de las plaquetas se produce sin la adición a la sangre extraída de sustancias activadoras, dando lugar a una estructura de fibrina fuerte4,5.
¿Qué es la fibrina rica en plaquetas y leucocitos?La L-PRF fue utilizada por primera vez por Choukroun en 20016. Es considerada como un concentrado de plaquetas de segunda generación2,5,7–9. Realmente es un coágulo de sangre autógeno optimizado, del que se obtiene una membrana de fibrina fuerte, formada por células autógenas y enriquecida con factores de crecimiento y proteínas de la matriz10,11.
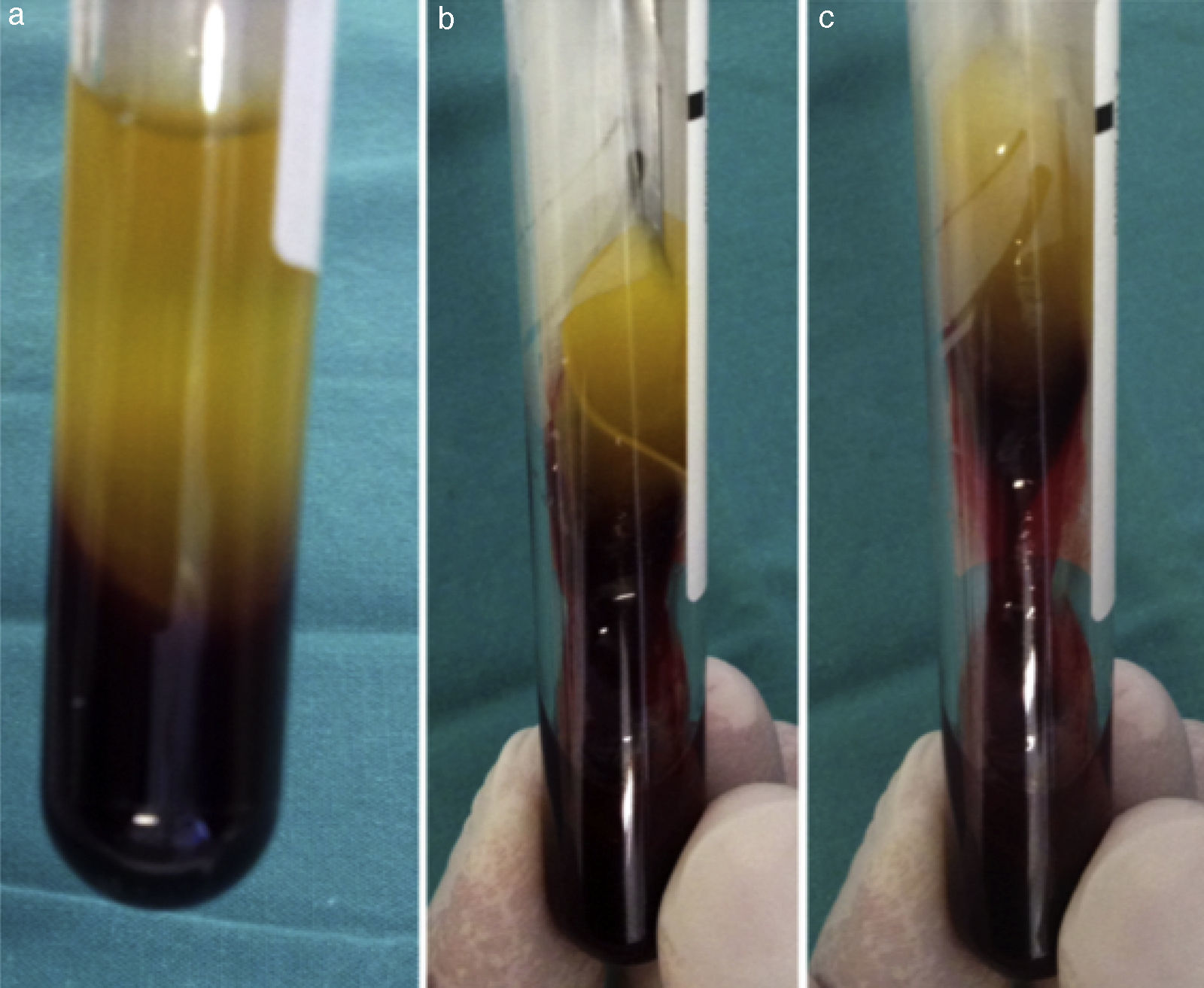
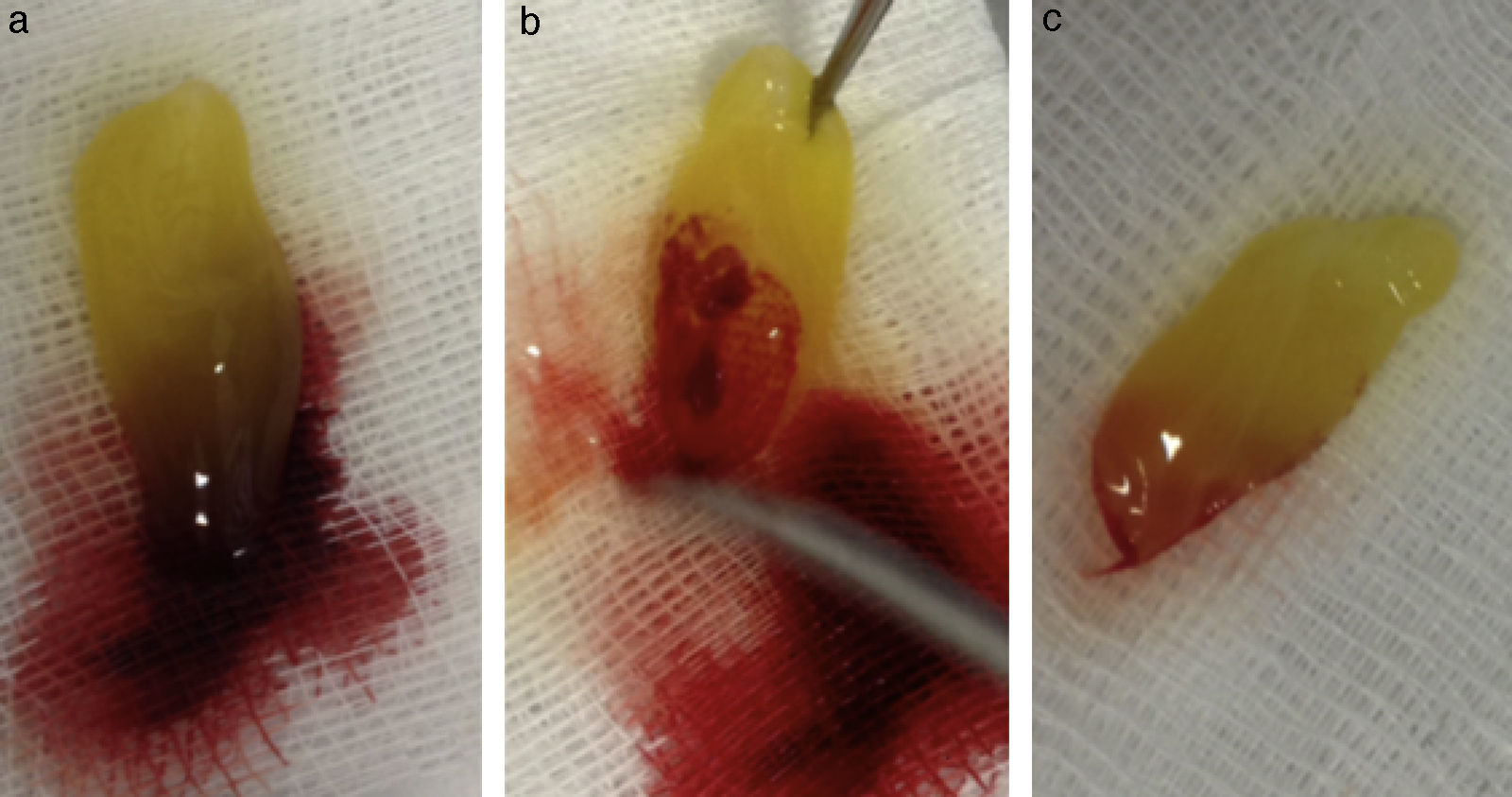
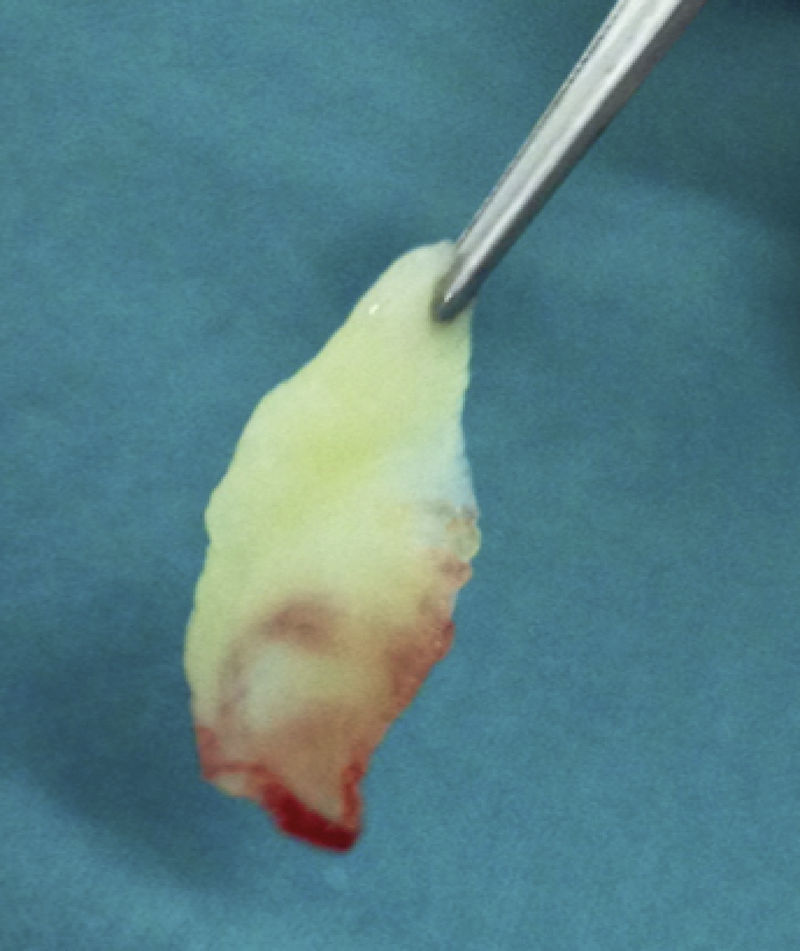
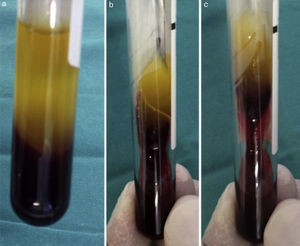
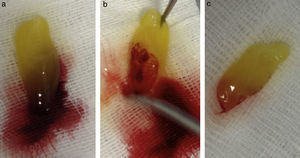
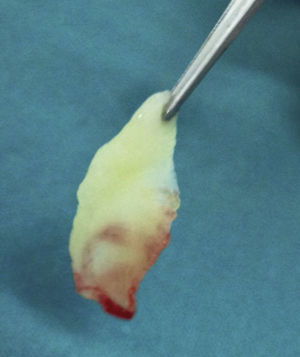
Su técnica de obtención consiste en la extracción de 10mL de sangre de la vena antecubital del paciente (aunque en ocasiones nos veremos obligados a canalizar otra vena) y su inmediata centrifugación sin anticoagulantes a 3.000rpm durante 10min o a 2.700rpm durante 12min2,4,5,9,11–20. Algunos autores recomiendan aumentar la velocidad de centrifugación en pacientes anticoagulados hasta 18min16. Cada tubo de extracción sanguínea equivaldrá a una membrana de fibrina21. La sangre comienza a coagularse inmediatamente al entrar en contacto con las paredes del tubo4,8,11,13,15,18,22. El fibrinógeno se concentra inicialmente en la parte media-alta del tubo de muestra y, posteriormente, la trombina circulante la transformará en fibrina, creando un coágulo de esta que se localizará en la parte media del tubo tras la centrifugación5,13,22; los eritrocitos, en la parte baja y el plasma acelular, en la parte superior13,17 (fig. 1). La sección de la muestra que se recoge es el coágulo de fibrina y plaquetas, una vez que se ha separado de la capa rica en eritrocitos (fig. 2). Se puede insertar directamente en el lecho quirúrgico en esta forma o se puede comprimir mediante la deshidratación del coágulo, de forma que se obtiene una membrana3,17,19 (fig. 3). Esto se puede realizar comprimiendo el coágulo entre 2 gasas estériles empapadas en solución salina, o con la ayuda de instrumental adecuado que permite obtener membranas con un grosor y un tamaño constante8,13,17,18,20–23. Kobayashi et al. (2012) desarrollaron un sistema quirúrgico que consiste en 2 cucharas con un tope en el mango que condiciona una separación de 1mm entre ambas (obteniendo así una membrana de ese espesor). La cuchara que se sitúa debajo tiene orificios para que el líquido que drena del coágulo pueda ser recolectado, ya que contiene una gran concentración de factores de crecimiento y proteínas como vitronectina y fibronectina14,18. Una vez confeccionada la membrana, la parte de esta más cercana a la capa de eritrocitos se colocará hacia el sitio que se quiere regenerar, porque es aquella la que contiene más factores de crecimiento, ya que las plaquetas no se distribuyen de igual modo dentro y en la superficie del coágulo de L-PRF3,14,17.
El coágulo de L-PRF contiene un 97% de plaquetas y más de un 50% de los leucocitos del coágulo inicial (así como linfocitos), dando lugar a una matriz fuerte de fibrina con una distribución tridimensional específica capaz de liberar factores de crecimiento y proteínas implicadas en la curación de heridas durante más de 7 días in vitro, promoviendo la proliferación y diferenciación celular3,10,11,15,18,19,21.
Es importante destacar que los tubos de extracción sanguínea tienen que estar adaptados según la norma ISO 10993 para el uso clínico, ya que los tubos estándar contienen partículas de sílice que pueden inducir citotoxicidad, mutagenicidad, irritación dérmica y hemolisis entre otros efectos indeseables, por lo que su uso se limita únicamente para pruebas in vitro. Por otro lado, la manipulación manual de las membranas puede añadir microorganismos y contaminantes ambientales indeseados previamente a su aplicación, por lo que se recomienda la utilización de cajas quirúrgicas convenientemente esterilizadas7.
El marco regulatorio del uso terapéutico no sustitutivo del plasma autógeno y sus fracciones, componentes o derivados está regido por el artículo 5 de la Directiva 2001/83/CE del Parlamento Europeo y del Consejo, de 6 de noviembre, y por las disposiciones legales que rige dicha Directiva en nuestro país, según aparece reflejado en el Informe/V1/23052013 de la Agencia Española de Medicamentos y Productos Sanitarios.
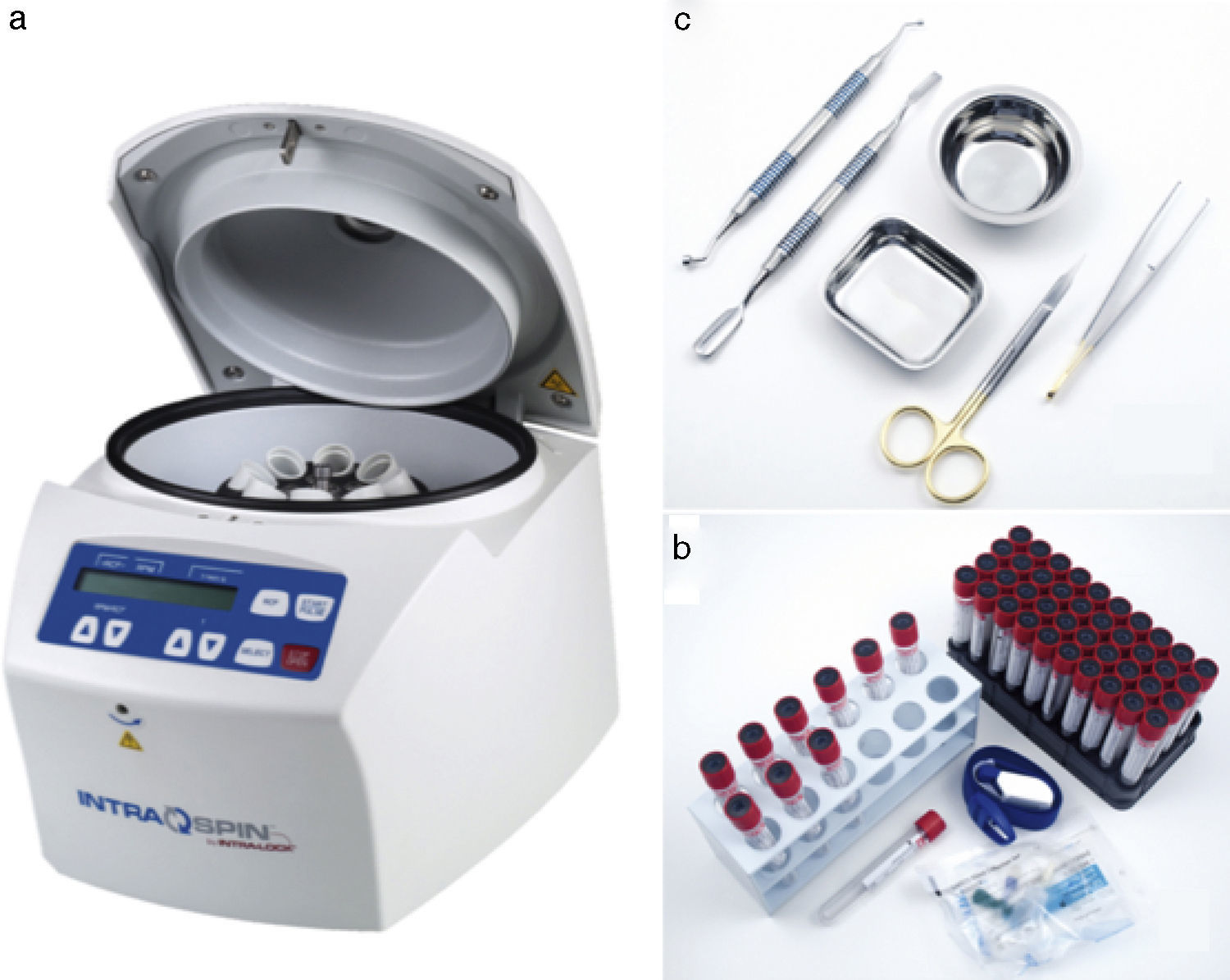
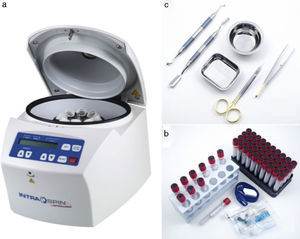
Material necesarioEl material necesario para realizar la técnica de L-PRF se compone de una centrífuga que tenga como parámetros regulables el tiempo y las revoluciones por minuto; un kit de extracción sanguínea; un kit de regeneración tisular (fig. 4); y una caja quirúrgica (fig. 5) (opcional según la técnica que realicemos de las anteriormente descritas).
A. Centrífuga (IntraSpin™, Intra-Lock Iberia). B. Kit de extracción sanguínea (IntraSpin™, Intra-Lock Iberia): incluye envase con 100 tubos de extracción Vacuette®, envase con 24 agujas mariposa y un torniquete libre de látex. C. Kit de regeneración tisular (IntraSpin™, Intra-Lock Iberia): pinza quirúrgica para tejidos, tijeras quirúrgicas curvas, recipiente redondo de acero inoxidable, recipiente rectangular de acero inoxidable, espátula doble portadora de biomaterial y condensador doble de biomaterial.
Aunque ambos productos de concentrados de plaquetas se han utilizado en técnicas regenerativas, las principales características diferenciales pueden verse en la tabla 1.
Diferencias entre PRP y L-PRF
| PRP | L-PRF |
|---|---|
| L-PRF presenta una mayor cantidad de plaquetas y leucocitos, así como de factores de crecimiento tales como PDGF, VEGF y TGF, y cuotas muy representativas de fibrina, fibronectina y vitronectina24,25 | |
| La disposición de la malla de fibrina tiene una estructura tetramolecular24 | La estructura es trimolecular24 |
| Las uniones bilaterales que se forman debido a las altas concentraciones de trombina determinan una malla con una estructura muy rígida24,25 | Su baja concentración en trombina determina una estructura más flexible capaz de favorecer el atrapamiento de citocinas y la migración de células como los leucocitos, que contienen VEGF. Su disposición espacial sirve de sustrato a las plaquetas para atraer quimiotácticamente a células madre circulantes24,25 |
| No se conoce del todo | El contenido exacto y la arquitectura de la membrana son conocidos26 |
| Es usado como una capa de fibrina transitoria añadida en el sitio quirúrgico | Su arquitectura fuerte de fibrina permite su uso como una verdadera membrana o tejido26 |
| Libera rápidamente los factores de crecimiento y su matriz desaparece pronto (durante las primeras 4h). Además, gran parte de su contenido plaquetario se disuelve rápidamente en el lecho quirúrgico5,10,27 | Libera factores de crecimiento y proteínas de membrana durante más de 7 días3,10,11,15,18,19,21 |
| Es un adyuvante farmacéutico transitorio | Es un biomaterial sólido2,8,10,15 |
| Más costoso24,28 | Económico3,8,10,11,13,15,18,20,22,24,28 |
| Técnica lenta y engorrosa. Requiere más fases para su obtención10,27,28 | Técnica rápida (<20min)2,3,10,13,19,28 |
| No existe una estandarización en los diferentes protocolos que han surgido para su elaboración27 | Existe una estandarización en su protocolo de elaboración27 |
| Requiere el uso de anticoagulantes18,24,26–28 | No se emplean aditivos, lo que lo convierte en una técnica estrictamente autógena2,3,13,15,18,22,24,27,28 |
Los fundamentos de esta técnica tratan de aunar y utilizar los efectos positivos de las sustancias implicadas en el proceso de cicatrización, como plaquetas, fibrina y leucocitos, que actuarían sinérgicamente. Además, se multiplica el efecto de la coagulación/regeneración tisular en el sitio quirúrgico mediante un coágulo natural que forma una matriz de fibrina que une los tejidos lesionados, permitiendo así la proliferación y la migración celular, la aposición de la matriz y el remodelado10,15,19. El L-PRF tiene un gran potencial de regeneración natural, acelerando la curación tanto de tejidos blandos como duros3,18,21,29.
Es importante conocer el mecanismo de acción de la cicatrización tisular o la curación de las heridas, en el que podemos distinguir varias fases. En primer lugar, se produce una hemostasia para evitar la hemorragia, mediada por una vasoconstricción y la agregación plaquetaria30. Las plaquetas (o trombocitos) contienen una serie de gránulos, llamados gránulos alfa, que son un reservorio de proteínas activas, particularmente de más de 30 factores de crecimiento, además de péptidos con actividad antibacteriana29. La liberación lenta de moléculas como la trombospondina 1 explica las propiedades antihemorrágicas inmediatas del coágulo de L-PRF11,16. Al final de esta fase se formará fibrina, lo que conducirá a la creación del trombo30. La matriz de fibrina actúa como un andamiaje para células mesenquimales indiferenciadas, facilitando su diferenciación para contribuir a la curación de heridas13,17,18.
Posteriormente se produce una fase inflamatoria: la fibrina expresa receptores CD11c que al unirse a CD18 forman integrinas, que facilitan la adhesión de leucocitos al endotelio vascular. CD11c/CD18 son esenciales para el proceso de migración y activación de muchos leucocitos como los neutrófilos18,30. Los leucocitos principalmente producen citocinas y factores de crecimiento en el lugar de la lesión, como la interleucina (IL) 1ß y la IL-6, y el factor de necrosis tumoral alfa que son proinflamatorios, mientras que la IL-4 es antiinflamatoria9,13,29.
Los monocitos se infiltran en la lesión y se diferencian en macrófagos, que producen colagenasas que actúan limpiando la herida. Estos, junto con los granulocitos, producen mediadores inflamatorios como leucotrienos B4 y el factor activante de plaquetas, que estimulan la vasodilatación y facilitan la producción de citocinas antiinflamatorias y de enzimas proteolíticas. Estos factores actúan sobre células endoteliales vasculares provocando la adhesión de neutrófilos y linfocitos y su migración a los vasos. También se libera el factor de crecimiento transformante ß, que activa los queratinocitos y los factores de crecimiento derivados de plaquetas, IL-1, factor de crecimiento fibroblástico y factor de necrosis tumoral alfa. Estas sustancias estimulan a los fibroblastos para producir colágeno que mejorará la angiogénesis y bloquean la actividad de las proteasas bacterianas3,5,9,11,13,15,18,19,29,30.
A continuación se produce una reepitelización, la formación de nuevos vasos sanguíneos y la síntesis de colágeno. Entre los factores de crecimiento liberados por las plaquetas se encuentra el factor de crecimiento vascular endotelial, que es un promotor de la angiogénesis. Otros serían el factor de crecimiento insulínico tipo 1, el factor de crecimiento fibroblástico, o el factor de crecimiento del tejido conectivo, entre cuyas funciones destacan la promoción de la división, la proliferación y la diferenciación celular, el aumento de la síntesis de colágeno, el estímulo de la angiogénesis y la retirada del tejido necrótico, con el fin de acelerar la reparación y la regeneración tisular. Además, el atrapamiento de células madre en el coágulo de fibrina permite la restauración vascular y tisular5,9,11,13,18,19.
Induce la diferenciación y la proliferación de osteoblastos, estimula la integración y el remodelado óseo, la respuesta mitogénica del periostio produciendo la reparación ósea y estimula la expresión del gen RUNX2 (que codifica proteínas que favorecen la diferenciación osteoblástica), la mineralización de la matriz y la actividad de la fosfatasa alcalina, y disminuye la expresión del inhibidor de la mineralización facilitando la producción de nuevo hueso. Las proteínas morfogenéticas óseas embebidas en la matriz de fibrina son liberadas progresivamente e inducen la producción de hueso ya que son osteoconductoras. Produce también la migración de células del ligamento periodontal y de fibroblastos gingivales. Finalmente, los linfocitos producen factores de crecimiento y contribuyen al remodelado tisular durante esta última fase de la curación3,9,11,15,18,21,29.
Estos productos son liberados en el lugar de la herida de forma lenta y mantenida durante un tiempo prolongado (más de 7 días in vitro)3,10,11,15,18,19,21,26.
VentajasEntre sus numerosas ventajas destaca que es una técnica sencilla y económica y que se realiza rápidamente (en menos de 20min), ya que únicamente precisa una centrifugación2,3,8,10,11,13,15,18,20,24. Es un material natural y fisiológico que no precisa el empleo de aditivos y que además tiene unas propiedades moleculares favorables, que permiten la liberación de factores de crecimiento durante un tiempo prolongado (más de 7 días in vitro)1,3,10,11,13,15,18,19,21,22,26. Todo ello hace que se acelere la curación del sitio quirúrgico y se reduzca el riesgo de contaminación, entre otras cosas porque permite un cierre primario de lechos postextracción amplios3,11,15,16,19,21,29,31. Además, disminuye el edema y el dolor postoperatorio en el paciente, lo que mejora su grado de satisfacción con el tratamiento10,15. Permite la obtención de numerosas membranas simultáneamente con propiedades elásticas y resistentes, lo que las hace fácilmente suturables2,8,10,13,15,19,22,26. Otra de sus principales ventajas es que es inocuo, ya que es preparado a partir de la propia sangre del paciente, eliminando la posibilidad de transmisión de enfermedades parenterales, así como de alergias o reacciones inmunes de rechazo. Todo ello hace que, por tanto, no existan limitaciones éticas para su uso7,10,13,15,16. Desde el punto de vista quirúrgico, es un procedimiento muy ventajoso porque ayuda en la homeostasis, previene la dehiscencia gingival y favorece la curación y el remodelado de las encías, actuando a su vez como barrera que evita que los tejidos blandos circundantes al lecho postextracción interfieran en la cicatrización ósea, pues durante las primeras fases de la cicatrización existe una competencia entre el tejido óseo y el gingival para rellenar el alvéolo, ya que la formación de este último es más rápida10,21,22,31.
InconvenientesEs importante destacar que realmente no existen inconvenientes que desaconsejen el uso de esta técnica. Anteriormente, un parámetro crítico era el tiempo que pasaba entre la obtención de las membranas de L-PRF y su inserción en el lecho quirúrgico, ya que tenía que realizarse inmediatamente porque la sangre una vez que entraba en contacto con las paredes del tubo de recolección comenzaba a coagularse, produciendo una polimerización difusa de la fibrina que conducía a la obtención de un coágulo sin consistencia13. Actualmente, con la utilización de las cajas quirúrgicas de L-PRF se puede retrasar hasta 3h la inserción de las membranas ya preparadas, siempre y cuando no se extraigan de la caja. La cantidad de membranas que se pueden extraer es limitada, ya que proceden del propio paciente; sin embargo, se pueden obtener hasta 8 membranas simultáneamente18,22. Sus usos potenciales son diversos, pero es necesario un mayor conocimiento del biomaterial y de su biología, eficiencia y límites15.
IndicacionesEsta técnica tiene numerosos usos en Odontología, sobre todo en el campo de la Cirugía y la Implantología Oral y la Periodoncia, así como en el campo de la Cirugía Maxilofacial, ya que acelera la curación tanto de tejidos blandos como duros y ayuda en la homeostasis3,11,16,18,21,29. Por todo ello es interesante su uso en pacientes con trastornos de la coagulación, así como en lechos quirúrgicos infectados o en pacientes cuyas condiciones médicas condicionan un retraso en la cicatrización (por ejemplo, diabetes mellitus, inmunodepresión, etc.)15,16. Dinca et al. (2014) usaron L-PRF en pacientes con osteonecrosis maxilar/mandibular estadio ii (según la clasificación de Ruggiero) tras terapia con bifosfonatos intravenosos en alvéolos postextracción32,33. La muestra empleada fue pequeña y el estudio presentaba limitaciones, pero en ninguno de los 10 casos estudiados hubo complicaciones postoperatorias y tras 30 días no hubo evidencia de exposición ósea32. El uso de L-PRF en pacientes con osteonecrosis de los maxilares relacionada a tratamiento con bifosfonatos parece esperanzador debido a la asociación de esta afección con una supresión del remodelado óseo, efectos antiangiogénicos, una reducción de la respuesta inmune y toxicidad de los tejidos blandos; sin embargo, son necesarios más trabajos de investigación para confirmar su efectividad34.
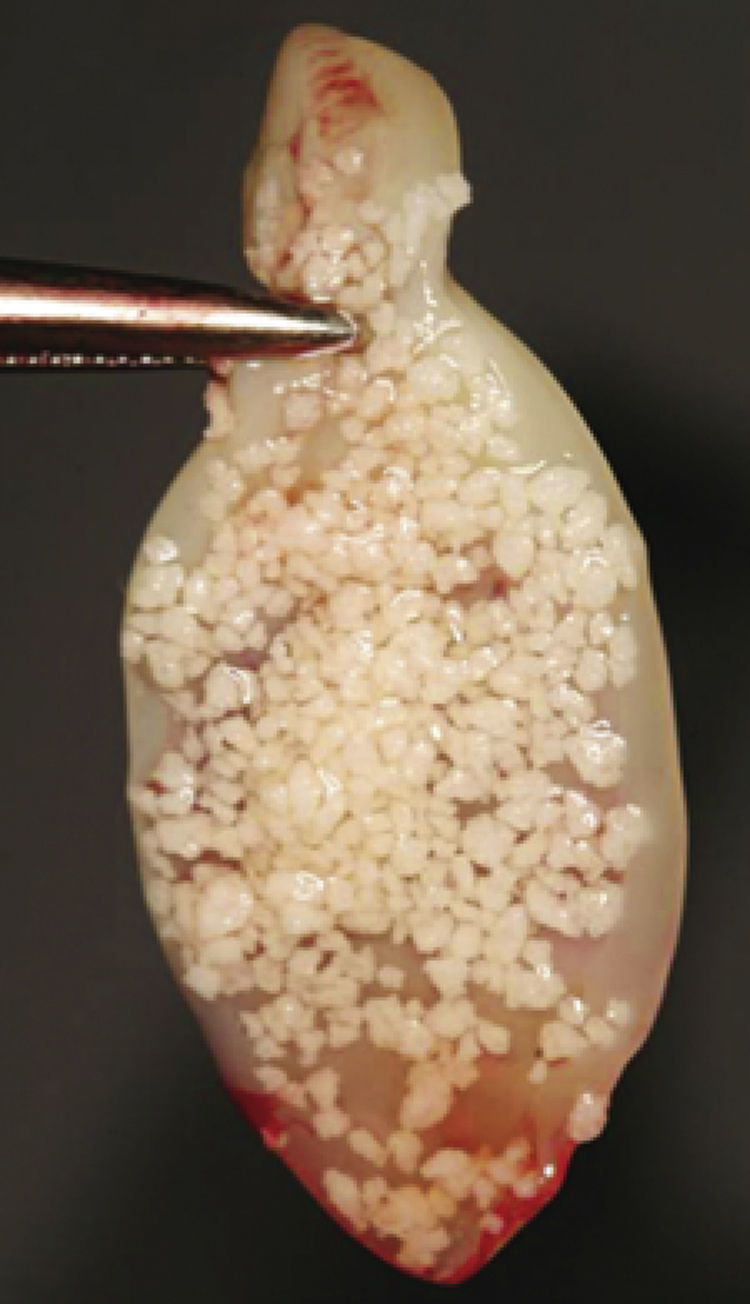
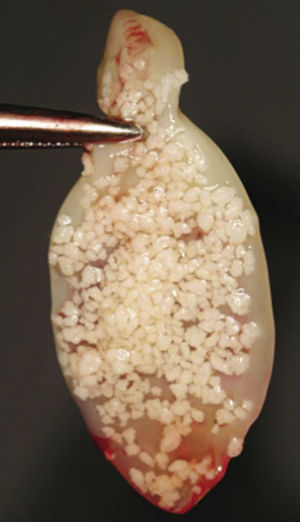
Se ha descrito su utilización en alvéolos postextracción o postavulsión como único material para preservar el alvéolo, demostrando la formación de hueso tras 6 semanas sin signos de reabsorción ósea23. Su uso aislado en alvéolos se recomienda cuando las paredes están intactas. Cuando una o más paredes están ausentes o dañadas, es recomendable usar L-PRF en combinación con sustitutos óseos, demostrando a su vez un excelente comportamiento como conector biológico entre las partículas óseas3,15,18,35 (fig. 6). Estudios clínicos muestran que los alvéolos postextracción tratados con membranas, con o sin injerto óseo, tienen mayores dimensiones de reborde comparados con los lechos que no son tratados de este modo31. También se ha visto su eficacia en el control del dolor y el edema postoperatorio en la extracción de terceros molares impactados36.
Actúa como barrera biológica facilitando el cierre primario del lecho quirúrgico, protegiéndolo de agresiones externas y acelerando la cicatrización. Se ha empleado en el tratamiento de lesiones combinadas periodontales y endodónticas, en la corrección de defectos de furca, así como en elevaciones de seno como único material de relleno con colocación inmediata de implantes2,15,28,35,36. En algunos estudios se ha descrito una ganancia de 7 a 13mm, sin pérdida implantaria y logrando unos porcentajes de éxito, a los 6 meses, del 100%11.
También se ha empleado como material de injerto para cubrir el lecho del paladar utilizado como zona donante en cirugía mucogingival para tratar recesiones radiculares unitarias o múltiples. Con esta técnica disminuye el tiempo de reepitelización del paladar de 3-4 semanas a 18 días, y si se compara con la curación por segunda intención, se reducen el dolor y las molestias postoperatorias2,8,37. También se ha empleado en otros campos, como la cirugía plástica, la otorrinolaringología, y en medicina deportiva11,20.
ConclusionesEl empleo de L-PRF constituye una técnica simple y eficaz que permite acelerar la curación de tejidos blandos y duros. La principal ventaja es que utiliza la propia sangre del paciente, lo que reduce las posibles reacciones inmunes de rechazo y la transmisión de enfermedades por vía parenteral. Sus posibles usos son diversos, tanto en el campo de la Odontología como en otras áreas, pero es necesario un mayor conocimiento del biomaterial, y de su biología, eficiencia y limitaciones.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónLos autores del presente artículo confirman que no existe ninguna fuente de financiación por parte de Intra-Lock Iberia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.