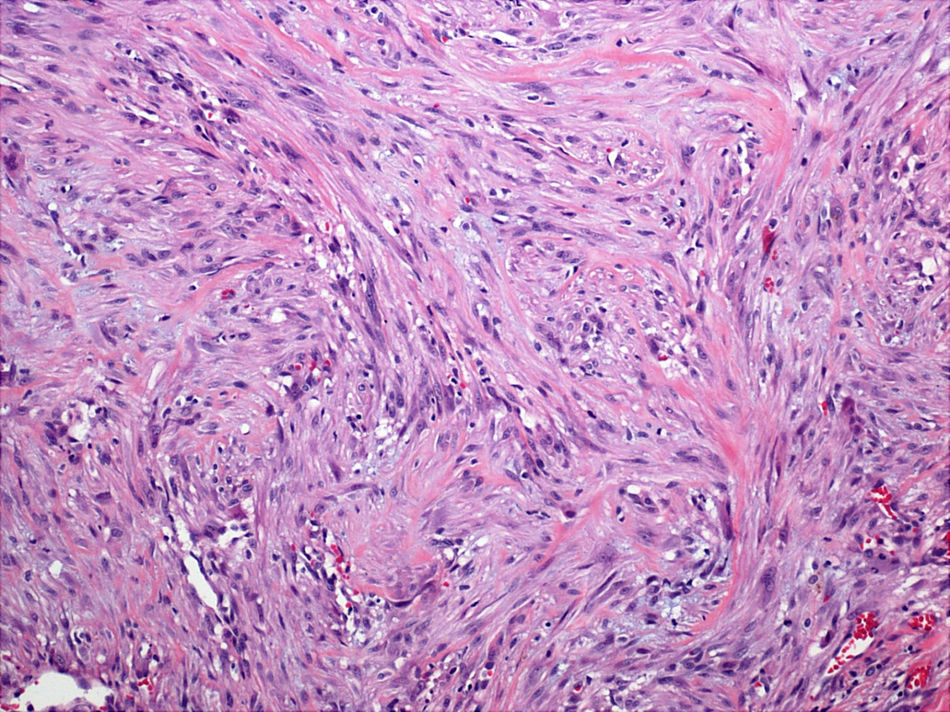
Se realizó una extirpación completa de la lesión con un margen amplio de seguridad, que incluyó un segmento de piel de 5×5cm y los dos tercios inferiores del músculo esternocleidomastoideo, junto con un vaciamiento cervical selectivo ipsilateral de los ganglios de los niveles cervicales II, III y IV. El informe definitivo de la anatomía patológica fue: «sarcoma miofibroblástico de bajo grado (miofibrosarcoma) de 2cm de diámetro que no afecta a los planos de resección bajo cicatriz hipertrófica subcutánea. Ganglios yugulares con linfadenitis reactiva inespecífica. Las características morfológicas de la neoplasia, así como su perfil inmunohistoquímico, son superponibles a los referenciados en el informe original de su Hospital de procedencia» (fig. 1).
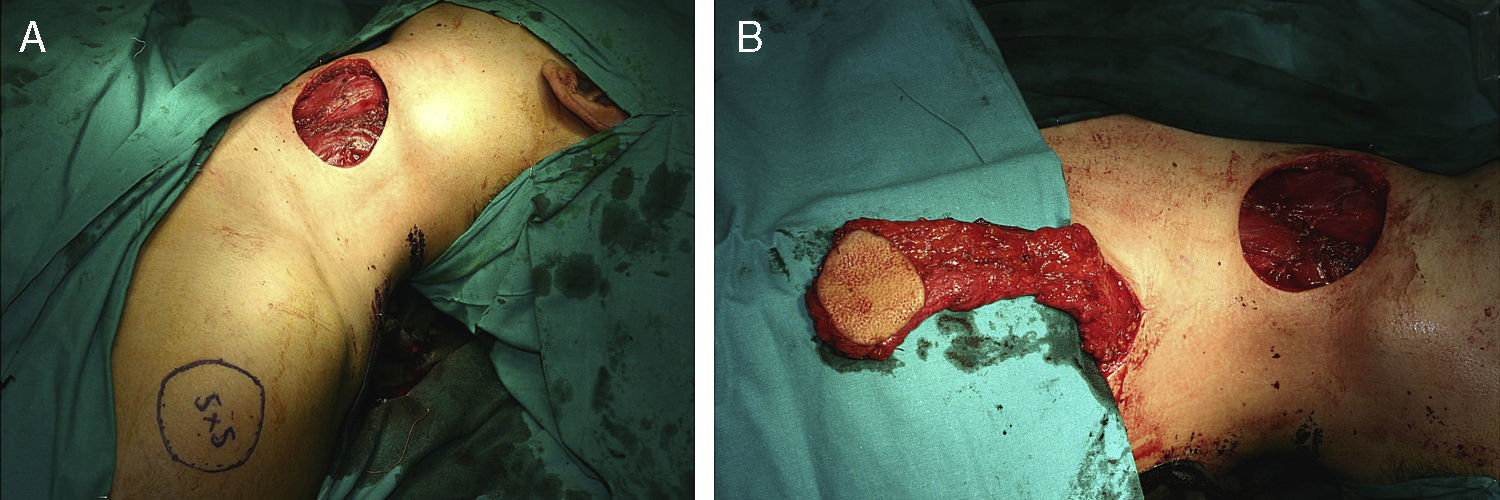
En el mismo acto quirúrgico se llevó a cabo la reconstrucción primaria del defecto con un colgajo fasciocutáneo supraclavicular tunelizado en isla (figs. 2A y 2B). Se diseñó una paleta cutánea de 6-7cm de ancho de morfología circunferencial sobre la piel del hombro y de la región supraclavicular. El colgajo se elevó desde lateral a medial, y de distal a proximal, en un plano subfascial. Se localizó el pedículo supraclavicular en la parte más inferior a nivel subfascial, haciendo un túnel subcutáneo en la parte superior hasta el origen de la arteria supraclavicular, punto sobre el cual se pivotó el colgajo. Finalmente, el colgajo fasciocutáneo se trasladó, a través del túnel, al defecto creado. La zona donante se cerró de forma primaria.
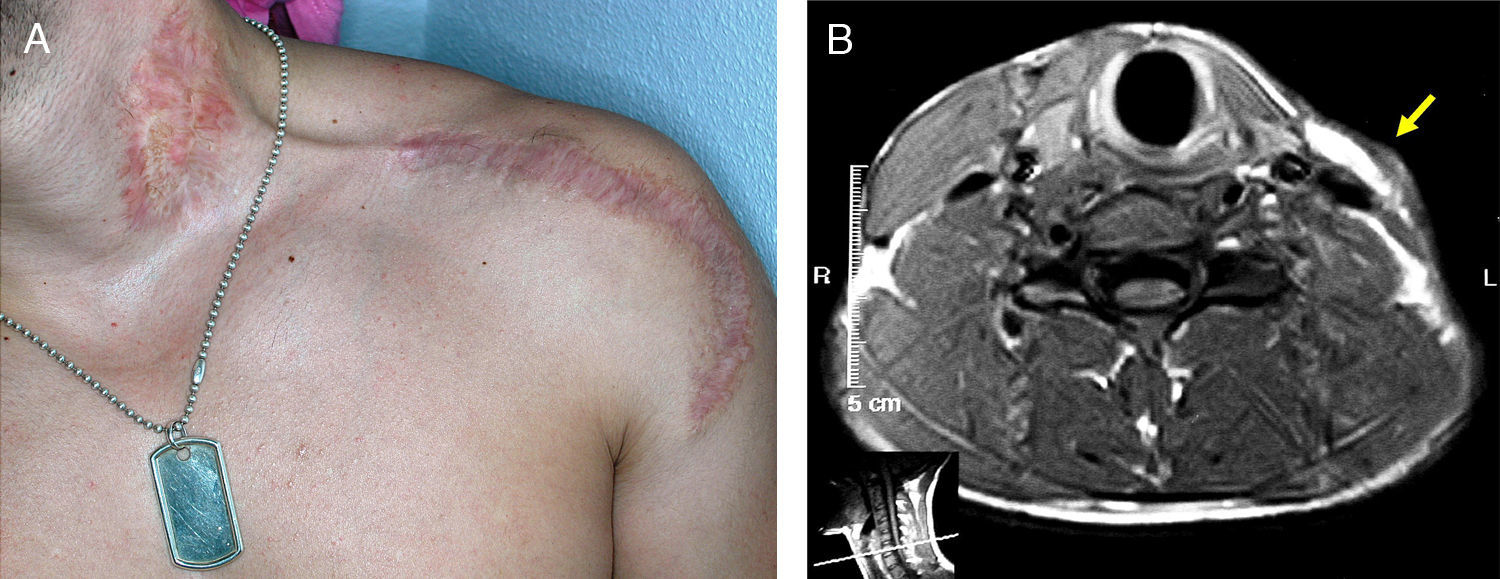
El resultado funcional ha sido excelente desde el primer momento, tanto de la zona donante como receptora, sin ninguna morbilidad, y contando con la edad del paciente, no ha representado ninguna merma en su actividad diaria (fig. 3A). Desde el punto de vista estético el resultado ha sido bueno, aún cuando el paciente ha desarrollado una cicatriz hipertrófica (el paciente tiene tendencia a la cicatrización queloide). Ha sido revisado periódicamente en nuestras consultas realizándose controles clínicos y radiográficos durante un tiempo de seguimiento de 5 años, sin encontrar recurrencia de la enfermedad (fig. 3B).
El miofibrosarcoma de bajo grado cervical es una lesión poco frecuente, puesto que se han descrito alrededor de medio centenar de casos en la literatura1. La edad de aparición se sitúa entre 9-75 años, aunque principalmente se presenta en torno a los 40 años de vida. Tiene un ligero predominio en el sexo masculino. En nuestro paciente la edad de presentación es algo inferior a la media, aunque se han descrito casos en pacientes más jóvenes. El tamaño de la lesión puede variar desde 1,5 a 17cm1, nuestro caso presentaba una tumoración indolora fija de 3cm de tamaño aproximado. Puede aparecer en el subcutáneo de tejidos blandos o en la submucosa, pero la mayoría de estas lesiones se hallan en profundidad, incluso algunas de ellas son intraóseas. Se localiza más frecuentemente en extremidades, tronco, y en cabeza y cuello en un tercio de los casos (incluyendo lengua, cara, cuello y huesos maxilares), por lo que la localización cervical de nuestro paciente no constituye una localización atípica de este tipo de tumores. Son tumores no capsulados y en la mayoría de las ocasiones son infiltrantes. Aunque de lento crecimiento, por su capacidad infiltrativa tienden a la recurrencia local, si bien raramente metastatizan. La tasa estimada de recurrencia local es del 27%1.
Histológicamente, la mayoría de los casos se caracterizan por un patrón de crecimiento infiltrante difuso, y en profundidad las células tumorales pueden crecer entre las fibras musculares esqueléticas. Las células neoplásicas se disponen generalmente formando fascículos o pueden mostrar un patrón de crecimiento en forma de huso. Es importante destacar que estas células muestran una moderada atipia nuclear, al menos focalmente, con núcleos hipercromáticos, alargados e irregulares, así como un aumento de la actividad proliferativa. El inmunofenotipo celular de los sarcomas miofibroblásticos es variable; la mayoría expresan actina de músculo liso y calponina, y algunas de ellas desmina2. Además, las células tumorales pueden teñirse positivamente para la fibronectina y vimentina, y expresar CD34 y CD99; por el contrario, las células tumorales son negativas para las proteínas S100 y los marcadores epiteliales. El estudio inmunohistoquímico de nuestro paciente informaba de células que expresaban actina de músculo liso, pero no desmina (lo que es bastante frecuente en estos tumores), además se teñían positivamente para la vimentina, CD31 y CD34. El análisis de la recurrencia local no suele mostrar un incremento en la celularidad de la lesión, su actividad proliferativa o su grado de atipia, comparada con la lesión primaria2.
El diagnóstico diferencial del sarcoma de bajo grado miofibroblástico se ha de establecer con lesiones tanto benignas como malignas. Entre las benignas se incluyen la fascitis nodular y la fibromatosis, las cuales pueden mostrar inmunofenotipos similares. Entre las variedades malignas, hay que llevar a cabo el diagnóstico diferencial con tumores miofibroblásticos, miofibroma/miofibromatosis, miopericitoma, fibrosarcoma y el leiomiosarcoma. En última instancia, otros tumores a considerar en el diagnóstico diferencial son el melanoma, sarcoma sinovial monofásico, los tumores malignos de nervios periféricos y el rabdomiosarcoma. El diagnóstico definitivo de estos tumores se basa en datos tanto clínicos como morfológicos. La inmunohistoquímica tiene un papel complementario y limitado, aunque un amplio estudio inmunohistoquímico puede ser de gran utilidad para excluir el leiomiosarcoma y el fibrosarcoma entre los posibles diagnósticos diferenciales.
La rareza de estos tumores hace que la experiencia terapéutica en este campo sea muy limitada. Durante años no han constituido una entidad como tal, aunque a partir de la serie de 18 casos presentada por Mentzel et al en 1998, los miofibrosarcomas se han reportado con más frecuencia en la literatura2. Aunque son tumores de bajo grado, exhiben un patrón de propagación localmente agresivo, por lo que el fundamento del tratamiento lo constituye la cirugía agresiva con márgenes de seguridad. La linfadenectomía no está indicada a menos que haya ganglios positivos. Se puede combinar con radioterapia y quimioterapia. Esto permitiría controlar la enfermedad, evitar recidivas y metástasis; aun cuando las recidivas locales son comunes, las metástasis se producen sólo en raras ocasiones y después de un período de tiempo prolongado libre de enfermedad. El seguimiento de estos tumores está escasamente documentado aunque se han descrito metástasis óseas, pulmonares y en partes blandas de miofribrosarcomas de bajo grado localizados en pared torácica3.
Se dispone de un gran abanico de opciones para la reconstrucción de defectos extensos de partes blandas en cabeza y cuello. Hasta la década de los 70, la reconstrucción se centró en los colgajos loco-regionales. El desarrollo de la transferencia de tejido libre y las técnicas microquirúrgicas en los años 80 inauguró una nueva era en la cirugía reconstructiva de esta región. Sin embargo, pese a que los colgajos libres son en la actualidad de primera elección, pueden conllevar una alta tasa de complicaciones y el resultado estético puede quedar condicionado por la morbilidad en la zona donante. Por ello, los colgajos regionales constituyen una buena alternativa debido a su fiabilidad, su menor complejidad técnica y a la reducción del riesgo de complicaciones asociadas. La región del hombro nos proporciona una piel de características óptimas, al ser muy similar a la del cuello y la cara. La vascularización principal de los colgajos de patrón axial de la región del hombro proviene de: arteria cervical transversa, arteria acromiotorácica, ramas perforantes de la arteria mamaria interna y la arteria supraclavicular. Tras un examen exhaustivo de la vascularización de este territorio anatómico, Lamberty describió en 1979 un colgajo supraclavicular de patrón axial4. No fue hasta 1997 cuando Pallua et al5 utilizaron este colgajo con éxito en ocho casos de reconstrucción contracturas mentoesternales post-quemadura. Estos autores realizaron también un detallado estudio anatómico del colgajo que, desde entonces, se ha utilizado ampliamente. Pallua y Noah6 lo emplearon para reconstruir defectos en mejilla, mentón, cuello y tórax, y recientemente se ha utilizado en el tratamiento de perforaciones esofágicas cervicales7 y defectos de hemicara8. En 2010, Chen et al9 han publicado una serie de 24 pacientes afectos de carcinoma escamoso oral reconstruidos en este colgajo con una tasa de éxito del 95,8%.
Este colgajo ofrece varias ventajas: (i) su disección no supone gran complejidad técnica, y por tanto, requiere un tiempo operatorio relativamente corto; (ii) la zona donante del colgajo está en el mismo campo operatorio y se puede realizar un cierre de forma primaria; (iii) el colgajo se puede transferir con facilidad y tunelizarlo subcutáneamente hacia el defecto de la cabeza y el cuello. La maniobra de tunelización mejora significativamente la cicatriz de la zona donante, que puede cerrarse de modo primario en colgajos de hasta 16cm. La gran longitud del pedículo (17-20cm) nos permite usar este colgajo para la reconstrucción de regiones torácica, cervical, lengua y suelo de boca, mentón y mejillas6; (iv) el pedículo del colgajo contribuye además a cubrir el defecto creado por el vaciamiento cervical y protege los vasos del cuello; (v) el colgajo se puede usar en pacientes previamente radiados, aunque no se recomienda la tunelización del mismo bajo tejidos radiados o cicatrices previas, y (vi) la morbilidad de la zona donante es baja.
En nuestro caso, el colgajo supraclavicular en isla, gracias a sus características de color, grosor y textura, constituía una opción reconstructiva válida y fiable para el defecto cervical. Nuestro paciente no había sido radiado con anterioridad, ni hubo que someterlo a linfadenectomía cervical radical, situaciones ambas que, junto con la aparición de anomalías vasculares, podrían contraindicar dicho colgajo. La morbilidad en la zona donante del hombro fue mínima, y aunque no se observó afectación de la movilidad del miembro superior, sí se puede apreciar un ensanchamiento de la cicatriz de la zona donante.