Los sarcomas mandibulares representan una entidad de difícil estudio por su escasa incidencia e histopatología.
Pacientes y métodosPresentamos la experiencia del servicio de Cirugía Oral y Maxilofacial del Hospital Vall d’Hebron de Barcelona en los últimos 10 años (2001-2010) en el manejo de los sarcomas mandibulares, realizando una revisión retrospectiva de 12 casos de pacientes afectos por este tipo de tumor.
ResultadosLa técnica más utilizada para la reconstrucción fue el colgajo microvascularizado (hueso peroné: 8/12), recibiendo tratamiento adyuvante (quimioterapia y/o radioterapia) el 82% de los pacientes. Cinco pacientes fallecieron (42%), 2 se encuentran con progresión de la enfermedad (16%) y 5 sobreviven libres de enfermedad (42%) hasta la finalización del seguimiento.
ConclusionesLos casos descritos representan una serie singular debido a la localización mandibular, no antes publicadas en la literatura. Aún así, los resultados obtenidos en términos de supervivencia y factores pronóstico son similares a los descritos para los sarcomas de cabeza y cuello. La consecución de márgenes libres con la cirugía es la clave del tratamiento, siendo necesario el tratamiento complementario para mejorar el pronóstico.
Sarcomas located in the mandible are difficult to study due to their relatively rare appearance and histology.
Patients and MethodsWe present the experience of the Oral and Maxillofacial Surgery Department of the Vall d’Hebron Hospital in Barcelona over the last 10 years (2001-2010) in the management of jaw sarcomas, performing a retrospective review of 12 cases of patients affected by this type of tumour.
ResultsThe technique mostly used for the reconstruction was the microvascularised bone graft (fibula: 8/12), with 82% of the patients receiving adjuvant therapy (chemotherapy and radiotherapy). Five of the patients died (42%), two were found with disease progression (16%), and 5 survived free of disease (42%) until the end of follow-up.
ConclusionsThe cases described are a unique series due to the mandibular location. Prognostic factors and survival rates are similar to those described for head and neck sarcomas. Free margin during surgery must be the goal of treatment, additional chemotherapy or radiotherapy or both being required to improve the survival rates.
El sarcoma de cabeza y cuello supone el 2% de los tumores de esta zona, representando el 4% de todos los sarcomas1,2. Existe una gran variedad histológica, con diferente comportamiento en función de la misma. El más prevalente en la infancia es el rabdomiosarcoma, siendo en el paciente adulto el de partes blandas y el angiosarcoma en el anciano3. Representan una entidad de difícil estudio, con gran heterogeneidad en la recogida de datos. No existen publicadas grandes series de pacientes con sarcomas localizados exclusivamente en mandíbula. Para algunos autores el sarcoma de Ewing, el rabdomiosarcoma y el dermatofibrosarcoma protuberans deberían distinguirse del resto, debido a su propia etiopatogenia y comportamiento.
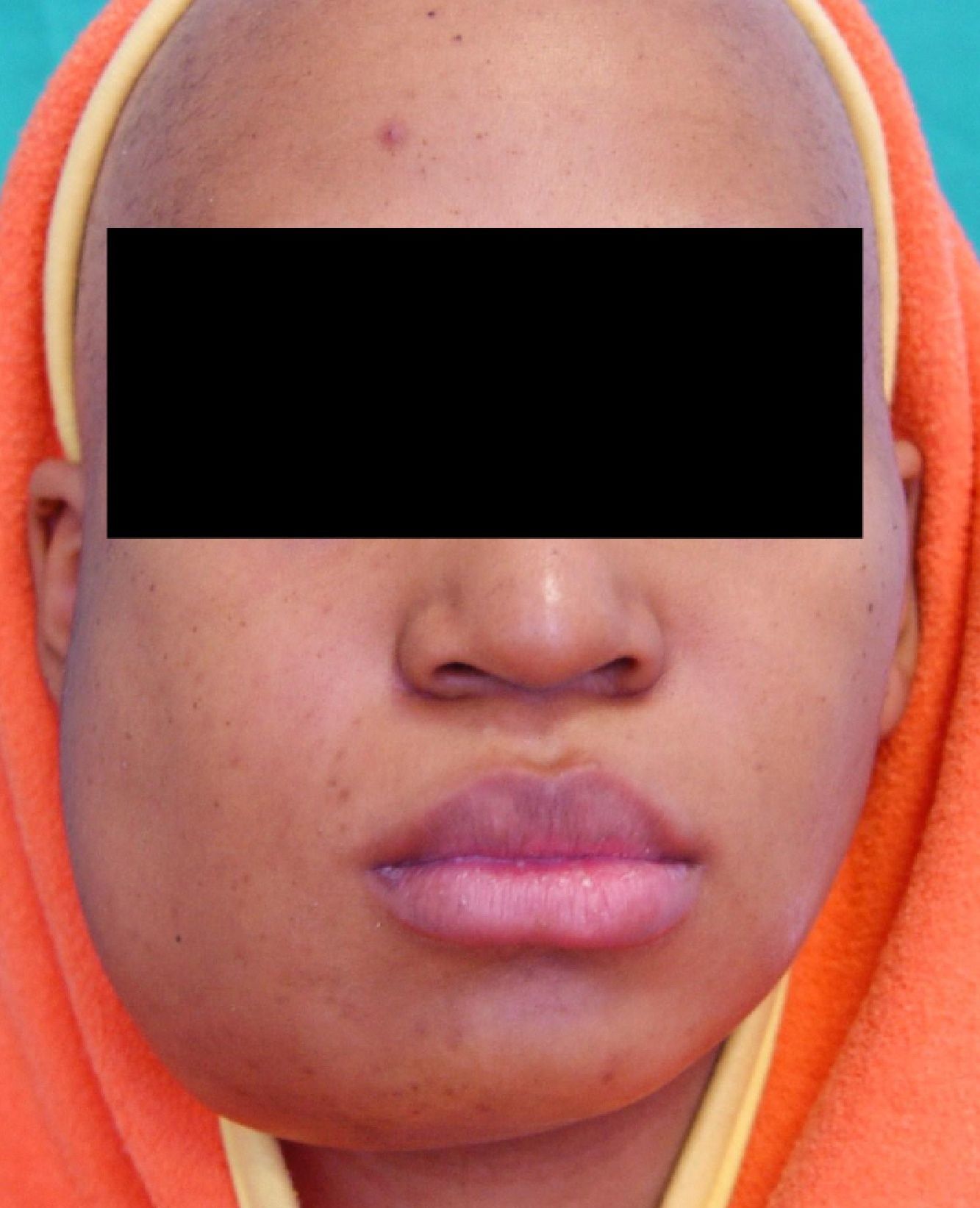
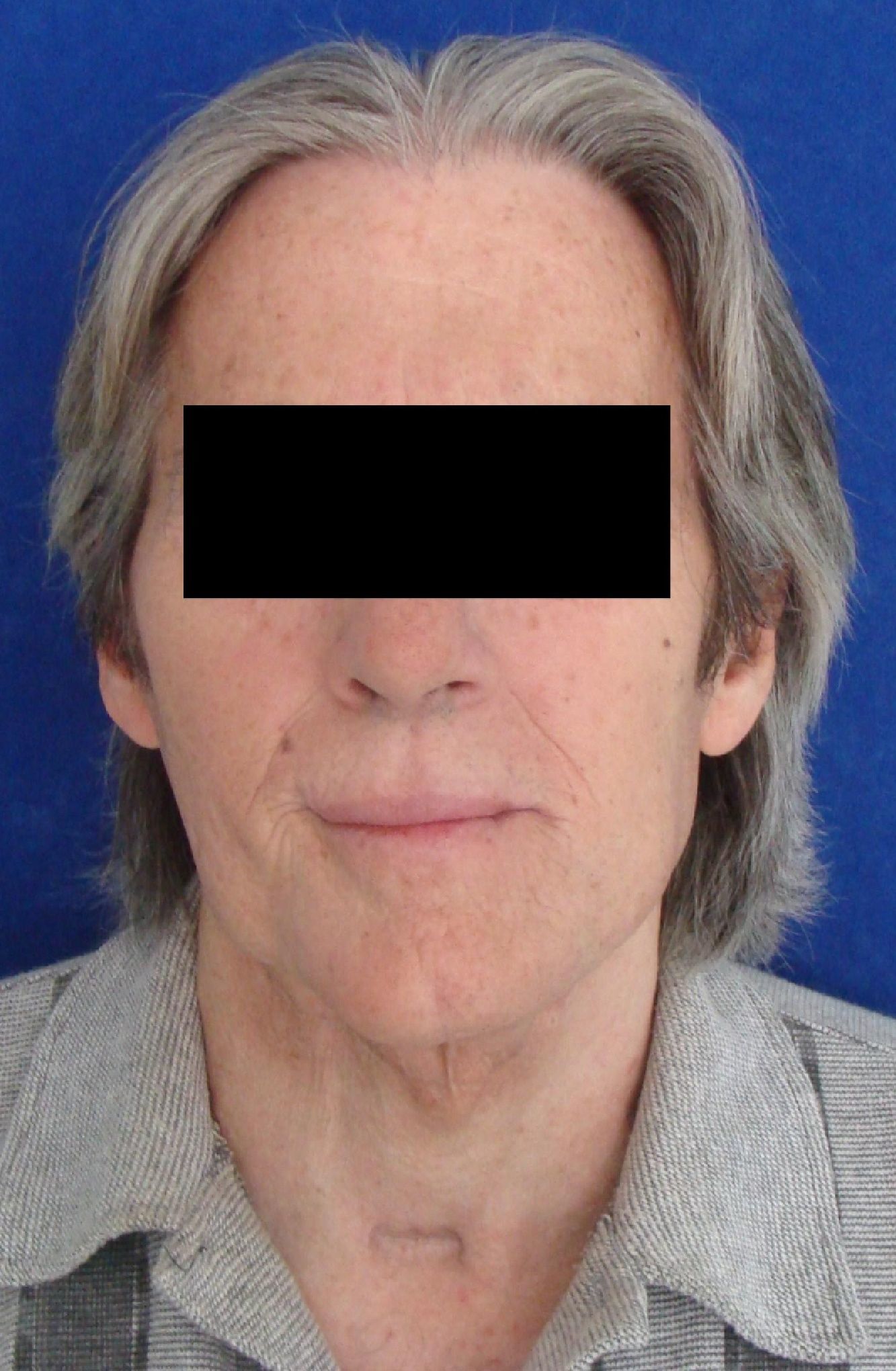
El 30% se desarrolla en niños (rabdomiosarcomas). La edad media al diagnóstico varía entre los 35-40años, con un predominio masculino. Tradicionalmente se ha relacionado su aparición con la radiación terapéutica o agentes alquilantes aunque no se ha podido demostrar mediante estudios correctamente diseñados. Clínicamente suelen manifestarse como una inflamación indolora (figs. 1 y 2). Otros síntomas que lo acompañan son la patología dental, parestesia en el territorio del nervio mentoniano, dolor o trismo.
Como factores pronósticos los márgenes quirúrgicos libres se postulan como el más importante (predictor independiente para supervivencia en análisis multivariante2), destacando sobre el subtipo histológico, el grado de diferenciación o el tamaño4.
Se han aplicado diversos tratamientos para su manejo. En la antigüedad la cirugía era la única arma, con alta tasa de recurrencias secundarias a la dificultad de obtener márgenes libres. En la actualidad el uso de la radioterapia y/o la quimioterapia adyuvantes o neoadyuvantes ha incrementado las tasas de supervivencia global y libre de enfermedad.
Pacientes y métodosSe revisaron los historiales médicos de los archivos de nuestro hospital, realizándose una selección de pacientes mayores de 16 años, diagnosticados como sarcomas mandibulares, con seguimiento mínimo de 6 meses e intervenidos quirúrgicamente por nuestro servicio entre enero de 2001 y diciembre de 2010, resultando 12 pacientes en total.
El sexo fue predominantemente masculino (8/12). La mediana de edad fue de 30,5años.
Para la recogida de datos se tuvieron en cuenta el diagnóstico de presunción por biopsia incisional o punción-aspiración con aguja fina, la fecha de intervención, el tipo de intervención y reconstrucción, el diagnóstico histopatológico definitivo, el tratamiento complementario/neoadyuvante y las complicaciones postquirúrgicas inmediatas/evolutivas, así como el estado en diciembre de 2010.
Todas las biopsias y piezas quirúrgicas fueron remitidas al servicio de Anatomía Patológica de nuestro hospital. La decisión acerca del tratamiento de los pacientes se tomó mediante consenso en un comité formado por cirujanos, oncólogos, patólogos y radiólogos, de acuerdo a los protocolos de la Sociedad Española de Cirugía Oral y Maxilofacial. Los pacientes siguieron controles conjuntos con el servicio de Oncología y con nuestro servicio, utilizándose la Resonancia Magnética (+/- Tomografía Axial Computarizada con ventana ósea y tomografía por Emisión de Positrones) como prueba de elección para el diagnóstico y seguimiento (fig. 3).
No se realizaron estudios estadísticos, limitando el artículo a la descripción de los casos debido al tamaño muestral pequeño (12 casos).
ResultadosLa histología de los diferentes sarcomas correspondió a 2 pacientes con sarcoma de Ewing, 2 con condrosarcoma, 4 con osteosarcoma (uno de ellos odontogénico: fibrosarcoma ameloblástico), uno con sarcoma de bajo grado, uno con sarcoma sinovial y 2 con rabdomiosarcoma embrionario (tabla 1).
Se describen individualmente los resultados del análisis anatomopatológico de la pieza quirúrgica y el estado actual de cada paciente
| Paciente | Histología | Grado diferenciación | Tamaño (cm) | Margen quirúrgico | Estado actual |
| 1 | Sarcoma de Ewing | 8×4,5×4 | Libres | EX | |
| 2 | Condrosarcoma ATM | Bajo grado | 4,5×2,5×2. | Libres | LE |
| 3 | Rabdomiosarcoma embrionario | Bajo grado | 8×7×3 | Infiltrados | EX |
| 4 | Condrosarcoma | Alto grado | 6×4×4 | Infiltrados | M1 |
| 5 | Osteosarcoma osteoblástico | 14×5×3 | Libres | LE | |
| 6 | FibrosarcomaAmeloblástico | 7cm | Libres | EX | |
| 7 | Sarcoma de Ewing | No tumor | LE | ||
| 8 | Osteosarcoma | Bajo grado | 7×4×4 | Libres | LE |
| 9 | Osteosarcoma condroblástico | 4,5×4×3,5 | Libres | M1 | |
| 10 | Osteosarcoma osteoblástico | 9×4,5×4 | Libres | LE | |
| 11 | Sarcoma Sinovial ATM | 7×5×5 | Libres | EX | |
| 12 | Rabdomiosarcoma embrionario | Grado intermedio | 5×5×4 | Libres | EX |
ATM: articulación temporo-mandibular; EX: Éxitus; LE: Libre de Enfermedad; M1: Metástasis.
A destacar que los márgenes quirúrgicos libres de tumor fueron el objetivo de la cirugía, estableciéndose 1 cm como la distancia mínima para considerarlo negativo. La reconstrucción microquirúrgica con colgajo peroneo fue empleada en 8 pacientes. En 2 optamos por reconstruir utilizando colgajo de músculo temporal (por su localización condilar) y en 2 pacientes se decidió en comité no emplear reconstrucción, dado el avanzado estadiaje de las lesiones.
El vaciamiento ganglionar no se empleó como procedimiento profiláctico, dada la escasa tendencia a la metástasis locorregional ganglionar de este tipo de tumores (diseminación hemática). Tan solo se llevó a cabo en 2 pacientes (y a un tercero se lo habían realizado en el centro desde el que fue derivado), debido a la estirpe histológica (fibrosarcoma ameloblástico y rabdomiosarcoma embrionario).
Se precisó de quimioterapia o radioterapia neoadyuvante en 3 pacientes (2 de ellos con diagnóstico de sarcoma de Ewing). Se practicó radioterapia adyuvante en 8 pacientes (dosis media de 60Gy) y quimioterapia adyuvante en 9 pacientes.
De los 12 pacientes 5 de ellos fallecieron (42%), correspondiendo a diferentes estirpes histológicas: 3 rabdomiosarcomas embrionarios (metástasis pulmonares y extensión local), fibrosarcoma ameloblástico (debido a enfermedad a distancia) y sarcoma de Ewing (secundaria a sepsis tras inmunodepresión yatrogénica).
Dos pacientes (16%) se encuentran con progresión de la enfermedad: el paciente afecto de un condrosarcoma presenta metástasis en pulmón y un segundo tumor primario (adenocarcinoma pulmonar). El otro paciente diagnosticado de condrosarcoma también tiene metástasis pulmonares (además de una osteorradionecrosis mandibular).
Cinco pacientes a fecha de 31 de diciembre se encuentran libres de enfermedad (42%).Como complicaciones en 2 se ha retirado el material de osteosíntesis tras exposición del mismo (secundaria a irradiación) y otro ha presentado un fracaso del primer colgajo con peroné, requiriendo una segunda intervención para anastomosis del contralateral. En 2 de ellos ya se ha realizado rehabilitación dental protésica implantosoportada. (tabla 2).
Descripción individual del tratamiento recibido por cada paciente, las complicaciones desarrolladas durante el seguimiento, el estado actual y la supervivencia y el intervalo libre de enfermedad
| Paciente | Reconstrucción | VGC | Neo (tipo de respuesta)/adyuvancia | Pauta QT | Complicaciones | Estado actual | SPVILE |
| 1 | Peroné | No | nQT+ RT (rta parcial) QT+RT post IQ. | Vincristina Adriamicina Ifosfamida CiclofosfamidActinomicina | Aplasia medular. OM | EX | 48m18m |
| 2 | Temporal | No | No | LE | 74m74m | ||
| 3 | No | Sí | QT+RT | Ifosfamida | EL | EX | 21m7m |
| 4 | Peroné | No | RT+QT | Epirrubicina Ifosfamida | M1 | 37m20m | |
| 5 | Peroné | No | QT | Cisplatino Adriamicina | LE | 41m41m | |
| 6 | Peroné | Sí | RT | ORN | EX | 25m18m | |
| 7 | Peroné | No | nQT+QT (rta parcial)+RT | Vincristina Adriamicina Ciclofosfamida | Necrosis peroné | LE | 50m41m |
| 8 | No | No | RT | LE | 72m72m | ||
| 9 | Peroné | Sí * | QT | Cisplatino Adriamicina | OM. ED | M1 | 76m48m |
| 10 | Peroné | No | nQT (rta parcial)+QT | Cisplatino Adriamicina | EICH. LMA | LE | 64m61m |
| 11 | Pectoral | No | QT+RT | Ifosfamida Doxorrubicina | Sd doloroso ATM | EX | 29m6m |
| 12 | Peroné | No | QT+RT | Epirrubicina Ifosfamida | EX | 6m2m |
ATM: Articulación Temporo-Mandibular; ED: Enfermedad Diseminada; EICH: Enfermedad Injerto Contra Huésped; EL: Extensión local; EX: ÉxituS; ILE: Intervalor Libre de Enfermedad; LE: Libre deEnfermedad; LMA: Leucemia Mieloide Aguda; M1: Metástasis; nQT: Quimioterapia neoadyuvante; nRT: Radioterapia neoadyuvante; OM: Osteomielitis; ORN: Osteorradionecrosis; QT: Quimioterapia; RT: Radioterapia; SPV: Supervivencia; VGC: Vaciamiento Ganglionar Cervical.
Los sarcomas de cabeza y cuello son un grupo heterogéneo de tumores de diversos orígenes, por lo que los estudios con gran número de pacientes y largo tiempo de seguimiento son escasos. Atendiendo a esto, hemos comparado nuestros datos con sarcomas en cabeza y cuello, por lo que las diferencias o semajanzas no son extrapolables (tabla 3). Encontramos cierta similitud atendiendo a los factores pronósticos5–7:
- –
Afectación de márgenes quirúrgicos en dos pacientes: un éxitus y otro con enfermedad en progresión
- –
Tamaño>5cm: 8 pacientes, de los cuales 3 fueron éxitus y 2 se encuentran con enfermedad a distancia
- –
Grado diferenciación: alto grado (1 paciente, con metástasis pulmonares)
- –
Histología (Rabdomiosarcoma=éxitus; Fibrosarcoma= éxitus; Sarcoma sinovial=éxitus; Sarcoma de Ewing=éxitus; condrosarcoma/osteosarcoma condroblástico= metástasis a distancia)
Comparación de las diferentes series publicadas con casos de sarcomas en región de cabeza y cuello a lo largo de los últimos 50 años. En la primera columna se han añadido los datos de nuestro estudio con propósitos simplemente comparativos (no significado estadístico)
| Vall D¿Hebron (2001-2010; n=12) | Asleigh B et al.8 (1960-2007; n=119) | Gil Z et al.2 (1956-2000; n=146) | Le QX et al.9 (1961-1993; n=65) | |
| Mediana segumiento | 45 meses | 70 meses | 34 meses | 64 meses |
| Reconstrucción | 75% | 42% | 77,4% | 49% |
| Metástasis locorregional | 0% | 0% | 2% | 3% |
| RT/QT | 58%/83% | 23%/53% | 69%/52% | 78%/21% |
| Márgenes libres | 83% | 68% | 77% | 35% |
| SPV global(5 a) | 67% | 63% | 62% | 66% |
| ILE (5 a) | 75% | 59% | 57% | 77% |
En términos de supervivencia el 42% (5/12) se encuentran libres de enfermedad. Uno de ellos presentó una recidiva 2 años después del tratamiento con quimioterapia y radioterapia, motivo por el cual fue intervenido. El 25% (3/12) presentó enfermedad metastásica. Y el 42% (5/12) fallecieron (menos de 12 meses tras intervención).
Coincidimos en que la cirugía radical es el tratamiento de elección. La técnica que más hemos utilizado y que mejores resultados nos ha proporcionado ha sido el colgajo microvascularizado con hueso peroné (figs. 4 y 5).
La reconstrucción con colgajo microvascularizado de peroné es la técnica reconstructiva de elección para las lesiones que ocupan gran parte de la mandíbula: imagen intraoperatoria del colgajo y la placa de reconstrucción (4) y ortopantomografía de control en el postoperatorio inmediato (5).
La radioterapia adyuvante parece mejorar el pronóstico en la mayoría de estos tumores, debido a la dificultad para conseguir márgenes de resección libres. En el osteosarcoma incrementa las tasas de supervivencia en pacientes con márgenes afectos, tumores de gran tamaño (T4), infiltración de partes blandas o invasión linfovascular10. Suele aplicarse de manera adyuvante a la cirugía, aunque para algunas histologías resulta especialmente beneficiosa previamente (osteosarcoma, angiosarcoma y sarcoma de Ewing)11. Las últimas guías recomiendan tratar de manera preoperatoria con radioterapia a pacientes con sarcomas de partes blandas (50,4Gy en pacientes con tumores resecables; 74,4Gy en pacientes con tumores irresecables, con posterior valoración de cirugía)12. Después de la cirugía se propone irradiar con dosis similares a las que se emplean en carcinomas escamosos (60Gy si no hay márgenes afectos o 74,4Gy si los márgenes son positivos).
En el caso del osteosarcoma existe un metaanálisis13 que muestra mejores resultados en pacientes tratados únicamente con cirugía frente a los que además reciben terapia adyuvante. Los resultados claramente están influenciados por un inadecuado análisis, ya que los tumores que reciben tratamiento adyuvante son de peor pronóstico que los que no lo reciben y por ello obtienen peores tasas de supervivencia. Otros estudios retrospectivos sugieren claro beneficio del tratamiento adyuvante con radioterapia en pacientes con sarcomas de partes blandas14,15.
La quimioterapia se reserva para tumores irresecables (de entrada) o para aquellos operados que tienen márgenes afectos. Se han propuesto diversas pautas quimioterápicas en los últimos años para el manejo de los sarcomas de partes blandas16: Le Cesne (2000) emplea la combinación de doxorrubicina e ifosfamida). Hensley (2002) y Leu (2004) coinciden con la pauta de gemcitabina y docetaxel. De Laney (2003) prefiere el uso de doxorrubicina, ifosfamida y dacarbazina. Worden (2005) propone añadir G-CSF a la doxorrubicina y la ifosfamida. Dileo (2007) administra vinorelbine y gemcitabina.
Estas combinaciones de fármacos se basan en estudios que describen la sensibilidad de determinadas estirpes histológicas ante ciertos quimioterápicos: el osteosarcoma para el cisplatino13, el angiosarcoma ante combinaciones de antraciclinas, Ifosfamidas y taxanos (parece ser que este tumor es muy quimiosensible a taxanos17; además otras drogas como bevacizumab, sunitinib, sorafenib, interferon e interleukina-2 pueden contribuir al mejor control de estas lesiones18), el dermatofibrosarcoma protuberans ante el imatinib y el sarcoma de Ewing con poliquimioterápicos basados en vincristina, fosfamidas, doxorrubicina e incluso platinos (en muchos protocolos se realizan varias sesiones de quimioterapia previamente a la cirugía, consiguiendo mejoría en las tasas de supervivencia).
ConclusionesCon este artículo pretendemos mostrar los resultados obtenidos por nuestro servicio en una patología tan agresiva como el sarcoma mandibular. Aportamos 12 casos a la literatura, estableciendo una serie con una localización concreta, aunque con diferentes histologías. El manejo llevado a cabo se adecúa a los protocolos de tratamiento de las sociedades americana y europea, reforzando las bases del tratamiento de la patología. Consideramos los márgenes quirúrgicos libres como un factor pronóstico fundamental para la supervivencia, por lo que promulgamos la cirugía «agresiva». Asimismo, se ha de individualizar el tratamiento complementario en función de las características del tumor. Los resultados obtenidos en términos de supervivencia e intervalos libres de enfermedad se asemejan a los descritos en la bibliografía. Los pacientes libres de enfermedad han conseguido un resultado estético aceptable (figs. 6 y 7), permitiéndoles su reintegración a la vida social en un período razonable de tiempo.
Se ha de reconocer que en una serie tan corta, con tan pocos años de seguimiento y siendo comparada con series de tumores de diferente localización, no es posible extrapolar los datos con los ya publicados en la literatura.
Pensamos que sería importante desarrollar estudios multicéntricos que describan localizaciones e histologías concretas para evaluar el rol de la cirugía, quimioterapia y radioterapia y el mejor momento para aplicarla, así como para estudiar el comportamiento de cada estirpe histológica.
Este artículo ha sido elaborado sin financiación ajena al servicio.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.