Evaluar la asociación entre la presencia en el genotipo de determinados polimorfismos genéticos (PG) de las citocinas y del óxido nítrico sintasa (NOS) y el desarrollo de la hernia discal lumbar (HDL) sintomática.
Material y métodoSe revisaron 179 pacientes en un estudio retrospectivo de casos y controles. El grupo de casos estaba formado por 50 pacientes con HDL confirmada mediante resonancia magnética. El grupo control lo componían pacientes ingresados para cirugía protésica de la cadera o de la rodilla que no presentaban ni habían presentado nunca clínica compatible con HDL. Se realizó una extracción de sangre a todos los participantes del estudio. Se genotiparon los PG de las citocinas que pretendíamos estudiar: interleucina (IL)-1 (IL-1α [−889 C/T] e IL-1β [+3953 T/C]) y factor de necrosis tumoral-α (TNF-α´ [−308 G/A] y TNF-α´ [−238 G/A]).
ResultadosEl genotipo CC y la frecuencia del alelo C del PG IL-1β (+3953 T/C) fueron significativamente mayores en el grupo de pacientes con HDL respecto a la población control. Por el contrario, los pacientes del grupo control portaban los PG de NOS endotelial (−768 T/C) y de NOS inducible 22 G/A con mayor frecuencia que el grupo de pacientes con HDL, esta diferencia es estadísticamente significativa para ambos polimorfismos.
ConclusionesEncontramos que ser portador del alelo C del PG IL-1β (+3953 T/C) puede ser un factor de predisposición para desarrollar una HDL. Por otro lado, ser portador del PG NOS endotelial (−768 T/C) y del NOS inducible 22 G/A parece comportarse como un factor protector frente al desarrollo de esta enfermedad.
To evaluate the association between the presence of the genotype of certain genetic polymorphisms (GP) of the cytokine and oxide nitric synthase (NOS) and the development of lumbar herniated disc (LHD).
Materials and methodsWe reviewed 179 patients in a retrospective case-control study. The case group was made up of 50 patients with confirmed lumbar herniated disc diagnosed by Magnetic Resonance Imaging (MRI). The control group was made up of patients admitted for hip and knee prosthetic surgery who did not have or had not had any symptoms consistent with LHD. Blood was drawn from all of the study participants. The genotypes of the GP were obtained of the cytokines to be studied: Interleukin-1 [IL-1α(−889 C/T), IL-1β(+3953 T/C)], Tumor Necrosis Factor-α [TNF-α (−308 G/A) and (−238G/A)].
ResultsThe CC genotype and C allele frequency of the IL-1β PG (+3953T/C) polymorphism were significantly more frequent in patients with LDH compared to the controls. On the contrary, the control group patients carried eNos GPs (−768 T/C) and iNOS22 G/A polymorphisms more frequently than the LHD group, this difference being statistically different for both polymorphisms.
ConclusionsWe found that individuals who were carriers of the CC genotype of the IL-1b(+3953T/C) polymorphism showed higher susceptibility to suffer lumbar disc herniation. Furthermore, being a carrier of ENOS (−786 T/C) and iNOS (22 G/A) polymorphisms suggests that this could behave as a protection factor against disc herniation.
La incidencia de la hernia discal lumbar (HDL) sintomática en la población general de España se estima en un 2%. Esta enfermedad se debe al desplazamiento del núcleo pulposo discal fuera de su localización anatómica normal, lo que puede producir una compresión de las raíces raquídeas próximas y un cuadro de lumbociatalgia1. Los niveles del raquis más implicados son los espacios intervertebrales L4-L5 y L5-S1. Todo lo anterior se traduce en frecuentes bajas laborales hasta la resolución del proceso.
Se ha visto en estudios epidemiológicos en gemelos que el factor individual más determinante para presentar una degeneración discal intervertebral es la herencia2. En el desarrollo de esta enfermedad también influyen los factores ambientales de tipo mecánico y otros sociales, como el tabaco. Sin embargo, el sustrato genético del paciente puede favorecer que bajo condiciones ambientales semejantes unos individuos desarrollen la enfermedad discal y otros no3. En este grupo de factores genéticos, cuya expresión puede o no generar variabilidad en el comportamiento del organismo ante un mismo estímulo ambiental, pertenecen los polimorfismos genéticos (PG), que son variables alélicas de un gen que existe de forma estable en una población con una frecuencia de al menos el 1%. Se pueden diferenciar 2 tipos de PG: los polimorfismos de repetición en tándem (del inglés variable number of tandem repeats) y los polimorfismos de un solo nucleótido (del inglés single nucleotide polymorphisms)4, que son los más frecuentes. Su expresión fenotípica carece de un efecto clínico concreto, pero de éstos depende, por ejemplo, el que una persona sea sensible o no a un determinado fármaco y la predisposición para tener una determinada enfermedad5–13. Son, por tanto, diferentes de las mutaciones, mucho menos frecuentes, habitualmente asociadas a enfermedades hereditarias.
Se ha podido demostrar el papel de las citocinas en el proceso de degeneración discal; en concreto, la implicación de la interleucina (IL)-1, entre otros mediadores de la inflamación. La predisposición a la degeneración discal puede guardar relación con la expresión de los PG de éstas y especialmente de la IL-114,15. El óxido nítrico es una molécula pequeña, un radical libre de vida media corta que el óxido nítrico sintasa (NOS) genera. Regula la presión arterial, la agregación plaquetaria, la cicatrización, la apoptosis y está también involucrado en la respuesta a los aloinjertos, la colitis y los desórdenes gastrointestinales. También se le implica en numerosos fenómenos habituales en cirugía ortopédica, como la inflamación, la artritis, la osteoporosis, las sepsis, la curación ligamentosa y el aflojamiento aséptico de prótesis articulares16–18. Del mismo modo que las citocinas, la expresión de óxido nítrico puede verse sujeta a variaciones, según el PG del que sea portador el paciente.
La determinación de los PG puede permitir realizar un cartografiado de la predisposición individual para experimentar determinadas enfermedades, así como de su virulencia, ante unas determinadas condiciones ambientales. De esta manera se podrían aplicar tratamientos preventivos previos a la aparición de los síntomas o al desarrollo de la enfermedad.
Pacientes y metodologíaSe obtuvo la muestra de 179 pacientes del Servicio de Cirugía Ortopédica y Traumatología del Hospital Universitario Central de Asturias (HUCA) entre julio de 2007 y diciembre de 2008. El grupo de casos estaba formado por 50 pacientes, 21 mujeres (el 43% del grupo de casos) y 29 hombres (el 58% del grupo), con clínica indicativa de HDL confirmada en todos ellos mediante una resonancia magnética. La edad media de este grupo fue de 44 años (DE: 12; rango: 23–77 años). El grupo control lo componían 129 pacientes ingresados para la realización de una artroplastia primaria de la cadera o de la rodilla, 44 hombres (el 34,1% del grupo control) y 85 mujeres (el 65,9% del grupo), y que no presentaban ni habían tenido nunca sintomatología compatible con HDL. La edad media del grupo control fue de 69 años (DE: 9; rango: 25–85 años).
Casos y controles pertenecían a una población caucásica homogénea (equilibrio de Hardy-Weinberg) con residencia en una misma región (Asturias). Cada participante aceptó ser incluido en el estudio y firmaron el correspondiente consentimiento informado previamente aprobado por el Comité de Ética Médica del HUCA. A todos los pacientes se les practicó la extracción de una muestra de 10ml de sangre total en un tubo de extracción con ácido etilendiaminotetracético-K3 como anticoagulante mediante una punción en una vía venosa periférica de la extremidad superior. Esta parte del estudio se llevó a cabo en el laboratorio de la Unidad de Genética Molecular del HUCA, donde se realizó la extracción y el aislamiento del ADN necesario para genotipar los siguientes PG: IL-1α (−889 C/T); IL-1β (+3953 T/C); factor de necrosis tumoral (−308 G/A y −238 G/A); óxido nítrico sintasa endotelial (eNOS) ([repetición de 27pb en el intrón 4] y [−786 T/C]) y óxido nítrico sintasa inducible (iNOS) (iNOS22 G/A).
Como primer paso se aisló el ADN a partir de los leucocitos presentes en la sangre contenida en el tubo etilendiaminotetracético y se siguió el procedimiento de precipitación salina descrito por Miller et al19. Posteriormente se llevó a cabo la amplificación del fragmento de ADN que contiene la secuencia polimórfica mediante PCR. El resultado de la amplificación se visualizó mediante la electroforesis en un gel de agarosa al 2% P/V. Se realizó con un campo eléctrico, de tal forma que el ADN de carga negativa migra al polo positivo. Al conocer previamente el tamaño de los posibles alelos resultantes y su patrón electroforético se determina el genotipo resultante para cada polimorfismo. Los cebadores utilizados en cada caso se muestran en la tabla 1, así como sus correspondientes temperaturas de cebamiento y la enzima de restricción utilizada.
Polimorfismos genéticos estudiados con sus temperaturas de cebamiento, enzimas de restricción y tamaños de la amplificación
| Polimorfismo | Cebadores (sentido/antisentido) | Temperatura de cebamiento | Enzima de restricción | Tamaño de la amplificación | Tamaño de los fragmentos |
| IL-1α | 5′-ATCACACCTAGTTCATTTCCTCTATTTA- 3′ | 58°C | NcoI | 195pb | 195pb(T) |
| (−889 C/T) | 5′- GATTTTTACATATGAGCCTTCCATG-3′ | 166+29pb(C) | |||
| IL-1β | 5′- CTCAGGTGTCCTCCAAGAAATCAAA-3′ | 60°C | TaqI | 194pb | 194pb (C) |
| (+3953 T/C) | 5′- GCTTTTTTGCTGTGAGTCCCG-3′ | 108+86pb(T) | |||
| TNF-α | 5′-GCAATAGGTTTTGAGGGCCAT- 3′ | 58°C | NcoI | 147pb | 122+25pb(G) |
| (–308 G/A) | 5′-GGGACACACAAGCATCAAG- 3′ | 147pb (A) | |||
| TNF-α | 5′-AAACAGACCACAGACCTGGTC-3′ | 58°C | BamHI | 154pb | 110+44(G) |
| (–238 G/A) | 5′-CTCACACTCCCCATCCTCCCGGATC- 3′ | 154pb(A) | |||
| eNOS (27pb, intrón 4) | 5′-CTATGGATGTGCCTTGGCTGGAGG-3′ | 63°C | – | 22pb (6rep) | – |
| 5′- TCGCCTCAAGGGACCCGCCA-3′ | 195pb(5rep) | ||||
| 168 (4rep) | |||||
| eNOS | 5′-TGGAGAGTGCTGGTGACCCCA-3′ | MspI | 180pb | 140+40pb(T) | |
| (–786 T/C) | 5′-CTGTCCCACCCCCACCTCCG-3′ | 62°C | 90+50+40pb(C) | ||
| iNOS | 5′-GCTGAATCTGAGTTGATGAACAGATC-3′ | 60°C | NcoI | 140pb | 120+20pb(G) |
| (iNOS 22 G/A) | 5′-CTCCCGGGATCACACGCCCA- 3′ | 140pb(A) |
eNOS: óxido nítrico sintasa endotelial; IL: interleucina; iNOS: óxido nítrico sintasa inducible; TNF: factor de necrosis tumoral.
El análisis de los datos se realizó con programas estadísticos para ordenador (SPSS software para Windows, versión 15.0, Chicago, Illinois, EE. UU. y Prism GraphPAd, versión 4.0, 2003, San Diego, California, EE. UU.). El test Chi-Cuadrado (χ2) se usó para comparar las frecuencias genotípicas en los diferentes grupos. También se calculó la odds ratio (OR) con un intervalo de confianza (IC) del 95%. Se consideró significativo un valor de p<0,05. La corrección de Yates y la prueba exacta de Fisher (2 colas) se utilizaron cuando la muestra lo requería.
ResultadosSe presentan los resultados obtenidos de la determinación de frecuencias genotípicas y alélicas de los distintos PG estudiados para el conjunto de pacientes con HDL y los controles (tablas 2 y 3).
Polimorfismos de las citocinas interleucina-1α (−889 C/T), interleucina-1β (+3953 T/C), factor de necrosis tumoral-α (−308 G/A y −238G/A) en pacientes con hernia discal lumbar y grupo control
| Gen | Frecuencia genotípica | Hernia (n=50) | Controles (n=129) | Pearson (χ2) | Odds ratio (IC del 95%) | Valor de p |
| IL-1-α (−889 T/C) (%) | TT | 3 (6) | 5 (3,9) | 0,38 | 1,58 (0,29–8,02) | 0,54 |
| CT | 25 (50) | 61 (47,3) | NS | |||
| CC | 22 (44) | 63 (48,8) | NS | |||
| IL-1-β (+3953 T/C) (%) | CC | 4 (8) | 3 (2,3) | 3,10 | 3,65 (0,66–21,54) | 0,008 |
| CT | 16 (32) | 50 (38,8) | NS | |||
| TT | 30 (603) | 76 (58,9) | NS | |||
| TNF-α (−308 G/A) (%) | AA | 1 (2) | 4 (3,1) | 0,16 | 0,64 (0,03–6,3) | 0,69 |
| AG | 16 (32) | 42 (32,6) | NS | |||
| GG | 33 (66) | 83 (64,3) | NS | |||
| (n=49) | (n=122) | |||||
| TNF-α (−238 G/A) (%) | AA | 0 | 0 | – | – | – |
| AG | 5(10) | 9(7,38) | 0,33 | 1,4 (0,39–4,90) | 0,57 | |
| GG | 45 (90) | 113(92,62) | ||||
IC: intervalo de confianza; IL: interleucina; NS: no significativo; TNF: factor de necrosis tumoral.
Frecuencias alélicas de los polimorfismos genéticos de las citocinas interleucina-1α (-889 C/T), interleucina-1β (+3953 T/C), factor de necrosis tumoral-α (−308 G/A y −238 G/A) en pacientes con hernia discal y grupo control
| Gen | Frecuencia alélica | Hernia (n=50) | Controles (n=129) | Pearson (χ2) | Odds ratio (IC del 95%) | Valor de p |
| IL-1-α (−889 T/C) (%) | C | 69/100 (0,69) | 187/258 (0,73) | 0,43 | 1,2 (0,69–2,02) | 0,51 |
| T | 31/100 (0,31) | 71/258 (0,27) | ||||
| IL-1-β (+3953 T/C) (%) | C | 32/100 (0,32) | 56/258 (0,22) | 4,12 | 1,7 (0,98–2,93) | 0,042 |
| T | 68/100 (0,68) | 202/258 (0,78) | ||||
| TNF-α (−308 G/A) (%) | A | 18/100 (0,18) | 50/258 (0,19) | 0,09 | 0,91 (0,48–1,72) | 0,77 |
| G | 82/100 (0,82) | 208/258 (0,81) | ||||
| (n=50) | (n=122) | |||||
| TNF-α (−238 G/A) (%) | A | 5/100 (0,05) | 9/244 (0,03) | 0,31 | 1,37 (0,39–4,63) | 0,58 |
| G | 95/100 (0,95) | 235/244 (0,97) | ||||
IC: intervalo de confianza; IL: interleucina; TNF: factor de necrosis tumoral.
Los portadores del genotipo homocigoto CC eran 3 veces más frecuentes en el grupo de casos que en el grupo control (χ2=3,1; OR=3,65 [0,66–21,54]; p=0,0008) (tabla 2). El alelo C se detectó más frecuentemente en el grupo de pacientes con HDL que en el grupo control (χ2=4,12; OR=1,7 [0,98–2,93]; p=0,042) (tabla 3).
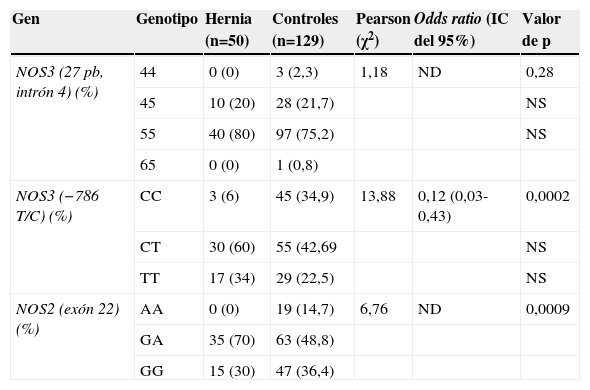
Polimorfismo del óxido nítrico sintasa endotelial (−786 T/C)El genotipo CC de este PG era 5 veces más frecuente en los controles que en los pacientes con HDL (χ2=13,88; OR [IC del 95%]=0,12 [0,03–0,43]; p=0,002) (tabla 4). El alelo C del PG NOS3 (−786 T/C) se detectó con mayor frecuencia entre los pacientes del grupo control (χ2=4,1; OR [IC del 95%]=0,6 [0,35–1,01]; p=0,0042) (tabla 5).
Polimorfismos del óxido nítrico sintasa endotelial (repetición de 27pb, intrón 4; −786 T/C) y óxido nítrico sintasa inducible 22 G/A en pacientes con hernia discal y grupo control
| Gen | Genotipo | Hernia (n=50) | Controles (n=129) | Pearson (χ2) | Odds ratio (IC del 95%) | Valor de p |
| NOS3 (27 pb, intrón 4) (%) | 44 | 0 (0) | 3 (2,3) | 1,18 | ND | 0,28 |
| 45 | 10 (20) | 28 (21,7) | NS | |||
| 55 | 40 (80) | 97 (75,2) | NS | |||
| 65 | 0 (0) | 1 (0,8) | ||||
| NOS3 (−786 T/C) (%) | CC | 3 (6) | 45 (34,9) | 13,88 | 0,12 (0,03-0,43) | 0,0002 |
| CT | 30 (60) | 55 (42,69 | NS | |||
| TT | 17 (34) | 29 (22,5) | NS | |||
| NOS2 (exón 22) (%) | AA | 0 (0) | 19 (14,7) | 6,76 | ND | 0,0009 |
| GA | 35 (70) | 63 (48,8) | ||||
| GG | 15 (30) | 47 (36,4) |
IC: intervalo de confianza; NOS: óxido nítrico sintasa; NS: no significativo.
Frecuencias alélicas de los polimorfismos del óxido nítrico sintasa endotelial (repetición de 27pb, intrón 4; −786 T/C) y óxido nítrico sintasa inducible 22 G/A en pacientes con hernia discal y grupo control
| Gen | Frecuencias alélicas | Hernia (n=50) | Controles (n=129) | Pearson (χ2) | Odds ratio (IC del 95%) | Valor de p |
| NOS3 (27 pb, intrón 4) (%) | 4 | 10/100 (0,1) | 34/258 (0,14) | 0,68 | 0,73 (0,32–1,62) | 0,41 |
| 5 | 90/100 (0,9) | 222/258 (0,86) | ||||
| 6 | 0/100 (0) | 2/258 (0,0) | ||||
| NOS (−786 T/C) (5%) | C | 36/87 (0,41) | 145/258 (0,66) | 4,1 | 0,6 (0,35–1,01) | 0,042 |
| T | 47/87 (0,59) | 113/258 (0,44) | ||||
| NOS2 (exón 22) (%) | A | 35/100 (0,35) | 101/258 (0,39) | 0,53 | 0,84 (0,5–1,39) | 0,47 |
| G | 65/100 (0,65) | 157/258 (0,61) |
IC: intervalo de confianza.
El genotipo AA se observó en el 14,7% de los controles y en ningún paciente con hernia discal. Se halló significación estadística al comparar las diferencias encontradas entre los 2 grupos (χ2=6,76; p=0,0009) (tabla 4). No se encontraron diferencias significativas al comparar las frecuencias alélicas de este PG entre los 2 grupos (p=0,47) (tabla 5).
Resto de polimorfismos genéticosNo se encontraron diferencias estadísticamente significativas al comparar las frecuencias genotípicas y alélicas del resto de los PG estudiados.
DiscusiónLa variabilidad genética determina que ante estímulos ambientales similares algunos individuos desarrollan una enfermedad y otros no. Se han identificado un número muy elevado de PG. Su expresión fenotípica no implica un efecto clínico concreto, pero de éstos depende, por ejemplo, el que una persona sea sensible o no a un determinado fármaco o la predisposición para tener una determinada enfermedad. Hemos centrado nuestra atención en la HDL sintomática, por la relevancia social y económica y por el interés como entidad patológica dentro de nuestra especialidad. La distribución por sexos no presentó diferencias estadísticamente significativas entre los 2 grupos. Sin embargo, la edad fue menor en el grupo control. Si bien hay PG cuya detección puede estar condicionada por la edad o el sexo de la población estudiada, no se han encontrado en la literatura médica diferencias condicionadas por estas variables para la detección de los PG objeto de nuestro estudio. Sí es posible que las diferencias que encontramos entre el grupo de casos y el grupo control podrían haber sido más importantes de haber comparado nuestros pacientes con una población control ideal para realizar el estudio. Esta hubiera sido una población con idéntica distribución respecto a edad y a sexo, y que no hubiera presentado nunca clínica de HDL.
Numerosos estudios se han ocupado de analizar las frecuencias de estos PG en pacientes con diversas enfermedades del hueso, pero hay pocos que se hayan centrado en la enfermedad del disco intervertebral. Asensi et al5 estudiaron diferentes polimorfismos de las citocinas proinflamatorias en pacientes con osteomielitis y en una población control sin esta infección ósea. Observaron que el polimorfismo (−889 C/T) de la IL-1α era significativamente más frecuente en los pacientes con osteomielitis que en los pacientes controles sanos. También vieron que los portadores de este PG desarrollaban osteomielitis 20 años antes que los pacientes no portadores de este. En un segundo estudio estos autores analizaron la posible asociación entre el desarrollo de osteomielitis en adultos y la presencia de 3 PG de la enzima eNOS: 1) intrónico caracterizado por la repetición de 27 pares de bases en el intrón 4; 2) caracterizado por polimorfismos de un solo nucleótido (−786 T/C) en la región del promotor, y 3) exónico, debido a un cambio E298D en el exón 7. Se encontró que el PG del intrón 4 aparecía con una frecuencia significativamente mayor en el grupo con osteomielitis que entre los controles sanos. Los pacientes con osteomielitis y homocigotos para este PG tenían unos niveles séricos de nitratos y nitritos significativamente mayores en comparación con los de los controles sanos. Este aumento en los niveles de nitratos y nitritos séricos podía deberse a un incremento constitutivo de su actividad condicionado por el genotipo, que a su vez podría ser la causa del mayor riesgo de presentar la infección. En el estudio concluyeron que existe riesgo de desarrollar osteomielitis crónica en los portadores de este PG de la enzima eNOS20.
Ya se ha observado con anterioridad que el componente genético asociado a fenómenos relacionados con la enfermedad de los tejidos blandos en condiciones tanto fisiológicas como fisiopatológicas, como es el caso de la enfermedad discal, es de gran complejidad. Involucra a un gran número de mediadores biológicos, tales como las IL, y otras enzimas, como la NOS. Los múltiples PG existentes para cada uno de los genes que codifican estas moléculas pueden tener un grado de implicación variable. El resultado final viene dado, en definitiva, por la suma de la expresión de un grupo de genes polimórficos que son los que ocasionan la variabilidad de efectos que se presentan en el conjunto de individuos con hernia discal.
La relación de las citocinas con la HDL no se ha analizado en profundidad. Se conoce el papel que desarrolla la IL-1 en la inducción de las enzimas que destruyen los proteoglucanos que contribuye a la degeneración discal. Takahashi et al21 detectaron la presencia de IL-1α, IL-1β, IL-6, factor de necrosis tumoral-α y prostaglandina E2 en el tejido discal de casi un centenar de pacientes con hernia discal. En pocos estudios relacionan los PG de las citocinas con esta enfermedad.
Solovieva et al22 estudiaron la posible relación de los diferentes polimorfismos de la IL-1 con la degeneración discal lumbar y el grado de influencia en el posible desarrollo de ésta en trabajadores que sobrecarguen la región lumbar. Este trabajo determinó que la presencia del genotipo TT de la IL-1α (−889 C/T) aumentaba unas 3 veces el riesgo de desarrollar una degeneración discal en comparación con los portadores del genotipo CC. Por todo lo anteriormente expuesto, nos pareció interesante ampliar el estudio de las posibles relaciones de las diferentes citocinas proinflamatorias en pacientes con HDL.
Los pacientes del grupo de pacientes presentaron el genotipo CC del PG IL-1β (+3953 T/C) con mayor frecuencia que en los del grupo control. Esta diferencia resultó estadísticamente significativa. Del mismo modo, el alelo C estaba presente con mayor frecuencia en los pacientes del grupo de casos y la diferencia fue estadísticamente significativa. La significación patogénica de este hallazgo requiere más estudios que incluyan la determinación de los niveles séricos de IL-1β en pacientes y controles. La elevación de esta citocina en sangre en los portadores del alelo C podría indicar que esta citocina daña el disco intervertebral y facilita la aparición de HDL sintomática.
La importancia de este hallazgo creemos que es clara: si existe asociación entre ser portador del genotipo CC, incluso en su forma heterocigoto, del polimorfismo IL-1β (+3953 T/C) y el desarrollo de una HDL, se podría plantear la realización de un estudio genético a todos los pacientes que fueran a desarrollar actividades con un mayor riesgo de desencadenar una enfermedad discal. En los portadores de este genotipo se podrían aplicar medidas preventivas y reorientar su actividad deportiva o laboral. Por todo esto, creemos que el estudio de los PG asociados a enfermedades del esqueleto puede ser de gran interés, si se emplea como una herramienta para la prevención y para el diagnóstico precoz.
Hemos encontrado diferencias entre las 2 poblaciones estudiadas en relación con los resultados obtenidos de los polimorfismos de la NOS estudiados. En ambos casos, el genotipo mutado CC (eNOS [−786 T/C]) o AA (iNOS22 G/A) se presentó con mayor frecuencia en el grupo control, esta diferencia fue estadísticamente significativa para ambos PG (p<0,0002). A falta de nuevos ensayos que permitan confirmar este dato, puede darse el hecho de que la expresión fenotípica de estos PG se comporte como un factor protector para el posible desarrollo de HDL.
FinanciaciónEste trabajo se desarrolló gracias a la ayuda recibida en virtud de la resolución del concurso de Proyectos de Investigación convocado por la Fundación SECOT en el año 2007.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.