La creación in vitro de cartílago hialino articular supone un reto, ya que, a día de hoy, no se ha conseguido la síntesis ex vivo de un tejido estructurado con las mismas propiedades biomecánicas e histológicas del cartílago articular. Para simular las condiciones fisiológicas hemos diseñado un sistema de cultivo in vitro que reproduce el movimiento articular.
Material y métodoHemos desarrollado un biorreactor de cultivo celular que imprime un estímulo mecánico sobre una matriz de elastina en la que están embebidas células troncales mesenquimales (MSC). La primera fase de estudio corresponde al desarrollo de un biorreactor para cultivo de cartílago hialino y la comprobación de la viabilidad celular en la matriz de elastina en ausencia de estímulo. La segunda fase del estudio engloba el cultivo de MSC bajo estímulo mecánico y el análisis del tejido resultante.
ResultadosTras el cultivo bajo estímulo mecánico no obtuvimos tejido hialino por falta de celularidad y desestructuración de la matriz.
ConclusiónEl patrón de estímulo utilizado no ha resultado efectivo para la generación de cartílago hialino, por lo que se deberán explorar otras combinaciones en futuras investigaciones.
The in vitro creation of hyaline joint cartilage is a challenge since, to date, the ex vivo synthesis of a structured tissue with the same biomechanical and histological properties of the joint cartilage has not been achieved. To simulate the physiological conditions we have designed an in vitro culture system that reproduces joint movement.
Material and methodWe have developed a cell culture bioreactor that prints a mechanical stimulus on an elastin matrix, in which mesenchymal stem cells (MSC) are embedded. The first phase of study corresponds to the development of a bioreactor for hyaline cartilage culture and the verification of cell viability in the elastin matrix in the absence of stimulus. The second phase of the study includes the MSC culture under mechanical stimulus and the analysis of the resulting tissue.
ResultsAfter culture under mechanical stimulation we did not obtain hyaline tissue due to lack of cellularity and matrix destructuring.
ConclusionThe stimulus pattern used has not been effective in generating hyaline cartilage, so other combinations should be explored in future research.
El cartílago articular hialino presenta una compleja estructura tisular que le confiere sus propiedades biomecánicas. Han sido muchos los intentos de cultivo in vitro para obtener este tejido, pero ninguno ha logrado, a día de hoy, reproducir la arquitectura tisular que se traduce en sus cualidades de alta resistencia a fuerzas de compresión, deslizamiento y lubrificación.
Los condrocitos, células cuyo origen se encuentra en las células madre mesenquimales (MSC), se hallan distribuidos en una matriz de colágenoII y proteoglicanos que ellos mismos producen siguiendo el patrón descrito por Benninghoff1.
El interés en el cultivo in vitro de este tejido radica en la creciente prevalencia de las lesiones condrales, tanto por el envejecimiento poblacional y el desarrollo de artrosis como por el aumento de actividades deportivas, que favorecen lesiones del cartílago. Disponer de un tejido sano para poder sustituir el enfermo sería el inicio de la terapia tisular y bioingeniería en el tratamiento de la enfermedad del cartílago.
Como muchos estudios previos ya han demostrado, el estímulo mecánico favorece la producción de matriz extracelular (MEC) de cartílago hialino2,3. Además produce un aumento de la proporción de proteoglicanos y colágenoII. Lo que no se ha conseguido es la reorganización de esas fibras en haces.
Existen estudios previos en los que se aplica un estímulo mecánico (compresión directa, cizallamiento, presión hidrostática, flujo de fluido superficial), para los cuales han sido diseñados biorreactores de diferente índole4. La mayoría de los biorreactores ejercen de forma monoaxial y solo unos pocos combinan presión y cizallamiento5-7.
Nosotros partimos de la hipótesis de que el estímulo mecánico cíclico ayuda a la diferenciación celular hacia condrocito y a la reorganización de la matriz extracelular. Empleando la tecnología de impresión 3D hemos diseñado un biorreactor que permite realizar de forma independiente el estímulo de compresión directa y el estímulo de cizallamiento.
Para la nutrición celular existen muchos medios de cultivo disponibles, de los cuales hemos elegido el Dulbecco's Modified Eagle Medium (DMEM), con el que ya se han realizado estudios bajo presión de células mesenquimales y de cultivos de condrocitos5,7,8, y el NH-Chondrodiff® para la diferenciación de células mesenquimales a condrocitos, medio que también ha sido probado en otros estudios para tal fin9.
Las células mesenquimales o condrocitos deben incluirse en una matriz que haga de soporte. La matriz ideal debe tener resistencia suficiente, permitir la supervivencia (biocompatible) y expansión celular y ser degradable para poder ser sustituida a largo plazo por el producto de nuestras células10. La ingeniería tisular ha estudiado múltiples biomateriales —naturales, polímeros y cerámicos— para el cultivo celular. Entre los biomateriales naturales encontramos matrices de colágeno, ácido hialurónico o matriz extracelular descelularizada. Los biomateriales cerámicos, como hidroxiapatita o fosfato de calcio, como materiales osteoinductores. Por último, los polímeros, como el ácido poliglicólico (PGA), el ácido poliláctico (PLA), muy hidrófobos, o los polímeros hidrogeles, con gran capacidad de hidratación y menor afectación de la MEC11. Para nuestro trabajo buscamos un hidrogel capaz de soportar las fuerzas a las que se iba a someter y que hubiese demostrado ya viabilidad celular para cultivos, eligiendo un recombinámero de elastina.
Material y métodosSistema de cultivoEl sistema de cultivo celular empleado está constituido por: biorreactor, matriz de cultivo y elementos celulares.
Desarrollo del biorreactorPara poder llevar a cabo nuestro experimento hemos creado un biorreactor que simula en la medida de lo posible el entorno natural del condrocito. Para ello hemos diseñado un biorreactor que cumple los requisitos necesarios para mantener la viabilidad de células en cultivo y además consta de los elementos mecánicos que aplican los estímulos de compresión y cizallamiento manteniendo las condiciones de esterilidad e incubación. El diseño del biorreactor se realizó mediante el software Tinkercad®. A continuación, las piezas fueron impresas en 3D. Para ello empleamos filamento de tereftalato de polietilenglicol (PETG). Este material fue elegido dado que no es tóxico para las células y es compatible con las condiciones ambientales de incubación (temperatura 37°C, 5% CO2, humedad del 80%). El biorreactor consta de un mecanismo con partes móviles, mediante las cuales un pistón entra en contacto con la superficie del cultivo celular y es capaz de realizar movimientos de compresión axial y rotación (cizallamiento). Este mecanismo es llevado a cabo mediante tres servos y un procesador (HiTec HS-65MG®, Arduino UNO). La duración y la magnitud de dichos estímulos es controlada a través de un programa informático creado por los autores. Dicho programa nos permite ajustar el código para modificar los intervalos de tiempo entre estímulos, así como la magnitud de la compresión y grados de cizallamiento (fig. 1).
Para asegurar que la magnitud del estímulo de compresión fuese similar en todos los cultivos se llevó a cabo un proceso de calibración realizando una medición de las fuerzas de compresión en un pocillo creado a tal fin con un sensor resistivo (FRS).
La presión elegida para someter a nuestro cultivo la hemos basado en experimentos previos en los que se ha demostrado un inicio de producción de matriz de colágenoII y producción celular de glicosaminoglicanos y proteoglicanos propios del cartílago articular cuando las MSC eran sometidas a presiones en un amplio rango (0,5-10MPa)8 y con más frecuencia a 5Mpa12-14. Esto, traducido en unidades de masa-fuerza, equivaldría a estímulos entre aproximadamente 50 y 1.100g fuerza/cm2. Elegimos una cifra máxima de presión que se encontrase en el rango (300g/cm2) que es capaz de imprimir el servomotor.
La frecuencia de cizallamiento la hemos basado en la mayoría de publicaciones en las que el estímulo se realiza a 1Hz, ya que es la más frecuentemente empleada en publicaciones previas15.
Previo a su uso, todo el conjunto (biorreactor, pocillos de cultivo y componentes electrónicos) fueron esterilizados mediante óxido de etileno y almacenados en paquetes sellados estériles.
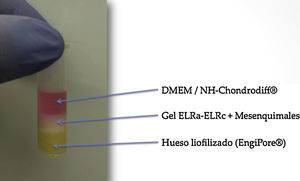
Matriz de cultivoEs el medio de soporte en el cual cultivaremos las células. Este constructo consta de tres componentes: una base de masilla de matriz ósea desmineralizada, un hidrogel en el que van embebidas las MSC, y el medio de cultivo que difunde para aportar nutrición a las células (fig. 2).
En las fases iniciales el diseño consistió en una base de hidroxiapatita (discos de hidroxiapatita obtenidos mediante corte de un cilindro de hidroxiapatita Engipore®). En un primer test se apreció una excesiva porosidad que resultaba en una desestructuración de la matriz, por lo que se sustituyó este elemento por matriz ósea desmineralizada de hueso humano en masilla (DBM putty SteriFuse®), menos porosa y que impedía la migración del gel de cultivo. El resto de cultivos se realizaron empleando este método.
La matriz elegida para plantar las MSC fue el gel ELRc-ELRa (Bioforge®). Es un gel recombinámero tipo elastina (ELR) que a bajas temperaturas se encuentra en estado líquido y a partir de la temperatura de transición (4°C) solidifica, pasando a un estado hidrófobo, dotando al gel de las propiedades biomecánicas que tolerarán el estrés del biorreactor. La preparación del gel ELRc-ELRa (Bioforge®) se realiza en eppendorf a baja temperatura (introducidos en hielo seco). Mientras el estado es líquido, nos permite la plantación de MSC. Una vez solidificado, a temperatura ambiente, las células quedan distribuidas por el gel recombinámero de elastina.
Como medios de cultivo usamos Dulbecco's Modified Eagle Medium (DMEM) como medio estándar y NH-Chondrodiff® como medio de diferenciación condral.
Obtención de las células madre mesenquimalesLas muestras de MSC fueron obtenidas, previo consentimiento informado y aprobación del Comité de Ética, mediante punción aspiración de cresta ilíaca anterior procedente de pacientes sanos. La técnica y los protocolos de extracción fueron los mismos que los descritos en nuestros estudios previos9,16.
La caracterización de las MSC se hará acorde con los criterios descritos por la Sociedad Internacional de Citoterapia17.
Cultivos de controlA continuación se realizó un cultivo de control en un biorreactor estándar. El objetivo de este control era comprobar el comportamiento y la viabilidad de las MSC en el gel ELR y la presencia del disco de hidroxiapatita.
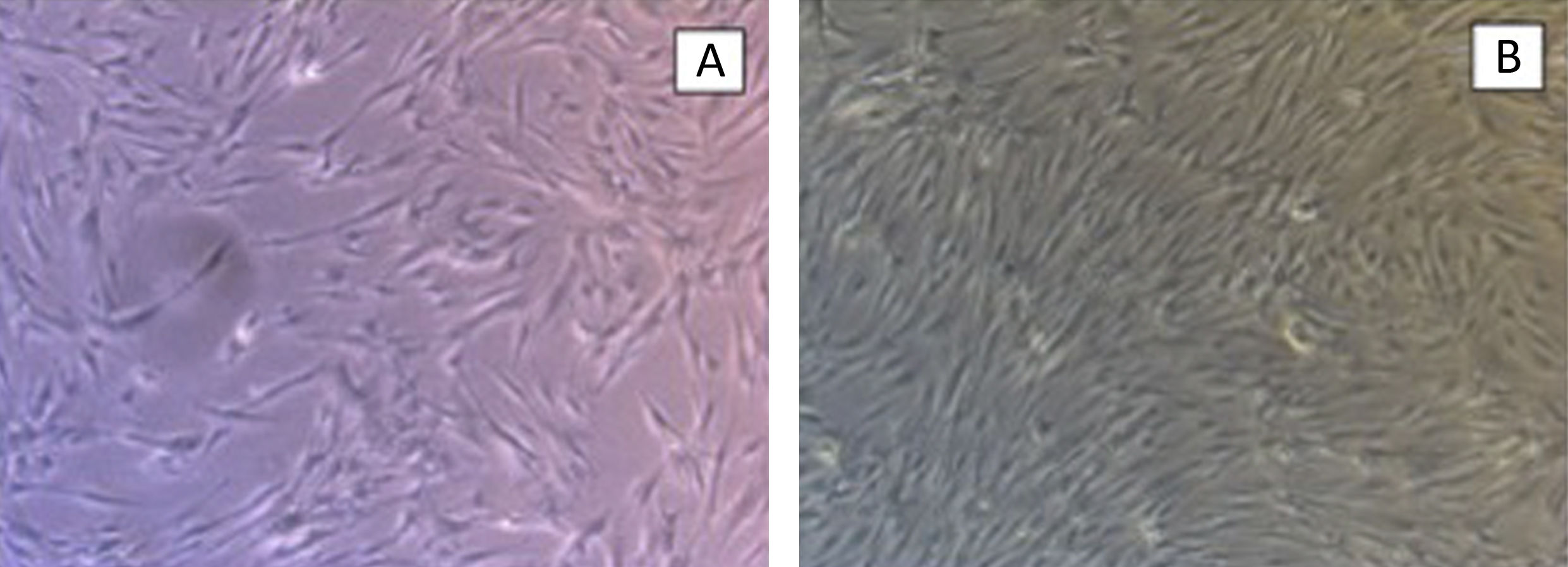
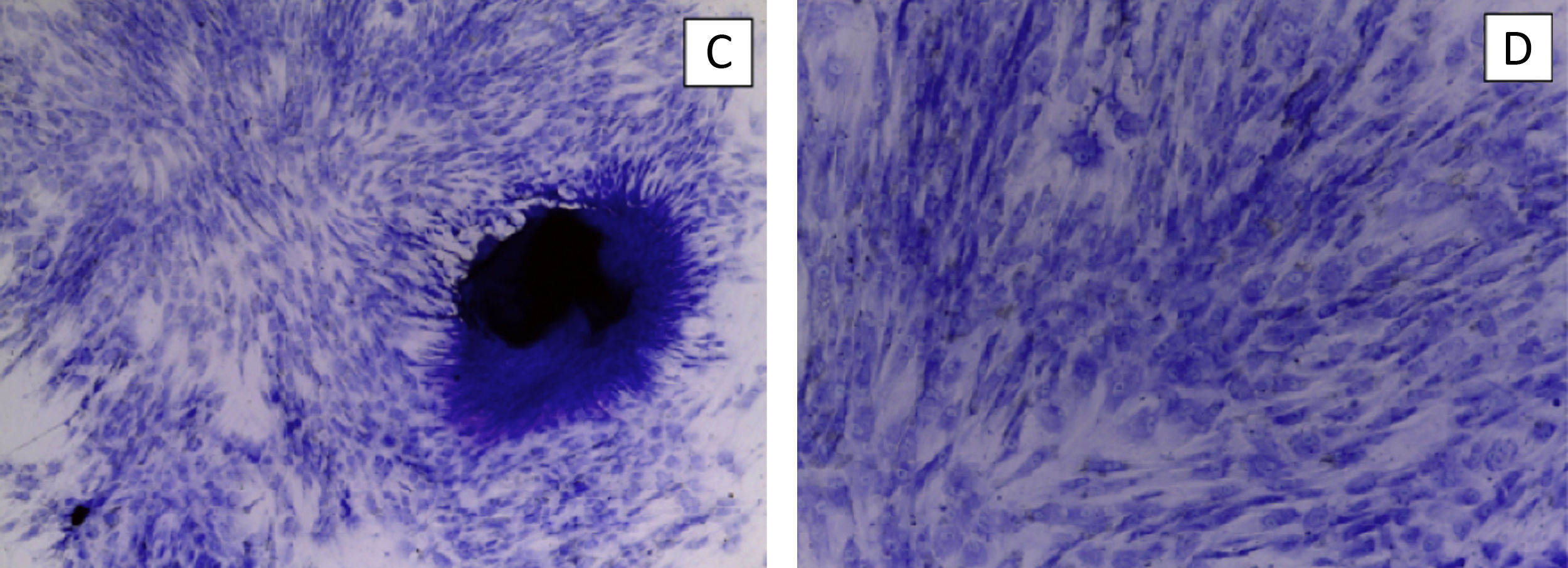
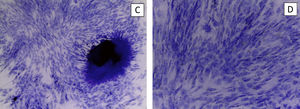
En pocillo de cultivo, se coloca la base de hidroxiapatita, el gel recombinámero de elastina con las MSC embebidas en él y DMEM. Se mantiene el cultivo durante 21días cambiado el medio 3veces a la semana. El cultivo se retira para realizar cortes histológicos y tinción con hematoxilina-eosina y así comprobar la viabilidad celular (fig. 3).
Realizamos la misma operación con medio de cultivo NH-Chondrodiff® observando también la supervivencia celular y la diferenciación de MSC a condrocito (fig. 4).
Cultivos bajo estímulo mecánicoSe realizaron dos líneas de cultivo: A)MSC en gel ELR con medio DMEM sometidas a ciclos de compresión y cizalla, y B)MSC en gel ELR con medio NH-Chondrodiff® sometidas a ciclos de compresión y cizalla. Durante este trabajo solo se expondrá la investigación correspondiente a la líneaA.
Tras la expansión de las células mesenquimales y su sembrado en el gel ELR a una concentración de 80.000 células/400μl, dejamos el cultivo en el pocillo con DMEM durante 7días para permitir la estabilidad celular en el nuevo medio de cultivo. A partir del día8 se ensambla el pocillo de cultivo en el biorreactor de estímulo mecánico e iniciamos los ciclos de presión y cizalla.
El estímulo mecánico de compresión se programó para aplicar una presión de 300mg/cm2, y el estímulo de cizallamiento para una rotación de 180° en posición de máxima compresión durante 3ciclos, durante un total de 30segundos. Este proceso se repite cada 10min, durante 3semanas, pausando el proceso únicamente para el cambio de medio de cultivo.
Cumplido el día 30, retiramos el biorreactor y desmontamos las muestras del pocillo, incluyéndolas en parafina, para realizar cortes histológicos y tinción con hematoxilina-eosina.
Durante todo el tiempo de cultivo el medio DMEM se cambia cada 2-3días y la manipulación del biorreactor y células se realiza bajo campana de flujo laminar. El biorreactor trabaja en la incubadora a 37°C.
ResultadosLos grupos control fueron cultivados durante 21días, observando la adecuada proliferación y supervivencia celular de MSC y condrocitos, sin estímulo mecánico.
A continuación se realizaron un total de 5cultivos, todos ellos correspondientes al grupo de MSC en gel ELR con medio DMEM sometidas a ciclos de compresión y cizalla (grupoA).
El primer cultivo fue el correspondiente al diseño inicial con disco de hidroxiapatita. Tras la primera semana observamos que la hidroxiapatita se deshizo en gránulos y el gel se interdigitó entre ellos. No pudimos realizar cortes histológicos, así que usamos la muestra para analizarla con microscopía electrónica de barrido. No observamos células en la superficie de la hidroxiapatita y el gel estaba desestructurado.
Ante estos resultados, como se ha comentado previamente, se cambió el diseño del estudio procediéndose a sustituir el disco de hidroxiapatita por una masilla de hueso humano liofilizado (DBM putty SteriFuse®).
Los tres siguientes cultivos se llevaron a cabo de forma completa. En las muestras obtenidas al final del proceso observamos una presencia celular mínima en el gel y la rotura de la interfaz hidroxiapatita-gel ELR. En una de ellas las células estaban distribuidas en forma de agregados celulares. No fue posible realizar comprobaciones de diferenciación celular.
La última muestra se contaminó con hongos en la segunda semana de cultivo y fue desechada.
En todas las muestras la matriz ELR a partir de los pocos días tras el inicio del estímulo mecánico aparecía adelgazada y débil, no superando el espesor de 1mm.
Tras los cinco experimentos de la líneaA paramos el estudio, debido a los problemas detectados.
DiscusiónNuestra hipótesis parte de la observación de la movilidad fetal durante el embarazo. El inicio de los movimientos fetales generales se inicia a las 9semanas de gestación. Estos movimientos permiten delimitar las zonas articulares y el desarrollo de las articulaciones sinoviales a partir de núcleos de células mesenquimales. Así, la presión intrauterina, sumada a la movilidad de cizalla y a la presión ejercidas por la musculatura fetal sobre la zona donde se alojará la futura articulación, van a permitir el desarrollo de las articulaciones y, por consiguiente, del cartílago articular18-20.
Ya son numerosas las publicaciones en las que se realiza un estímulo mecánico de cultivos celulares condrales para la obtención de cartílago hialino articular.
Los estímulos mecánicos encontrados serán la presión directa, el cizallamiento, la presión hidrostática y el flujo de un fluido por la superficie3,21-23.
Muchos de los modelos presentan diseños de estímulo unidireccional. Otros usan la presión hidrostática sin comprimir directamente las células. Y en los que el mecanismo es combinado no diferencian el componente de cizallamiento de aquel de presión7,24,25. En algunos de los modelos en los que combinan presión y cizallamiento una de las superficies es curva, de manera que las presiones no son homogéneas en toda la superficie de cultivo5,6.
En todos ellos, la mayoría cultivados a 21días, no se obtiene un tejido con una estructura histológica que presente el orden de fibras en haces verticales en la profundidad y paralelos en la superficie.
Nuestro biorreactor permite independizar el movimiento de cizallamiento y presión, simula una leve presión hidrostática hasta que desciende la columna de estímulo vertical. Cuando contacta con el cultivo comienza el estímulo por presión directa.
En cuanto a la fuente celular elegida, las MSC están presentes principalmente en la médula ósea y tienen una gran plasticidad que les permite su diferenciación a tejido adiposo, cartílago y hueso.
Decidimos el empleo de esta fuente celular ya que son las células que encontramos en el embrión cuando inicia sus movimientos26. Además, son fáciles de expandir y conservar y ya han sido empleadas bajo estímulos mecánicos, demostrando la capacidad de producción de matriz extracelular de tejido cartilaginoso2,3.
Para la elección de la matriz, buscamos aquella que tuviera una resistencia al estímulo mecánico, sólida a 37°C y que permitiera la supervivencia y la proliferación celular, así como la difusión de nutrientes. La nanotecnología ha desarrollado matrices de polímeros recombinámeros capaces de generar entramados de elastina a la que se pueden añadir secuencias de degradación. Estas matrices, resistentes en mayor o menor medida a estímulos de compresión y cizalla, líquidas a temperaturas por debajo de los 4°C y sólidas a 37°C, respondían a nuestras necesidades27. Es interesante también su capacidad de autodegradación, ya que, una vez que los condrocitos empiecen a sintetizar matriz, esta debe ser la que empiece a dotar a la estructura de consistencia y capacidad de tolerancia al estímulo físico. La supervivencia celular en ellas fue adecuada en los experimentos sin presión ni cizalla, pero encontramos un adelgazamiento de la matriz a los pocos días del inicio del estímulo mecánico. Asimismo observamos una baja celularidad en los cortes histológicos.
En cuanto a la resistencia de la matriz, a día de hoy no existen estudios para conocer la carga máxima que tolera, pero el haber tenido un pocillo transparente nos hubiese permitido ver su colapso y relacionarlo con un exceso de compresión axial.
Para investigar la baja celularidad de los cortes histológicos de los cultivos realizados bajo las condiciones descritas de presión y cizallamiento, buscamos los lugares donde podían estar las MSC. Por un lado, sometimos el pocillo de PETG a lavado y tripsinización. Al tripsinizarlo (proceso por el cual las MSC se despegan del PETG) y mirar bajo microscopía óptica, vimos muchas de las MSC. Nos dimos cuenta de que las células no habían muerto ni desaparecido, se habían adherido al PETG, plástico por el que las MSC presentan, por naturaleza, gran avidez. Creemos que las células migraron a través de los poros del gel, ayudadas por la compresión que se estaba realizando sobre ellas. Cuando llegaron a las paredes del pocillo se adhirieron a ellas.
El resto de células que no encontramos al tripsinizar creemos que pudieron perderse en los cambios de medio DMEM o por rebosamiento del pocillo.
La hidroxiapatita tiene, como primer objetivo, imitar el ambiente del condroblasto que en las capas más profundas se encuentra cerca del tejido óseo, y, como reto, conseguir una capa de transición de hueso a cartílago dotando al proyecto un carácter traslacional, ya que sería posible la implantación de un injerto osteocondral generado in vitro.
En nuestro caso tuvimos dificultad en el corte histológico de grandes partículas de hidroxiapatita y creemos que puede ser causa de migración celular hacia la fase mineral previa a la estabilización del cultivo condral, lo que explicaría la baja celularidad en los cortes histológicos. En el próximo protocolo de cultivo eliminaremos este factor hasta controlar la matriz y la estabilización celular.
Otros autores han empezado a dar soluciones a la creación de una interfaz con el empleo de nanopartículas o con gradientes de concentración químicos más favorables para la diferenciación condral u ósea28-30.
Pensamos que el hecho de que la matriz se haya desestructurado puede ser debido a un exceso de presión sobre el cultivo. Tendremos que readaptar el peso ejercido hasta que la matriz empiece a desarrollar propiedades mecánicas con la activación de las MSC y su propia producción de matriz extracelular.
En cuanto a los periodos de cizallamiento, no están definidos los periodos de pausa entre los que se deberían producir los ciclos de movimiento. Si atendemos de nuevo al movimiento sacádico fetal, las pausas que realizan entre ciclos de movimiento oscilan entre los 13 y los 45min según el momento de gestación. Si estos movimientos son los que estimulan la formación articular, y por ende el cartílago hialino, deberíamos adaptar estos periodos de pausa en los ciclos de movimiento de presión y cizalla18,19
ConclusionesEl estímulo mecánico favorece la formación de productos de matriz extracelular de cartílago hialino, como ya se ha demostrado en experimentos previos, pero a día de hoy no se ha conseguido la organización estructural del colágeno en arcos de Benninghoff. Seguimos sin conocer los efectos que tienen la compresión y el cizallamiento.
Nuestro experimento ha resultado fallido al obtener una baja celularidad y una desestructuración de la matriz por un error en el diseño del biorreactor, una baja consistencia del gel y la dificultad de procesamiento de muestras en presencia de hidroxiapatita.
Para la próxima fase, ya hemos realizado cambios en el biorreactor para corregir las deficiencias del descrito en este estudio. Los pocillos son más altos para impedir la fuga de medio de cultivo y son de poliestireno en vez de PETG, que es transparente y genera menor adhesión celular.
El gel va a ser sustituido por otro de mayor resistencia y menor porosidad (estamos estudiando los geles disponibles que se adapten mejor a nuestras necesidades) y vamos a eliminar el componente de hidroxiapatita o hueso liofilizado.
Esperamos que un nuevo estudio bajo la introducción de estos cambios aporte resultados satisfactorios.
FinanciaciónEconómicamente el trabajo ha sido posible gracias a la Beca para la Investigación SECOT. Asimismo, la empresa BioForge (Universidad de Valladolid) ha cedido sus matrices de recombinámeros de elastina para la construcción de las matrices de cultivo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.