La lesión medular (LM) traumática conlleva aumento de la presión intramedular, pudiéndose reducir mediante durotomía y duroplastia. El objetivo del estudio es evaluar la fibrosis y la extensión de la lesión en cerdos con LM sometidos a duroplastia y relleno del defecto tisular con ácido hialurónico (AH).
Material y métodosEstudio experimental. Elaboramos un modelo de LM porcino mediante durotomía y hemisección medular con exéresis de un segmento cervical (1cm). Se emplearon 6 cerdos (Sus scrofa domestica), evaluándose tres escenarios quirúrgicos: 1)lesión control con microcirugía reparativa dural; 2)duroplastia mediante pericardio bovino (DPB), y 3)situación anterior asociando aplicación de AH en la zona de lesión. Los animales fueron sacrificados 1mes post-lesión para evaluar la fibrosis y el estado del tejido neural por técnicas de histología convencional e inmunohistoquímica.
ResultadosEn la situación control, la sutura dural previno la invasión de la lesión por tejido conectivo extradural, presentándose engrosamiento meníngeo de 1mm en la zona perilesional. El parche de pericardio bovino también bloqueó la entrada de fibroblastos extradurales, relajó la tensión de la duramadre y se integró satisfactoriamente con el tejido receptor. Sin embargo, también incrementó la fibrosis subdural y perilesional, y dicha fibrosis no fue inhibida por la aplicación de AH de bajo o alto peso molecular en el defecto medular.
ConclusiónLa DPB previene el colapso de la duramadre sobre el tejido medular lesionado, así como la invasión de la lesión por tejido fibrótico extramedular, sin causar daño neural adicional. Sin embargo, incrementa la fibrosis dentro y alrededor del defecto medular. Se requieren tratamientos antifibróticos adicionales para facilitar la reparación de la médula espinal.
Traumatic spinal cord injury (SCI) leads to increased intraspinal pressure that can be prevented by durotomy and duroplasty. The aim of the study was to evaluate fibrosis and neural damage in a porcine model of SCI after duroplasty and application of hyaluronic acid (HA) in the tissue cavity.
Materials and methodsExperimental study. We created a porcine SCI model by durotomy and spinal cord hemisection of a cervical segment (1cm). Six pigs (Sus scrofa domestica) were used to evaluate three surgical scenarios: (1)control injury with dural reparative microsurgery, (2)duroplasty using bovine pericardium (BPD), and (3)previous method plus HA applied at the lesion. Animals were sacrificed one-month post-injury to assess fibrotic responses and neural tissue damage using conventional histological and immunohistochemical methods.
ResultsIn the control case, dural suture prevented invasion of the lesion by extradural connective tissue, and the dura mater showed a 1-mm thickening in the perilesional area. The bovine pericardium patch blocked the entrance of extradural connective tissue, decreased dura-mater tension, and satisfactorily integrated within the receptor tissue. However, it also enhanced subdural and perilesional fibrosis, which was not inhibited by filling the lesion cavity with low- or high-molecular-weight HA.
ConclusionsDuroplasty prevents collapse of the dura-mater over the spinal cord tissue, as well as invasion of the lesion by extramedullary fibrotic tissue, without creating additional neural damage. Nevertheless, it enhances the fibrotic response in the spinal cord lesion and the perilesional area. Additional antifibrotic strategies are needed to facilitate spinal cord repair.
La fibrosis peridural (FP) e intradural es un fenómeno cicatricial con una alta incidencia tras traumatismos raquimedulares o cirugía electiva de raquis, y no se conoce ningún procedimiento clínico eficaz para prevenir su aparición. El origen celular de la fibrosis es diverso, participando principalmente los fibroblastos del tejido conectivo extramedular y células meníngeas, así como los pericitos y fibroblastos perivasculares del propio parénquima neural1-4.
La fibrosis contribuye de forma determinante al fallo reparativo axonal en el sistema nervioso central (SNC), constituyendo una barrera mecánica y molecular para la regeneración neural a la vez que limitando la expresión de claves moleculares que de otra forma ayudarían a la reparación tisular3,5,6. Tras la lesión, el tejido fibrótico contribuye a la restauración de los límites tisulares, de manera que se crea una interfase SNC/tejido conectivo por lo general impenetrable para las células neurales1-6. Esto se debe esencialmente a que en el lado neural de la interfase las células neurales poseen moléculas de adhesión para las neuronas y células gliales, además de factores tróficos y muchas otras biomoléculas que retienen a los elementos celulares homotípicos; mientras que en el tejido conectivo no solo son escasas las moléculas pro-regeneradoras, sino que también hay abundancia de reguladores negativos del crecimiento neural, incluyendo semaforinas, proteoglicanos y un entramado denso de matriz extracelular3-5.
Ante una FP establecida y diagnosticada convenientemente, las medidas terapéuticas son escasas. Algunos estudios han evaluado la eficacia de diversos agentes en la prevención parcial de la FP tras una intervención quirúrgica, como son la duroplastia con parches pericárdicos7,8, así como el empleo de geles antifibróticos, siendo en la actualidad un problema clínico no resuelto.
Una de las estrategias empleadas en la actualidad son los geles de ácido hialurónico (AH)9-12. El AH es altamente biocompatible y no produce reacción a cuerpo extraño. Existen datos que reflejan en las primeras fases de reparación tisular altas concentraciones de AH en el espacio extracelular, pudiendo prevenir parcialmente el depósito de matriz colágena9-12. Estos efectos pueden ser explicados por la barrera física que se genera, así como por la regulación inflamatoria. No obstante, el mecanismo molecular por el que el AH previene la adhesión epidural no ha sido descrito en la literatura. También han sido empleados diversos tipos de parche pericárdico7,8. Ambas estrategias han tenido relativo éxito en cuanto a que disminuyen significativamente el tejido cicatricial, pero no evitan la aparición de una interfase con separación entre el tejido neural y el tejido conectivo, y todavía no han sido eficaces para promover la reparación neural.
El objetivo de este trabajo experimental es el desarrollo de una metodología para el control de los fenómenos cicatriciales tras la lesión medular mediante microcirugía reconstructiva de las meninges y aplicación de parche dural. También investigamos el empleo de AH de bajo peso molecular y de alto peso molecular como terapias antifibróticas en la zona lesional.
Material y métodosAnimalesEstudio experimental aleatorizado. La población del presente proyecto lo componen 6 cerdos prepuberales (Sus scrofa domestica) hembras, de 2meses de edad, con un peso medio de 12 a 15kg en el momento de la lesión, distribuidos en tres grupos experimentales. Se ha empleado el cerdo dado su idoneidad por el tamaño medular que presenta, así como por su neuroanatomía y su histopatología, similares a las del humano3,13,14.
Los procedimientos experimentales se han llevado a cabo cumpliendo con las normas de bienestar animal, las recomendaciones de la Comisión Europea y las regulaciones españolas para la protección de los animales de experimentación (86/609/CEE, 32/2007 y 223/1988). Los protocolos fueron aprobados por el Comité Ético de Experimentación Animal de nuestro centro y por la Junta de Comunidades de Castilla-La Mancha (resolución 2859425).
Los animales permanecieron en nuestras instalaciones durante al menos 3semanas desde su llegada para su aclimatación y entrenamiento antes de realizar cualquier procedimiento. Durante este periodo de tiempo fueron acostumbrados a su manejo por el personal del animalario y por los investigadores, así como a llevar arneses que posteriormente se requerían para su rehabilitación.
Metodología general y descripción de los grupos experimentalesLos dos primeros animales de experimentación fueron empleados para la puesta a punto de las distintas técnicas quirúrgicas y procedimientos, y en los siguientes cuatro (numerados 1 a 4) se evaluaron los tratamientos experimentales. El animal1 recibió hemisección medular C6 y microcirugía reparativa dural, siendo este supuesto el empleado como lesión control. En el animal2, tras la durotomía y hemisección medular se procedió a la reparación con pericardio bovino con sutura continua de monofilamento 7-0 bajo microscopio quirúrgico. En los animales3 y4, tras realizarse la hemisección medular, se instilaron en el defecto medular 0,5cc de AH de alto peso molecular (6×106Da) (SynviscOne©) o de bajo peso molecular (Anti AD©), respectivamente, y posteriormente se reparó la duramadre con pericardio bovino con sutura continua de 7-0.
Procedimientos quirúrgicosTras el periodo de adaptación, los animales fueron trasladados al quirófano experimental y recibieron anestesia inhalatoria para la realización de la hemisección medular, siendo el proceso anestésico realizado por el veterinario de nuestro centro. La anestesia fue inducida con una inyección intramuscular (i.m.) de ketamina (10mg/kg), midazolam (0,1mg/kg) y medetomidina (0,02mg/kg), seguido por la administración intravenosa (i.v.) de propofol (3mg/kg). Posteriormente, los animales fueron intubados con un tubo endotraqueal y la anestesia fue mantenida con sevoflurano (1,7%-2%) junto con remifentanilo (26mg/kg/h i.v.) y rocuronio (1,2mg/kg/h i.v.). La ventilación mecánica (Fabius Tiro, Dräger) fue configurada a 12-14 respiraciones/minuto con un volumen tidal de 10-15ml/kg. Además, se monitorizó durante todo el procedimiento el ritmo cardíaco, la presión sanguínea, el dióxido de carbono exhalado, la saturación de oxígeno en sangre y los niveles de sevoflurano inspirados y exhalados.
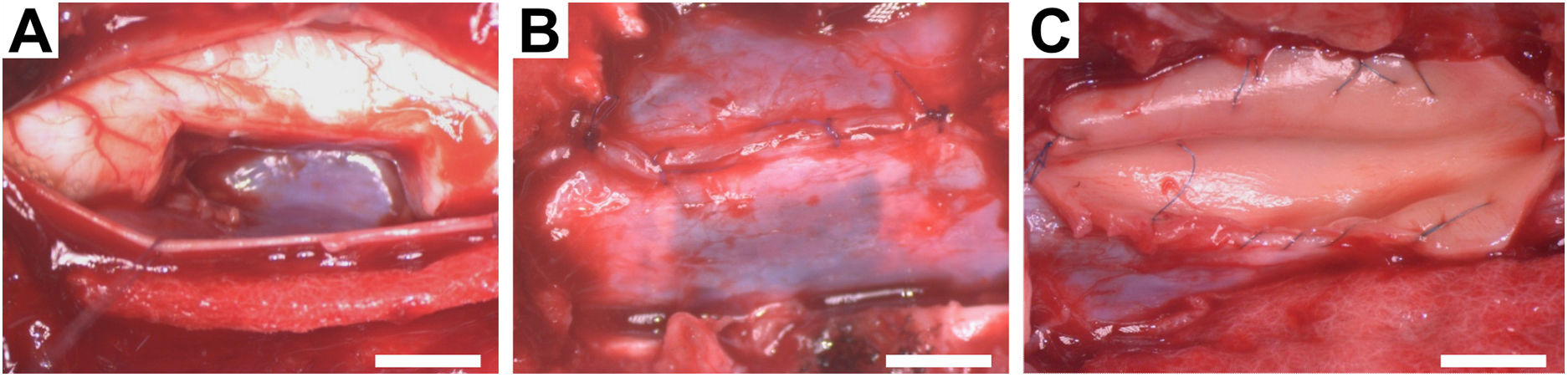
Los animales fueron colocados en decúbito prono. Se preparó el campo quirúrgico rasurando la zona cervical dorsal y aplicando clorhexidina 2% como desinfectante. A continuación, se procedió a la realización del abordaje posterior cervical desde C4 a C7. Se localizó la vértebra cervical C5, procediéndose a la hemilaminectomía con laminotomo del 2 y, bajo microscopio quirúrgico, se practicó una durotomía en línea media con exposición de la aracnoides y de las raíces dorsal y ventral del lado derecho del segmento medular C6. Una vez que se identificó correctamente el segmento C6 se cortaron las raíces dorsal y ventral. Se localizó la línea media y se procedió a realizar la hemisección, mediante la escisión de una porción de 1cm de longitud del lado derecho de la médula espinal (fig. 1). Una vez controlado el sangrado producido por la escisión del tejido se realizó una microcirugía reconstructiva dural con prolene de 7-0, así como la aplicación de la plastia dural bovina sola o con AH en función de la aleatorización. Tras la terapia realizada no se requirió ningún sistema de estabilización espinal cervical, dada la escasa inestabilidad producida y la potente musculatura cervical del cerdo. Se procedió al cierre por planos, empleando una sutura intradérmica en piel para evitar que el animal se autolesionara. Tras la intervención quirúrgica los animales recibieron meperidina (4mg/kg) subcutánea (s.c.) como analgésico cada 12horas durante dos días y marbofloxacino (2mg/kg i.m.) como antibiótico, y meloxicam (0,2mg/kg s.c.) como agente antiinflamatorio durante 7días.
Fotografías intraoperatorias de los procedimientos quirúrgicos. A)Cavidad resultante de la escisión de 1cm de longitud del lado derecho del segmento medular C6. B)Microcirugía reconstructiva dural con sutura continua. C)Aplicación de ácido hialurónico en el defecto medular y plastia dural con pericardio bovino y sutura continua. Barra de escala, 5mm.
En su estabulación posterior se prestaron los cuidados analgésicos necesarios y se asistió a los animales para la alimentación y la hidratación. Los cerdos lesionados requirieron el empleo de silla de ruedas con el objeto de comenzar la movilidad de las extremidades y evitar la atrofia muscular.
Extracción, procesamiento e histología de la médula espinalUn mes tras la lesión, los animales recibieron anestesia inhalatoria y se les realizó laminectomía dorsal de las vértebras C1 a T2. Posteriormente, se les administró una dosis letal de pentobarbital (120mg/kg i.v.), y se extrajo rápidamente la médula espinal cervical, que se sumergió inmediatamente en una solución de paraformaldehído al 4% en tampón fosfato salino (PBS) para su fijación durante 3días a 4°C. Una vez completada la fijación del tejido, se identificaron e individualizaron los segmentos medulares, y se procedió a su crioprotección por inmersión en sacarosa al 30% en PBS por 4días. Finalmente, cada segmento medular se embebió en medio de inclusión para congelación, y se almacenó a −20°C hasta el momento de seccionarlos en el crióstato. Se obtuvieron secciones parasagitales de 50μm de grosor que fueron teñidas con violeta de cresilo, y también secciones de 10μm para inmunohistoquímica combinada de neurofilamento (NF) y receptor-β del factor de crecimiento derivado de las plaquetas (PDGFRβ). El violeta de cresilo tiñe los cuerpos de Nissl y los núcleos, aportando una imagen general del estado de la médula, la muerte neuronal y la presencia de células y cavitación tisular. El neurofilamento tiñe las neuronas y sus axones, y el PDGFRβ, los fibroblastos y pericitos, permitiendo visualizar los bordes de la lesión y la fibrosis. Para la inmunohistoquímica, las secciones de tejido se incubaron 30minutos en PBS con tritón al 1% y suero de cabra al 2%, se enjuagaron tres veces con PBS, y posteriormente se incubaron toda la noche a 4°C con los anticuerpos primarios (NF, Sigma Aldrich N0142, 1:500; PDGFRβ, Abcam AB32570, 1:100) disueltos en PBS con 1% de tritón y 1% de suero. A continuación, los cortes se lavaron e incubaron 2horas con los anticuerpos secundarios marcados con Alexa 488 y 594 (Molecular Probes, 1:500), y también se marcaron los núcleos celulares con Hoechst 33342 (Molecular Probes, 1,5mg/ml en PBS por 15minutos).
ResultadosEstado general de los animalesEn el periodo de seguimiento posquirúrgico de los animales de experimentación no se objetivó ningún proceso infeccioso o necrosis cutánea visible. No hubo pérdidas de animales en el periodo de estudio.
Se han descrito previamente el grado de disfunción de la motricidad tras la hemisección medular cervical en cerdos14. En el presente estudio no se observó pérdida funcional adicional a la causada por la propia lesión medular en ninguno de los animales, indicando que los nuevos procedimientos quirúrgicos de reconstrucción de la duramadre no tienen efectos perjudiciales sobre el curso de la enfermedad.
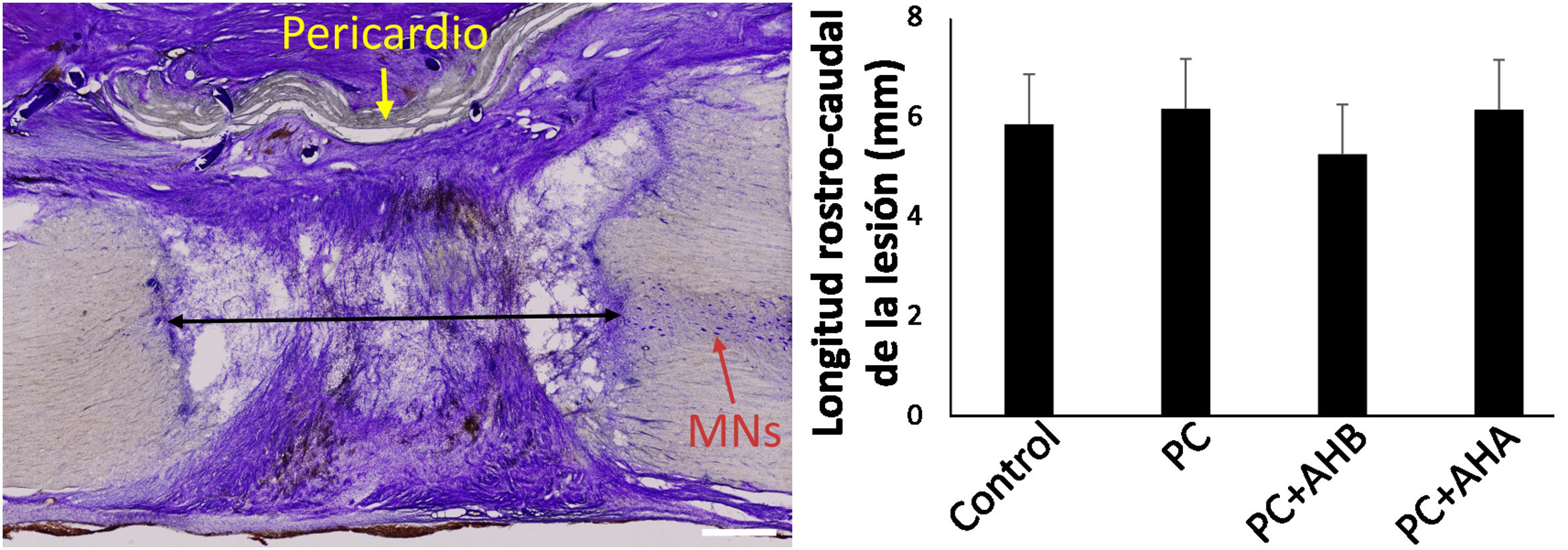
Extensión de la lesiónAl estudio de las muestras mediante tinción con violeta de cresilo 1mes tras la lesión, en la hemisección control se encontró un defecto tisular de aproximadamente 6mm en el plano rostro-caudal de la médula espinal, siendo similar esta longitud en los animales que recibieron la sutura pericárdica bovina con o sin AH añadido (fig. 2), independientemente del peso molecular. En este momento, el pericardio bovino no se había reabsorbido completamente, creando una separación efectiva entre el tejido conectivo extramedular y el interior de la lesión, y permitiendo el análisis de las respuestas celulares a los procedimientos quirúrgicos. Por otra parte, no se apreció necrosis, quistes, u otros signos de patología neural atribuible a la duroplastia o a la administración del AH.
Extensión rostro-caudal del daño medular y apariencia general de la zona lesionada. Izquierda, sección tisular centrada en la lesión medular, procesada para violeta de cresilo. La extensión de la lesión se midió como la distancia al tejido sano entre los muñones rostral y caudal (flecha negra), no habiendo diferencias entre los diferentes grupos de estudio (derecha). MNs, neuronas motoras. Obsérvese el tejido conectivo denso que ha invadido la zona de lesión. Barra de escala, 1mm.
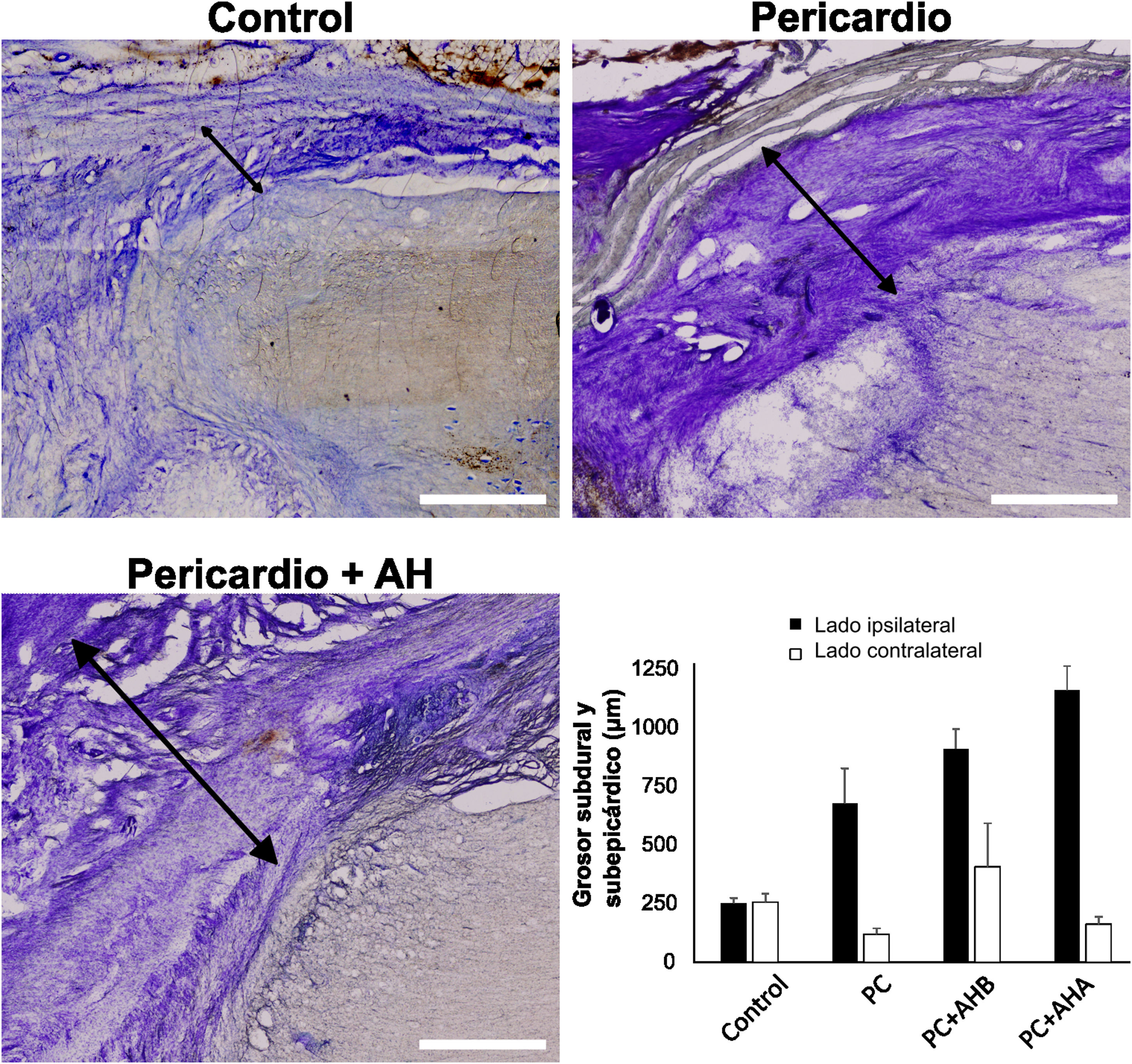
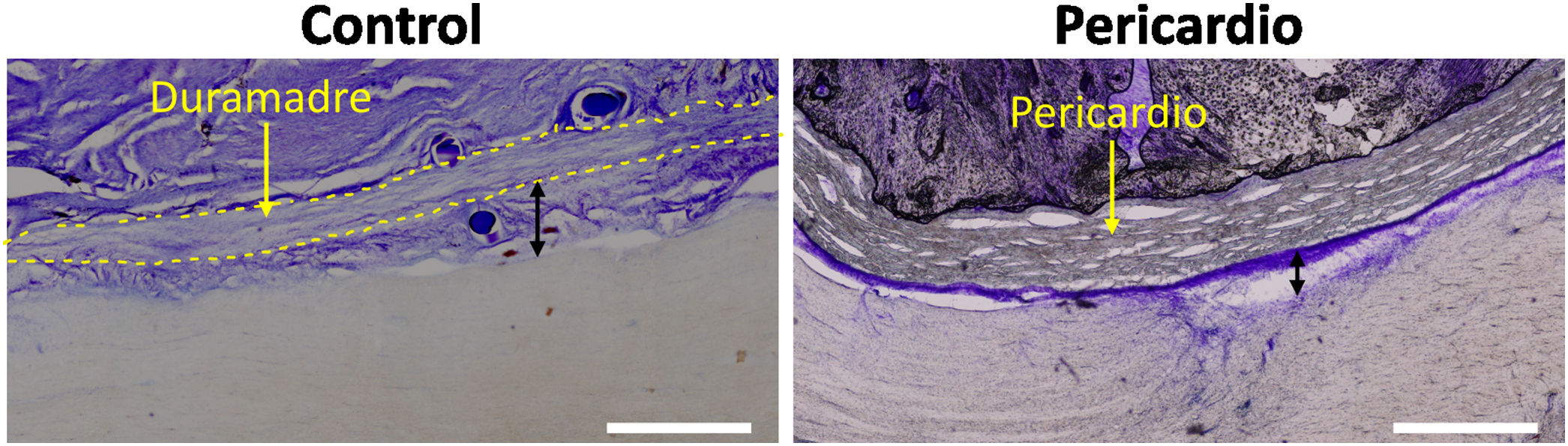
Mediante histología convencional se evidenció que la lesión indujo una proliferación de las células meníngeas, encontrándose una extensa fibrosis meníngea que se extendía al interior del defecto tisular y se fusionaba en el sentido dorsoventral de la médula. El grosor del tejido fibrótico meníngeo subdural fue de aproximadamente 250micras en el lado de la lesión en el caso control, triplicándose en el caso del injerto de pericardio bovino (fig. 3). Dicho engrosamiento subpericárdico alcanzó casi 1mm tras el empleo de AH de bajo peso molecular y más de 1mm en el AH de alto peso molecular.
Tejido conectivo cicatricial subdural y subpericárdico, ipsilateral y contralateral a la lesión. Se muestran secciones histológicas ipsilaterales a la lesión ejemplificando la fibrosis subdural y subpericárdica en los distintos grupos, así como su respectiva cuantificación. El engrosamiento fibrótico se midió entre la médula y la dura/pericardio (flechas negras), siendo, para el lado ipsilateral a la lesión, menor en el control y aumentándose con los procedimientos adicionales. Barra de escala, 1mm.
A pesar del aumento de la fibrosis en los animales tratados con pericardio bovino solo o en combinación con HA, dicha reacción tisular se observó mayoritariamente en el lado lesionado de la médula, mientras que en el lado no lesionado se indujo una mínima respuesta, similar o incluso menor que en la situación control (fig. 4).
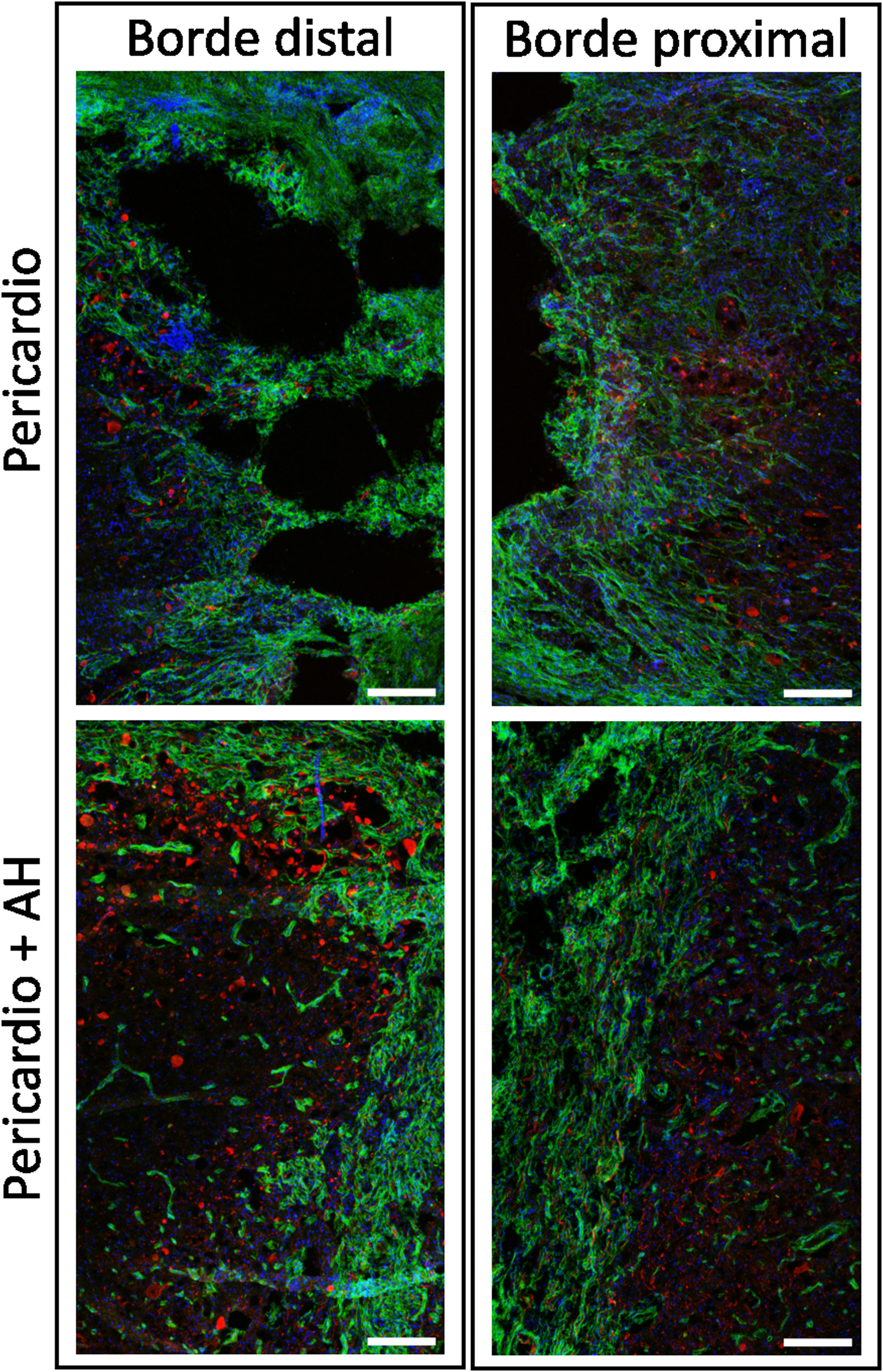
Cicatrización y crecimiento axonalPara obtener una mejor visualización de las células presentes en la cicatriz y la respuesta de crecimiento neural se realizó inmunohistoquímica doble identificando los axones mediante tinción para neurofilamento (NF), y las células fibróticas (fibroblastos y pericitos) mediante tinción para el receptor beta del factor de crecimiento derivado de las plaquetas (PDGFRβ). Al igual que en roedores15 y en humanos16, en la lesión medular porcina las células fibróticas expresaron PDGFRβ y formaron una cicatriz impenetrable para la mayoría de los axones, independientemente del tratamiento recibido (fig. 5). En los animales tratados con HA se observó incluso una mayor reacción fibrótica con orientación transversal en el borde de lesión (fig. 5).
Imágenes de fluorescencia obtenidas con un objetivo de 10× en un microscopio confocal, centradas en los bordes distal y proximal de la lesión, tomadas de secciones de tejido procesadas para PDGFRβ (verde) y NF (rojo). Los núcleos se muestran en azul teñidos con Hoechst. Se observó una densa cicatriz fibrótica positiva para PDGFRβ que imposibilitó el crecimiento axonal (rojo). La cicatriz fue más densa e impenetrable para los axones cuando se aplicó ácido hialurónico en la lesión. Barra de escala, 0,2mm.
La fibrosis peridural e intramedular es un fenómeno frecuente tras traumatismo raquimedular y su reducción es un reto terapéutico. Se han propuesto diversas estrategias terapéuticas, sin conseguir su prevención.
En ausencia de un tratamiento que induzca el crecimiento neural y bloquee la fibrosis intraespinal, el espacio subdural y las cavidades resultantes de la lesión medular se rellenan con tejido fibrótico3. La sutura dural directa atenúa dicho proceso en ratas5,17, evitando la infiltración de la zona lesionada por tejido conectivo proveniente de los ligamentos, del periostio y de otras estructuras espinales. No obstante, no la elimina por completo debido a la proliferación de células fibróticas a partir de los tejidos intradurales, incluyendo las propias células meníngeas1,3,18, pericitos2,6 y fibroblastos perivasculares15. Finalmente, el tejido fibrótico adhiere los bordes de la médula espinal a las meninges y limita la aplicación exitosa de las terapias neurorreparativas3,19.
Por otra parte, la sutura dural disminuye el espacio disponible para introducir posibles implantes neurorreparativos, además de conllevar riesgo de aumento de la presión intraespinal, asociada con isquemia y deterioro neurológico20.
Este efecto potencialmente negativo podría prevenirse mediante duroplastia. Estudios previos han evaluado la respuesta fibrótica en cerdos tras la realización de laminectomía, apertura de la duramadre y aplicación de diferentes tipos de parches durales7,8,21. A nuestro entender, no existen antecedentes de evaluación de una DPB en un modelo de lesión medular porcino. A tenor de los resultados obtenidos en nuestro estudio, esta alternativa terapéutica es de interés para el tratamiento de la lesión medular y debe explorarse con mayor profundidad.
En este estudio preliminar evaluamos la fibrosis subdural y perilesional, así como la extensión de la lesión, en cerdos con lesión medular sometidos a duroplastia con pericardio bovino (DPB) y relleno de defecto tisular con AH. A pesar de que la DPB bloqueó la entrada de tejido fibrótico desde las estructuras extradurales sin evidencia de rechazo inmunológico, el procedimiento aumentó la fibrosis en el interior de la lesión y dicha fibrosis no fue inhibida por la aplicación de AH en el defecto tisular. El entorno de la zona medular traumatizada es proinflamatorio en la fase aguda, y en estas condiciones la apertura de la duramadre y el injerto de pericardio bovino probablemente potenciaron la proliferación y la migración de fibroblastos y otras células del tejido conectivo a la lesión. Además, en ausencia de un tratamiento que induzca el crecimiento neural, el mayor espacio disponible tras la duroplastia se rellenó con tejido fibrótico. Estos resultados indican que la DPB puede utilizarse para reducir la tensión mecánica tras un trauma medular e incorporar implantes en la zona de lesión, pero debe acompañarse de tratamientos antifibróticos efectivos que faciliten la reparación neural.
Este estudio preliminar se ha centrado en la evaluación del efecto de la DPB sobre la fibrosis subdural, perilesional e intralesional, puesto que estos elementos cicatriciales contribuyen al fallo regenerativo axonal tras la lesión medular y su control es indispensable para el desarrollo de un tratamiento neuroreparativo3,5. No obstante, es esperable que la DPB y su efecto de barrera también influyan en las reacciones histológicas de la propia duramadre y en la fibrosis extradural. Estos aspectos de gran relevancia clínica22 no se han abordado en el presente estudio y requieren una metodología experimental específica, incluyendo la utilización de marcajes específicos para los distintos tipos de células meníngeas y del tejido conectivo23.
Dentro de las limitaciones existentes en el estudio también se reflejan el número reducido de sujetos experimentales utilizados, así como su seguimiento a solo un mes tras la lesión. La utilización de casos únicos en cada grupo no permite controlar apropiadamente la variabilidad individual en la respuesta a los procedimientos quirúrgicos. Se han descrito variaciones interpersonales en la formación de cicatrices posquirúrgicas hipertróficas24, y desconocemos si un fenómeno similar podría tener lugar en nuestro modelo porcino. Sin embargo, la utilización de animales del mismo proveedor, así como la reproducibilidad de la extensión de la fibrosis observada en el mismo tipo de animales sometidos a una lesión medular por contusión3, disminuyen dicha posibilidad. Además, cabe resaltar que las principales respuestas histológicas fueron similares en los tres animales que recibieron DPB, incluyendo la ausencia de mayor daño tisular, de inflamación crónica alrededor del injerto, de compresión medular, y el aumento de la fibrosis.
Por otra parte, los animales fueron sacrificados al mes post-lesión, momento en el cual el pericardio bovino aún no se había reabsorbido completamente. Sería deseable realizar la evaluación histológica a más largo plazo, cuando ya no existan restos del implante, así como utilizar un número mayor de animales y sacrificarlos en diferentes tiempos para analizar la evolución de la fibrosis. A pesar de estas limitaciones, es relevante mencionar que, en los cerdos prepuberales utilizados, un mes de evolución equivale a aproximadamente dos años humanos13. Por consiguiente, las respuestas histológicas observadas probablemente corresponden al estadio crónico y proporcionan información clínicamente relevante.
Finalmente, cabe mencionar la posibilidad de que otros geles22 o esquemas farmacológicos que han demostrado efecto antifibrótico tras una lesión medular en roedores19 permitan la aplicación de la DPB sin incrementar la invasión de la zona dañada por tejido conectivo. De esta manera, se podría aumentar la utilidad clínica de la DPB, limitando las consecuencias negativas de la fibrosis y facilitando las respuestas neurorreparativas en lesiones de la médula espinal.
ConclusionesLa fibrosis en el defecto medular no fue inhibida por la aplicación de AH de bajo o alto peso molecular. La DPB previene el colapso de la duramadre sobre el tejido medular lesionado, así como la invasión de la lesión por tejido fibrótico extramedular, sin causar daño neural adicional. Sin embargo, incrementa la fibrosis dentro del defecto medular, haciéndose necesaria la utilización de tratamientos antifibróticos adicionales en conjunción con las terapias neurorreparativas para la lesión medular.
Nivel de evidenciaNivel de evidencia I.
FinanciaciónEl presente proyecto de investigación ha recibido ayudas específicas provenientes de becas de investigación de la Sociedad Española de Cirugía Ortopédica y Traumatología (SECOT) y Sociedad Española de Cirugía de Columna Vertebral (GEER) para su elaboración.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.