Existendiferentes opiniones sobre la etiología y patogenia delaflojamiento protésico. Fundamentalmente se agrupan en dostendencias: a) protagonismo de los factores biológicos quesuceden inmediatamente después del implante de laprótesis y que permiten o no una buena estabilidadinicial,27,35,41 y b) destacar el papel de laspartículas de desgaste de los materiales protésicoscuando alcanzan la interfaz hueso-implante,16,25,26,46ya que parece establecido que las partículas de desgasteinducen una reacción a cuerpo extraño con presenciade células gigantes ymacrófagos.16,25,26,46 Estos macrófagos,cuando fagocitan las partículas, son activados y puedenliberar mediadores que activan a los osteoclastos,iniciándose el proceso de osteolisisperiprotésica.13,14,19,29,31,44
Losprimeros datos sobre la presencia de partículas de desgasteen ganglios linfáticos y en vísceras a distancia,provienen de los trabajos experimentales de Walker yBullough42 y de Mendes y cols.24 a principiosde los años 70. Willert y cols.45 postularon quelas partículas de desgaste producidas en las diferentesinterfaces de las prótesis eran eliminadas por víalinfática. Cuando la producción de partículassobrepasaba la capacidad de drenaje linfático, laspartículas se acumulaban en la interfazhueso-prótesis y desencadenaban procesos dereabsorción del hueso periprotésico y finalmente elaflojamiento del implante. En los últimos años se hanacumulado evidencias de que al menos una parte de laspartículas producidas en las interfaces protésicassiguen un drenaje linfático y pueden acumularse en gangliosa distancia2,3,18,20,23,28,37,39,40 e incluso provocarefectos patológicos sobre los mismos.7,33,34 Elefecto de las partículas de polietileno producidas en lasinterfaces protésicas sobre el sistema linfático yórganos a distancia38 ha recibido pocaatención hasta el momento. En este trabajo, sediseñó un estudio experimental para analizar elefecto de las partículas de polietileno implantadas en elhueso de la rata, sobre las cadenas ganglionares del territorio dedrenaje de las extremidades inferiores, una cadena ganglionar adistancia, el hígado y el pulmón.
Material ymétodo
Seha implantado polietileno de peso molecular ultra alto en forma depolvo, constituido por una mezcla heterogénea departículas de un tamaño entre 1 y 100 micras,procedente de la Fundación Robert Mathys (Bettlach, Suiza).El material se ha conservado en recipientes de 1 mg en condicionesde esterilidad, hasta su utilización. Como animales deexperimentación, se han empleado 32 ratas de la razaSprague-Dawley con un peso entre 250 y 280 g. Los animales se hanacondicionado en el estabulario de la Facultad de Medicina yCiencias de la Salud de la Universidad Rovira i Virgili encondiciones de estabulación estándar, siguiendo lasnormas de experimentación animal vigentes en nuestropaís. Las 32 ratas se han dividido en dos grupos: un grupode 16 ratas a las que se ha implantado partículas depolietileno y un grupo control. Cada uno de ellos se ha subdivididoen dos grupos de ocho ratas que se han sacrificado a los 15 y 60días respectivamente.
Técnica quirúrgica
Bajo anestesia general inhalatoria con éteretílico se procede a la preparación del campoquirúrgico en condiciones estériles. Se practica unaincisión de 1,5 cm en la cara anterolateral del tercioproximal de la pata posterior izquierda. Se dislacera lamusculatura del grupo extensor y se expone la cara anterolateral dela tibia con un elevador perióstico. En el centro de latibia y a unos 2 cm de la interlínea articular, se practicauna perforación de 2 mm de diámetro por 3 mm deprofundidad, con un punzón. El orificio se llena con 1 mg.del polvo de polietileno. Se cierra la incisión con puntosde seda. En el grupo control se practica la mismaintervención pero no se implantan partículas dematerial. Transcurridos 15 ó 60 días, según elgrupo, se procede al sacrificio del animal con una sobredosis deinhalación de éter etílico hasta que seproduce la parada cardiorespiratoria y se obtienen las cadenasganglionares paraórtica y cervical, un fragmento dellóbulo hepático izquierdo y un fragmento dellóbulo inferior del pulmón derecho.
Lasmuestras se fijan con formol tamponado a pH 7,2-7,4 al 10% durante24 horas. El procesamiento de las muestras ha sido el convencionalde inclusión en parafina, corte y tinción conhematoxilina-eosina. Se estudian al microscopio óptico conluz normal y luz polarizada los cambios reactivos producidos en lascadenas ganglionares paraórticas y cervicales comorepresentantes de una región ganglionar en el territorio dedrenaje linfático de las extremidades posteriores y unaregión ganglionar a distancia. Se valora el número deganglios por muestra y la presencia o no de los siguientesparámetros: hiperplasia folicular (presencia defolículos linfoides con centros germinaleshiperplásicos), hiperplasia sinusal (presencia de sinusoidesdilatados y ocupados por macrófagos), hiperplasia difusa(desaparición de la arquitectura normal del ganglio),macrófagos libres (presencia de infiltradomacrofágico) y material intraganglionar. Se estudian loscambios patológicos en las muestras de tejidohepático y se valora la presencia o no de losparámetros: hiperplasia de las células deKüpffer, partículas de polietileno e infiltradoinflamatorio. A nivel pulmonar, se estudia la presencia o no deinfiltrado inflamatorio peribronquial y perivascular.
Para el tratamiento estadístico de los datos obtenidos yel análisis descriptivo de las variables categóricas,se han usado las frecuencias relativas y frecuencias absolutas.Para el análisis bivariable, se ha usado el test exacto deFischer y se ha establecido el nivel de significaciónestadística para una p menor o igual a 0,05. Elanálisis de los datos se ha llevado a cabo con el paquete deprogramas estadísticos BMDP (Dixon, WJ, Ed. BDMP StatisticalSoftware Vol. 1,2. Berkeley, University of California Press, 1988)y SPSS (SPSS 6.1 Base system user's guide. Chicago: SPSS Inc,1994).
Resultados
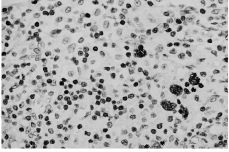
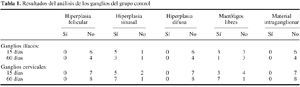
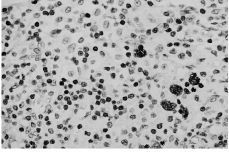
Losresultados del análisis de los ganglios ilíacos ycervicales del grupo control se detallan en la tabla 1. No se hanhallado ganglios en dos de las muestras de ganglios ilíacosde 15 días, en cuatro de las de 60 y en una muestra deganglios cervicales de 15 días. En la mayoría de losganglios del grupo control se encuentran cambios reactivos alproceso quirúrgico en forma de hiperplasia sinusal con mayoro menor infiltrado macrofágico. Los resultados delanálisis de los ganglios del grupo al que se ha implantadopartículas de polietileno se exponen en la tabla 2. No sehan hallado ganglios en una muestra de ganglios ilíacos de15 días y en dos de 60 y en una muestra de ganglioscervicales de 15 y en tres de 60. En la mayoría de muestrasse han observado áreas de hiperplasia sinusal y áreasde desestructuración completa de la arquitectura normal delganglio en forma de hiperplasia difusa (Fig. 1), con un mayor omenor infiltrado macrofágico. La presencia de hiperplasiadifusa en los ganglios del grupo con partículas depolietileno, es estadísticamente significativa en losganglios ilíacos a los 15 (p = 0,02) y 60 días (p =0,04) y también en los ganglios cervicales, tanto a los 15(p = 0,03) como a los 60 días (p = 0,006). El resto deparámetros estudiados no ha mostrado diferenciasestadísticamente significativas. En ninguno de los gangliosestudiados con luz normal luz polarizada se han detectadopartículas de polietileno. No se han observado diferenciasentre los cambios estructurales observados en los gangliosilíacos y cervicales. El tiempo de evolución tampocoha influido sobre los hallazgosanatomopatológicos.
Figura 1. Microfotografía de un ganglioilíaco de una rata a la que se ha implantadopartículas de polietileno, sacrificada a los 60 días.Se observa una marcada hiperplasia difusa e infiltradomacrofágico. Hematoxilina-eosina, 400*.
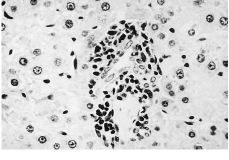
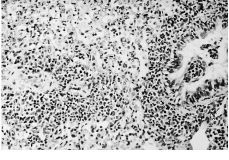
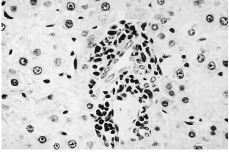
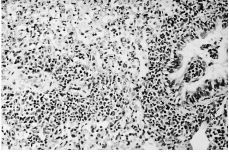
Alanalizar las muestras del tejido hepático no se hanobservado cambios importantes ni a los 15 ni a los 60 días.No hay alteraciones en el sistema macrofágico representadopor las células de Küpffer ni se ha demostrado lapresencia de partículas en ninguna de las muestras. En trescasos de 15 días y en dos de 60, se han podido observarpequeños infiltrados periportales (Fig. 2) que no se hanobservado en ninguna de las muestras del grupo control. En elpulmón se han detectado infiltrados inflamatoriosperibronquiales y perivasculares en cinco de las ocho muestras de15 días y en tres de las ocho muestras de 60 días(Fig. 3). Estos infiltrados no se han observado en ninguna de lasmuestras del grupo control y estas diferencias sonestadísticamente significativas, tanto a los 15 días(p = 0,002) como a los 60 días (p = 0,04).
Figura 2. Microfotografía de tejidohepático de una rata a la que se ha implantadopartículas de polietileno 60 días antes. Se observaun pequeño infiltrado inflamatorio periportal rodeado detejido de aspecto completamente normal. Hematoxilina-eosina,200*.
Figura 3. Microfotografía del tejido pulmonar deuna rata a la que se ha implantado partículas de polietileno15 días antes. Se observa una marcada reaccióninflamatoria perivascular y peribronquial. Hematoxilina-eosina,200*.
Discusión
Laspartículas de desgaste son producidas en alguna medida entodas las prótesis articulares debido a las propiedades delos materiales, a la presencia de movimiento en laarticulación y las diferentes interfaces. Laspartículas de polietileno son generadas directamente en laarticulación metal-plástico, en la interfaz entre elpolietileno y en su cobertura metálicaposterior,5,10 o en los tornillos adyacentes, y por untercer cuerpo de desgaste como la presencia de partículas decemento libres en la articulación.1,17 Losprimeros estudios sobre la tasa de desgaste del polietileno fueronefectuados por Charnley y Cupic,6 que cuantificaron latasa de desgaste lineal del acetábulo en 0,15 mm poraño, lo que provoca la liberación de 40 a 4* 1010partículas al año.4,8 Algunos factorescomo la disminución del peso molecular,36 lascondiciones de moldeado,43 los procedimientos deesterilización,36 las condiciones dealmacenamiento15 y otros factores que dependen delpaciente y de la técnica quirúrgica, pueden influirsobre la tasa de desgaste y producción de partículasde polietileno.
Losprimeros estudios experimentales sobre los efectos de laspartículas sobre el organismo se atribuyen a Newman yScales30 que estudiaron los efectos de laspartículas de polietileno de distintos tamaños sobreel hueso. Desde el primer momento se evidenciaron dosobstáculos para este tipo de estudios: la dificultad paradeterminar cuantitativamente el grado de reacción tisular yla dificultad para caracterizar el estímulo, es decir, eltipo de partícula.9 Algunas de las propiedades delas partículas son importantes a la hora de determinar eltipo e intensidad de la reacción histológica:composición química, tamaño, forma,número y ritmo de liberación.17,27,46 Losestudios de membranas de prótesis aflojadas han observadopartículas de diferentes tamaños yformas.12,17,21 Pazzaglia y cols.32 hanobservado que las partículas de polietileno teníanuna forma irregular pero siempre eran superiores a 3 micras. Eneste estudio se ha empleado una mezcla heterogénea con unamplio rango que va desde 1 hasta 100 micras.
Aprincipios de la década de los 70, Mendes ycols.24 y Walker y Bullough42 identificaronpartículas de polietileno en los ganglios paraórticosy en las paredes alveolares del pulmón de tres perros a losque se había implantado una prótesis de cadera. Otrosautores han demostrado la presencia de partículas dediferentes materiales en los ganglioslinfáticos.2,3,18,20,23,28,37,39,40 Se handescrito cambios estructurales en los ganglios con presencia de uninfiltrado macrofágico alrededor de las partículas.Al examinar los ganglios del grupo control, se ha observado lapresencia de sinusoides dilatados con áreas de hiperplasiasinusal, infiltrado macrofágico y algunos mastocitosaislados. Estos cambios se pueden explicar por un cierto grado derespuesta al estrés quirúrgico. Cuando se hanexaminado los ganglios, tanto los ilíacos como cervicales,de los animales a los que se han implantado partículas depolietileno, se ha observado la desaparición de laarquitectura normal del ganglio en forma de hiperplasia difusa. Enningún caso se han observado partículas en elinterior del ganglio. Esta ausencia de partículaspodría explicarse por el período deobservación, relativamente corto: ocho semanas, y ladificultad de difusión de las partículas através de los linfáticos de la rata. Estos cambios,observados tanto en los ganglios ilíacos situados en elterritorio de drenaje de las extremidades posteriores como en loscervicales, situados a distancia, no pueden atribuirse a lapresencia de partículas sino a la activación delsistema inmunológico de forma desconocida en la actualidad.Shea y cols.39 y Lundeen y cols.22 hansugerido que el examen con luz polarizada presenta algunaslimitaciones en estos estudios y que deberían sercompletados con microscopia electrónica y análisiselemental. Esto es especialmente importante cuando se analizanganglios de pacientes portadores de prótesis, en los quepueden generarse partículas de tamaño inferior a 1micra. En este estudio se conoce de antemano que laspartículas más pequeñas pueden ser detectadascon técnicas de microscopia convencional.
Elestudio de las vísceras en pacientes portadores deprótesis o en animales de experimentación harecibido, hasta el momento, muy poca atención. Walker yBullough42 identificaron partículas depolietileno en el pulmón del perro; Escalas ycols.11 estudiaron el efecto de 25 materiales diferentesimplantados en la musculatura paravertebral del conejo. Elhígado presentaba un aspecto normal, pero algunos cortesmostraban pequeños infiltrados periportales, tal como se hapodido observar en las muestras de este experimento. Los pulmonesmostraban cambios inflamatorios intersticiales y algunosinfiltrados peribronquiales. Recientemente, Segura Mata ycols.38 han hallado partículas de polietileno ytitanio en el pulmón de la rata, que previamente sehabían inyectado en la tibia. Las partículas aparecenrodeadas de células gigantes y una corona de linfocitos. Elexamen de las muestras de tejido pulmonar ha mostrado unasorprendente respuesta inflamatoria con presencia de coronaslinfocíticas peribronquiales y perivasculares. Enningún caso se ha podido detectar presencia departículas en los alvéolos pulmonares. En el estudiode Segura Mata y cols.38 las partículashabían sido inyectadas, por lo que podrían haberllegado con mayor facilidad al pulmón por víasanguínea. La difusión hematógena de laspartículas podría explicar la ausencia dereacción ganglionar en su modelo. No se conocen referenciasde la inducción de perivasculitis pulmonar, por la presenciade partículas de desgaste en el organismo, ni en trabajosexperimentales ni clínicos. En conclusión, laspartículas de desgaste de polietileno implantadas en elhueso de la rata provocan cambios patológicos en el sistemalinfático y en el pulmón. El mecanismoetiopatogénico y las consecuencias de estas alteraciones nose conocen con detalle.