Las metástasis espinales representan una importante carga sobre la calidad de vida en los pacientes afectados por una enfermedad oncológica activa, debido a la alta incidencia de síndromes dolorosos, deformidad espinal y deterioro neurológico. La cirugía juega un papel determinante a la hora de mejorar la calidad de vida mediante el control del dolor, el restablecimiento de la función neurológica y el mantenimiento de la estabilidad espinal, además de contribuir a la respuesta de la terapia médica. La cirugía mínimamente invasiva (MIS) es una opción de tratamiento en determinados pacientes con alto riesgo quirúrgico, ya que tiene una baja tasa de complicaciones, de sangrado intraoperatorio, de estancia hospitalaria y ofrece resultados similares a la cirugía abierta.
Presentamos en esta revisión el papel de la MIS en esta enfermedad, y algunos casos tratados en nuestro centro hospitalario.
Spinal metastases represent a significant burden on the quality of life in patients affected by active oncological disease due to the high incidence of pain syndromes, spinal deformity, and neurological impairment. Surgery plays a decisive role in improving quality of life by controlling pain, restoring neurological function and maintaining spinal stability, as well as contributing to the response to medical therapy. Minimally invasive surgery (MIS) is a treatment option in certain patients with high surgical risk since it has a low rate of complications, intraoperative bleeding, hospital stay, and offers similar results to open surgery. In this review, we present the role of MIS in this pathology and some cases treated in our hospital.
Anualmente se diagnostican en los EE. UU. 1,6 millones de casos nuevos de cáncer, con una mortalidad cercana al 50%, y una importante carga asociada a la enfermedad1,2. La afectación metastásica espinal representa una de las complicaciones más frecuentes de la enfermedad oncológica, siendo cada vez más prevalente debido a la mejoría en los tratamientos complementarios (quimioterapia, terapia hormonal, entre otros) teniendo como resultado una mejoría en la sobrevida de los pacientes3. Después de la afectación pulmonar y hepática, la columna vertebral es el sitio más frecuente de metástasis, principalmente secundario a tumores de próstata, pulmón y mama, siendo estos 2 últimos las neoplasias primarias más frecuentes4. Entre el 30-90% de los pacientes con cáncer desarrollan metástasis espinales, no obstante, pese a su alta prevalencia tan solo en 10% de estos presenta síntomas asociados a la afectación metastásica, el 50% requiere algún tipo de tratamiento y entre el 5-10% de los pacientes requieren tratamiento quirúrgico5.
Afectación espinalLa diseminación tumoral puede suceder a través diferentes mecanismos, principalmente mediante diseminación hematógena, invasión por contigüidad o siembras patológicas en el líquido céfalo-raquídeo (LCR)3. Esta diseminación está en íntima relación con la naturaleza y comportamiento del tumor primario, siendo la diseminación hematógena el mecanismo más frecuente debido a la importante vascularización arterial de los cuerpos vertebrales, lo que permite la migración de las células tumorales desde el su lugar de origen hasta el cuerpo vertebral donde se genera el depósito metastásico. También es posible la diseminación a través del plexo venoso de Batson debido a la amplia comunicación entre dicha estructura con otros lechos de drenaje venoso (sistema porta, vena ácigos, venas intercostales, vena cava, vena renal, entre otros), lo que facilita el alojamiento de las células tumorales6. Bien sea secundaria a la ruta arterial o venosa, es importante tener en cuenta que este tipo de diseminación determina una afectación espinal multicéntrica5.
Presentación clínicaLa presentación clínica de las metástasis espinales puede ser variable. No obstante, el síntoma predominante en los pacientes con afectación espinal es el dolor, el cual está presente hasta en el 95% de los casos5,7, y puede ser de tipo local, mecánico o radicular. Dicho síntoma puede preceder en días a semanas a la aparición de clínica neurológica. La evaluación meticulosa de las características del dolor es de vital relevancia debido a que permite diferenciar el dolor local secundario al crecimiento tumoral, el dolor mecánico secundario a la instabilidad segmentaria inminente o establecida y los síntomas radiculares o medulares asociados a la compresión de estructuras neurológicas5.
La disfunción motora es el segundo síntoma más frecuente en la afectación metastásica espinal. Hasta el 85% de los pacientes presenta debilidad en uno o más grupos musculares al diagnóstico y puede ser debida a mielopatía, radiculopatía o una combinación de ambas7.
TratamientoEl tratamiento de las metástasis espinales incluye diferentes modalidades de tratamiento (quimio-radioterapia, radiocirugía, entre otros) y especialidades médicas. A su vez, la decisión terapéutica depende de múltiples factores, entre ellos el estado clínico del paciente (evaluable a través del Karnofsky Performance Score)8, la expectativa de vida8-10, localización y control del tumor primario, los síntomas predominantes de la afectación metastásica, la extensión de la afectación espinal, entre otros, siendo aceptable la decisión quirúrgica en aquellos pacientes con una expectativa de vida mayor de 3-6 meses11.
En la mayoría de los casos la afectación espinal representa uno de los múltiples órganos afectados por la actividad oncológica, de tal manera que el objetivo principal del tratamiento médico y quirúrgico no es de tipo curativo sino paliativo, garantizando así la seguridad y la calidad de vida del paciente11–14.
El tratamiento quirúrgico de las metástasis espinales debe tener como objetivo mejorar o curar el dolor, mantener o mejorar la función neurológica y mantener o restablecer la estabilidad espinal (siendo el único medio disponible) de una forma que sea duradera, teniendo en cuenta la expectativa de vida del paciente, con una tasa de morbilidad aceptable3.
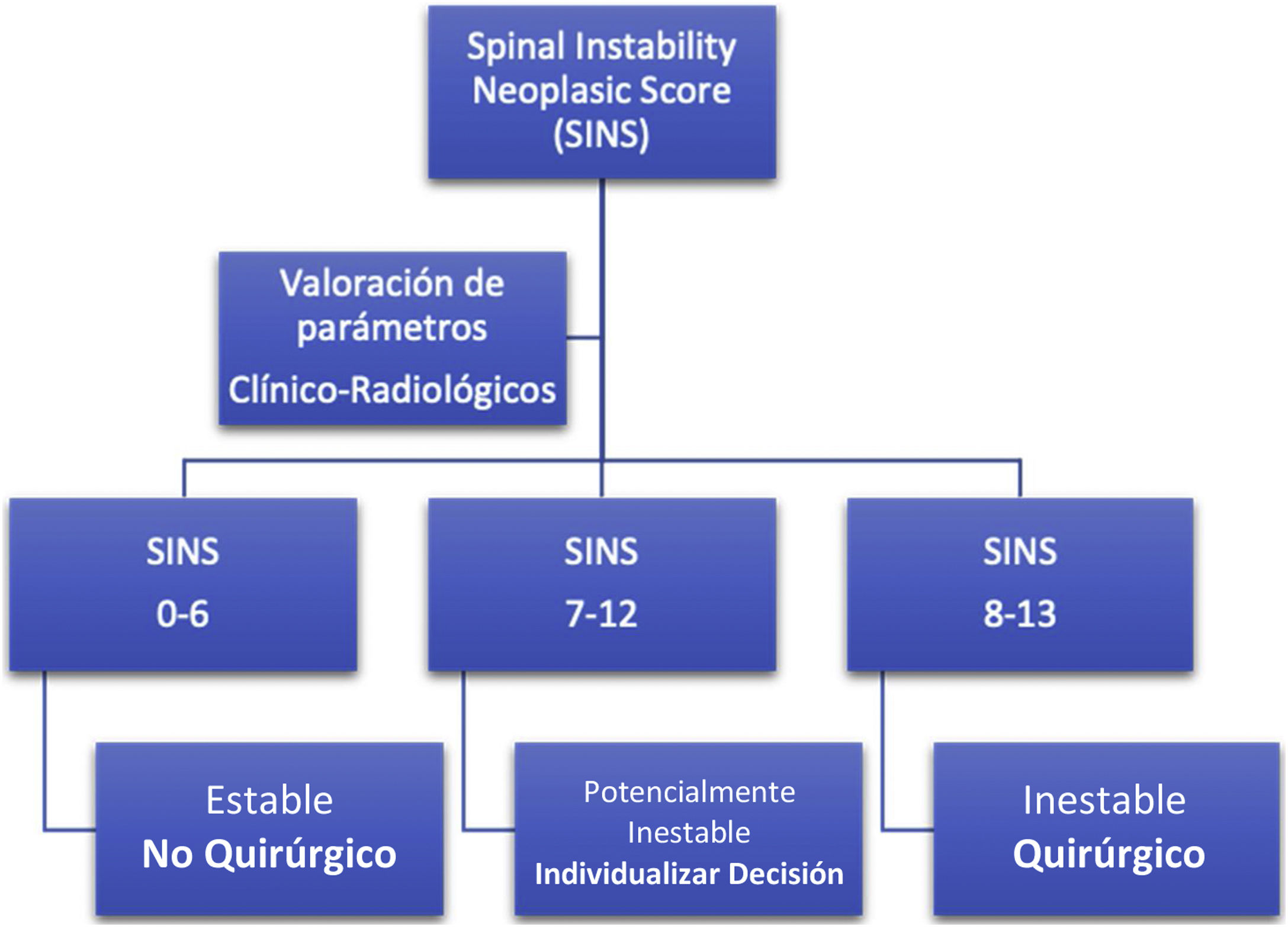
El Spine Oncology Study Group (SOSG) ha definido la inestabilidad espinal neoplásica como la pérdida de la integridad espinal como un resultado de un proceso que se asocia a dolor mecánico, deformidad sintomática o progresiva y/o compromiso neurológico bajo cargas fisiológicas15.
La presencia de inestabilidad espinal representa una indicación quirúrgica de estabilización independiente del grado de compresión epidural (evaluable a través de escala ESCC). Dicho grado de inestabilidad es valorado mediante la escala Spine Instaiblity Neoplastic Score (SINS) (tabla 1), que valora parámetros clínicos y radiográficos y, aunque no recomienda ningún tipo específico de tratamiento, permite al cirujano identificar y tratar aquellos pacientes que pueden estar en riesgo de desarrollar inestabilidad espinal y deformidades secundarias15 (fig. 1).
Escala SINS
| Componente | Descripción | Puntaje |
|---|---|---|
| Localización | Occipital-C2, C7-T12, T11-L1 o L5-S1Columna móvil (C3-C6, L2-L4)Columna semirrígida (T3-T10)Columna rígida (S2-S5) | 3210 |
| Dolor | SíDolor ocasional no mecánicoSin dolor | 310 |
| Lesión ósea | LíticaMixta (lítica/blástica)Blástica | 210 |
| Alineación espinal radiográfica | Subluxación/traslaciónDeformidad nueva (cifosis/escoliosis)Normal | 420 |
| Colapso de cuerpo vertebral | >50%<50%Sin colapso, pero >50% cuerpo afectadoNinguno | 3210 |
| Compromiso de elementos espinales posteriores | BilateralUnilateralNinguno | 310 |
SINS: Spine Stability Neoplasic Score.
Spinal Instability neoplasic score (SINS). La puntuación neoplásica de inestabilidad espinal ayuda a evaluar la inestabilidad de la columna vertebral relacionada con el tumor. Un SINS de 7 a 18 precisa una valoración quirúrgica para evaluar si existe inestabilidad vertebral antes de proceder con cualquier tratamiento de radiación planificado.
Los avances en las técnicas quirúrgicas han permitido desarrollar la cirugía mínimamente invasiva (MIS) como una alternativa a la cirugía abierta en el tratamiento de la enfermedad oncológica espinal, garantizando una mejor conservación del tejido muscular adyacente, menor pérdida sanguínea operatoria, menor tiempo de estancia hospitalaria, mejor control del dolor y disminución en el consumo de opioides en el postoperatorio. En general, permite ofrecer a los pacientes una recuperación más rápida y de calidad2,16.
Cuando se comparan los resultados de la cirugía abierta vs. MIS es posible evidenciar, además de los beneficios previamente mencionados, que existe una tasa de resultados similar en términos de mejoría neurológica17–21 lo que podría demostrar que la MIS es una opción terapéutica viable en determinados pacientes que no son aptos para la cirugía abierta debido a su edad, fragilidad, comorbilidades, extensión de la enfermedad o baja expectativa de vida, además de considerarse como parte de un tratamiento combinado multidisciplinar (cirugía de separación). No obstante, dichos resultados deben ser interpretados con cautela debido a que en la actualidad se carece de evidencia nivel I para realizar una recomendación fuerte sobre el uso extendido de la MIS11, es por esta razón que debe individualizarse cada caso.
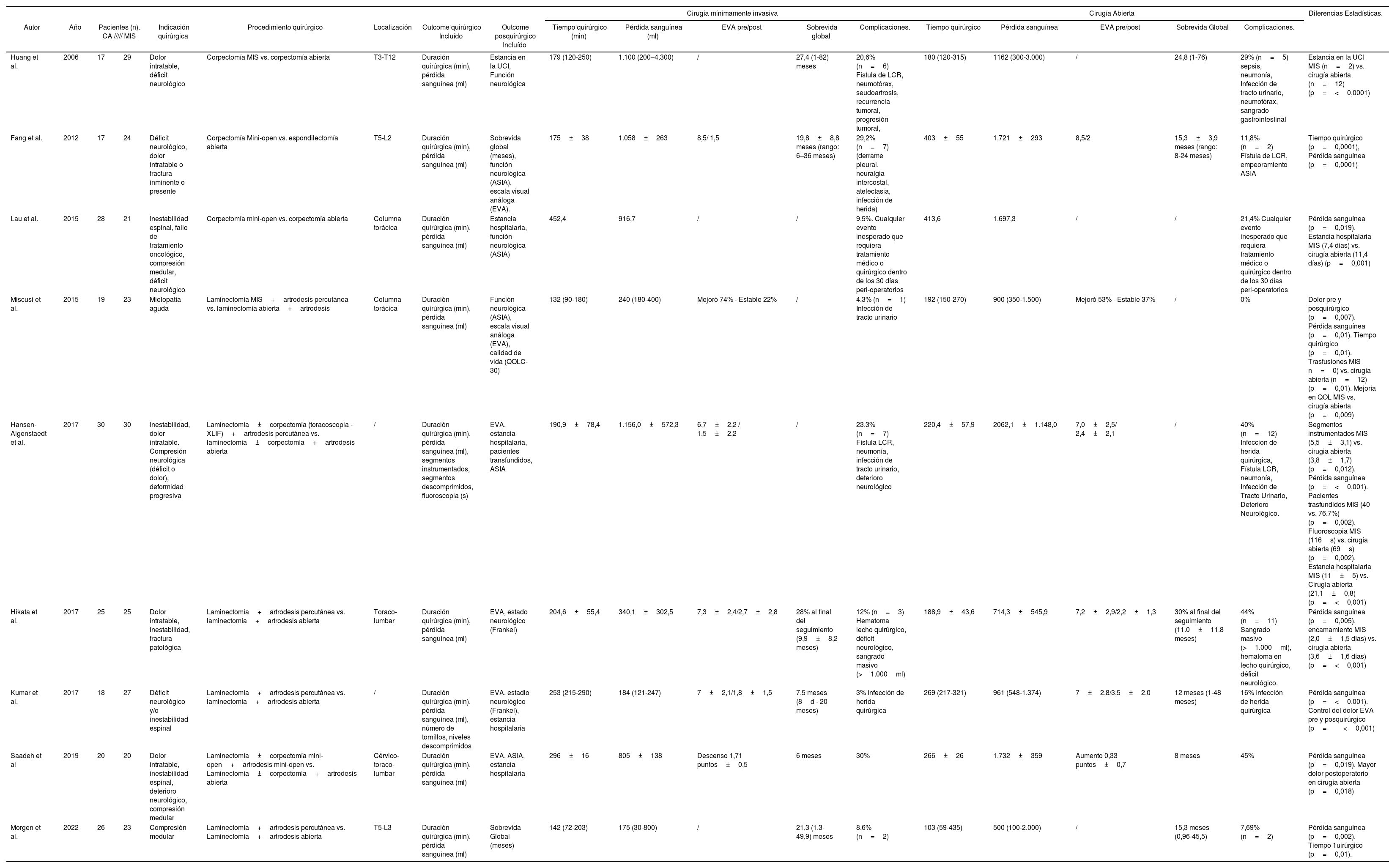
Hasta la actualidad, hemos encontrado publicados en la literatura 9 estudios que comparan la cirugía abierta vs. MIS en el tratamiento de las metástasis espinales, dicha comparación se encuentra disponible en la tabla 2.
Estudios comparativos entre MIS y CA para el tratamiento de las metástasis espinales
| Cirugía mínimamente invasiva | Cirugía Abierta | Diferencias Estadísticas. | |||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Autor | Año | Pacientes (n). CA ///// MIS | Indicación quirúrgica | Procedimiento quirúrgico | Localización | Outcome quirúrgico Incluído | Outcome posquirúrgico Incluído | Tiempo quirúrgico (min) | Pérdida sanguínea (ml) | EVA pre/post | Sobrevida global | Complicaciones. | Tiempo quirúrgico | Pérdida sanguínea | EVA pre/post | Sobrevida Global | Complicaciones. | ||
| Huang et al. | 2006 | 17 | 29 | Dolor intratable, déficit neurológico | Corpectomía MIS vs. corpectomía abierta | T3-T12 | Duración quirúrgica (min), pérdida sanguínea (ml) | Estancia en la UCI, Función neurológica | 179 (120-250) | 1.100 (200–4.300) | / | 27,4 (1-82) meses | 20,6% (n=6) Fístula de LCR, neumotórax, seudoartrosis, recurrencia tumoral, progresión tumoral, | 180 (120-315) | 1162 (300-3.000) | / | 24,8 (1-76) | 29% (n=5) sepsis, neumonía, Infección de tracto urinario, neumotórax, sangrado gastrointestinal | Estancia en la UCI MIS (n=2) vs. cirugía abierta (n=12) (p=<0,0001) |
| Fang et al. | 2012 | 17 | 24 | Déficit neurológico, dolor intratable o fractura inminente o presente | Corpectomía Mini-open vs. espondilectomía abierta | T5-L2 | Duración quirúrgica (min), pérdida sanguínea (ml) | Sobrevida global (meses), función neurológica (ASIA), escala visual análoga (EVA). | 175±38 | 1.058±263 | 8,5/ 1,5 | 19,8±8,8 meses (rango: 6–36 meses) | 29,2% (n=7) (derrame pleural, neuralgia intercostal, atelectasia, infección de herida) | 403±55 | 1.721±293 | 8,5/2 | 15,3±3,9 meses (rango: 8-24 meses) | 11,8% (n=2) Fístula de LCR, empeoramiento ASIA | Tiempo quirúrgico (p=0,0001), Pérdida sanguínea (p=0,0001) |
| Lau et al. | 2015 | 28 | 21 | Inestabilidad espinal, fallo de tratamiento oncológico, compresión medular, déficit neurológico | Corpectomía mini-open vs. corpectomía abierta | Columna torácica | Duración quirúrgica (min), pérdida sanguínea (ml) | Estancia hospitalaria, función neurológica (ASIA) | 452,4 | 916,7 | / | / | 9,5%. Cualquier evento inesperado que requiera tratamiento médico o quirúrgico dentro de los 30 días peri-operatorios | 413,6 | 1.697,3 | / | / | 21,4% Cualquier evento inesperado que requiera tratamiento médico o quirúrgico dentro de los 30 días peri-operatorios | Pérdida sanguínea (p=0,019). Estancia hospitalaria MIS (7,4 días) vs. cirugía abierta (11,4 días) (p=0,001) |
| Miscusi et al. | 2015 | 19 | 23 | Mielopatía aguda | Laminectomía MIS+artrodesis percutánea vs. laminectomía abierta+artrodesis | Columna torácica | Duración quirúrgica (min), pérdida sanguínea (ml) | Función neurológica (ASIA), escala visual análoga (EVA), calidad de vida (QOLC-30) | 132 (90-180) | 240 (180-400) | Mejoró 74% - Estable 22% | / | 4,3% (n=1) Infección de tracto urinario | 192 (150-270) | 900 (350-1.500) | Mejoró 53% - Estable 37% | / | 0% | Dolor pre y posquirúrgico (p=0,007). Pérdida sanguínea (p=0,01). Tiempo quirúrgico (p=0,01). Trasfusiones MIS n=0) vs. cirugía abierta (n=12) (p=0,01). Mejoría en QOL MIS vs. cirugía abierta (p=0,009) |
| Hansen-Algenstaedt et al. | 2017 | 30 | 30 | Inestabilidad, dolor intratable. Compresión neurológica (déficit o dolor), deformidad progresiva | Laminectomía±corpectomía (toracoscopia - XLIF)+artrodesis percutánea vs. laminectomía±corpectomía+artrodesis abierta | / | Duración quirúrgica (min), pérdida sanguínea (ml), segmentos instrumentados, segmentos descomprimidos, fluoroscopia (s) | EVA, estancia hospitalaria, pacientes transfundidos, ASIA | 190,9±78,4 | 1.156,0±572,3 | 6,7±2,2 / 1,5±2,2 | / | 23,3% (n=7) Fístula LCR, neumonía, infección de tracto urinario, deterioro neurológico | 220,4±57,9 | 2062,1±1.148,0 | 7,0±2,5/ 2,4±2,1 | / | 40% (n=12) Infeccion de herida quirúrgica, Fístula LCR, neumonía, Infección de Tracto Urinario, Deterioro Neurológico. | Segmentos instrumentados MIS (5,5±3,1) vs. cirugia abierta (3,8±1,7) (p=0,012). Pérdida sanguínea (p=<0,001). Pacientes trasfundidos MIS (40 vs. 76,7%) (p=0,002). Fluoroscopia MIS (116s) vs. cirugía abierta (69s) (p=0,002). Estancia hospitalaria MIS (11±5) vs. Cirugía abierta (21,1±0,8) (p=<0,001) |
| Hikata et al. | 2017 | 25 | 25 | Dolor intratable, inestabilidad, fractura patológica | Laminectomía+artrodesis percutánea vs. laminectomía+artrodesis abierta | Toraco-lumbar | Duración quirúrgica (min), pérdida sanguínea (ml) | EVA, estado neurológico (Frankel) | 204,6±55,4 | 340,1±302,5 | 7,3±2,4/2,7±2,8 | 28% al final del seguimiento (9,9±8,2 meses) | 12% (n=3) Hematoma lecho quirúrgico, déficit neurológico, sangrado masivo (>1.000ml) | 188,9±43,6 | 714,3±545,9 | 7,2±2,9/2,2±1,3 | 30% al final del seguimiento (11.0±11.8 meses) | 44% (n=11) Sangrado masivo (>1.000ml), hematoma en lecho quirúrgico, déficit neurológico. | Pérdida sanguínea (p=0,005). encamamiento MIS (2,0±1,5 días) vs. cirugía abierta (3,6±1,6 días) (p=<0,001) |
| Kumar et al. | 2017 | 18 | 27 | Déficit neurológico y/o inestabilidad espinal | Laminectomía+artrodesis percutánea vs. laminectomía+artrodesis abierta | / | Duración quirúrgica (min), pérdida sanguínea (ml), número de tornillos, niveles descomprimidos | EVA, estadio neurológico (Frankel), estancia hospitalaria | 253 (215-290) | 184 (121-247) | 7±2,1/1,8±1,5 | 7,5 meses (8d - 20 meses) | 3% infección de herida quirúrgica | 269 (217-321) | 961 (548-1.374) | 7±2,8/3,5±2,0 | 12 meses (1-48 meses) | 16% Infección de herida quirúrgica | Pérdida sanguínea (p=<0,001). Control del dolor EVA pre y posquirúrgico (p=<0,001) |
| Saadeh et al | 2019 | 20 | 20 | Dolor intratable, inestabilidad espinal, deterioro neurológico, compresión medular | Laminectomía±corpectomía mini-open+artrodesis mini-open vs. Laminectomía±corpectomía+artrodesis abierta | Cérvico-toraco-lumbar | Duración quirúrgica (min), pérdida sanguínea (ml) | EVA, ASIA, estancia hospitalaria | 296±16 | 805±138 | Descenso 1,71 puntos±0,5 | 6 meses | 30% | 266±26 | 1.732±359 | Aumento 0,33 puntos±0,7 | 8 meses | 45% | Pérdida sanguínea (p=0,019). Mayor dolor postoperatorio en cirugía abierta (p=0,018) |
| Morgen et al. | 2022 | 26 | 23 | Compresión medular | Laminectomía+artrodesis percutánea vs. Laminectomía+artrodesis abierta | T5-L3 | Duración quirúrgica (min), pérdida sanguínea (ml) | Sobrevida Global (meses) | 142 (72-203) | 175 (30-800) | / | 21,3 (1,3-49,9) meses | 8,6% (n=2) | 103 (59-435) | 500 (100-2.000) | / | 15,3 meses (0,96-45,5) | 7,69% (n=2) | Pérdida sanguínea (p=0,002). Tiempo 1uirúrgico (p=0,01). |
CA: cirugía abierta; EVA: escala visual analógica; MIS: cirugía mínimamente invasiva.
Mujer de 46 años con antecedente de cáncer de mama que acude a urgencias por pérdida progresiva de fuerza en los miembros inferiores hasta imposibilidad para la deambulación de <24SOSGh de instauración.
A la exploración física: Miembro inferior (D/I): flexión de cadera 3−/3−, extensión de cadera 5/5, extensión de rodilla 5/5, flexión de rodilla 5/5, flexión dorsal y plantar pie 5/5 y nivel sensitivo D6.
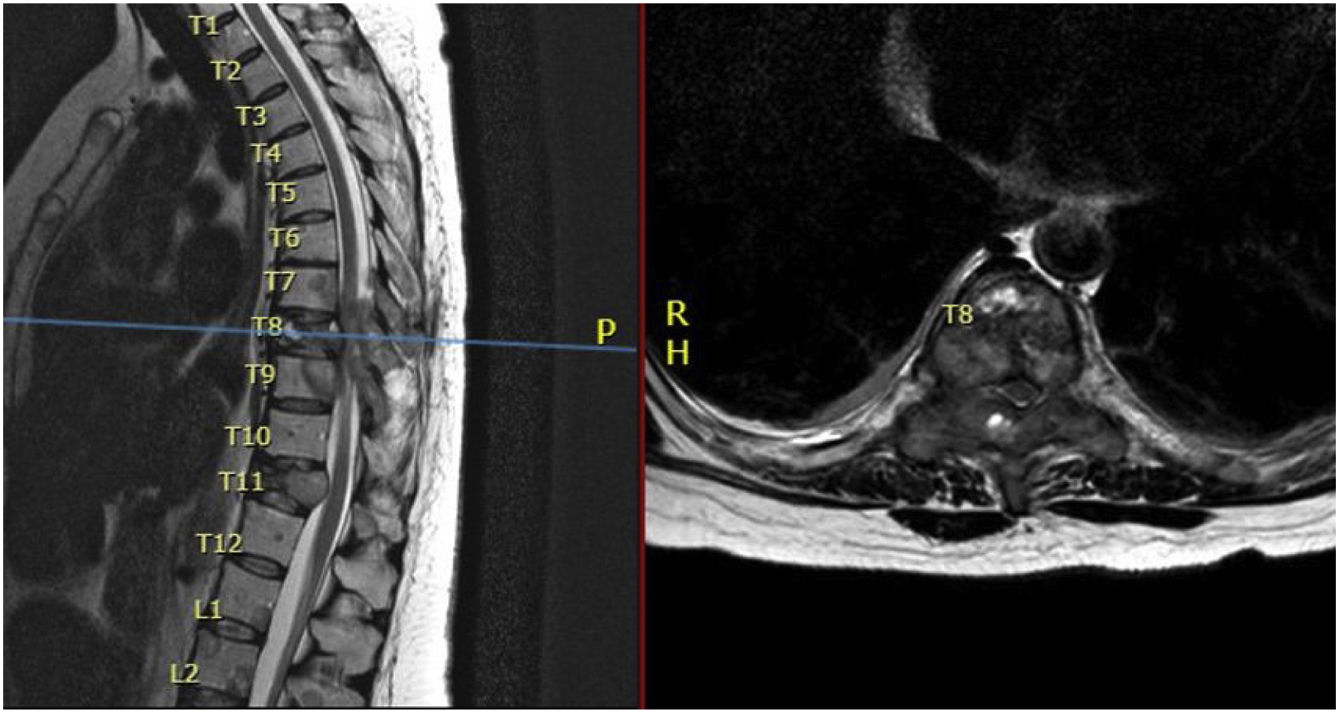
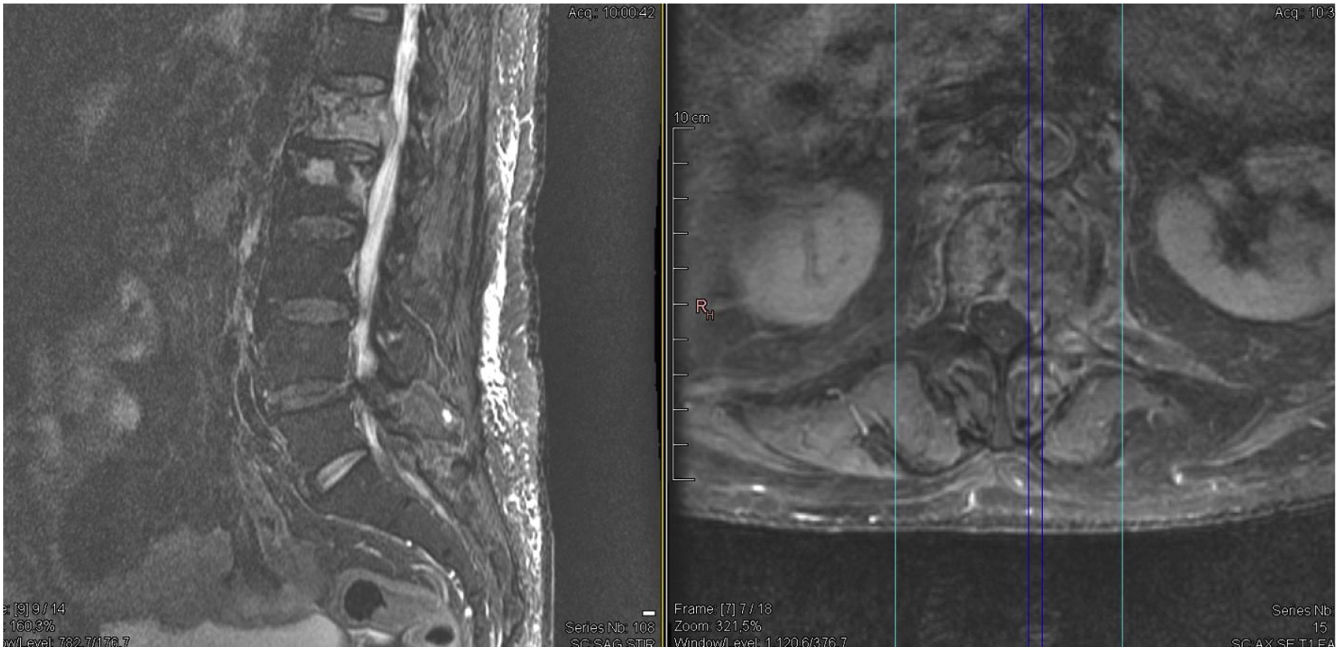
Se realizó de manera urgente resonancia magnética (RM) de columna dorsal que evidenció afectación multinivel de la columna dorsal (lesiones infiltrativas) asociando, además, fracturas patológicas en los niveles D8 y D11; ocasionando compresión medular a nivel D8 con mielopatía radiológica desde D7 a D9 (fig. 2).
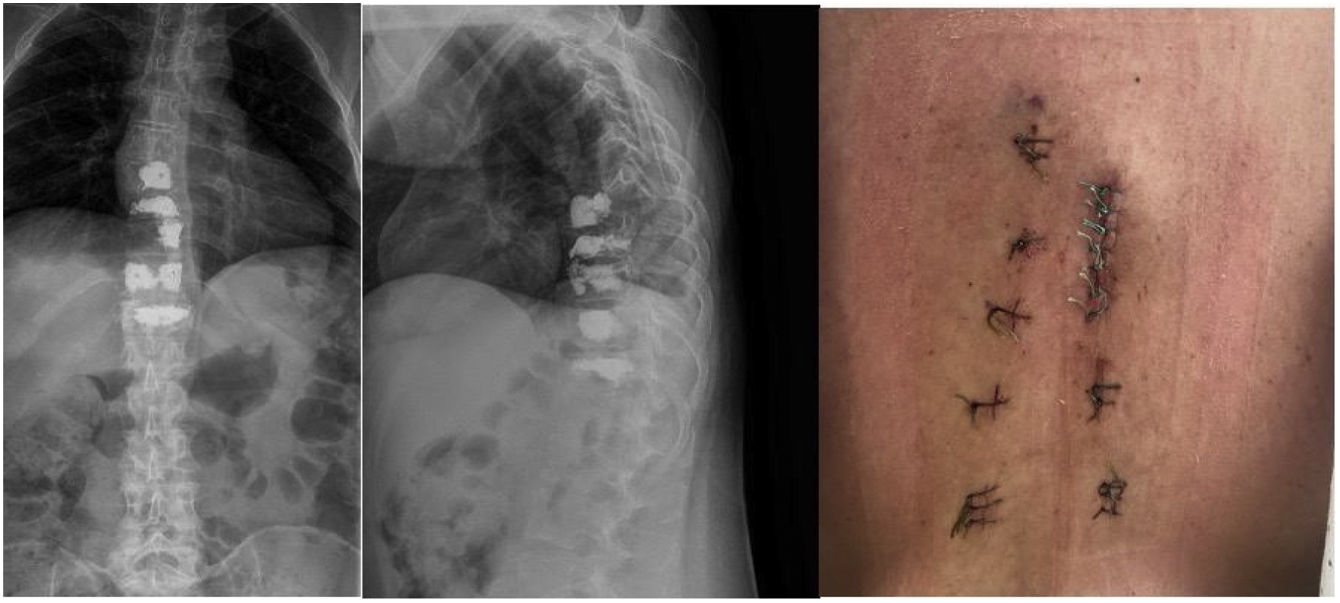
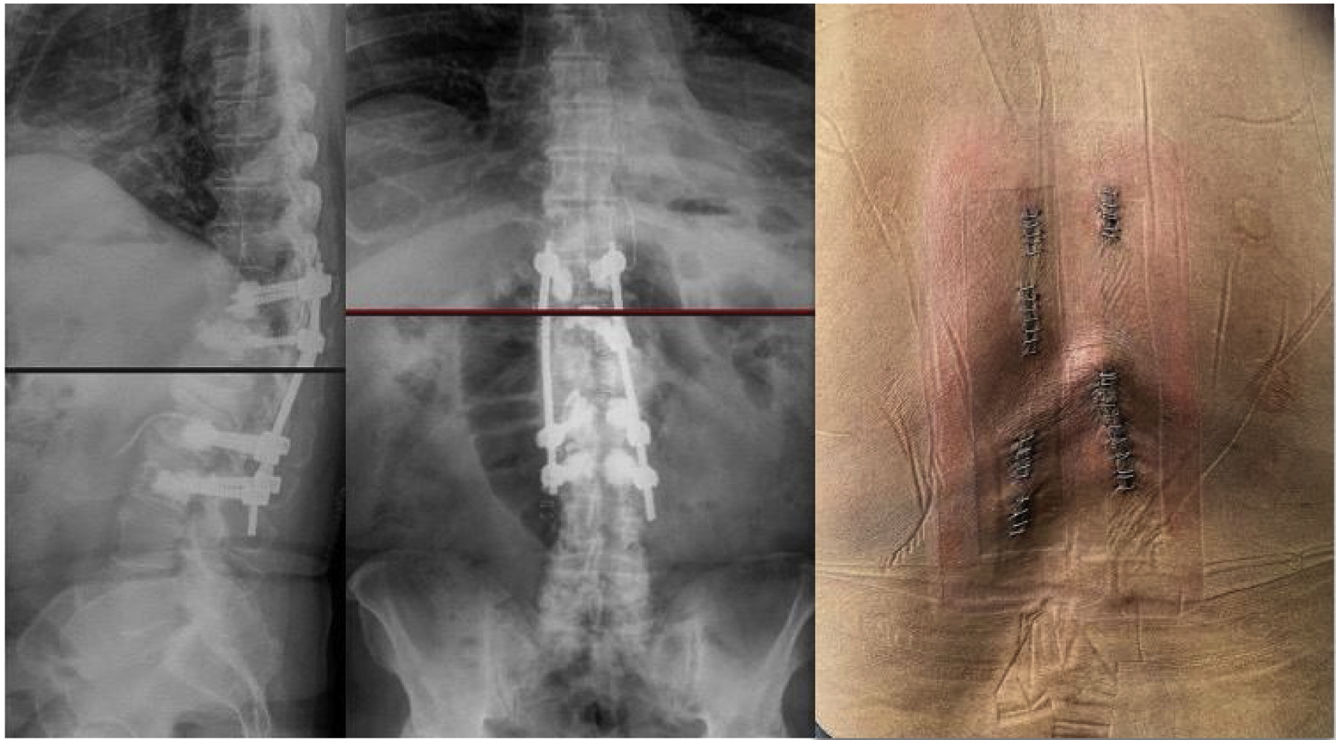
Se realizó tratamiento quirúrgico urgente mediante cifoplastia unipedicular izquierda D7, D8 y D9 (ya que el pedículo derecho presentaba destrucción por masa tumoral) y D10-D11 pedicular bilateral (fig. 3). Laminectomía D8-D9 mínimamente invasiva «over the top» entrando por el lado derecho y realizando una descompresión bilateral a través de abordaje unilateral, con resección de tumoración epidural posterior, de consistencia fibrosa, altamente vascularizada y adherida a la duramadre. Presentó un sangrado intraoperatorio de 40cc y tiempo quirúrgico de 3h.
La evolución postoperatoria trascurrió sin incidencias, con buena evolución general en el tiempo de seguimiento de 10 meses, presentó mejoría progresiva de la fuerza en miembros inferiores y recuperación del nivel sensitivo a nivel de D11.
Caso clínico 2Varón de 69 años con antecedente de carcinoma de pulmón estadio IV y sobrepeso, que acudió a urgencias por dolor incapacitante dorsolumbar refractario a analgesia habitual. Se realizó RM que evidenció lesión metastásica L1 sin fractura. Es tratado por el servicio de oncología mediante radioterapia paliativa y corsé dorsolumbar. Un año posterior a este manejo, reingresó por dolor incapacitante sin evidencia de déficit neurológico, con escalas clínicas de dolor y discapacidad EVA 10/10 y ODI 78/100. Para el tratamiento del dolor se encontraba con parches de fentanilo 75μg/h y sulfato de morfina oral (MST) 90mg/cada 12h.
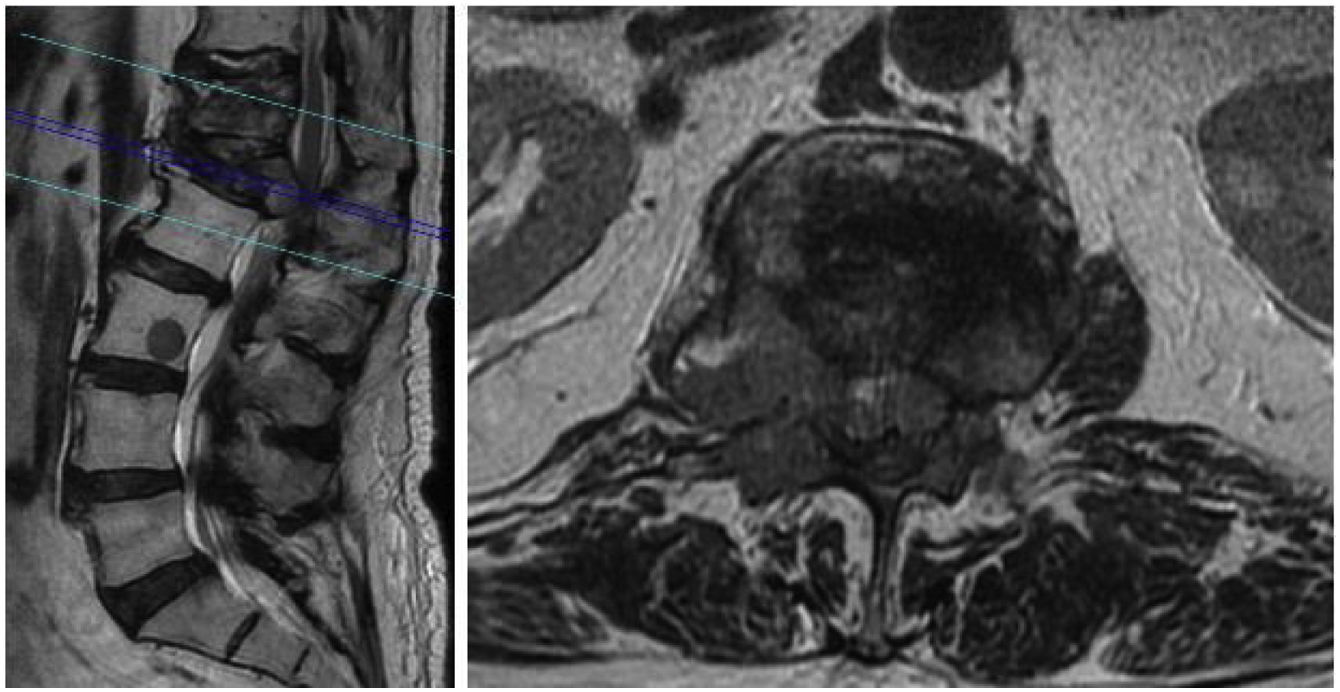
Durante su ingreso se realizó nueva RM que evidenció fractura L1 con rotura de muro posterior, invasión del canal espinal y compresión de cono medular (fig. 4). Además, se evidenció afectación metastásica multinivel (afectación D12 con acuñamiento del platillo superior y otros 2 focos en L3 y L5, sin fractura). Por el dolor incapacitante requirió perfusión intravenosa de cloruro mórfico a 10mg/hora.
Se decidió MIS realizándose laminectomía L1 «over the top» siendo de preferencia el lado derecho debido a su mayor afectación tumoral evidenciable en la RM y realizando una descompresión bilateral a través de abordaje unilateral, cifoplastia D12 unipedicular izquierda y fijación transpedicular percutánea D11 bilateral, D12 unilateral izquierda, L2 y L3 bilateral (fig. 5) con un sangrado intraoperatorio menor a 30cc y tiempo quirúrgico de 4h.
La evolución postquirúrgica del paciente fue satisfactoria, con un tiempo de seguimiento de 6 meses, no presentó complicaciones posquirúrgicas (déficit neurológico o dehiscencia de heridas) y fue posible el descenso progresivo de opiáceos intravenosos logrando una analgesia óptima mediante el tratamiento con MST oral 10mg/cada 12h, con escalas de valoración postoperatoria de EVA: 3/10 y ODI: 38/100.
Caso clínico 3Mujer de 72 años con antecedente de cáncer de ovario y sobrepeso, ingresada en otro hospital por dolor dorsolumbar incapacitante manejado con analgesia habitual y parche de fentanilo 50μg/72h, que requiere perfusión intravenosa de cloruro mórfico a 6mg/h y es traslada a nuestro centro para tratamiento. A su llegada presenta escalas de dolor EVA: 8/10 y discapacidad (ODI): 68/100. A la exploración no presenta déficit neurológico.
La RM dorsolumbar evidenció afectación metastásica en cuerpos vertebrales de L1 y L2; con fractura L2 con hundimiento del patillo de L2 derecho. En nivel L1 invasión del canal espinal en el lado izquierdo y fractura pedicular L1 y L2 izquierdas (fig. 6).
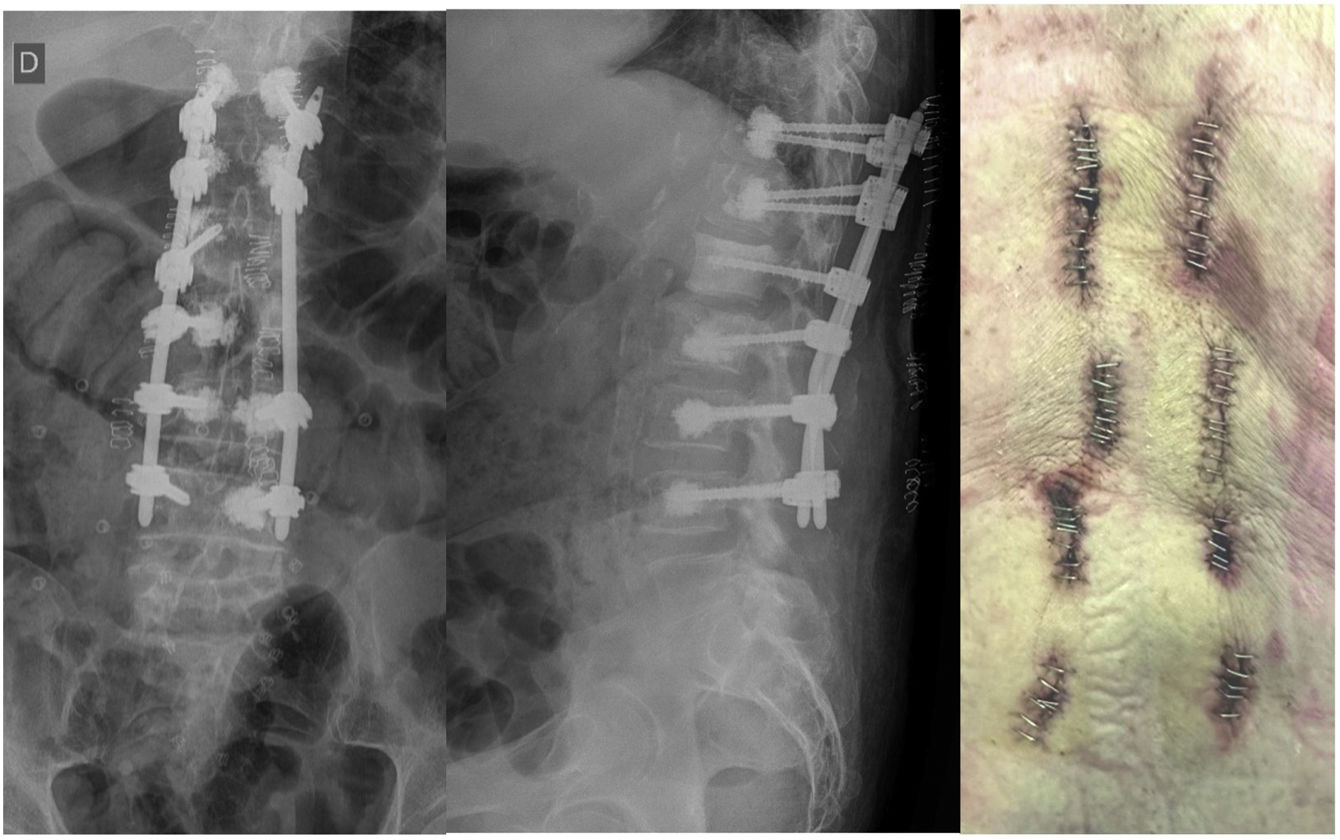
Se decidió cirugía MIS realizándose hemilaminectomía L1 izquierda mediante abordaje tubular izquierdo, objetivando lesión ósea muy sangrante, con hemostasia dificultosa, cifoplastia L2 derecha con levantamiento del platillo superior para mejoría de escoliosis y fijación transpedicular percutánea cementada D11 y D12 bilateral, L1 y L2 derecha, L3 bilateral (fig. 7). Sangrado intraoperatorio de 200cc y tiempo quirúrgico de 4h.
La evolución posquirúrgica del paciente fue satisfactoria, con un seguimiento de 3 meses no ha presentado complicaciones posquirúrgicas, se ha suspendido la bomba de morfina y los parches de fentanilo. Presenta escalas clínicas postoperatorias hacia la mejoría del dolor EVA: 3/10 y ODI: 20/100.
DiscusiónLa MIS en el tratamiento de casos seleccionados de metástasis espinales ha representado una revolución respecto al tratamiento quirúrgico tradicional de dicha enfermedad, ya que ha permitido intervenir de manera segura y eficaz a determinados pacientes que previamente podrían no ser considerados candidatos quirúrgicos. La MIS aporta ventajas sobre las técnicas clásicas, entre las que se incluyen menor pérdida sanguínea y menores tiempos de estancia hospitalaria (UCI y hospitalización general), y una tendencia a una menor tasa de complicaciones, ofreciendo de manera paralela resultados similares a la cirugía abierta en control del dolor (valorable mediante la escala EVA), sobrevida global y mejoría o conservación del estado neurológico (valorable mediante la escala ASIA y Frankel). Tan solo un estudio, hasta la actualidad, ha reportado diferencias en la calidad de vida favoreciendo la MIS sobre la cirugía abierta, lo que podría inferir un mayor impacto de la MIS en la calidad de vida de los pacientes afectados por esta devastadora entidad en las etapas finales de su vida21.
No obstante, es relevante dar a conocer que el dominio de la técnica MIS requiere una curva de aprendizaje importante, esto se ve reflejado en la tabla comparativa de cirugía MIS vs, abierta en la que no se aprecia una diferencia importante de tiempo quirúrgico y que la MIS implica tiempo, dedicación y entrenamiento, variables que podrían interferir con los resultados y en los tiempos quirúrgicos prolongados en los primeros casos.
Dentro de la selección de la técnica quirúrgica es importante recalcar la relevancia de los costos directos e indirectos de cada procedimiento, lo que permite determinar la existencia de diferencias económicas a la hora de escoger el tipo de procedimiento a realizar.
La enfermedad metastásica espinal representa un reto económico para los sistemas sanitarios debido a su alto costo a la hora de ofrecer tratamiento. En Europa, específicamente en Dinamarca, se ha evidenciado rangos de gastos entre 36,616 a 87,814€ por paciente durante su sobrevida dependiendo el tratamiento recibido, estimando específicamente gastos de 36.616€ (33.835-39.583€) para el tratamiento conservador; 49.632€ (42.287-57.767€) para la cirugía de descompresión; 70.997€ (62.244-82.354€) para la cirugía de descompresión+artrodesis y 87.814€ (76.638-101.528€) para la cirugía de descompresión+artrodesis+reconstrucción, teniendo en cuenta que a mayor tiempo de sobrevida global mayor es el costo de la atención. Es de gran relevancia resaltar que la estancia hospitalaria podría representar hasta el 65% del gasto total del paciente, siendo este ítem un objetivo a la hora de disminuir gastos directos, seguido por las visitas de revisión que abarca hasta el 31% del gasto total22.
En la actualidad, en las bases de datos revisadas, no existen estudios disponibles que comparen los costos directos de la MIS vs. la cirugía abierta específicamente en el tratamiento de la enfermedad tumoral de la columna vertebral23. No obstante, existen estudios disponibles que comparan los gastos asociados de ambas técnicas en la fusión espinal. Lucio et al., evaluaron la diferencia de costos hospitalarios entre la MIS y la cirugía abierta en procedimientos de fusión espinal en 210 pacientes, 101 sometidos a cirugía abierta y 109 a MIS. Encontrando un gasto directo de instrumental mayor en la MIS respecto a la cirugía abierta en 3810.76U$ (aproximadamente 3.500€) un 27% del costo total del procedimiento. No obstante, observó que los costos derivados del uso de salas de cirugías, suministros quirúrgicos y gastos asociados a la estancia hospitalaria fue menor para la MIS respecto a la cirugía abierta en 2,756.50U$ (56%), 955.64U$ (45%) y 788.51U$ (52%), aproximadamente 2.500, 880 y 726€, respectivamente. Además de observar una menor tasa de trasfusiones, reintervenciones y eventos residuales (complicaciones), lo que generó al final del proceso hospitalario y quirúrgico una reducción estimada de 2825U$ (aproximadamente 2.600€) y un estimado del 10% de reducción del gasto total de proceso quirúrgico24.
En otro estudio, Vertuani et al., compararon la fusión espinal en pacientes quienes fueron intervenidos en Reino Unido y en Italia. En su análisis de costos incluyó los recursos utilizados para cada paciente y su procedimiento, entre lo que cabe resaltar los costos quirúrgicos (salas de cirugía, fungibles y prótesis, equipo técnico, transfusiones, drenaje quirúrgico), recursos hospitalarios (cama hospitalaria y medicación perioperatoria) y complicaciones quirúrgicas. Los costos directos derivados del material quirúrgico en Italia para la MIS fue de 3.137€ en relación a 2.684€ de la cirugía abierta, con una diferencia de 453€ favoreciendo la cirugía abierta, y en Reino Unido los costos asociados fueron de 2.856€ vs. 2.135€ con una diferencia de 721€ a favor de la cirugía abierta. Pese a existir una tendencia a la favorabilidad económica de la cirugía abierta en tema de costos directos asociados al instrumental, en Reino Unido se observó un menor costo total asociado a la MIS vs. la cirugía abierta (13.399€ vs. 15.065€) sucediendo el mismo fenómeno en Italia (10.012€ vs. 10.985€) observando una diferencia a favor de la MIS de 1.666€ y 973€ para cada país, respectivamente. Este evento se explica debido a que un descenso de la tasa de complicaciones y trasfusiones (las cuales son más frecuentes en la cirugía abierta), y una reducción de la estancia hospitalaria compensa el incremento del valor unitario del material para la realización de la MIS respecto a la cirugía abierta, no obstante, pese a existir una tendencia a la costo-efectividad de la MIS, cuando el valor del material MIS supera los 4.111€ por paciente en Italia y 4.578€ en Reino Unido, deja de existir el beneficio de ahorro de costos para el sistema sanitario25. Es de vital importancia conocer el presupuesto requerido para el tratamiento óptimo de cada paciente, individualizando sus requerimientos, ya que el gasto sanitario impacta de manera directa la sostenibilidad del sistema.
ConclusionesEn la actualidad no existe una evidencia sólida y de calidad que soporte el uso extendido de la MIS para el tratamiento de las metástasis espinales, pero las ventajas que ésta aporta a la pronta recuperación del paciente, la baja estancia hospitalaria, el bajo riesgo de infección postoperatorio y menor uso de opioides postoperatorios hacen que éstos abordajes puedan ser considerados en el manejo de casos seleccionados de pacientes frágiles oncológicos. Es necesaria la realización de ensayos clínicos prospectivos aleatorizados que permitan demostrar los beneficios de la cirugía MIS respecto a la tradicional para poder implementarla en el tratamiento quirúrgico de manera rutinaria, ya que en la actualidad se utiliza solo en casos seleccionados.
En la actualidad no existen estudios económicos que comparen el costo-beneficio de la MIS en la patología oncológica, no obstante, la evidencia disponible en la fusión espinal podría permitir inferir una tendencia a un menor gasto sanitario final derivado del uso de la MIS respecto a la cirugía abierta producto de una menor tasa de complicaciones post-quirúrgicas y de trasfusiones sanguíneas, así como una menor estancia hospitalaria, pese a ser claro un coste unitario mayor por paciente del material requerido para la realización de la MIS en comparación con la cirugía abierta. Sin embargo, para mantener la costo-eficiencia de la indicación quirúrgica MIS es importante establecer un límite de gasto en el instrumental dado que superar los 4.000€ por caso podría generar una pérdida de beneficio económico respecto a la cirugía tradicional.
Nivel de evidenciaNivel de evidencia II.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
FinanciaciónLos autores declaran que no han recibido financiación para la realización de la presente investigación, la preparación del artículo, ni su publicación.