La sospecha diagnóstica de un tumor lipomatoso atípico (TLA) es difícil. El objetivo de este estudio es ahondar en los aspectos diagnósticos más controvertidos del tema.
Material y métodoEstudio observacional, longitudinal y retrospectivo de una serie de 96 tumores grasos profundos a la fascia (75 lipomas y 21 TLA) de 2006 a 2016. Se analizaron y compararon variables demográficas, clínicas, de imagen y patológicas, así como otras relacionadas con el tratamiento y los resultados oncológicos de los pacientes. Para el estudio estadístico, se realizó un análisis descriptivo de las variables recopiladas. Para evaluar las potenciales variables predictoras de malignidad, se realizó un análisis multivariante tipo regresión logística, incluyendo las que fueron estadísticamente significativas en el análisis univariado.
ResultadosUna edad mayor al diagnóstico, la localización en miembros inferiores y un mayor tamaño fue significativamente más frecuente en los TLA. Los hallazgos en RM no mostraron diferencias estadísticamente significativas entre ambos grupos. En el análisis multivariado, las mismas variables clínicas se confirmaron como factores predictores de malignidad. En la curva ROC, se determinó como como factor predictor de malignidad un punto de corte óptimo de 134,0 mm.
ConclusionesLa edad avanzada, la localización en miembros inferiores y un tamaño mayor son factores pronósticos de malignidad en el diagnóstico diferencial entre los lipomas profundos y el tumor lipomatoso atípico. Ninguna variable radiológica en RM alcanzó significación como factor predictor de malignidad en nuestra serie.
The diagnostic suspicion of an atypical lipomatous tumour (ALT) is difficult. The aim of this study is to delve into the most controversial diagnostic aspects of the subject.
Material and methodObservational, longitudinal, and retrospective study of a series of 96 deep adipose tumours (75 lipomas and 21 TLA) from 2006 to 2016: demographic, clinical, imaging and pathological variables were analysed and compared, as well as other variables related to treatment and oncological outcomes of the patients. A descriptive analysis of the collected variables was performed for the statistical study. To evaluate the potential predictor variables of malignancy, a multivariate logistic regression analysis was performed, including those that were statistically significant in the univariate analysis.
ResultsOlder age at diagnosis, lower limb location and larger size were significantly more frequent in ALTs. MRI findings showed no statistically significant differences between the two groups. In multivariate analysis, the same clinical variables were confirmed as predictors of malignancy. In the ROC curve, an optimal cut-off point of 134.0 mm was used as a predictor of malignancy.
ConclusionsAdvanced age, location in the lower limbs and larger size are risk factors for malignancy in the differential diagnosis of deep lipomas and atypical lipomatous tumours. No radiological variable on MRI reached significance as a predictor of malignancy in our series.
Los tumores de estirpe lipomatosa son las neoplasias de partes blandas más comunes e incluyen un amplio espectro lesional, con un comportamiento biológico muy variable. La Organización Mundial de la Salud (OMS), en el año 2020, los clasificó en tres categorías: benignos, intermedios o localmente agresivos y malignos. Dentro de los tumores adiposos de agresividad intermedia, distinguió el tumor lipomatoso atípico (TLA), para referirse a los que se localizaban en las extremidades o el tronco, y el liposarcoma bien diferenciado (LSBD), para los que asentaban en cavidades como el mediastino, retroperitoneo, abdomen o pelvis1. Si bien ambas entidades son idénticas en morfología, cariotipo y comportamiento biológico, el pronóstico de los segundos se considera peor, por asentarse en localizaciones con un abordaje quirúrgico más complejo1.
El pronóstico de un lipoma profundo a la fascia (LPF) y un TLA/LSBD es muy distinto desde el punto de vista biológico. Si bien en los primeros el riesgo de recurrencia local es muy pequeño y no hay riesgo de metástasis o de malignización, los segundos pueden recidivar (7,5-52%)2,3, metastatizar a órganos distantes (0-1,2%) y hasta desdiferenciarse (1,1-8,3%)4.
La sospecha diagnóstica con base en datos clínicos y de imagen entre un lipoma profundo a la fascia (LPF) y un TLA es difícil, a pesar de que existan signos y hallazgos de resonancia magnética (RM) que sugieran la distinción. La morfología celular tampoco es definitoria. De hecho, los hallazgos citológicos de células multinucleadas, pleomorfismo y células atípicas grandes en muestras de tejido teñidas con Papanicolaou, pueden estar presentes en ambas entidades5. Solo la demostración de la presencia de amplificaciones para la región cromosómica 12q13-15, que afectan constantemente a MDM2 (100%) y frecuentemente a CDK4 (90%) en los TLA, aseguraría el diagnóstico6,7. Sin embargo, la detección mediante técnicas inmunohistoquímicas (IHQ) tiene peor sensibilidad (68,4% para CDK4 y 89,5% para MDM2) que la que deparan las técnicas moleculares7, siendo estas menos accesibles en los laboratorios. Con todo, sin entrar en la controversia que supone la indicación o no de una biopsia preoperatoria6, la amplificación de MDM2 por hibridación in situ fluorescente (FISH), en el análisis de la pieza de resección, se considera el «patrón oro» en el diagnóstico diferencial de un tumor adiposo profundo3.
Respecto al tratamiento, los LPF se extirpan quirúrgicamente con márgenes marginales cuando son sintomáticos, o existen dudas diagnósticas, usualmente sin biopsia previa. Ante un diagnóstico razonablemente seguro en pacientes asintomáticos, la observación es de elección. El tratamiento de los TLA/LSBD es quirúrgico, siendo controvertido el margen de resección y la necesidad o no de radioterapia, que se decidiría en equipos multidisciplinarios teniendo en cuenta diferentes factores8,9.
Aunque los tumores lipomatosos han sido ampliamente estudiados, son relativamente pocos los estudios que continúen incidiendo en los factores predictores de malignidad en las lesiones profundas de agresividad incierta. El objetivo del nuestro es presentar nuestra experiencia en los aspectos diagnósticos más controvertidos del tema en una serie amplia y con uno de los mayores tiempos de seguimiento.
Material y métodoSe ha realizado un estudio observacional retrospectivo de variables clínicas y de imagen potencialmente predictoras de malignidad, en una serie de pacientes con tumores adiposos profundos de los miembros y el tronco. Se incluyeron pacientes mayores de 18 años de edad, tratados quirúrgicamente desde el 1 de julio de 2006 hasta el 31 de diciembre de 2016, en un mismo centro hospitalario terciario con diagnóstico patológico de LPF o TLA. Todos los pacientes se sometieron a procedimientos quirúrgicos con conservación del miembro y en todos los casos se realizaron radiografías y RM previa a la cirugía. Una vez obtenidas las pruebas de imagen pertinentes, los pacientes son valorados en el Comité de Tumores Musculoesqueléticos (CTME), donde se decide si es necesario o no biopsiar la tumoración. La decisión sobre qué pacientes, quedó a criterio del CTME. En términos generales, no se indicó biopsia en los casos con diagnóstico radiológico de LPF o TLA. Por el contrario, en aquellos casos en los que existían otros diagnósticos de presunción diferentes a los previos o sospecha de lesión agresiva, se procedió a biopsiar la tumoración.
El diagnóstico definitivo de la lesión se obtuvo tras el análisis histológico de la pieza de resección por parte del Servicio de Anatomía Patológica, para lo cual se realizaron estudios de microscopía convencional, IHQ (CDK4 y MDM2) y citogenética (amplificación MDM2-FISH).
Se evaluaron variables demográficas, clínicas y de imagen: edad, sexo, primer síntoma o signo de consulta médica, crecimiento y localización de la tumoración (miembro superior, inferior o tronco), diagnóstico en el informe radiológico, presencia de septos fibrosos y su grosor, tamaño de la tumoración (según el diámetro mayor en RM), localización (intra o intermuscular), contorno lesional (capsulado o no), tipo de patrón graso (homogéneo o heterogéneo), edema perilesional y captación de contraste en RM (presencia o no). Se registró si el paciente había recibido radioterapia y si presentó recidiva local (RL) o metástasis durante el seguimiento. La radioterapia postoperatoria en los TLA se consensuó en el CTME atendiendo a la edad, tamaño, localización y márgenes de resección del tumor. En general se indicaba en aquellos pacientes con resección marginal y sin contraindicación expresa para la misma, como pudiera ser complicaciones locales de la herida quirúrgica. Atendiendo a estos criterios 13 (61,9%) de los 21 pacientes del grupo B, recibieron dicho tratamiento adyuvante.
La mediana de seguimiento fue de 72,1 meses (rango intercuartílico [RIC]: 54,6), en los pacientes del grupo A; y de 93,3 meses (RIC: 56,7) en los diagnosticados del grupo B.
Los datos fueron analizados con el programa estadístico SPSS, versión 25.0 (IBM Corp., Armonk, NY, EE. UU.). El análisis descriptivo de las variables categóricas se expresó en forma de porcentajes y las cuantitativas en términos de mediana y RIC. El análisis comparativo de las variables categóricas se realizó mediante la prueba de χ2 o prueba exacta de Fisher. Al comparar variables cuantitativas con cualitativas con dos categorías se usó la prueba de U de Mann-Whitney como test no paramétrico. Para todos los test previamente descritos, se consideró como significativo un valor de p<0,05. Se realizó un análisis multivariante según un modelo de regresión logística binaria, incluyendo aquellas variables que habían alcanzado significación estadística en el análisis univariante. Los resultados fueron expresados en forma de odds ratio (OR), con sus respectivos intervalos de confianza a 95% (IC 95%). La adecuación del modelo fue evaluada mediante la prueba de bondad de ajuste de Hosmer y Lemeshow, considerando un buen ajuste la presencia de un valor de p no significativo. Se realizó un análisis de la curva receiver operating characteristic (ROC) y obtención de su respectiva área bajo la curva (AUC), para localizar el punto de corte óptimo en términos de diámetro mayor del tumor, para la discriminación del diagnóstico de malignidad.
ResultadosLa muestra final incluyó 96 pacientes, que se dividieron en dos grupos: grupo A (LPF, 75 casos) y grupo B (TLA, 21 casos). Los resultados clínicos y de imagen se resumen en las tablas 1 y 2, respectivamente. En la tabla 3 se muestran los resultados del análisis microscópico de la lesión. La IHQ para CK4 y MDM2 fue negativa en todos los pacientes del grupo A. En los del grupo B fue positiva para CDK4 en 15 (71,4%) y para MDM2 en 18 (85,7%). La amplificación genómica de MDM2 por técnica FISH fue negativa en todos los pacientes del grupo A y positiva en todos los del grupo B (100%).
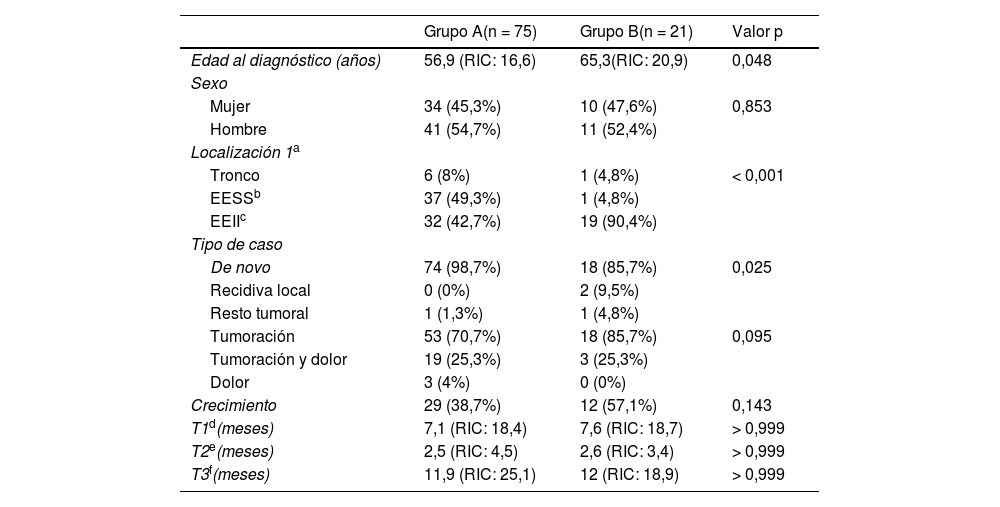
Principales características clínicas y epidemiológicas de los grupos del estudio
| Grupo A(n = 75) | Grupo B(n = 21) | Valor p | |
|---|---|---|---|
| Edad al diagnóstico (años) | 56,9 (RIC: 16,6) | 65,3(RIC: 20,9) | 0,048 |
| Sexo | |||
| Mujer | 34 (45,3%) | 10 (47,6%) | 0,853 |
| Hombre | 41 (54,7%) | 11 (52,4%) | |
| Localización 1a | |||
| Tronco | 6 (8%) | 1 (4,8%) | < 0,001 |
| EESSb | 37 (49,3%) | 1 (4,8%) | |
| EEIIc | 32 (42,7%) | 19 (90,4%) | |
| Tipo de caso | |||
| De novo | 74 (98,7%) | 18 (85,7%) | 0,025 |
| Recidiva local | 0 (0%) | 2 (9,5%) | |
| Resto tumoral | 1 (1,3%) | 1 (4,8%) | |
| Tumoración | 53 (70,7%) | 18 (85,7%) | 0,095 |
| Tumoración y dolor | 19 (25,3%) | 3 (25,3%) | |
| Dolor | 3 (4%) | 0 (0%) | |
| Crecimiento | 29 (38,7%) | 12 (57,1%) | 0,143 |
| T1d(meses) | 7,1 (RIC: 18,4) | 7,6 (RIC: 18,7) | > 0,999 |
| T2e(meses) | 2,5 (RIC: 4,5) | 2,6 (RIC: 3,4) | > 0,999 |
| T3f(meses) | 11,9 (RIC: 25,1) | 12 (RIC: 18,9) | > 0,999 |
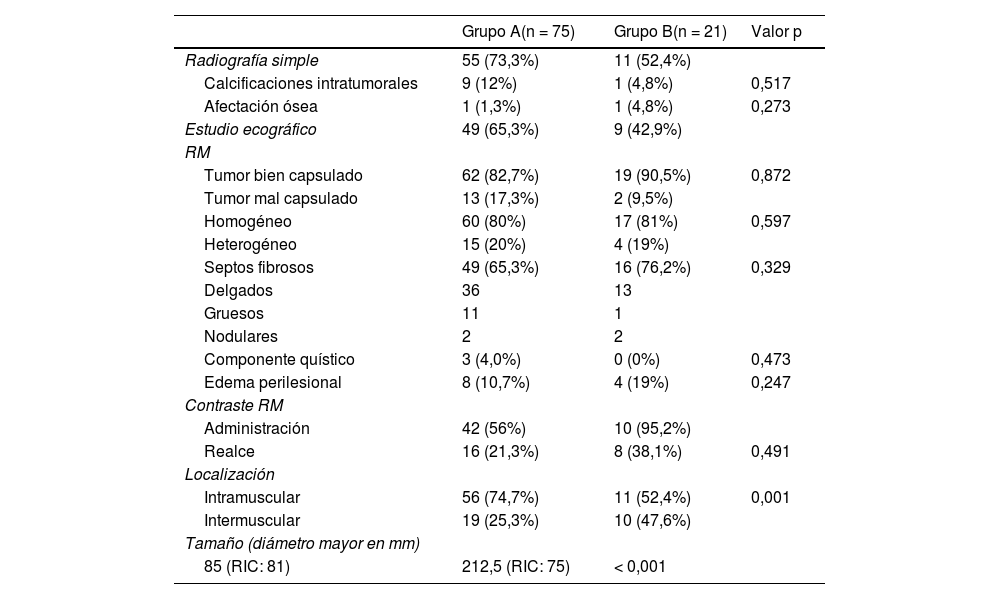
Principales características de las pruebas de imagen empleadas en el proceso diagnóstico de los tumores grasos para los distintos grupos del estudio
| Grupo A(n = 75) | Grupo B(n = 21) | Valor p | |
|---|---|---|---|
| Radiografía simple | 55 (73,3%) | 11 (52,4%) | |
| Calcificaciones intratumorales | 9 (12%) | 1 (4,8%) | 0,517 |
| Afectación ósea | 1 (1,3%) | 1 (4,8%) | 0,273 |
| Estudio ecográfico | 49 (65,3%) | 9 (42,9%) | |
| RM | |||
| Tumor bien capsulado | 62 (82,7%) | 19 (90,5%) | 0,872 |
| Tumor mal capsulado | 13 (17,3%) | 2 (9,5%) | |
| Homogéneo | 60 (80%) | 17 (81%) | 0,597 |
| Heterogéneo | 15 (20%) | 4 (19%) | |
| Septos fibrosos | 49 (65,3%) | 16 (76,2%) | 0,329 |
| Delgados | 36 | 13 | |
| Gruesos | 11 | 1 | |
| Nodulares | 2 | 2 | |
| Componente quístico | 3 (4,0%) | 0 (0%) | 0,473 |
| Edema perilesional | 8 (10,7%) | 4 (19%) | 0,247 |
| Contraste RM | |||
| Administración | 42 (56%) | 10 (95,2%) | |
| Realce | 16 (21,3%) | 8 (38,1%) | 0,491 |
| Localización | |||
| Intramuscular | 56 (74,7%) | 11 (52,4%) | 0,001 |
| Intermuscular | 19 (25,3%) | 10 (47,6%) | |
| Tamaño (diámetro mayor en mm) | |||
| 85 (RIC: 81) | 212,5 (RIC: 75) | < 0,001 | |
RIC: rango intercuartílico; RM: resonancia magnética.
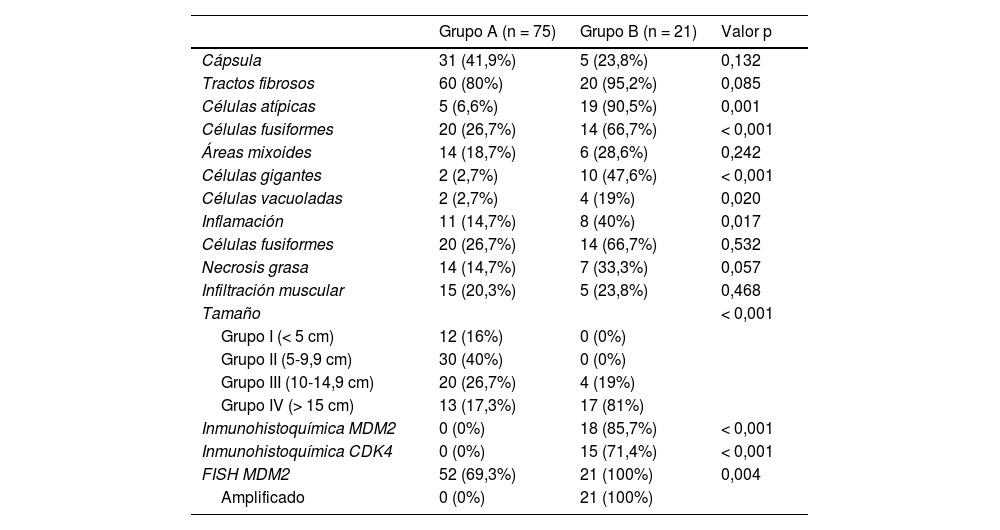
Principales características histopatológicas de los distintos grupos estudiados
| Grupo A (n = 75) | Grupo B (n = 21) | Valor p | |
|---|---|---|---|
| Cápsula | 31 (41,9%) | 5 (23,8%) | 0,132 |
| Tractos fibrosos | 60 (80%) | 20 (95,2%) | 0,085 |
| Células atípicas | 5 (6,6%) | 19 (90,5%) | 0,001 |
| Células fusiformes | 20 (26,7%) | 14 (66,7%) | < 0,001 |
| Áreas mixoides | 14 (18,7%) | 6 (28,6%) | 0,242 |
| Células gigantes | 2 (2,7%) | 10 (47,6%) | < 0,001 |
| Células vacuoladas | 2 (2,7%) | 4 (19%) | 0,020 |
| Inflamación | 11 (14,7%) | 8 (40%) | 0,017 |
| Células fusiformes | 20 (26,7%) | 14 (66,7%) | 0,532 |
| Necrosis grasa | 14 (14,7%) | 7 (33,3%) | 0,057 |
| Infiltración muscular | 15 (20,3%) | 5 (23,8%) | 0,468 |
| Tamaño | < 0,001 | ||
| Grupo I (< 5 cm) | 12 (16%) | 0 (0%) | |
| Grupo II (5-9,9 cm) | 30 (40%) | 0 (0%) | |
| Grupo III (10-14,9 cm) | 20 (26,7%) | 4 (19%) | |
| Grupo IV (> 15 cm) | 13 (17,3%) | 17 (81%) | |
| Inmunohistoquímica MDM2 | 0 (0%) | 18 (85,7%) | < 0,001 |
| Inmunohistoquímica CDK4 | 0 (0%) | 15 (71,4%) | < 0,001 |
| FISH MDM2 | 52 (69,3%) | 21 (100%) | 0,004 |
| Amplificado | 0 (0%) | 21 (100%) |
Ningún paciente del grupo A presentó recidiva local durante el tiempo de seguimiento. En el grupo B se registraron seis (28,6%) recidivas locales, con una mediana de tiempo hasta la RL de 13 (RIC: 80,3) meses. En cuanto al desarrollo de metástasis pulmonares, esta no se dio en ningún paciente de la serie.
Factores pronósticos de malignidadEn el análisis de regresión logística binaria, considerando la edad, el diámetro mayor de la tumoración en RM, la localización corporal (extremidades inferiores [EEII] frente a otra) y en RM (intramuscular o intermuscular), se demostró que el modelo fue significativo (χ2 = 48,9; p<0,001) y se confirmó que la edad (OR 1,1 por año [IC 95% 1,02-1,13]; p = 0,008), el tamaño tumoral (OR 1,3 por cm [IC 95%: 1,13-1,49]; p<0,001) y la localización en miembros inferiores (OR 6,6 [IC 95%: 1,01-41,32]; p = 0,049), se mostraban como variables pronósticas de malignidad independientes. Por el contrario, la localización interintramuscular no alcanzó significación estadística (p = 0,128), quedando excluida del modelo.
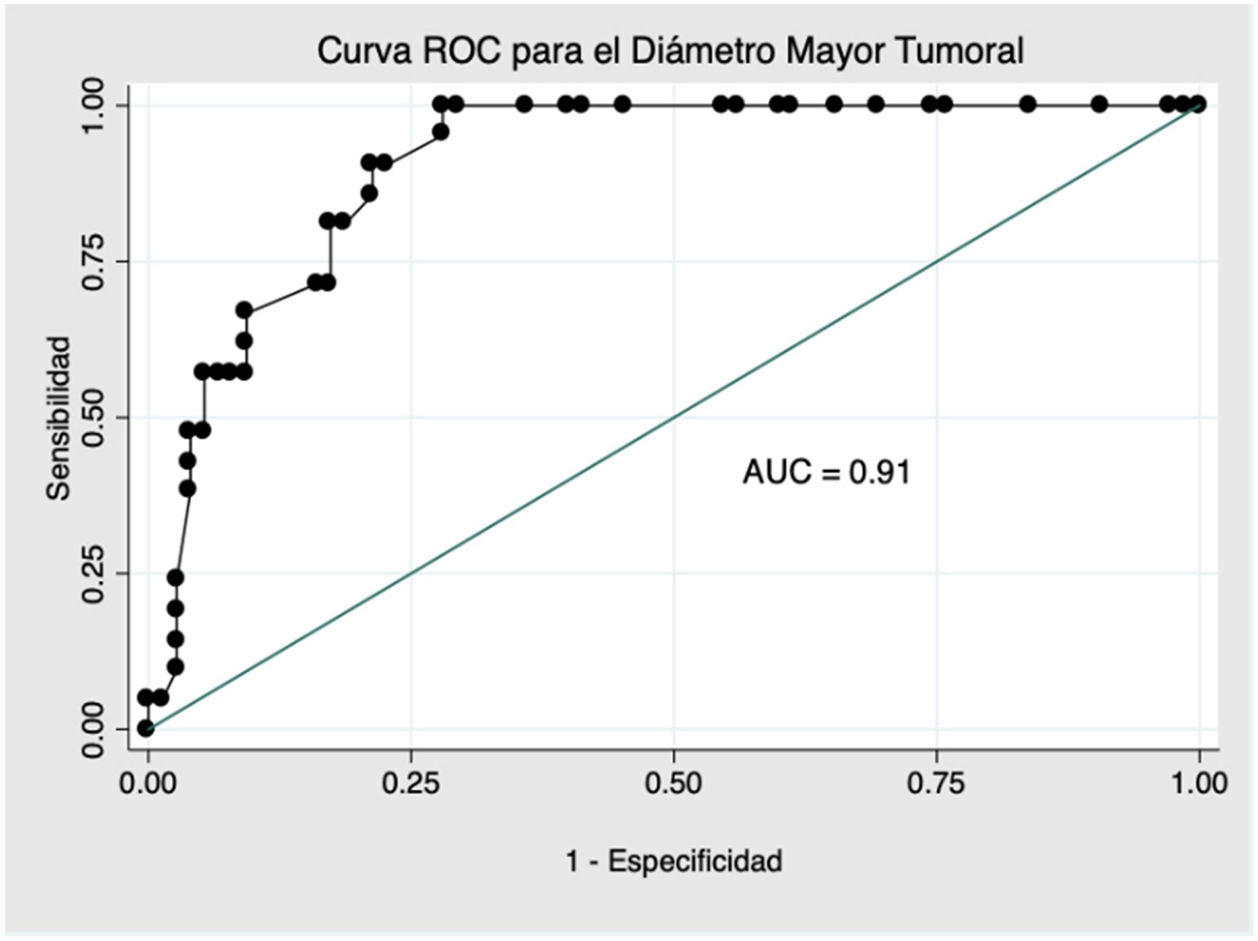
En el análisis de la curva ROC (fig. 1), se obtuvo un punto de corte óptimo para el diagnóstico de TLA de 134,0 mm con un AUC de 0,91 (IC 95%: 0,85-0,96), una sensibilidad de 90,5% (IC 95%: 71,1-97,3) y una especificidad de 78,7% (IC 95%: 68,1-86,4). Para una prevalencia en la muestra de 21,9% de TLA, los valores predictivos positvo (VPP) y negativo (VPN) fueron de 54,3 y de 96,7%, respectivamente.
DiscusiónLa sospecha diagnóstica de un liposarcoma de alto grado es relativamente sencilla. Por el contrario, distinguir entre un LPF y un TLA es mucho más complejo. Con respecto a sus aspectos demográficos, la mayoría de los autores coinciden en que hay una asociación estadísticamente significativa entre la edad y el diagnóstico de malignidad, de tal forma que los pacientes con diagnóstico de TLA tienen una mediana de edad superior a la de los pacientes con diagnóstico de lipoma10–13. Nuestros resultados al respecto no difieren de los de la mayoría de los autores, con una mediana de edad al diagnóstico significativamente superior en el grupo de los TLA en comparación con los LPF. Además, en el modelo de regresión logística binaria se observa un mayor riesgo de ser diagnosticado de liposarcoma de bajo grado frente al de lipoma, a medida que aumenta la edad, con una OR 1,1 (IC 95%: 1,02-1,13). En cuanto al género, algunos autores han sugerido que el sexo masculino se asocia de manera significativa con el diagnóstico de TLA11,14. Sin embargo, son más los que no han encontrado tales diferencias12,13,15. En nuestro estudio tampoco se han observado diferencias significativas. En cuanto a la sintomatología, hay coincidencia entre los autores de que el primer signo o síntoma por el que consultó el paciente fue más frecuentemente la presencia de el bulto o una tumoración palpable11,14.
Desde el punto de vista de la imagen, el tamaño tumoral en RM se ha revelado en las distintas series como uno de los factores predictores de malignidad más avalado, siendo el diámetro de los TLA significativamente mayor que el de los lipomas, estableciéndose distintos puntos de corte según distintos autores. Si bien la American Joint Committee on Cancer (AJCC)16 ha sugerido un punto de corte > 8 cm como factor pronóstico de malignidad en los sarcomas, las características propias del TLA han demostrado en distintas series valores superiores. Brisson et al.10 determinaron una mediana de 13 cm en el grupo de los lipomas en comparación con la de los TLA, que presentaron una mediana de 18,4 cm. En el caso de Kransdorf et al.11, los TLA obtuvieron una mediana de tamaño casi el doble a la del grupo de los lipomas (24 vs. 10 cm). Knebel et al.13 observaron que los tumores grasos con un diámetro mayor superior a 130,0 mm tenían más probabilidades de ser diagnosticados como TLA que como lipomas (66,1 vs. 33,9%). Estos autores realizaron un análisis ROC para la diferenciación de ambas entidades con un AUC de 0,809 (IC 95%: 0,73-0,89), un valor de corte óptimo de 130,0 mm, una sensibilidad de 80,9% y una especificidad de 69,7%, lo que se traduce en que la probabilidad de que un tumor graso sea finalmente diagnosticado de TLA se incrementará en 2,74 (OR) veces (IC 95%: 1,82-4,11, p<0,001), si su diámetro mayor es superior a 130 mm. Estos datos son equiparables a los resultados del presente estudio. Además, en el análisis multivariable el tamaño se asoció de forma independiente con el diagnóstico de TLA. Por lo tanto, se comportaría como predictor de malignidad, con una OR de 1,3 (IC 95% 1,13-1,49), p<0,001.
Al comparar la localización de los lipomas con la de los TLA, en la mayoría de los estudios, se observa una distribución más frecuente de los segundos en miembros inferiores y región glútea en comparación con la de los lipomas10–14. Resultados similares observamos en el presente estudio, si bien en nuestro análisis multivariable la potencia estadística para la localización en miembros inferiores como predictor de malignidad fue más baja que en el caso de la edad y del tamaño de la lesión.
Las pocas series que evalúan los márgenes en RM de las lesiones adiposas profundas coinciden en que las de margen no capsulado o pseudoinfiltrativo corresponden más frecuentemente a TLA13,15. No fue así en nuestro estudio, si bien los resultados probablemente obedezcan a la variabilidad interobservador, dado que las RM procedían de distintos centros, donde la experiencia en patología músculoesquelética oncológica de los radiólogos intervinientes no era pareja. La variabilidad metodológica también existe en la literatura científica en relación con la evaluación de la señal grasa10–13,15. En nuestra serie, los patrones homogéneos fueron más frecuentes en todos los grupos, obviando una división volumétrica del área tumoral en función de su patrón graso y dejando la interpretación al criterio subjetivo del radiólogo. La evaluación mediante RM con contaste endovenoso paramagnético, si bien es una técnica generalmente empleada en el estudio de una masa de parte baldas, su uso, en este contexto, es inconstante11.
En nuestra serie, a pesar de que la captación fue más frecuente en el grupo del TLA, estos hallazgos no alcanzaron significación estadística, a diferencia de otros autores13–15. Respecto al edema perilesonal en RM, Jaovisidha et al.15 identificaron una mayor frecuencia en el caso de los TLA (11,1%), en comparación con los lipomas (3,4%), pero sin que estas diferencias alcanzaran significación estadística. Algo similar ocurrió en nuestra serie.
Centrándonos en la presencia de septos en RM, constante tema de discusión como factor predictor de malignidad en el tema que nos ocupa, Kransdorf et al.11 encontraron diferencias significativas entre los LPF (6%) y los TLA (96%), considerando la presencia de septos gruesos y nodulares como hallazgos de malignidad. Cheng et al.14 también describieron diferencias entre los dos grupos, con presencia de septos fibrosos en 14,4% de los lipomas y en 70,7% de los TLA, si bien no estudiaron la repercusión de los septos nodulares en el diagnóstico diferencial de las dos entidades. Jaovisidha et al.15 también indicaron una mayor presencia de septos, en el caso de los TLA, 88,9% en comparación con los lipomas 10,3%. Sin embargo, no definieron diferencias en cuanto al grosor ni si eran nodulares o no, limitándose a describir si estaban presentes en cualquiera de sus formas. Para Knebel et al.13, la presencia de septos gruesos fue considerada factor de riesgo para padecer un TLA. En nuestro estudio, no observamos diferencias significativas entre el diagnóstico de malignidad y la presencia de septos fibrosos (65,3% en el caso de los LPF y 76,2% en el grupo de los TLA; p = 0,329), aunque fueron más frecuentes en el grupo de los tumores malignos. El hallazgo podría interpretarse como un sesgo de referencia, ya que es más probable que los lipomas que se derivan a un centro experto en sarcomas sean aquellos que presentan características atípicas o sugestivas de malignidad en las pruebas de imagen. Tampoco observamos una correlación significativa al comparar si los septos eran finos, gruesos o nodulares.
El uso de la biopsia en el diagnóstico diferencial de un LPF o TLA sigue siendo controvertido, su indicación dependerá del grado de sospecha clínico y radiológico17. Thavikulwat et al.18 observaron que el rendimiento diagnóstico de la biopsia por punción con aguja gruesa (BAG) era inferior en el caso de los TLA, en comparación con los sarcomas de alto grado. No obstante, la identificación del gen MDM2 podría hacer más sensible y específico el procedimiento19, sobre todo si las muestras se obtienen por biopsias incisionales20 y mediante la amplificación de MDM2 por FISH en comparación con la detección de la expresión de la proteína MDM2 por técnicas inmunohistoquímicas6. En nuestro trabajo, en los 29 pacientes en los que se realizaron, siempre con trocar, hubo coincidencia diagnóstica tras el análisis de la pieza de resección en 85,7% de los LPF y en 75% de los TLA. Con todo, parece recomendable biopsiar solo los casos en los que podría cambiar el enfoque terapéutico, o cuando existan dudas con respecto al grado de malignidad que se supone5.
La biopsia podría obviarse si los márgenes de la resección fueran los mismos, independientemente de que se trate de un LPF o de un TLA. En este supuesto habría que informar al paciente de la posibilidad o no de precisar radioterapia postoperatoria. Actualmente, el papel de la radioterapia (RT) en el tratamiento de estos tumores es controvertido, si bien algunos autores sugieren que el tratamiento con RT reduce las tasas de recurrencia local8, otros recomiendan no usarla de forma generalizada en este grupo de pacientes, dado que las tasas de recurrencia actuales junto con la infrecuencia de metástasis y desdiferenciación a sarcoma de alto grado no justifica la toxicidad de la RT, además es posible que la respuesta del TLA a la RT sea baja debido a su naturaleza de bajo grado, reservando estos tratamientos para aquellos casos recidivados9 o en localizaciones complejas a criterio del CTME.
Ahondando en la recurrencia local, nuestra serie obtuvo una tasa de 28,6% (seis pacientes), dentro de la horquilla de valores publicada por otros autores2,3. Si bien destacar que de los seis pacientes que recidivaron tres recibieron tratamiento radiooncológico y en los otros tres se decidió no era procedente a criterio del CTME.
En cuanto a nuestros resultados histopatológicos, tanto inmunohistoquímicos como citogenéticos, en el análisis de la pieza de resección, estos no difieren de los de otros autores5–7.
ConclusionesEn conclusión, sigue siendo difícil distinguir un LPF de un TLA por datos clínicos, de imagen e incluso histológicos. El TLA se sospechará clínicamente en pacientes de edad avanzada con una lesión grande de estirpe adiposa localizada en los miembros inferiores. Ninguna variable radiológica en RM alcanzó significación como factor predictor de malignidad en nuestra serie.
Nivel de evidenciaNivel de evidencia IV.
FinanciaciónEl estudio fue financiado por una ayuda a proyectos de investigación en Biomedicina, Gestión Sanitaria y Atención Sociosanitaria de la Gerencia Regional de Salud de Castilla y León, Consejería de Sanidad (Junta de Castilla y León) en 2016 al proyecto «Estudio comparativo de lipomas y liposarcomas bien diferenciados/lipomas atípicos. Orientaciones diagnósticas y terapéuticas ante tumores lipomatosos profundos de los miembros», cuyo investigador principal fue el Dr. Francisco Miguel Izquierdo García, con una dotación económica de 3.983 euros (con número de expediente GRS 1281/A/16).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A Carlos Pérez por su apoyo en el análisis estadístico. A la Dra. Yesica Soto por su colaboración logística en la fase de recogida de datos. Y a Rosario Turiel Vicente, técnico de anatomía patológica por la realización de las técnicas de inmunohistoquímica y FISH.