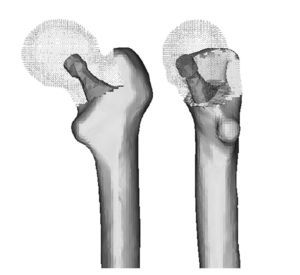
El hueso es un tejido vivo permanentemente sometido a un proceso de recambio, el cual se caracteriza por resorción y formación de hueso nuevo, sin modificar su morfología; este proceso se denomina remodelado. Por otra parte, el hueso adapta su estructura, de acuerdo con la Ley de Wolff, a las fuerzas y cargas biomecánicas que recibe.
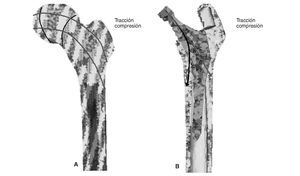
En una articulación de cadera la carga procedente del cuerpo se transmite a la cabeza femoral; desde allí al hueso cortical medial del cuello femoral hasta el trocánter menor, desde donde se distribuye por el hueso diafisario.
La implantación de un vástago femoral, cementado o no cementado, produce en el hueso una clara alteración de la transmisión fisiológica de las cargas, ya que éstas se transmiten ahora a través del vástago protésico, de forma centrípeta, desde la cavidad central al hueso cortical. Esta alteración de la biomecánica normal de la cadera da lugar en el hueso a un fenómeno denominado remodelado adaptativo1, ya que éste tiene que adaptarse a la nueva situación biomecánica. En dicho remodelamiento el hueso se ve sometido a factores mecánicos y biológicos. Los factores mecánicos están en relación con la nueva distribución de cargas que supone la implantación de la prótesis en el fémur y con las características físicas del implante (tamaño, diseño y aleación), así como con el tipo de fijación del implante al fémur2-6. Los factores biológicos están en relación con la edad y el peso del individuo, la masa ósea inicial, la calidad de la fijación primaria y la carga a la que se somete el implante. De todos estos factores el más importante es la masa ósea inicial2.
El objetivo de todos los diseños protésicos no cementados ha sido conseguir una óptima transmisión de cargas —de tipo fisiológico— desde la zona metafisaria al resto del fémur, intentando evitar los fenómenos de puenteo de fuerzas o stress-shielding. El seguimiento a largo plazo de distintos modelos de vástagos no cementados ha demostrado que esto no se consigue7-14. También se pensó que confiriendo a vástagos de apoyo metafisario un recubrimiento de sustancia osteoconductora, como la hidroxiapatita (HA), que consiguiese una buena osteointegración proximal15, se obtendría una mejor transmisión de cargas y se evitarían los fenómenos de stress-shielding, basándose en que se convertirían las fuerzas verticales transmitidas por el vástago en fuerzas horizontales que se transmitirían a la zona metafisaria16.
El fémur responde al puenteo de fuerzas o stress-shielding en su zona proximal con una desvitalización ósea que puede apreciarse con radiología simple17 a partir de pérdidas entre el 30 y 40% de masa ósea, pero es necesario el estudio con densitometría de rayos X de doble energía (DEXA) para cuantificarla y valorar su evolución a lo largo de los años18-20.
El estudio con DEXA a 10 años de un vástago anatómico de apoyo metafisario y recubrimiento con HA (ABG 1) ha demostrado que hay una desvitalización del fémur proximal, lo cual indica que existe un claro fenómeno de stress-shielding porque la parte proximal femoral no recibe cargas, y en aplicación de la Ley de Wolf la disminución del estado tensional en esta zona produce pérdida de masa ósea21,22. Este comportamiento no se corresponde con las previsiones de diseño.
La simulación mediante elementos finitos (EF) permite caracterizar los cambios biomecánicos que se producen en el fémur como resultado de la implantación de un vástago protésico y sus posibles consecuencias en cuanto al comportamiento a largo plazo. Existen numerosos estudios que plantean diversos modelos para estudiar el efecto y la interacción que produce en el fémur la implantación de una prótesis de cadera. Muchos de ellos centran su atención en el comportamiento mecánico de diferentes tipos de implantes protésicos bajo el efecto de cargas estáticas, dinámicas o de fatiga, y la influencia que tiene el material en el mismo23-26. Es especial-mente relevante el estado de cargas que se aplican en el mode-lo de elementos finitos, por lo que existen estudios27 que analizan la aplicación de diferentes combinaciones de fuerzas, aunque lo más habitual es considerar dos cargas: la reacción de la cadera en la cabeza femoral y la producida por la acción del músculo abductor28,29. Existen, además, numerosos trabajos orientados a la modelización de la remodelación ósea, pero enfocados bien a corto plazo (uno o dos meses posteriores a la operación), bien a la transición entre pre y posoperatorio30-32.
Los objetivos de este trabajo han sido en primer lugar analizar los cambios a largo plazo en la densidad ósea del fémur tras la implantación de un vástago femoral no cementado, anatómico, de apoyo metafisario y recubierto de HA (ABG-I); en segundo lugar, realizar sendos modelos tridimensionales de elementos finitos del fémur sano y tras la implantación de un vástago ABG-I para estudiar su comportamiento mecánico, fundamentalmente en lo que se refiere a la adecuada transmisión de cargas por contacto entre hueso y prótesis; finalmente, comprobar si los resultados de la simulación mediante elementos finitos permiten explicar los cambios biomecánicos que justifiquen la evolución observada en el estudio con DEXA a largo plazo con este modelo de vástago femoral, y si es un procedimiento válido para la predicción de la evolución ósea a largo plazo. No se pretende incidir en modelos de remodelación ósea, ampliamente estudiados en la bibliografía30-33, sino verificar la correlación entre el estímulo mecánico, caracterizado por los valores medios de tensión en cada zona, y los cambios detectados en la densidad ósea.
MATERIAL Y MÉTODO
Se diseñó un estudio prospectivo y controlado para determinar el remodelado periprotésico causado por el vástago femoral ABG-I, no cementado y de diseño anatómico.
El tamaño de la muestra se calculó a partir del promedio de pérdida de densidad ósea observado para las 7 áreas de Gruen en estudios previos, que fue, por cm2, de 130 mg de HA2,5,19,34-37, y la variación de densidad ósea en las determinaciones preoperatorias. De este modo se consideró necesario incluir un mínimo de 60 pacientes, aunque finalmente se añadieron 20 más con objeto de garantizar este mínimo número de sujetos a lo largo del seguimiento.
Los criterios de inclusión fueron los siguientes:
1) En primer lugar tener indicación médica para la utilización de este tipo de implante en función de la edad, forma y calidad del fémur.
2) En segundo lugar el diagnóstico debía ser de coxartrosis primaria y la afectación unilateral, ya que la cadera sana se tomó como control.
3) Finalmente, los pacientes aceptaban su inclusión en el estudio, que fue aprobado por el Comité local de Ética para la Investigación.
Los pacientes que se incluyeron en el estudio fueron intervenidos entre los meses de febrero y octubre de 1994. Sin embargo, del total de 80 pacientes que cumplieron los criterios de inclusión tan sólo 61 completaron el seguimiento a 10 años (32 hombres y 29 mujeres); presentaban una edad media de 59 años (rango 38 a 76) en el momento de la intervención, y un peso medio de 79,3 kg (rango 49 a 110 kg).
Todos los datos referentes a los 19 pacientes perdidos a lo largo del seguimiento se excluyeron del estudio. Los motivos de abandono fueron dos casos de enfermedad neurológica que impedía a los pacientes la marcha normal, tres casos de osteólisis que precisaron revisión del vástago, 8 pacientes que desarrollaron coxartrosis en la cadera control y precisaron ser protetizados y 6 que cambiaron de domicilio y no completaron el seguimiento.
El implante utilizado fue el vástago femoral ABG-I (Stryker, Howmedica) y el cotilo del mismo sistema cuya evolución no se incluyó en el estudio. Este vástago es no cementado, de diseño anatómico y encaje a presión (press-fit) a nivel metafisario. El implante está recubierto proximal-mente con una capa de HA de 70 micras de espesor, con cristalinidad del 97%, y muestra un diseño en forma de escamas en su cara anterior y posterior para aumentar su estabilidad. La cola del implante es delgada y corta para evitar el contacto con el hueso endostal diafisario.
Todos los pacientes fueron intervenidos usando un abordaje posterolateral. El canal femoral fue preparado mediante fresado diafisario (1 mm más que el diámetro de la cola del implante definitivo) y raspado progresivo hasta el encaje de la prótesis buscando dejar un espesor de 2-3 mm de hueso esponjoso alrededor del vástago. El par de fricción fue en todos los casos de cabeza metálica con inserto de polietileno. Se autorizó la carga parcial con dos muletas durante las primeras 6 semanas y el posterior abandono de las muletas según la tolerancia.
La valoración clínica se realizó con la escala de Merle-D'Aubigné en el preoperatorio y a lo largo del seguimiento. Periódicamente se obtuvieron radiografías de cada paciente a lo largo de los 10 años para determinar cambios en la posición de los implantes o cualquier otro hallazgo radiográfico indicativo de aflojamiento de acuerdo con los criterios de Engh38. Todos los estudios radiográficos fueron evaluados por el mismo observador.
Para valorar la evolución de la densidad mineral ósea se analizaron pequeñas áreas de 30 por 30 píxeles centradas en cada una de las 7 zonas de Gruen en torno al fémur, tanto en la cadera operada como en la sana. Para asegurar la colocación exacta de las áreas a analizar se utilizó un software de comparación de las exploraciones. Las determinaciones se realizaron con el densitómetro HOLOGIC QDR 1000 (Ho-logic Inc, Waltham, Massachusetts), utilizando un programa con exclusión de metales en ambas caderas en el preoperatorio y a los 10 años, con determinaciones adicionales en la cadera intervenida a los 15 días, 6 meses, primer, tercer, quinto y séptimo año postoperatorio. Sin embargo, considerando que es sobre el hueso que permanece tras la protetización donde tendrá lugar el remodelado, se tomaron las determinaciones de densidad ósea en el postoperatorio como referencia para posteriores comparaciones. La adecuada colocación del paciente se consideró de máxima importancia para garantizar la fiabilidad de las exploraciones, por lo que se desarrolló un protocolo de colocación de los pacientes39,40: en decúbito supino sobre la mesa del escáner con la cadera y las rodillas en extensión y con la extremidad en posición neutra sujeta a un dispositivo de plástico rígido mediante unas cintas de velcro. Las características técnicas del densitómetro utilizado son: error de precisión en fémur 1,5 a 2%; error de exactitud 2 a 4%, hasta un 10% en pacientes obesos; radiación al paciente menor de 3 mRem y tiempo de exploración de 8 minutos.
Para el análisis estadístico de los datos obtenidos a lo largo del seguimiento se realizó, en primer lugar, una prueba de ANOVA con nivel de significación 0,05 entre los datos de densidad ósea para cada zona femoral. Cuando se encontraron diferencias se realizó una prueba de la "t" de Student, con nivel de significación 0,025 para analizar los resultados entre la densidad preoperatoria y la obtenida en cada momento del seguimiento. Finalmente, se realizó otra prueba de la "t" Student para datos apareados, con el objetivo de comparar la densidad ósea entre la cadera operada y la sana a los 10 años de evolución.
Para la simulación con EF se utilizaron un fémur cadavérico, obtenido de un paciente sano de 60 años de edad, fallecido en accidente de tráfico, y una prótesis de cadera tipo ABG-I con vástago recubierto de HA (lado derecho y tamaño número 3, que es el más frecuentemente empleado en la práctica clínica, con código de REF 4841-103).
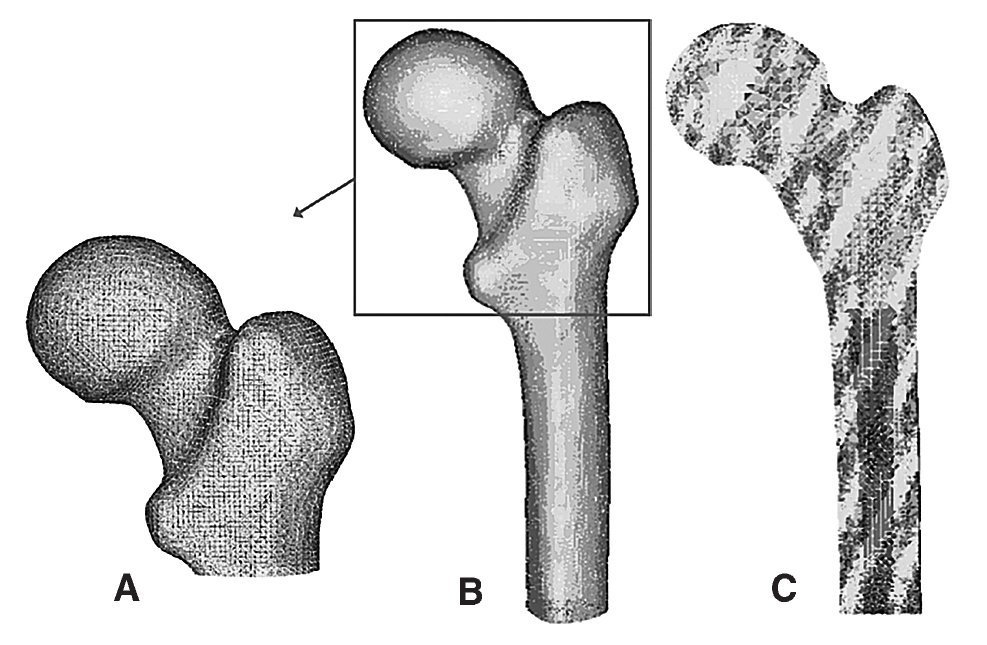
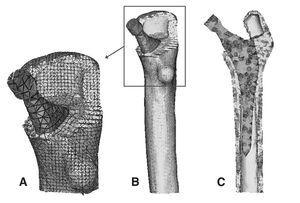
Para la realización del modelo de fémur no protetizado se utilizó un Escáner láser 3D Roland PIZCA. Se escaneó el fémur sano utilizando los programas Dr. Pizca 3 y 3D Editor. Mediante el escaneado del fémur se obtuvo un único modelo geométrico sin distinción entre los tres materiales que lo componen, hueso cortical, hueso esponjoso y médula ósea. Para determinar la geometría del hueso esponjoso se realizaron mediante tomografía axial computarizada (TAC) (General Electric Brightspeed Eltie) 30 cortes tomográficos en dirección transversal y 8 en dirección longitudinal. Los cortes horizontales fueron realizados a intervalos de 5 mm. Posteriormente se realizó un mallado inicial de las superficies de las diversas partes escaneadas y se procedió en I-deas41 a la realización de un mallado tridimensional (fig. 1) y a la introducción de las condiciones de contorno. El modelo se basaba en elementos de tipo tetraédrico de aproximación lineal.
Figura 1.(A) Detalle de la malla en la zona proximal del modelo de fémur sano; (B) modelo de elementos finitos de fémur sano; (C) corte longitudinal del modelo de fémur sano.
Para el desarrollo del modelo con prótesis se procedió a la operación de artroplastia de cadera en el fémur de cadáver, implantándose la prótesis del mismo modo que se realizaría en clínica humana. Este fémur operado fue escaneado por segunda vez para utilizarlo como base del posicionamiento de la prótesis.
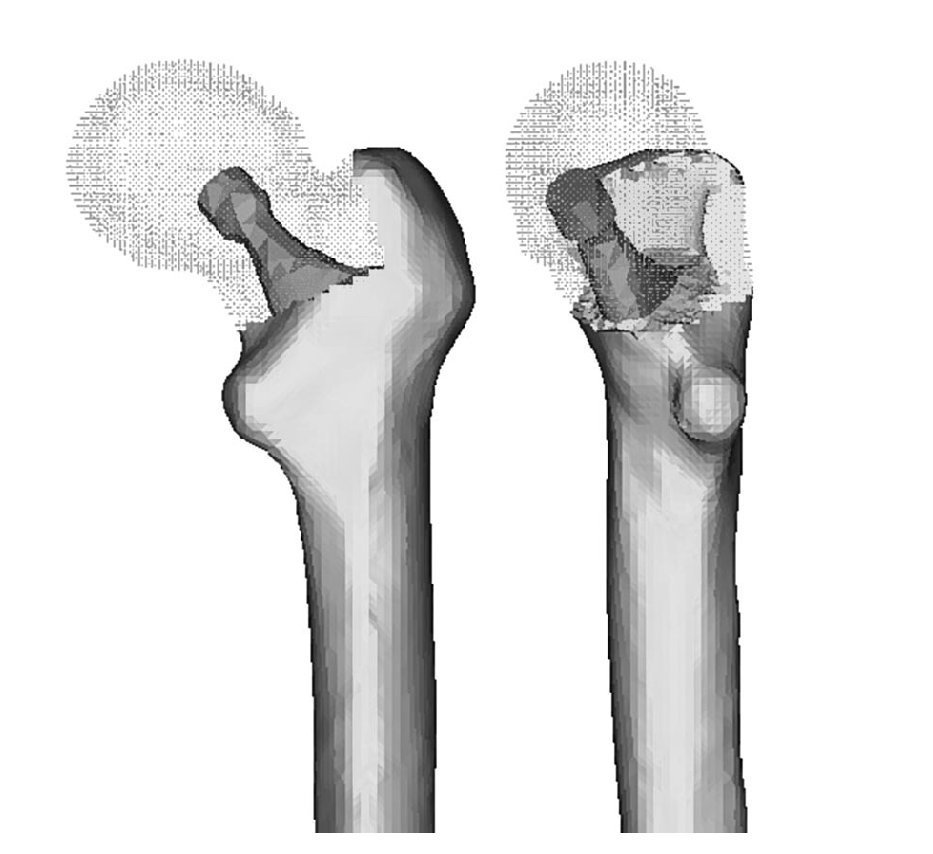
Una vez escaneada la prótesis ABG-I, e importadas las tres mallas en I-deas (fémur sano, prótesis ABG-I y fémur operado), se eliminó informáticamente la epífisis del fémur de cadáver, con cortes similares a los realizados en la cirugía, para poder insertar la prótesis, y posteriormente se posicionó ésta en el fémur tomando siempre como base la tercera de las mallas (fig. 2). Del proceso anterior de modelado del fémur de cadáver se utiliza únicamente el hueso cortical, y se modela nuevamente el hueso esponjoso a partir de él, de tal modo que se ajuste perfectamente al contacto con la prótesis (fig. 3). El programa Abaqus 6,542 se utiliza para el cálculo y simulación de los modelos previamente generados, y para la posterior visualización de sus resultados se emplea el programa Abaqus Viewer.
Figura 2.Superposición de ambos modelos.
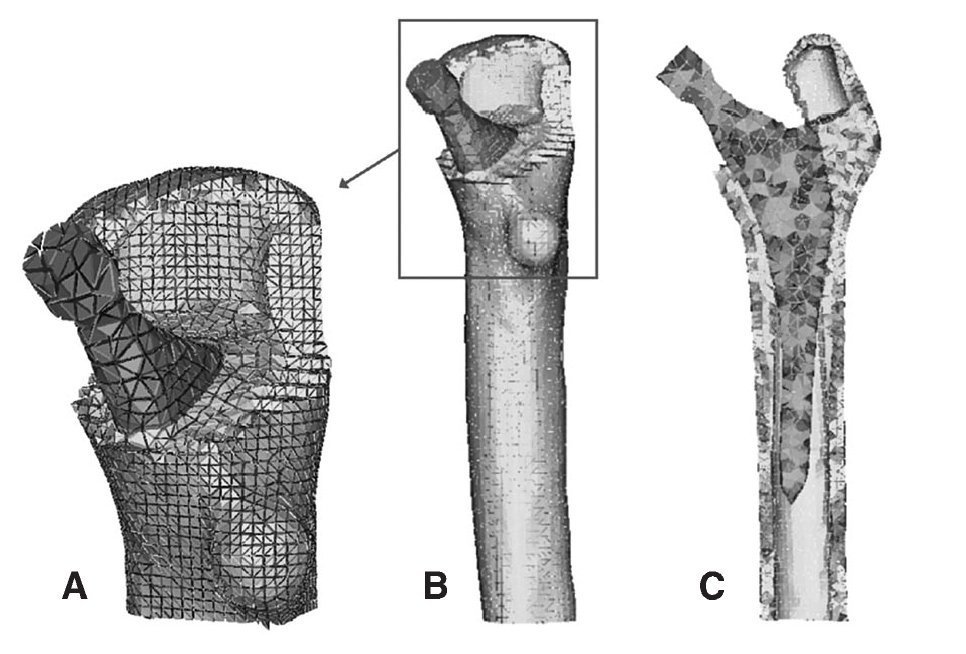
Figura 3.(A) Detalle de la malla en la zona proximal del modelo con prótesis ABG-; (B) modelo de elementos finitos del fémur con prótesis ABG-I; (C) corte longitudinal del modelo con prótesis ABG-I.
El primer modelo de fémur sano constaba de 408.518 elementos (230.355 pertenecían al hueso cortical, 166.220 al hueso esponjoso y 11.943 a la médula ósea), aunque después este número de elementos fue reducido, puesto que se obtenía suficiente precisión con menor coste computacional. De este modo, el modelo final con la prótesis ABGI estaba compuesto de 60.401 elementos (33.504 pertenecían al hueso cortical, 22.088 al hueso esponjoso y 4.809 conformaban la prótesis ABG I).
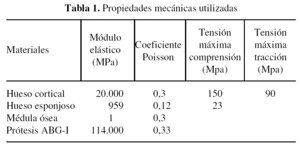
La prótesis ABG-I está fabricada en una aleación de titanio forjado del tipo Ti-6Al-4V. Este material está certificado por las Normas ASTM/ISO con el código F136/5832-3. La tabla 1 muestra un resumen de los valores de las propiedades mecánicas utilizadas en la prótesis, así como en los materiales biológicos en los que se ha simplificado, considerándolos isótropos. Dichos valores se han obtenido de la bibliografía especializada en el tema43-45. La prótesis posee una rigidez de tres órdenes de magnitud superior al hueso esponjoso. Esta gran diferencia posibilita, en el caso del modelo con prótesis, que se pueda asumir la prótesis como sólido rígido, puesto que al estar ambos en contacto toda la deformación será siempre absorbida por el hueso esponjoso, permaneciendo esta intacta durante dicha deformación. No se matematiza ni modeliza la unión entre prótesis y hueso, sino que se definen condiciones de contacto con rozamiento (aplicando un coeficiente de fricción 0,5).
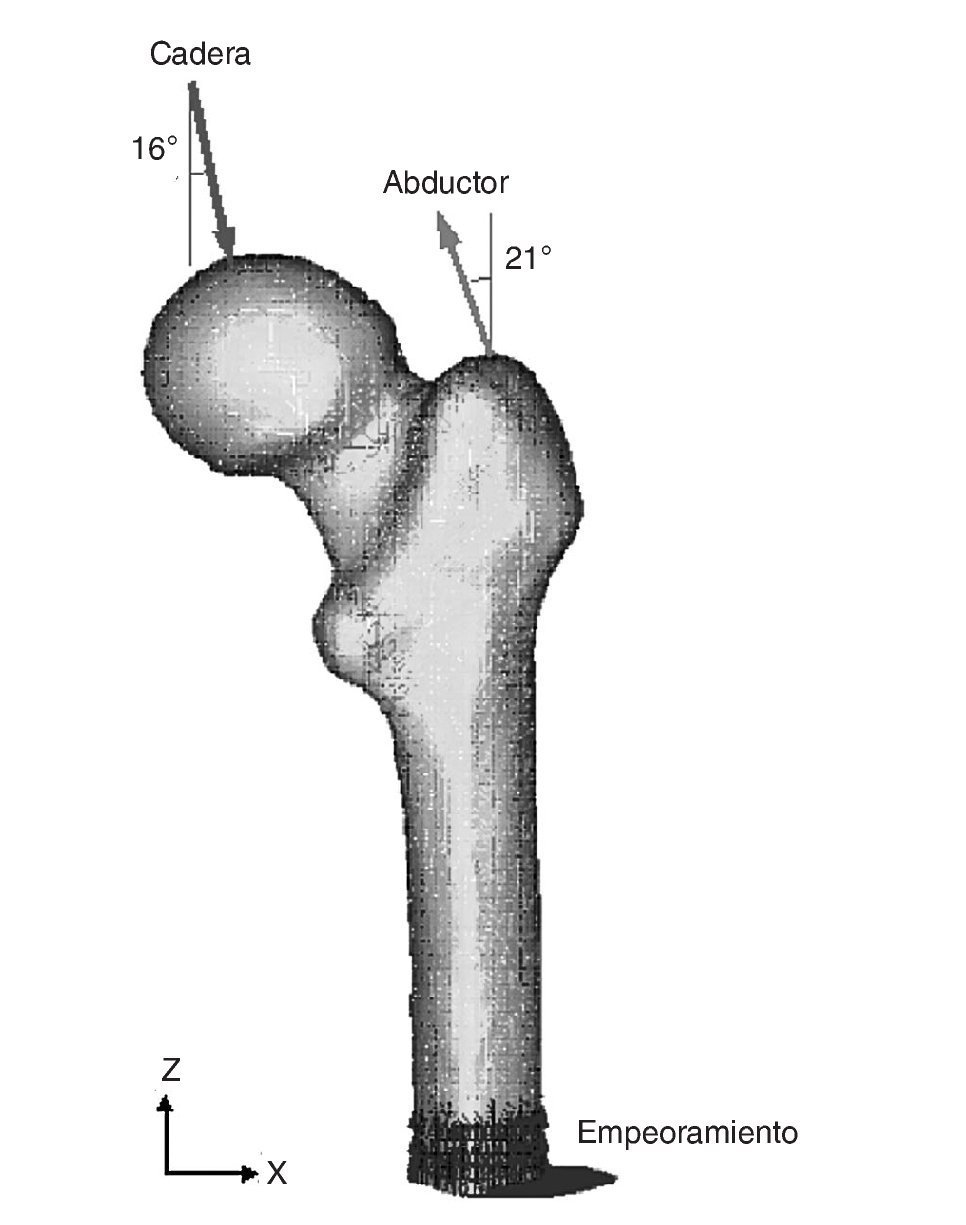
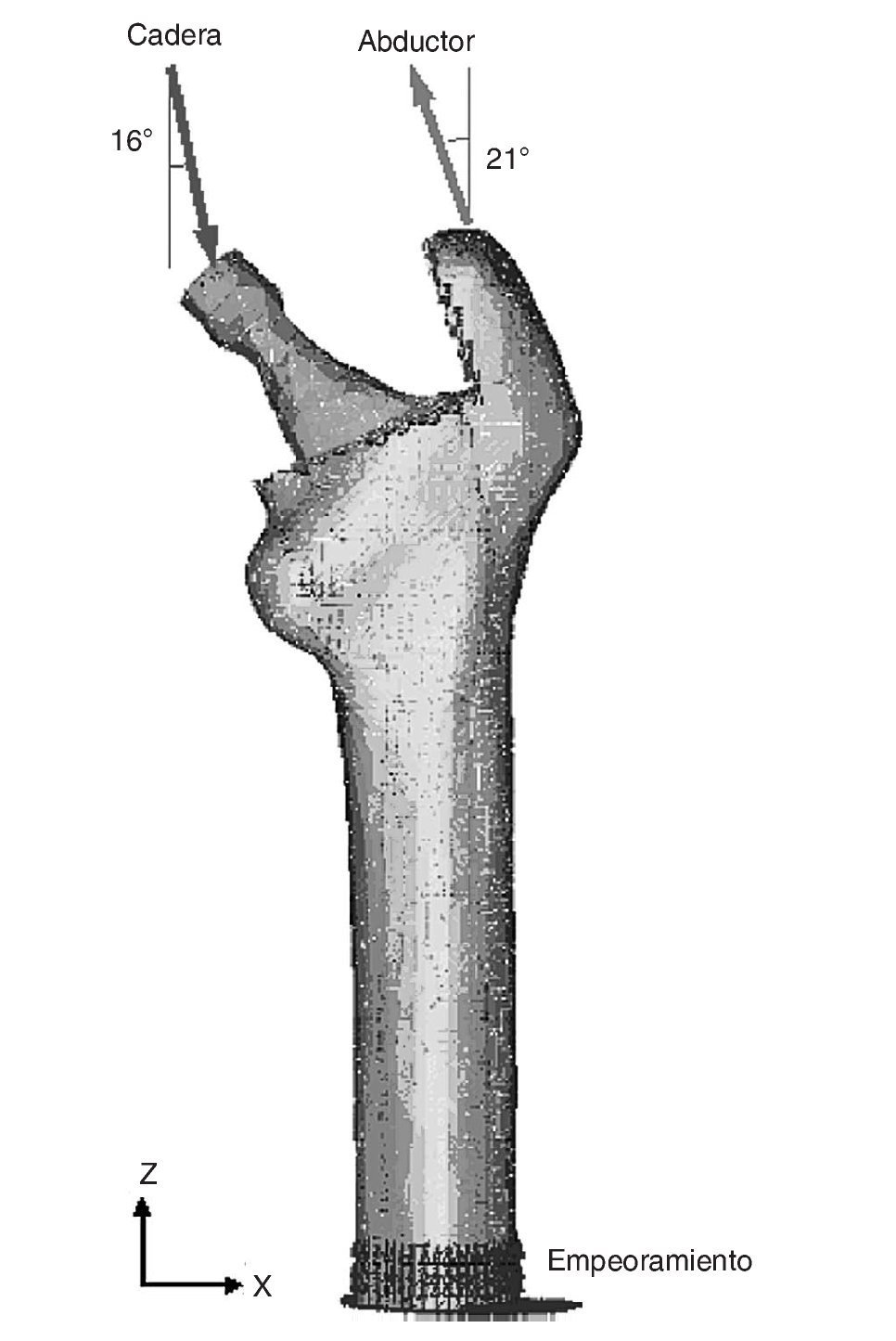
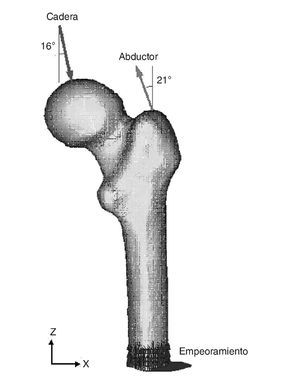
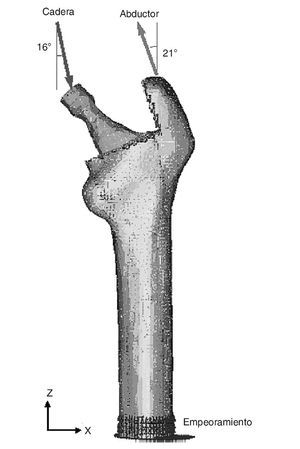
Existen numerosos estudios previos que incluyen un análisis comparativo para diferentes combinaciones de cargas musculares, concluyendo que lo más apropiado es considerar las cargas del glúteo medio, tracto iliotibial y el psoas ilíaco, o únicamente la acción de la musculatura abductora. En este estudio se ha considerado esta última opción por ser la más utilizada por la mayoría de los autores. En general, la fuerza muscular que se genera en los abductores es de dos veces el peso corporal, y esto produce una reacción en la cabeza femoral de 2,75 veces dicho peso. Sin embargo, en el instante en el cual el talón impacta con el suelo y en el doble apoyo esta carga aumenta hasta 4 veces el peso corporal46. Para imponer las condiciones de contorno se ha considerado este último caso, por ser el más desfavorable, y se ha tomado el caso promedio del estudio densitométrico de 79,3 kg de peso. Se imponen tres condiciones de contorno: bloqueo completo en la parte medial del fémur; fuerza en la cabeza del fémur debida a la reacción de la cadera por el peso de la persona, y fuerza en el trocánter mayor generada por los músculos abductores. La orientación de las fuerzas se puede observar en la figura 4 para el fémur cadavérico y en la figura 5 para el modelo con prótesis ABG-I. La zona medial ha sido empotrada, en lugar de empotrar la zona distal, por considerarla suficientemente alejada del hueso proximal, reduciendo así el coste computacional que supondría la utilización del fémur completo. Este modelo es comparable con aquellos cuyas condiciones de contorno consistan en un empotramiento a nivel distal, puesto que las cargas aplicadas coinciden prácticamente con la dirección del eje femoral y esto reduce las diferencias con los valores finales.
Figura 4.Modelo de elementos finitos del fémur sano con condiciones de contorno.
Figura 5.Modelo de elementos finitos con condiciones de contorno del fémur con la prótesis ABG-I.
Para poder realizar el análisis mediante elementos finitos se divide el hueso cortical de cada uno de los modelos en 7 grupos que coincidan con las denominadas "zonas de Gruen". Como ya se ha mencionado, todos los materiales se han considerado isótropos y elásticos lineales. Tomando como referencia diversos estudios publicados32,33,47 se ha establecido una relación entre los valores de masa ósea proporcionados por el estudio médico22 y la densidad aparente, y entre esta última y el módulo elástico, obteniendo así los valores del módulo de elasticidad del hueso cortical para cada una de las 7 zonas de Gruen. Estos valores se van ajustando sucesivamente para cada uno de los modelos en diferentes instantes temporales: post-operatorio (considerado a los 15 días de la intervención), 6 meses, 1, 3, 5, 7 y 10 años para la prótesis ABG-I, y a los 10 años en el caso del fémur sano. Ambos modelos poseen además los datos iniciales (en el momento del preoperatorio). De este modo se consiguen ajustar las propiedades mecánicas del hueso al paso del tiempo, tal como sucedería en la realidad.
RESULTADOS
Los 61 pacientes que completaron el estudio densitométrico mostraron una buena evolución clínica (su puntuación media según la escala de Merle D'Aubigne alcanzaba 16,90 puntos), con ausencia de complicaciones significativas a lo largo del seguimiento. Radiológicamente todos los vástagos fueron considerados con fijación estable, con ausencia de hipertrofia cortical significativa, líneas reactivas o radiolucencias; no obstante, se apreció condensación del hueso esponjoso en las zonas 2, 3, 5 y 6 en más del 80% de los pacientes, y resorción ósea en la zona 1 en el 32% de ellos y en la zona 7 en el 68%.
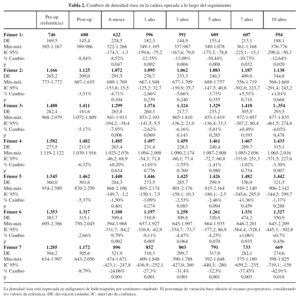
La evolución de la densidad ósea en los fémures operados y sanos se muestra en las tablas 2 y 3 respectivamente. Las determinaciones preoperatorias realizadas en ambas caderas mostraron cifras ligeramente más altas en los fémures sanos, desde 0,1% en zona 6 a 4,3% en zona 2, aunque estas diferencias no fueron estadísticamente significativas y se atribuyeron a una discreta atrofia ósea secundaria a menor carga de la extremidad por el dolor y pérdida de movilidad de la cadera.
Las cifras obtenidas en el postoperatorio se tomaron como referencia para los fémures intervenidos. Se detectaron diferencias del 2,66 al 10,01% respecto a las determinaciones previas a la cirugía, y se atribuyeron estos cambios a la pérdida ósea que tiene lugar con el raspado y fresado durante la protetización. A los 6 meses de la intervención se detectó un descenso de densidad ósea en todas las áreas excepto en la zona 4, lo cual se atribuyó al reposo relativo, a la carga parcial y al efecto tardío sobre el hueso de la preparación quirúrgica.
Los cambios de densidad ósea en el segundo semestre reflejan la respuesta del hueso a la nueva situación biomecánica que supone la protetización. Se observó una discreta pérdida ósea adicional en las zonas 1 y 7, así como una leve recuperación en las zonas medias y distales en torno al implante. Estos cambios sugieren que hay una transmisión efectiva de cargas desde el vástago a las zonas 2 y 6, capaz de promover la conservación e incluso una cierta recuperación de densidad ósea desde esas áreas a otras más distales. Del mismo modo, las cargas que se transmiten a las zonas 1 y 7 parecen no ser suficientes para favorecer la conservación ósea en esas zonas.
No se observaron cambios significativos de densidad ósea en las zonas 1 a 6 desde el final del primer año hasta el final del décimo año. La masa ósea permanece estable en ese período, con recuperaciones mínimas en las zonas 2 y 6. Sin embargo, se detectó un descenso en la zona 7 en el período entre el quinto y décimo año, momento en el que se alcanza una pérdida de hasta el 42,9%. Para determinar las causas de esta pérdida tardía se revisaron las radiografías correspondientes a este período, apreciándose que todos los vástagos mostraban signos de estabilidad radiológica, pero existía resorción ósea, visible con radiología simple, en dos tercios de ellos.
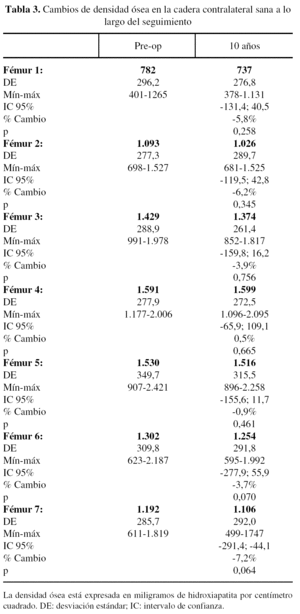
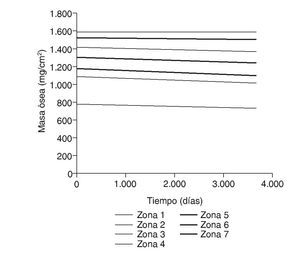
La densidad ósea en la cadera contralateral, sana, mostró ligeras diferencias durante el seguimiento, con descensos variables del 0,9 al 7,2%, más evidentes en la parte proximal del fémur, rica en hueso esponjoso. Los valores obtenidos para las zonas 2 a 6 fueron semejantes a los fémures operados; sólo las zonas 1 y 7 mostraron diferencias significativas, como ocurre con las variaciones de tensión (figs. 6 y 7). Se ha utilizado la tensión de von Mises por ser una magnitud relevante y estándar en el software de elementos finitos.
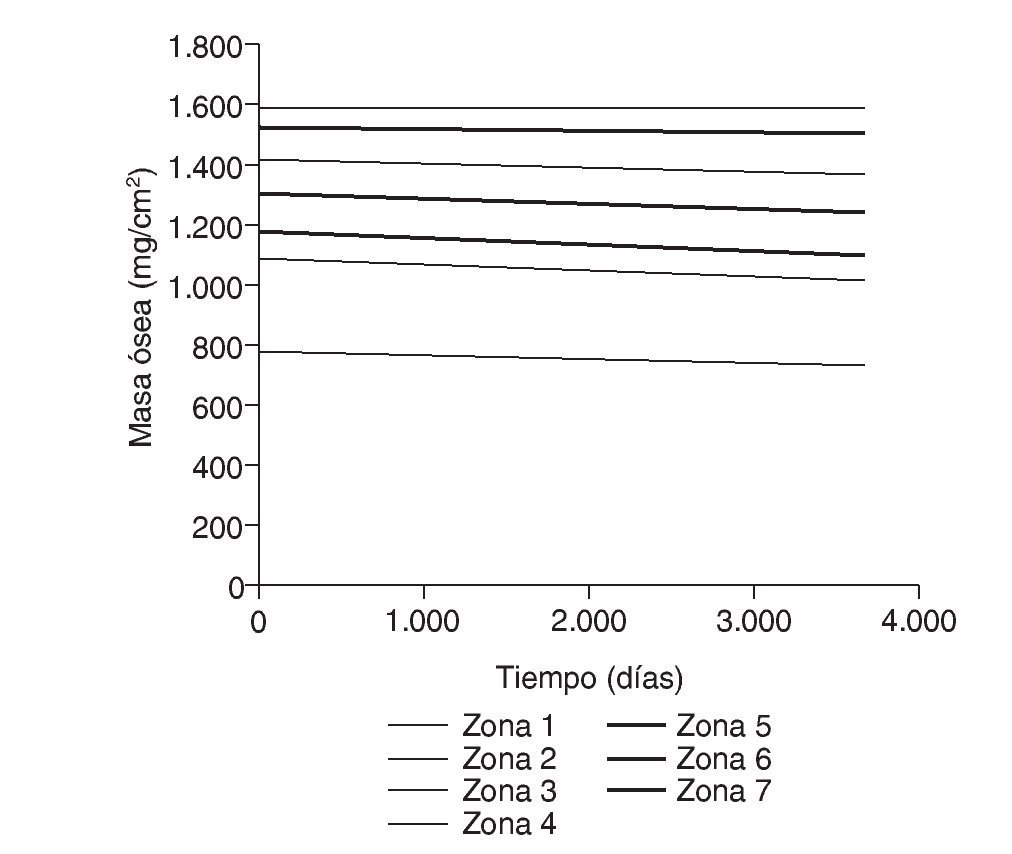
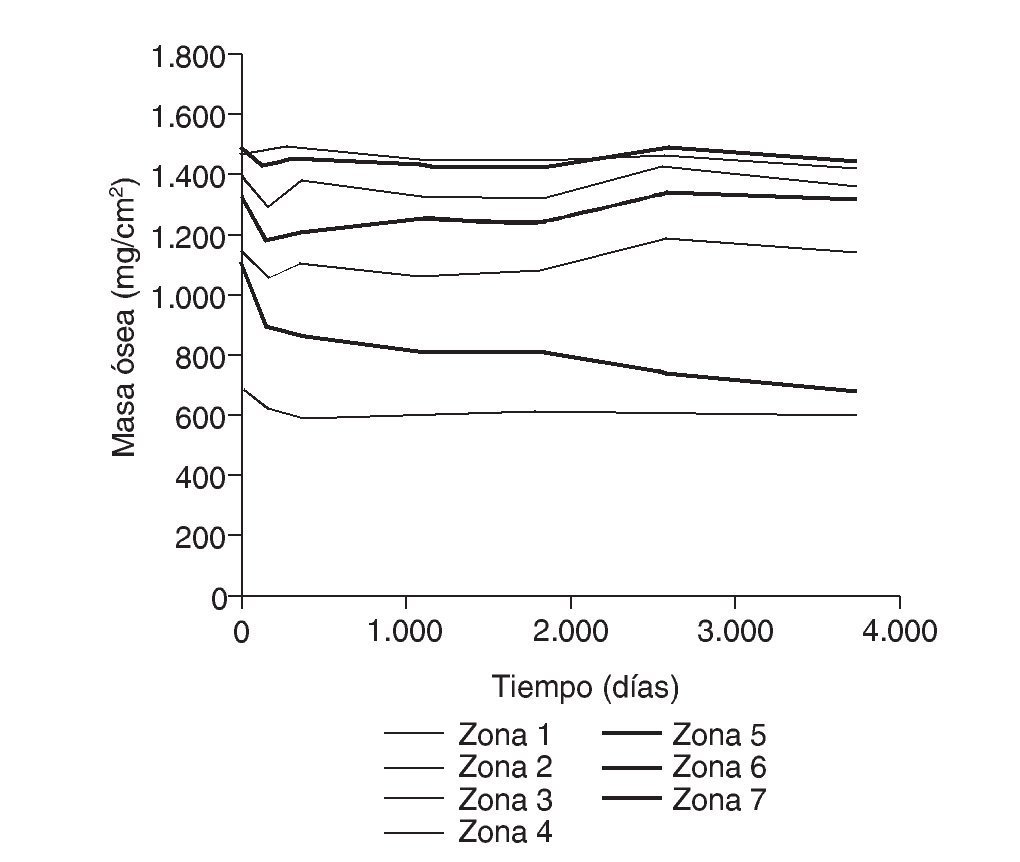
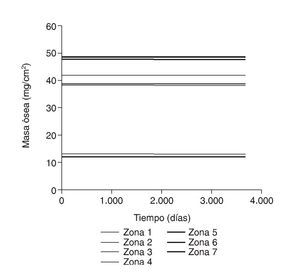
Figura 6.Masa ósea frente a tiempo para el fémur sano.
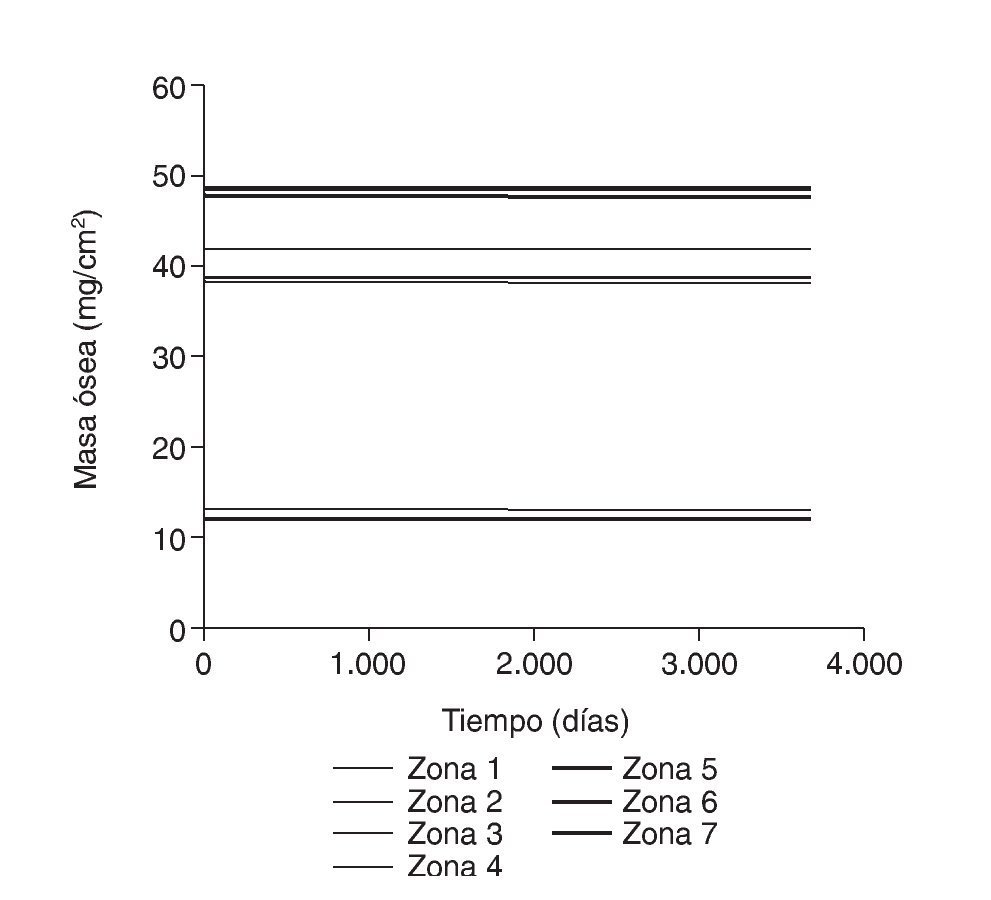
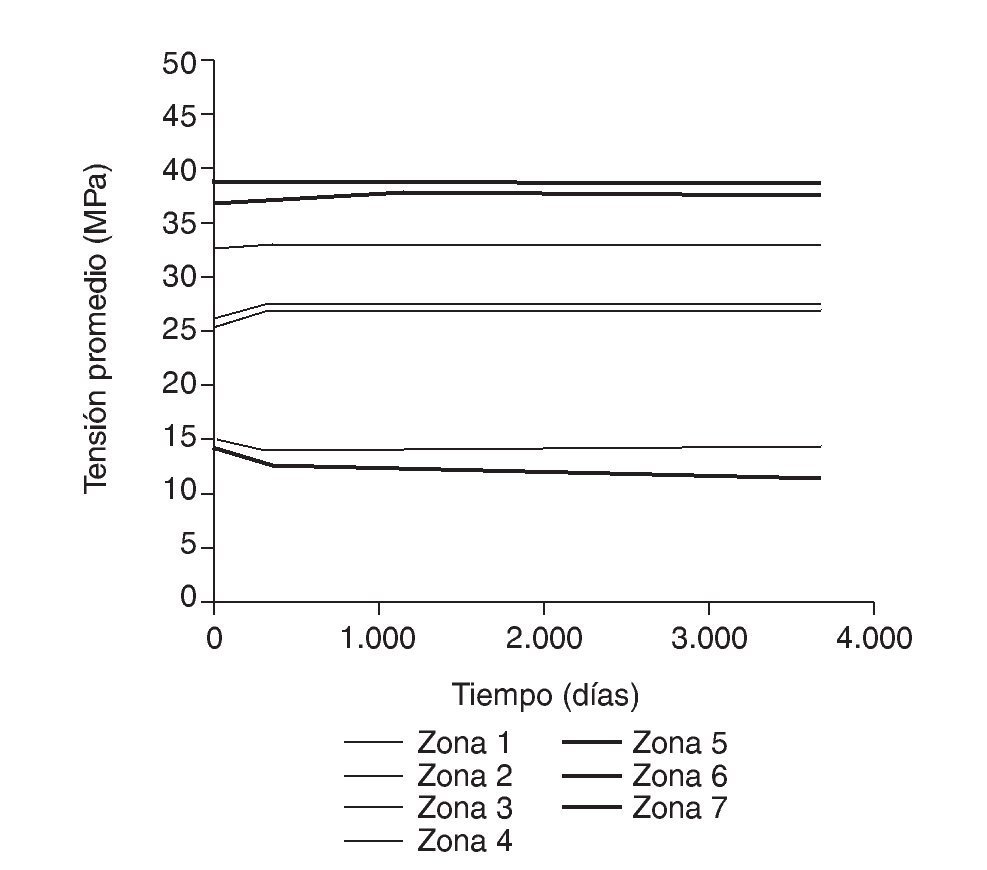
Figura 7.Tensión promedio de von Mises frente a tiempo para el fémur sano.
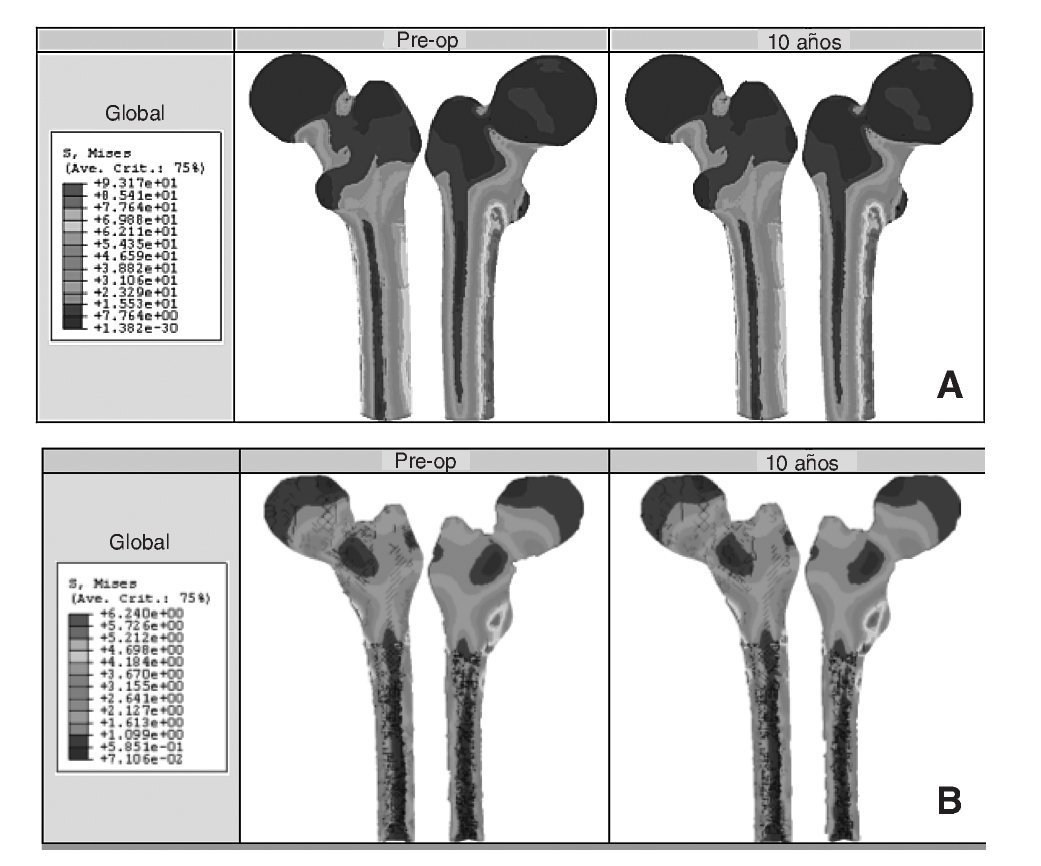
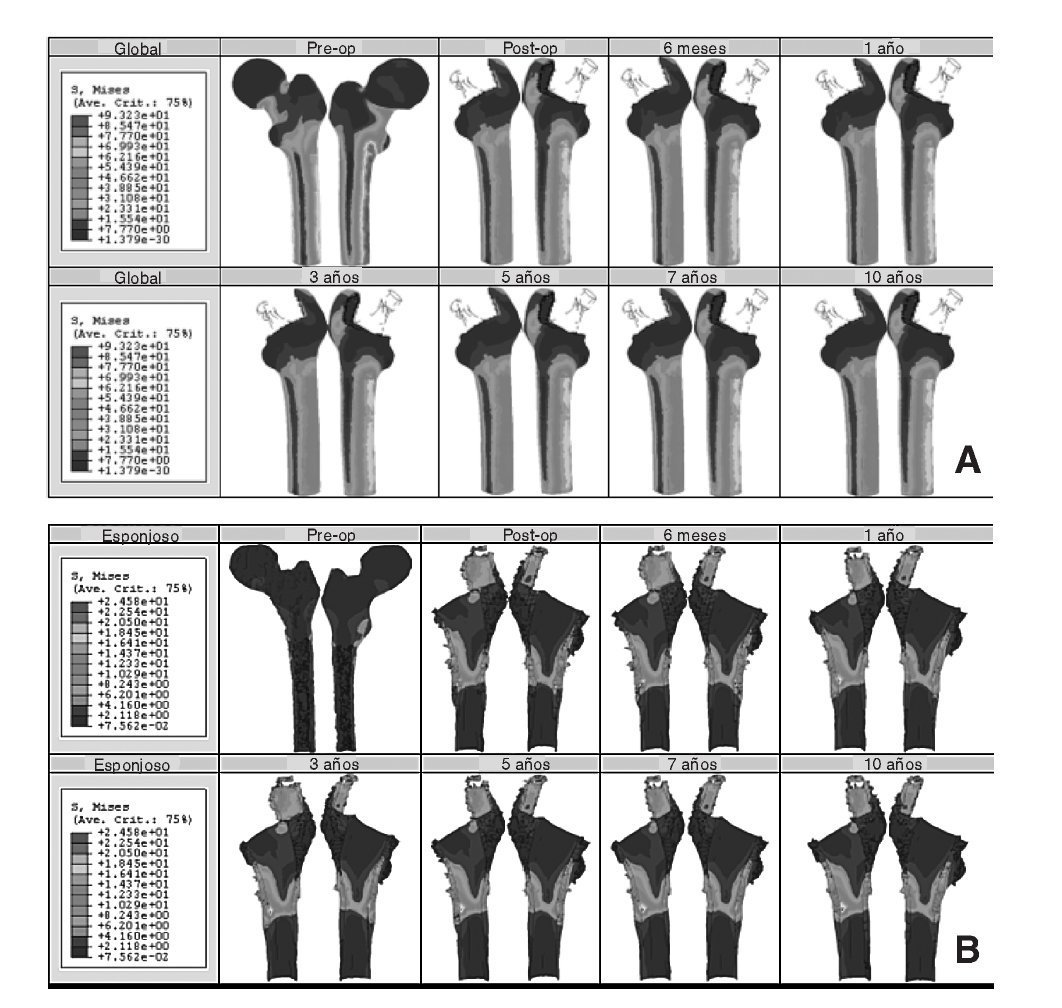
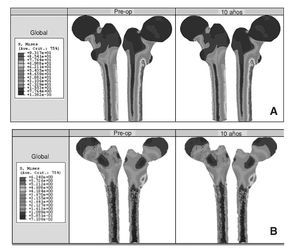
Los resultados obtenidos en cada uno de los modelos a partir de la simulación mediante elementos finitos se contrastan y se intentan correlacionar con el estudio clínico de los pacientes22. En el caso de la cadera sana se tienen datos para dos instantes temporales, un primer instante inicial, al comienzo del estudio, y un segundo transcurridos 10 años. La figura 8 (A y B) muestra la distribución de tensiones de von Mises en el modelo para los dos instantes. Se ha utilizado la misma escala en todos los casos para facilitar la comparación. Se puede apreciar cómo la cara interna del fémur es la más solicitada debido a la excentricidad de la carga.
Figura 8.(A) Tensión de von Mises en el fémur sano; (B) detalle de las tensiones de von Mises en un corte longitudinal del hueso esponjoso.
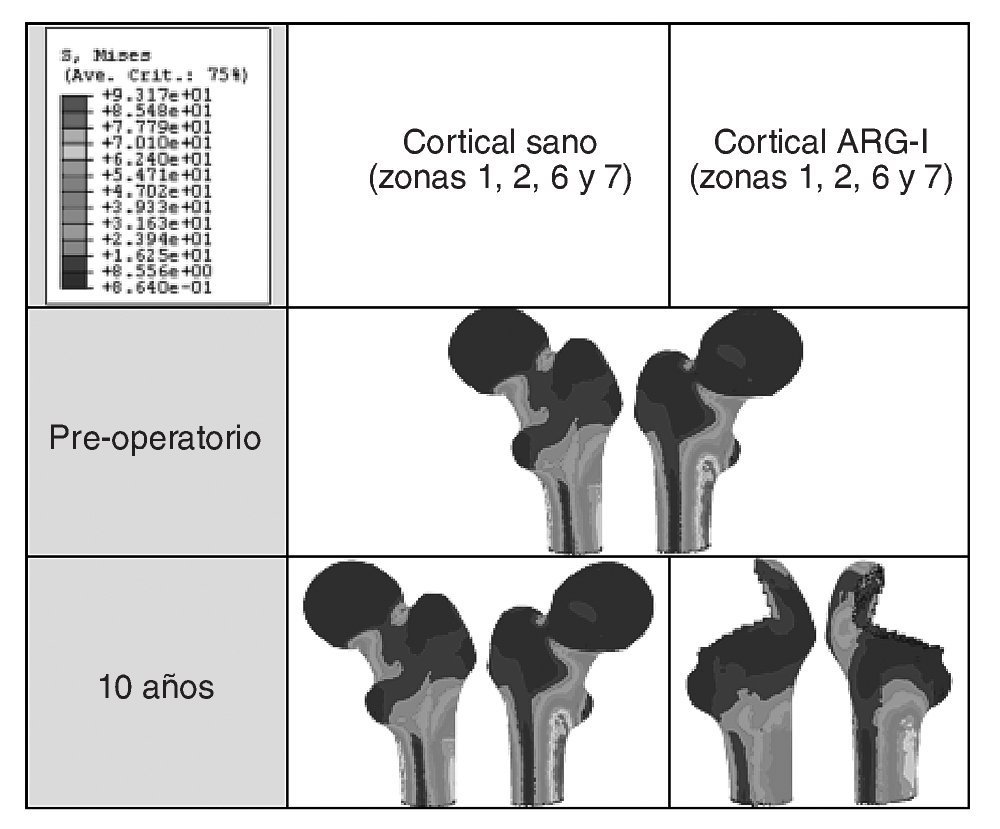
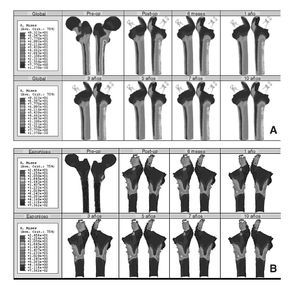
El modelo de cadera implantada se ha estudiado clínicamente para 8 momentos temporales diferentes: un primer instante inicial o preoperatorio, en el post-operatorio (a los 15 días del implante), a los 6 meses y al cabo de 1, 3, 5, 7 y 10 años. En la figura 9 (A y B) se muestra la evolución de la tensión de von Mises para los diferentes instantes temporales. En el hueso esponjoso (fig. 9B), en la zona donde termina la HA de la prótesis, se aprecia un incremento con el tiempo de la intensidad de la carga, lo que indica su transmisión por efecto embudo en lugar de por rozamiento. Partiendo de los mismos valores de masa ósea se analiza el hueso cortical de la zona proximal en ambos modelos. Si se representa la tensión de von Mises en las zonas de Gruen 1, 2, 6 y 7 en el instante del preoperatorio y a los 10 años (fig. 10) se puede apreciar un decremento de la tensión en el fémur operado respecto del sano, resultado de la descarga proximal.
Figura 9.(A) Tensión de von Mises en el modelo con prótesis ABG-I; (B) detalle de la tensión de von Mises en un corte longitudinal del hueso esponjoso.
Figura 10.Tensión de von Mises en el hueso cortical (zonas 1, 2, 6 y 7) del fémur sano y con prótesis ABG-I.
DISCUSIÓN
El remodelado adaptativo tras la prótesis total de cadera tiene un origen multifactorial2,9,12. Para cuantificar de forma precisa los cambios de densidad ósea que ocurren en el fémur por este proceso es imprescindible el estudio con DEXA seriado y a largo plazo48. La simulación mediante EF permite explicar los cambios biomecánicos que ocurren en el fémur tras la implantación de la prótesis. Se trata de un estudio pionero para comprobar si se pueden correlacionar los hallazgos obtenidos mediante DEXA y con simula-ción mediante elementos finitos a la hora de analizar la evolución a largo plazo de la densidad ósea.
Los estudios con DEXA realizados a los 3 y 6 meses de la intervención muestran descensos de masa ósea que pueden oscilar del 20 al 50%, según el implante utilizado y la metodología del estudio. Estas pérdidas están causadas por varios factores, citándose el reposo y la menor actividad como los más influyentes, a los cuales hay que añadir el efecto de la intervención. En primer lugar la preparación femoral con fresas y raspas causa un inmediato descenso del capital óseo18,35, que en nuestro estudio varió del 2 al 10%, y que no es atribuible al remodelado, por lo que se tomó la deter-minación postoperatoria como referencia para comparar la evolución de la densidad ósea. No obstante, el efecto de la técnica quirúrgica va más allá del postoperatorio inmediato. Las raspas femorales y el ajuste a presión del vástago causan microfracturas adicionales en el hueso esponjoso alrededor del implante, y este tejido óseo posteriormente sufrirá necrosis y resorción, causando descensos adicionales de densidad ósea que se detectarían al final del sexto mes. Pero la cuantía de estos cambios no es homogénea; en zonas medias y distales la lesión de la circulación endostal por las raspas y fresas puede producir necrosis parcial de la porción interna del hueso cortical, y éste tardará varias semanas en recuperarse49,50. Pero en el calcar hay que añadir la devascularización y denervación que supone la exposición del cuello para la ubicación de la osteotomía. A la suma de estos dos efectos le sigue el hecho de que esta zona no recibe una adecuada transmisión de cargas, justificando todo ello un descenso de la densidad ósea de hasta el 32% al final del primer año.
En el caso de la simulación mediante EF, si se observa la figura 11, y tomando siempre como referencia la determinación posoperatoria, se puede apreciar que en las zonas media y distal, hasta los 6 meses, la tensión permanece prácticamente constante o aumenta ligeramente, lo cual facilita el incremento de densidad en estas zonas en fases posteriores. Sin embargo, en el mismo periodo temporal, en la zona proximal del fémur, la tensión sufre un decremento que puede llegar a alcanzar valores del 3 al 11%, es decir, se corrobora el sospechado puenteo de fuerzas, lo que acarrea la pérdida de masa ósea, como se aprecia en la figura 12. Estos resultados no son cotejables con los previos de simulación, dado que hasta la fecha no se han realizado estudios a tan largo plazo.
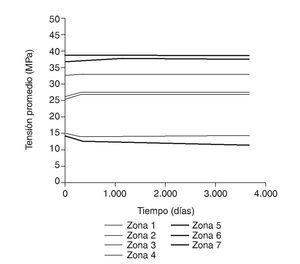
Figura 11.Tensión promedio de von Mises frente a tiempo para el fémur con prótesis ABG-I.
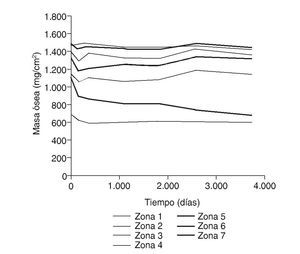
Figura 12.Masa ósea frente a tiempo para el fémur con prótesis ABG-I.
En general, se acepta que la mayoría del remodelado adaptativo está establecido al final del primer año, alcanzándose un equilibrio en la densidad ósea en todas las áreas a partir de ese momento2,5,51-53. Los resultados de este estudio sugieren que esta estabilidad se alcanza entre el sexto y el duodécimo mes, cuando los cambios en la densidad ósea reflejan la respuesta biomecánica del hueso siguiendo la Ley de Wolf. Tras este período la densidad ósea no muestra cambios significativos durante un período de 10 años. Únicamente la zona 7 muestra descensos tardíos adicionales que consideramos atribuibles a la atrofia proximal por stress-shielding. Este descenso de densidad ósea en una zona con reducida transmisión de cargas no parece tener consecuencias mecánicas ni biológicas en las demás áreas óseas; sin embargo, una mayor atrofia proximal puede afectar a la estabilidad del implante y tornar el fémur más vulnerable a fracturas. Se observan pérdidas tardías de masa ósea, atribuibles a lesiones quísticas osteolíticas en el calcar en un tercio de los pacientes, pero sin repercusión clínica en este momento del seguimiento.
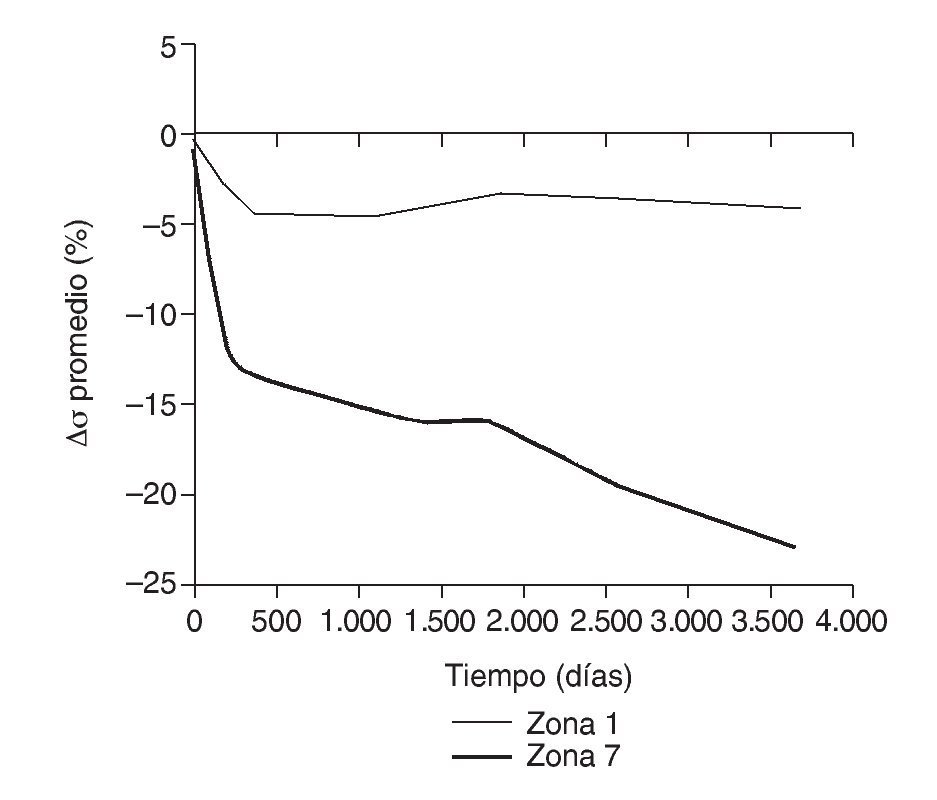
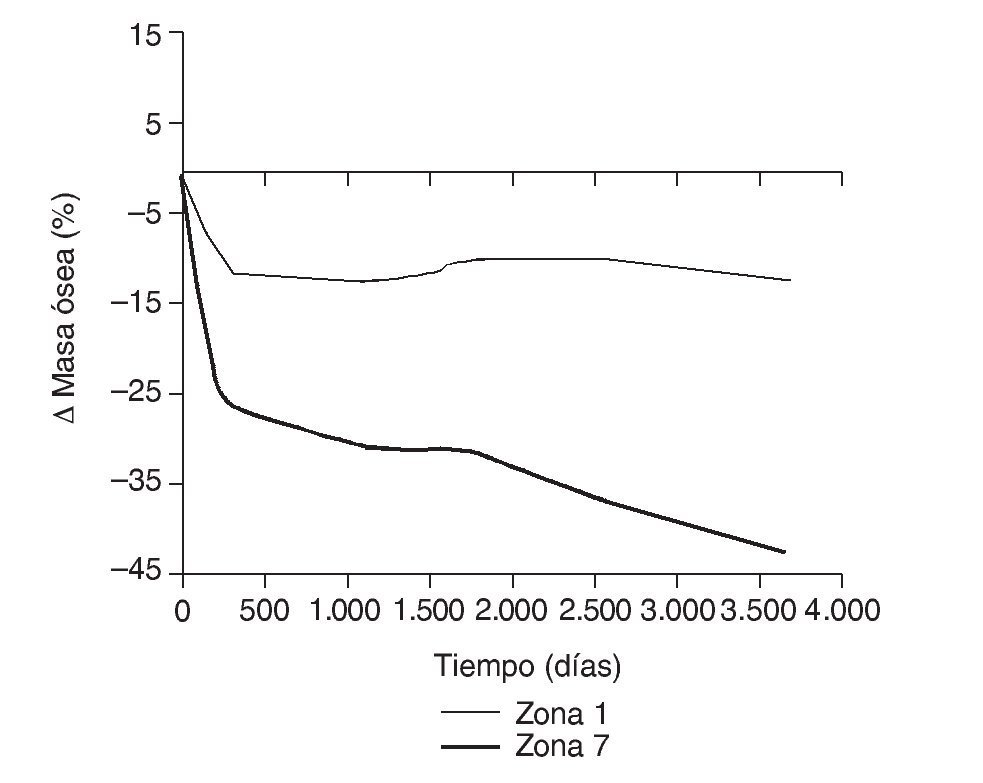
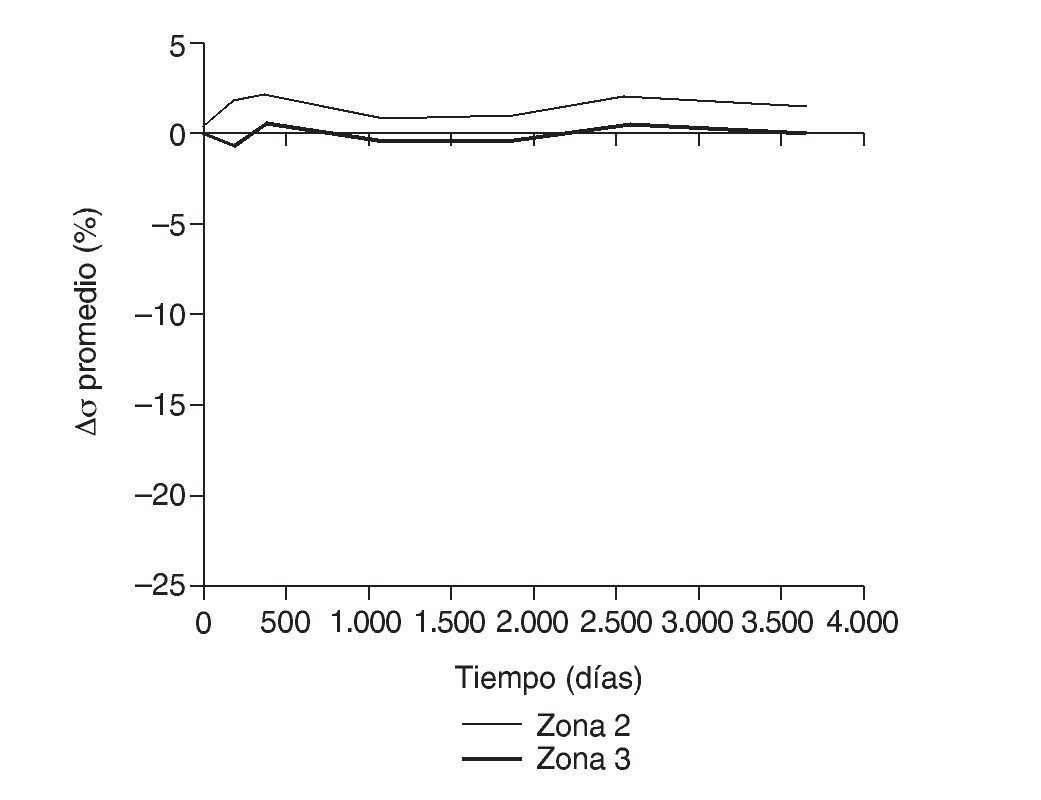
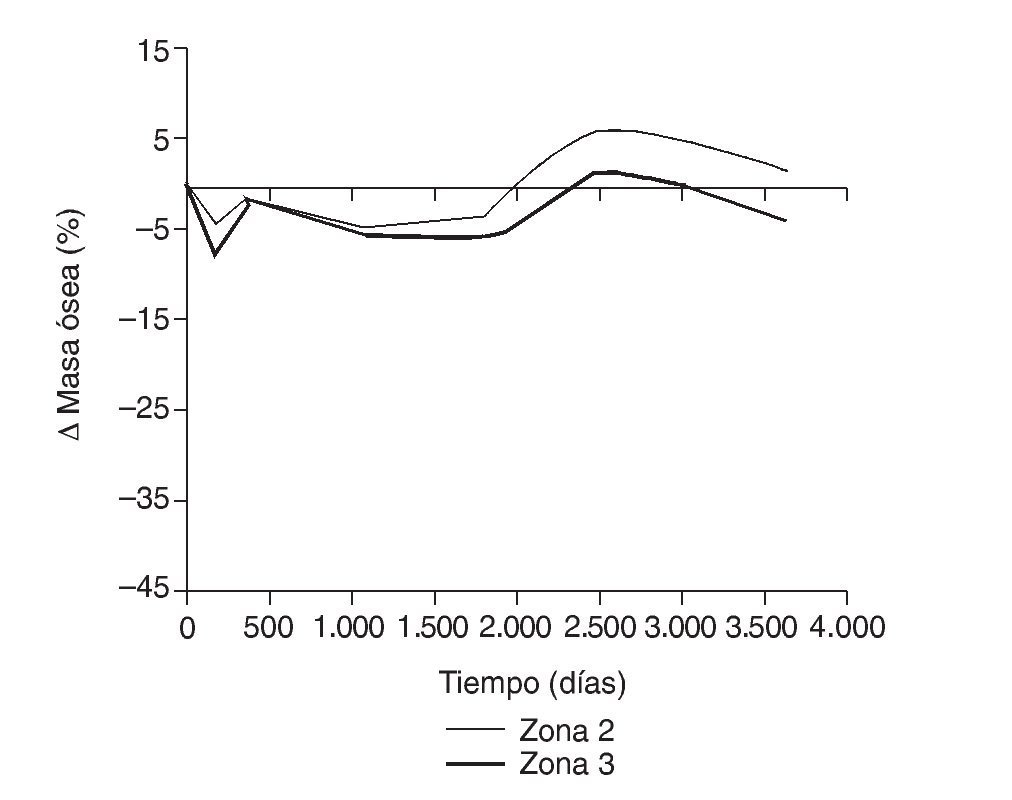
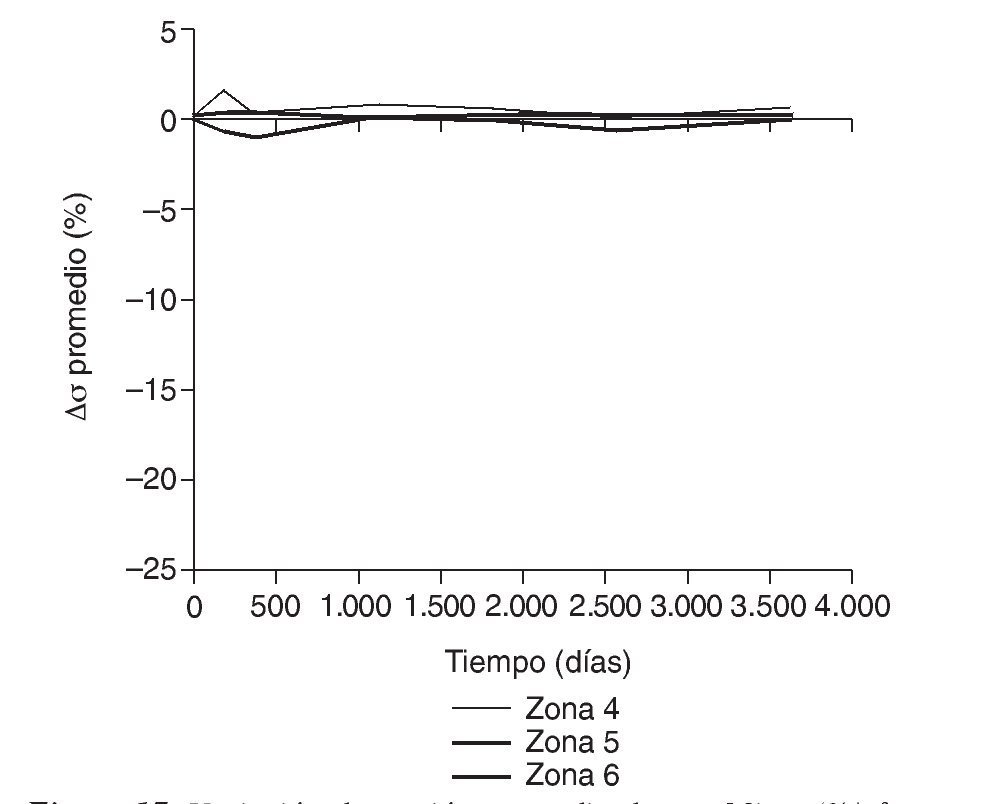
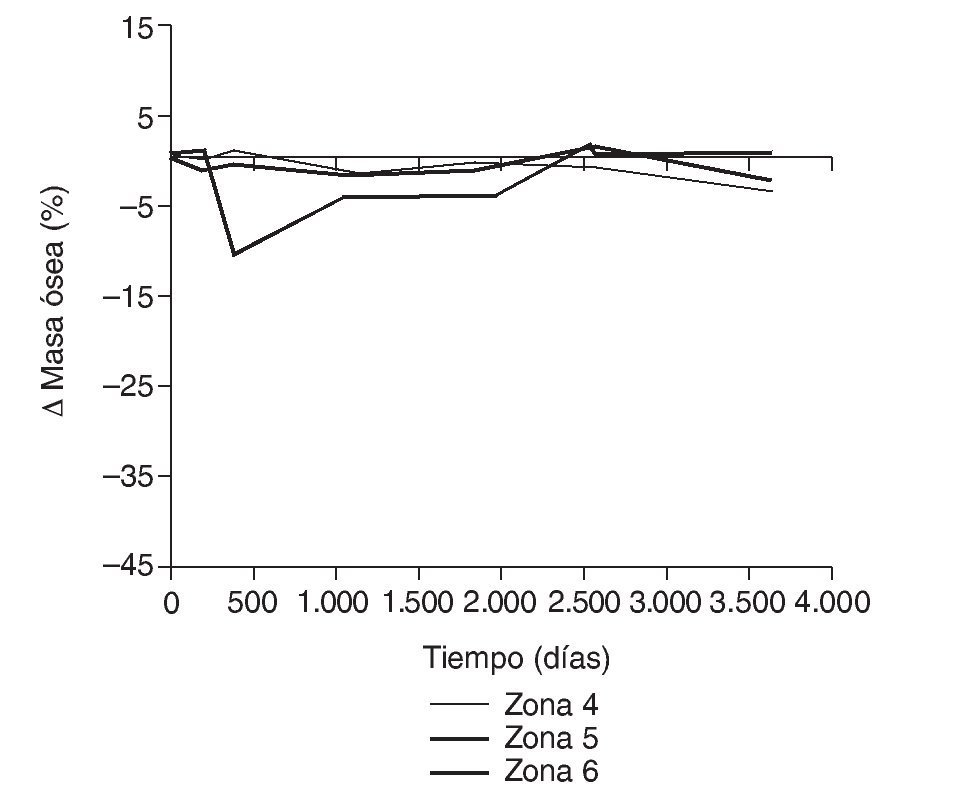
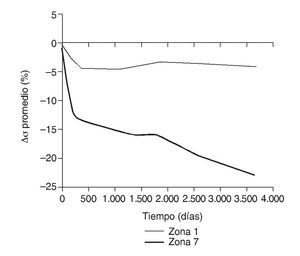
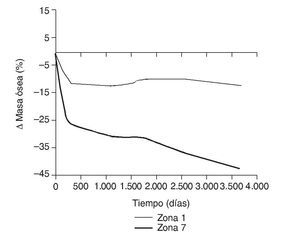
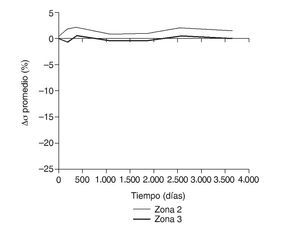
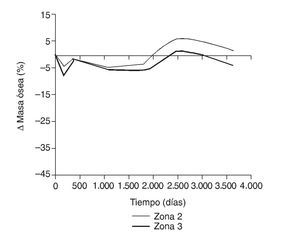
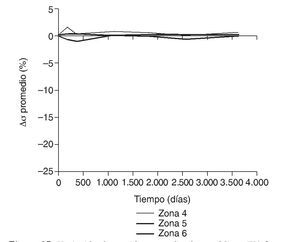
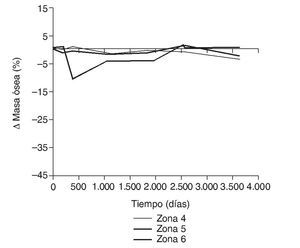
En la simulación por EF, de acuerdo con lo que puede observarse en la figura 11, la variación de tensión termina prácticamente al final del primer año, manteniéndose después niveles de tensión prácticamente constantes en todas las zonas; por tanto, su densidad no muestra cambios significativos. La excepción se sitúa en la zona 7, en la cual se produce una descarga adicional a largo plazo, por lo que su densidad continúa disminuyendo. En las figuras 13 a 18 se detalla la evolución de masa ósea y de nivel tensional en cada zona a lo largo del tiempo: para ello se ha representado el incremento/decremento de masa y de tensión (en porcentaje) tomando como base la determinación posoperatoria, punto de partida en que se considera que comienza la remodelación adaptativa. De este modo se observa que en las zonas 2 a 6, zonas medias y distales, las variaciones de tensión son mucho menores que en las zonas proximales, con pérdidas de tensión de en torno al 1-2%, frente a los valores del 3 al 5% de la zona 1 y las pérdidas del 11 al 23% que se alcanzan en la zona 7.
Figura 13.Variación de tensión promedio de von Mises (%) frente a tiempo para el fémur con prótesis ABG-I en las zonas de Gruen 1 y 7.
Figura 14.Variación de masa ósea (%) frente a tiempo para el fémur con prótesis ABG-I en las zonas de Gruen 1 y 7.
Figura 15.Variación de tensión promedio de von Mises (%) frente a tiempo para el fémur con prótesis ABG-I en las zonas de Gruen 2 y 3.
Figura 16.Variación de masa ósea (%) frente a tiempo para el fémur con prótesis ABG-I en las zonas de Gruen 2 y 3.
Figura 17.Variación de tensión promedio de von Mises (%) frente a tiempo para el fémur con prótesis ABG-I en las zonas de Gruen 4, 5 y 6.
Figura 18.Variación de masa ósea (%) frente a tiempo para el fémur con prótesis ABG-I en las zonas de Gruen 4, 5 y 6.
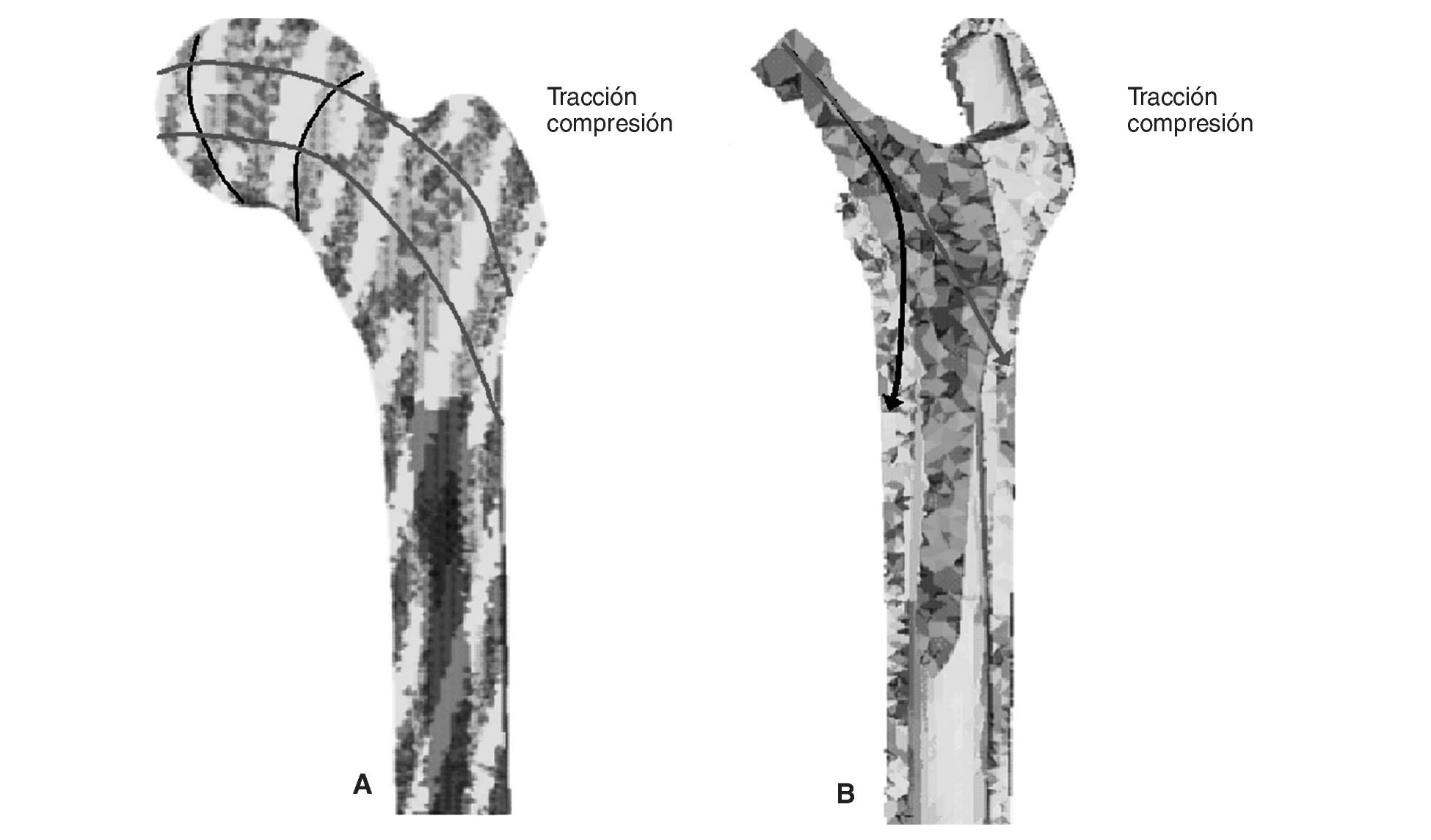
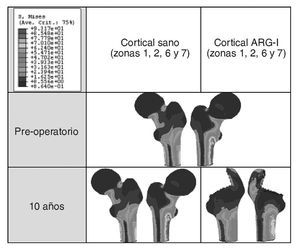
Cuando se diseñó esta prótesis anatómica de apoyo meta-fisario se pensó que el encaje a presión en la zona metafisaria sería capaz de convertir las cargas recibidas desde la cabeza femoral en fuerzas de compresión a nivel metafisario, y desde allí transmitirlas a zonas distales evitando el fenómeno de stress-shielding. Los cambios de densidad ósea atribuibles a la atrofia proximal por puenteo de fuerzas se aprecian ya al final del primer año, tanto en el estudio con DEXA como en la simulación con EF. En el fémur sano las cargas se transmiten desde la cabeza femoral al trocánter menor, el cual distribuye las fuerzas compresivas a la diáfisis femoral34. Tras la protetización este modelo de cargas se invierte, produciéndose un efecto embudo, como se demuestra en la simulación con EF (fig. 9B): la mayoría de las fuerzas de compresión se distribuyen desde el vástago a las zonas diafisarias, dejando el fémur proximal sin carga, lo que producirá resorción ósea. En la figura 19 se ha representado el flujo tensional que se genera a partir de la carga en la cabeza femoral en un fémur sano frente a uno protetizado: estas figuras se han obtenido a partir de la representación del flujo de tensiones principales en cada uno de los modelos mediante el software de cálculo Abaqus. De este modo se pueden identificar perfectamente en el fémur sano los haces trabeculares primarios, el arciforme de Gallois y Bosquet, formado por fuerzas de tracción, y el fascículo cefálico o abanico de sustentación de Delbet, formado por fuerzas de compresión36. A diferencia de esto que ocurre en el fémur sano, en el protetizado se comprueba que las tensiones fundamentalmente se transmiten desde la cabeza protésica a su vástago, lo cual genera la descarga proximal, y el fémur recibe la transmisión de cargas principal-mente en las zonas que corresponden al final de la HA, lo que produce el efecto de embudo. Estos cambios en la biomecánica de la cadera explican que con vástagos no cementados de primera generación las pérdidas de densidad ósea en zonas proximales alcancen el 45%2,4,54, que con los de segunda generación aún sean del 20 al 25% al final del primer o segundo año55,56, y que con vástagos de diseño en cuña se aprecien descensos del 10 al 30%5,20. Con vástagos a medida se obtienen descensos en zonas proximales del 10 al 15% al final del primer año53,57 y con vástagos femorales de rigidez reducida se han visto descensos del 15% en el cálcar femoral al final del segundo año6,55,58.
Figura 19.Flujos tensionales en el modelo sano (A) y en el modelo con prótesis ABG-I (B).
En el diseño teórico también se consideró que la adición de un recubrimiento de HA a nivel metafisario optimizaría su integración a ese nivel, como ha sido comprobado en autopsias de pacientes operados15. Sin embargo, de acuerdo con los resultados de este estudio, se ha comprobado que la mejora en la osteointegración contribuye únicamente a la estabilidad del vástago, pero no influye en los fenómenos de remodelado óseo. El patrón de remodelado mostrado por este vástago anatómico no cementado es similar al de los vástagos cementados de segunda generación, en los que mediante estudios densitométricos se han apreciado descensos de densidad ósea del 20 al 25% para áreas proximales, del 5 al 15% para áreas intermedias y ausencia de cambios apreciables en zonas distales5,55,56,59. Estos estudios también han descrito cómo los cambios permanecían estables a partir del primer o segundo año tras la intervención.
A largo plazo el remodelado puede verse afectado por cambios en la densidad ósea relacionados con la edad, por osteólisis secundaria a las partículas de desgaste del polietileno y por la atrofia ósea proximal por puenteo de fuerzas.
Varios estudios muestran cómo el envejecimiento afecta tanto al hueso cortical como al endostal2,8,54,60. Sin embargo, en los pacientes incluidos en este estudio la pérdida ósea detectada en la cadera sana (variable del 0,9 al 7,2%) se localizó preferentemente en zonas de hueso esponjoso, detectándose una variación mínima en el hueso cortical. Estos datos coinciden con las diferencias en la densidad ósea femoral observada para la población de nuestro país en los grupos etarios de 50 a 59 y 60 a 69 años61. Estas diferencias, además, fueron significativas sólo en áreas proximales y atribuibles al efecto de la protetización. Todos estos hallazgos sugieren que en pacientes con edad de 60 años en el momento de la intervención cabe esperar pocos cambios en la densidad ósea en los 10 años siguientes, siempre que mantengan una actividad física normal. El implante analizado parece proporcionar un modelo de transmisión de cargas capaz de preservar la densidad ósea en zonas medias y distales de un modo similar al fémur sano.
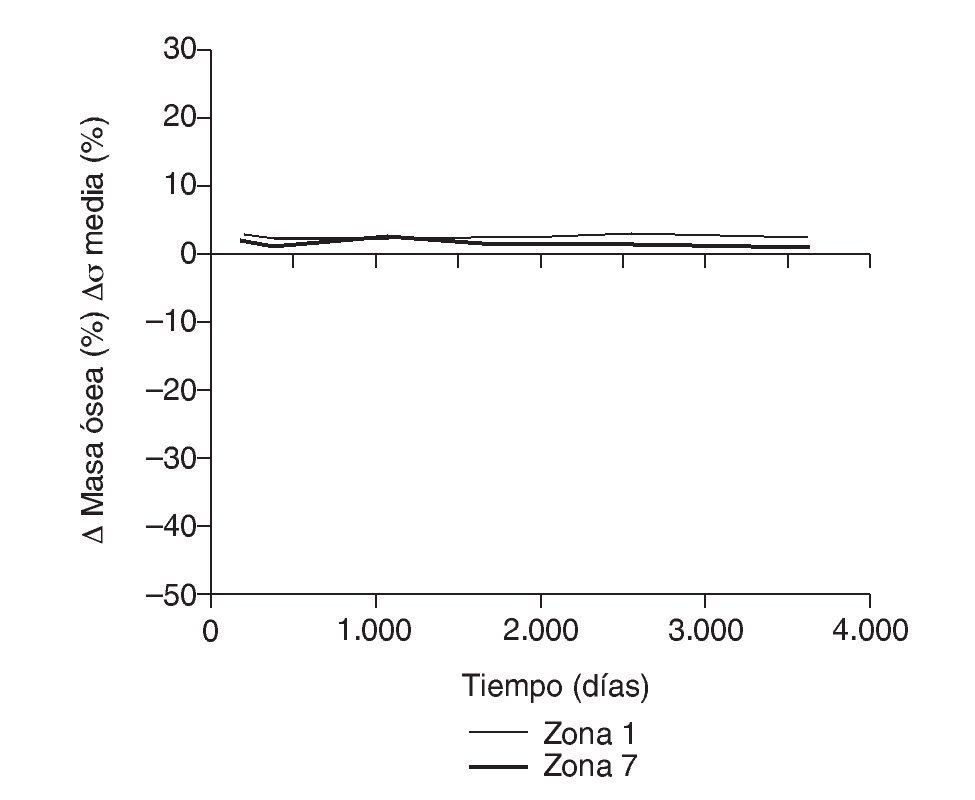
Los datos descritos de densidad ósea concuerdan con los resultados de la simulación, donde aparece una marcada irregularidad a largo plazo, con variaciones tensionales tanto crecientes como decrecientes, con un comportamiento bastante irregular (figs. 15-18), equiparable a lo que sucede con la densidad. Los niveles de tensión más bajos se producen en las zonas proximales, a continuación en las zonas 2 y 3, debido a la descarga proximal y a su ubicación en la cara externa, y los niveles más altos en las zonas 5 y 6, en las cuales coinciden tanto el efecto embudo como su ubicación en la cara medial del fémur (fig. 11). Finalmente, la correlación entre la evolución de la densidad ósea y la evolución de las tensiones es casi perfecta en las zonas 1 y 7, de modo que si se establece la ratio entre los incrementos de densidad ósea (%) y los incrementos de tensión (%) se obtienen líneas prácticamente horizontales (fig. 20).
Figura 20.Correlación entre incremento de masa ósea y tensión media de von Mises frente a tiempo para el fémur con prótesis ABG-I en las zonas de Gruen 1 y 7.
A modo de conclusión podemos destacar que el objetivo inicial al diseñar un vástago de apoyo metafisario era conseguir una transmisión de fuerzas de proximal a distal capaz de evitar el stress-shielding, hecho que no se ha cumplido; el esquema de remodelado mostrado por el vástago ABG es semejante al que se ha visto con otros diseños anatómicos.
El patrón de remodelado causado por el vástago ABG-I se establece en el periodo entre el sexto y duodécimo mes, permaneciendo después estable durante los 10 años siguientes a la protetización. En pacientes relativamente jóvenes los cambios de densidad ósea atribuibles a la edad son poco relevantes en los 10 años siguientes de la intervención, y no afectan a la estabilidad del implante, pero queda por determinar su efecto en períodos más largos. Los cambios por remodelación observados en el fémur permanecen estables salvo que varíen las condiciones metabólicas, biológicas o mecánicas del fémur.
La simulación con EF permite explicar los cambios biomecánicos que se producen en el fémur tras la implantación del vástago, así como establecer un paralelismo evidente entre los resultados obtenidos en el estudio con DEXA y los del estudio con EF, tal y como se observa en las figuras 13 a 18, lo que evidencia una perfecta correlación entre las variaciones de masa ósea y la evolución tensional en cada una de las zonas de Gruen obtenidas por simulación. La buena correlación obtenida entre los resultados de la simulación y el estudio densitométrico permite, por una parte, explicar desde el punto de vista del comportamiento biomecánico los cambios observados en la densidad ósea a largo plazo, donde queda claro que éstos se deben a una diferente transmisión de carga en el modelo implantado frente al fémur sano; por otra parte, queda validado el modelo de simulación, de forma que puede utilizarse en diferentes condiciones y a diferentes plazos temporales para realizar una predicción suficientemente precisa de la evolución de la densidad ósea a partir del comportamiento biomecánico en la interacción prótesis-fémur.
Declaración de conflicto de intereses
Los autores han declarado no tener ningún conflicto de intereses.
Correspondencia:
A. Herrera.
Paseo de Isabel la Católica, 1-3.
50009 Zaragoza.
Correo electrónico: aherrera@salud.aragon.es
Recibido: agosto de 2007.
Aceptado: octubre de 2007. *Premio de Investigación Básica. Fundación SECOT 2007.