Introducción Las infecciones asociadas con instrumentación de columna (IAIC) son una de las principales causas de complicación posquirúrgica y comorbilidad. Nuestro objetivo fue describir las características clínicas, microbiológicas, tratamiento y pronóstico de estas infecciones.
Material y métodosRealizamos un estudio retrospectivo en nuestro hospital (2011-2018) e incluímos a pacientes adultos con cirugía instrumentada de columna, que cumplieran los criterios diagnósticos de infección confirmada. Se procesaron muestras de herida quirúrgica superficial y muestras intraoperatorias profundas para cultivo microbiológico. El equipo médico y traumatológico fue siempre el mismo.
ResultadosSe diagnosticaron 41 casos, de los que 39 pacientes (95,1%) presentaron infección precoz (<3 meses tras cirugía inicial) con síntomas en las 2 primeras semanas, la media de PCR al diagnóstico fue de 133mg/dl y un 23% asoció bacteriemia. Los 2 pacientes restantes (4,8%) fueron infecciones crónicas (síntomas >3 meses tras cirugía). El tratamiento de elección en las infecciones precoces fue la estrategia Debridement, Antibiotics and Implant Retention (DAIR) sin retirada del injerto óseo, que demostró la curación en el 84,2% de los pacientes. La principal etiología fueron los grampositivos (S. aureus: 31,7%), seguido por los gramnegativos y la flora polimicrobiana. Los antibióticos fueron optimizados según los cultivos con una duración media de 12 semanas.
ConclusionesEn las infecciones precoces, el diagnóstico precoz y la estrategia DAIR (con retención del injerto óseo) demostró una tasa de curación superior al 80%.
Spinal instrumentation-related infections (SIRI) are one of the main causes of post-surgical complication and comorbidity. Our objective was to describe the clinical and microbiological characteristics, treatment and prognosis of these infections.
Material and methodsWe conducted a retrospective study in our institution (2011-2018) including adult patients undergoing spinal instrumentation who met the diagnostic criteria for confirmed infection. Superficial surgical wound and deep intraoperative samples were processed for microbiological culture. The medical and orthopaedic team was always the same.
ResultsForty-one cases were diagnosed of which 39 patients (95.1%) presented early infection (<3 months after initial surgery) with symptoms in the first two weeks, mean CRP at diagnosis was 133mg/dl and 23% associated bacteremia. The remaining two patients (4.8%) were chronic infections (symptoms >3 months after surgery). The treatment of choice in early infections was the Debridement, Antibiotics and Implant Retention (DAIR) strategy without removal of the bone graft, which successfully resolved 84.2% of the infections. The main etiology was gram-positive (Staphylococcus aureus: 31.7%), followed by gram-negative and polymicrobial flora. Antibiotics were optimized according to cultures with a mean duration of 12 weeks.
ConclusionsIn early infections, early diagnosis and DAIR strategy (with bone graft retention) demonstrated a healing rate higher than 80%.
El porcentaje de infección asociado a cirugía instrumentada de raquis varía dependiendo de los estudios y población revisada oscilando entre un 0,5-15%1,2. Los factores de riesgo se asocian a condiciones prequirúrgicas de los pacientes (comorbilidad, inmunosupresión, edad, malnutrición..), así como factores intraoperatorios (tiempo quirúrgico, sangrado, niveles de fusión, vía de abordaje, localización quirúrgica…) y posquirúrgicos (incontinencia, cicatrización,...)1. Los pacientes que presentan infección asociada a instrumentación de columna (IAIC) pueden presentar dolor, inestabilidad, disfunción, déficit neurológico, fiebre, signos inflamatorios, sepsis e incluso derivar en la muerte. En la mayoría de los centros se siguen los criterios diagnósticos de los Centers for Diseases Control and Prevention (CDC) para infección vertebral, modificados según Kowalski et al. y Dubée et al. que incluyen un criterio clínico (presencia de fístula, exposición del material o pus intraoperatorio), microbiológico (al menos ≥2 cultivos positivos para el mismo microorganismo o uno si es patógeno primario, sonicación positiva con ≥50UFC/ml) o histológico para confirmar la infección3–5.
Las IAIC pueden ser precoces, las que se presentan antes de los 3 meses, habitualmente en las primeras 6 semanas tras la cirugía, y suelen cursar con síntomas agudos, así como aumento de reactantes de fase aguda (PCR, VSG) en la analítica. Hasta un 25% pueden asociar bacteriemia. La etiología principal es S. aureus6, seguida de bacilos gramnegativos y flora polimicrobiana2. En estos pacientes el Debridement, Antibiotics and Implant Retention (DAIR) y los antibióticos con capacidad de difusión en el biofilm bacteriano aseguran la curación de más del 80% de los pacientes7. Desde el punto de vista quirúrgico, hay que realizar un desbridamiento agresivo con retención del implante, limpieza del material purulento y resección del tejido necrótico. La herida quirúrgica debe ser explorada exhaustivamente, tanto de forma superficial como profunda a la fascia muscular. La necesidad de retirar los injertos óseos está discutida8. En algunas series se documenta la necesidad de retirada del injerto óseo para la curación, así como el tratamiento antibiótico prolongado durante al menos 12 semanas8.
Las infecciones crónicas serían por tanto aquellas de presentación posterior a los 3 meses tras la cirugía con clínica más larvada e insidiosa en el tiempo y menos repercusión sistémica y analítica. Los agentes etiológicos suelen ser grampositivos menos virulentos como C. acnes o S. coagulasa negativa. En la mayoría de las ocasiones es necesario la retirada del implante si la columna se encuentra ya fusionada o el recambio del implante en uno o 2 tiempos si hay inestabilidad o seudoartrosis, implicando todo ello mayor morbimortalidad y secuelas ortopédicas9.
Nos propusimos hacer una revisión de las IAIC ocurridas en nuestro centro para describir las características clínicas, microbiológicas, quirúrgicas y pronósticas, así como investigar el porcentaje de éxito de nuestro protocolo terapéutico.
Material y métodosSe realizó un estudio descriptivo retrospectivo de las IAIC diagnosticadas en un hospital terciario durante 8 años, desde el año 2011 hasta el 2018. Se revisaron las historias clínicas de aquellos pacientes adultos (>18 años) con diagnóstico confirmado siguiendo los consensos internacionales de IAIC: que cumplieran un criterio clínico (presencia de fístula o pus peri-implante), histológico (presencia de inflamación en los tejidos peri-implante) o microbiológico (al menos ≥2 cultivos intraoperatorios positivos con la misma especie y sensibilidad o un cultivo positivo si es patógeno primario, fluido de sonicación positivo para >50UFC/ml).
Se registraron criterios demográficos, información de la cirugía primaria (motivo de la intervención, niveles fusionados, profilaxis quirúrgica), así como algunos factores de riesgo más importantes como: diabetes mellitus, neoplasia o inmunodepresión (tratamiento con quimioterapia, agente biológico o corticoide a dosis altas). También se revisaron aspectos microbiológicos y los tratamientos antibióticos recibidos por los pacientes.
Todos los pacientes fueron diagnosticados y tratados por el mismo equipo médico (unidad de infecciosas) y quirúrgico (unidad de columna de traumatología) siguiendo los protocolos establecidos para las infecciones osteoarticulares y avalados por la Comisión de Infecciones del hospital. Los pacientes tuvieron un seguimiento de 5 años por parte de traumatología con un seguimiento conjunto inicial con la unidad de infecciosas de un año hasta resolución de la infección.
El tratamiento quirúrgico de la infección consistió en lavado, desbridamiento amplio y exéresis de tejidos necróticos. Los injertos óseos se retiraron y se lavaron con suero salino, posteriormente se sumergieron durante 20min en solución antibiótica con gentamicina 240mg y tras aclarado con suero salino se reintrodujeron al lecho quirúrgico. Siempre se tomaron un mínimo de 3-5 muestras intraoperatorias para cultivo microbiológico. A la salida todos los pacientes permanecieron con un sistema externo de lavado a través de herida quirúrgica, que consistía en un drenaje de entrada craneal conectado a una infusión continua de suero fisiológico a 21ml/h durante 3 días y un drenaje caudal de salida aspirativo. Al cuarto día ambos drenajes se convertían en aspirativos y según el volumen de drenado se iban retirando en días progresivos (cuando el volumen aspirado era menor de 100ml/día).
Las muestras para cultivo fueron tomadas de la herida quirúrgica superficial al inicio de los síntomas, mediante jeringa con aspiración, bajo condiciones de asepsia. En la cirugía de revisión se tomaron muestras profundas de la herida durante la exposición y previo a cualquier lavado.
En los pacientes febriles o con signos clínicos de sepsis se obtuvieron además hemocultivos. A ningún paciente se le administró antibiótico hasta que no se tuvieron las muestras tomadas.
Todas las muestras se procesaron según los procedimientos habituales de la Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica (SEIMC), con tinción de Gram y cultivos en medios sólidos (aerobios y anaerobios) y líquidos (caldo de enriquecimiento). La identificación de los microorganismos crecidos en cultivo se realizó mediante espectrometría de masas (MALDI-TOF) y la sensibilidad antibiótica de los aislados mediante sistemas de microdilución en caldo (MicroScan® WalkAway® y Wider®)10,11.
El tratamiento antimicrobiano consistió en la utilización de un lipopéptido/glucopéptido (vancomicina o daptomicina) y beta-lactámico antiseudomónico (cefepime/piperacilina-tazobactam/meropenem) empírico con optimización posterior según cultivos. La antibioterapia se administró por vía intravenosa con secuenciación oral a antibióticos con buena biodisponibilidad y difusión en biofilm, dando preferencia a rifampicina en las infecciones por grampositivos y quinolonas en las producidas por gramnegativos12 cuando el paciente presentó buena evolución de herida quirúrgica y descenso de marcadores inflamatorios.
El éxito del tratamiento en las IAIC se definió como:
Curación: ausencia de signos clínicos locales y/o sistémicos, así como descenso o normalización de parámetros inflamatorios mantenido en el tiempo al menos 6 meses tras la finalización del tratamiento antibiótico.
Fracaso: reaparición de signos clínicos y/o aumento de parámetros analíticos durante el tratamiento o tras la finalización del mismo. Causas:
- -
Persistencia de la infección: infección no curada por el mismo microorganismo inicial.
- -
Sobreinfección: infección por nuevos microorganismos diferentes a los iniciales.
Se realizó un análisis descriptivo-univariante de todas las variables clínicas estudiadas. Estas se presentan en frecuencias absolutas y relativas en caso de variables cualitativas y las principales medidas de centralización y dispersión (media, desviación típica) en caso de variables cuantitativas.
Aspectos éticosEl trabajo fue aprobado por el Comité Ético de nuestro hospital y se desarrolló de acuerdo con el protocolo y las consideraciones éticas aplicables en la declaración de Helsinki y las guías éticas del consejo internacional de asociaciones médicas (CIOMS).
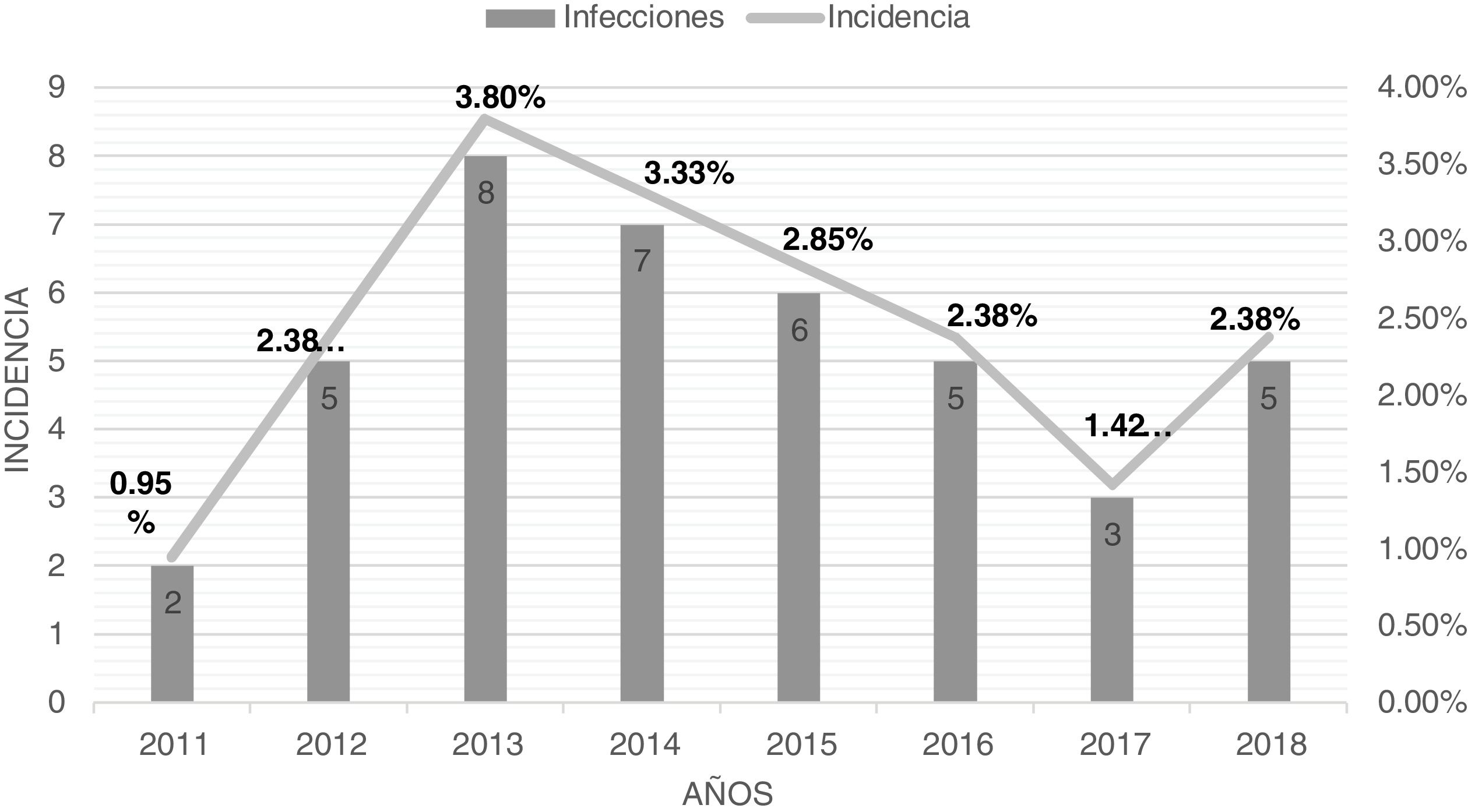
ResultadosEn el estudio presentado revisamos todas las cirugías de columna instrumentadas realizadas desde el año 2011 hasta el año 2018 (8 años). Se diagnosticaron 41 casos de IAIC sobre 1.680 intervenciones totales, obteniendo una incidencia media anual del 2,43%. Los casos de infección e incidencia se detallan en la figura 1.
La media de edad fue de 59 años, siendo algo mayor la prevalencia en mujeres 53,7%. De los 41 pacientes infectados, el segmento más afecto fue la columna lumbar con 34 pacientes (82,9%), a continuación, la columna torácica con 12 pacientes (29,2%), la columna cervical con 5 pacientes (12,1%) y localización en más de un segmento en 8 pacientes (19,5%).
Dentro de los factores de riesgo analizados se encontró que un 24,4% presentaban diabetes mellitus, un 24,4% recibían tratamiento inmunosupresor y un 22% tenía algún tipo de neoplasia activa o en tratamiento.
En cuanto a las profilaxis quirúrgicas durante la primera parte del estudio (2011-2014) se administró cefazolina 2g según las recomendaciones internacionales diagnosticando 22 infecciones (incidencia 2,61%). A finales de ese año se revisaron los protocolos de profilaxis quirúrgicas por la Comisión de Infecciones de nuestro hospital y se modificó la pauta de profilaxis a cefazolina 2g + gentamicina 240mg (dosis únicas intravenosas en la inducción anestésica). En el segundo período del estudio (2015-2018) diagnosticamos 19 casos de infecciones, observando una incidencia del 2,25%.
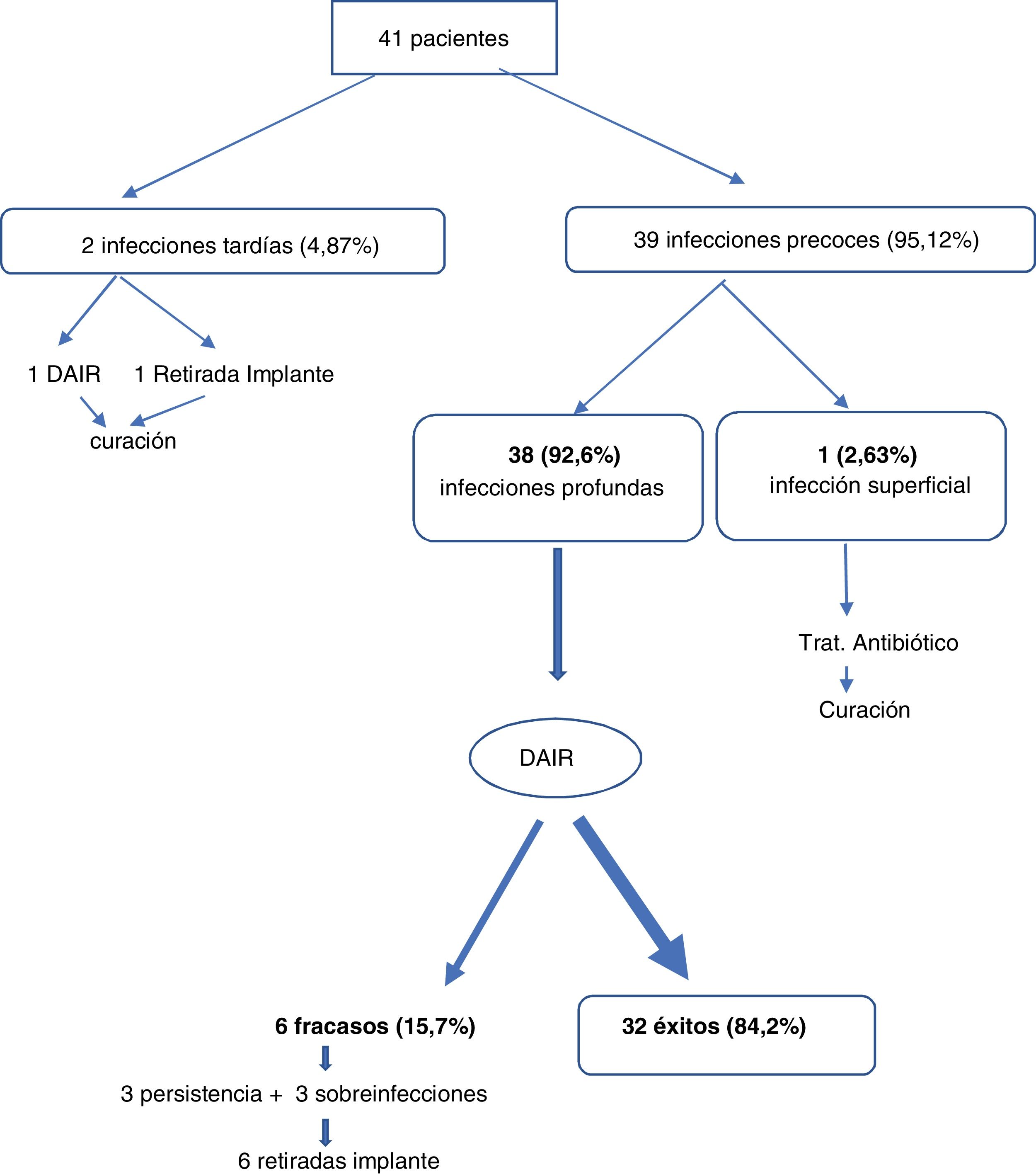
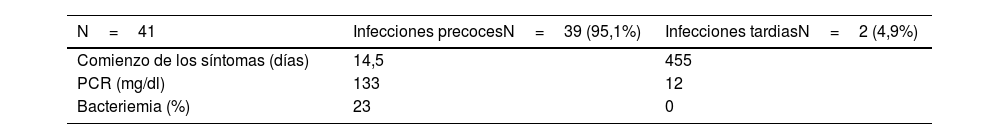
De las 41 infecciones diagnosticadas, 39 fueron de presentación precoz. De ellas una fue infección superficial y 38 fueron infecciones precoces y profundas con compromiso de fascia e implantes (92,7%). En estas infecciones precoces, los días hasta el comienzo de los síntomas fue de 14,51 días, el valor medio de la PCR fue de 133mg/dl, y hasta un 23% de los pacientes asoció bacteriemia secundaria. Hubo 2 infecciones de presentación tardía que tuvieron una media en aparición de síntomas de 455 días y una media en los valores de PCR de 12mg/dl (tabla 1).
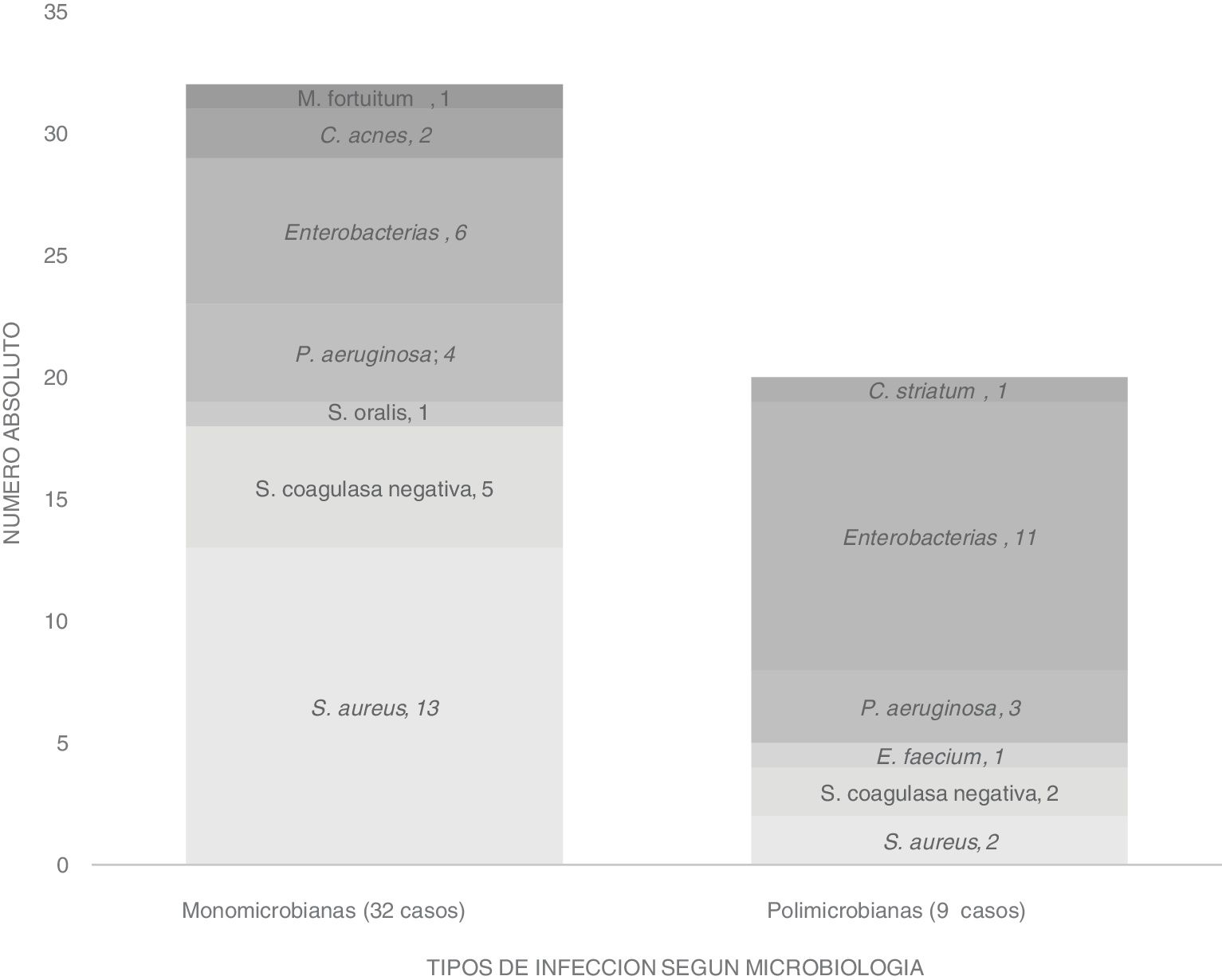
Para el diagnóstico microbiológico, el número de muestras enviadas para cultivo fue de 6 muestras como media, y la rentabilidad diagnóstica fue del 86%, entendiendo rentabilidad como el número de cultivos positivos respecto al total de muestras enviadas de un paciente. No tuvimos ningún paciente sin diagnóstico microbiológico. Hubo discordancia microbiológica en 10 pacientes (24,9%) donde los resultados de los cultivos obtenidos de herida superficial no eran concordantes con las muestras intraoperatorias. En cuanto a la etiología microbiana, de los de los 41 pacientes infectados, 32 casos (78%) fueron infecciones monomicrobianas: S. aureus13, S. coagulasa negativa5, S. oralis1, E. coli2, P. mirabilis2, H. alvei1, K. pneumoniae1, P. aeruginosa4, C. acnes2 y M. fortuitum1; mientras que 9 casos (22%) fueron infecciones polimicrobianas aislándose S. aureus2, S. coagulasa negativa2, E. faecium1, P. aeruginosa3, P. mirabilis4, E. coli3, K. pneumoniae3, M. morganii1 y C. striatum1.
Globalmente los microorganismos más aislados fueron los estafilococos14, principalmente S. aureus, seguido de las enterobacterias15, en nuestro caso la más frecuente fue P. mirabilis. Se detalla a continuación los hallazgos microbiológicos en la figura 2.
Tuvimos una prevalencia de S. aureus resistente a meticilina (SAMR) del 17,6%, enterobacterias con resistencia a cefalosporinas del 16% y resistencia a quinolonas entre el 20-30% dependiente del microorganismo. De los 41 pacientes con IAIC, 34 de ellos (82,9%) recibieron tratamiento empírico tras toma de cultivos intraoperatorios, teniendo la mayoría, 32 (94,1%) una cobertura antibiótica empírica adecuada para el microorganismo responsable de la infección.
Respecto a la estrategia de tratamiento y el pronóstico, del total de 41 pacientes:
- -
Treinta y nueve (95,12%) pacientes presentaron infecciones precoces, de los cuales uno (2,63%) fue infección superficial recibiendo solo antibióticos con curación y 38 (92,6%) fueron manejados con DAIR obteniéndose la curación en 32 pacientes (84,2%). Durante la cirugía no hubo que retirar ningún injerto óseo, todos fueron lavados, desinfectados y reintroducidos al lecho quirúrgico.
- -
Dos (4,87%) pacientes presentaron infecciones crónicas (uno fue tratado con retirada de implantes más antibioterapia y el otro con DAIR) con curación de la infección en ambos.
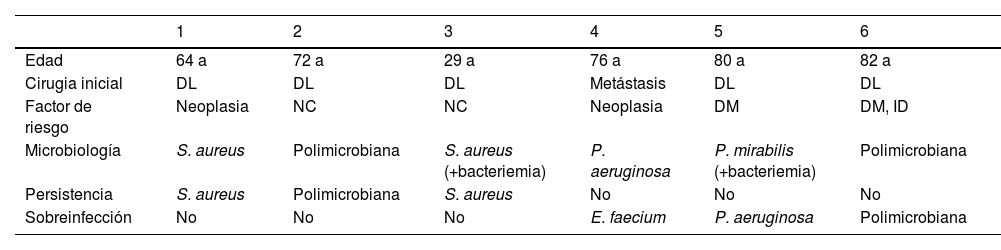
El fracaso al DAIR se produjo en 6 pacientes (15,7%) por persistencia del mismo microorganismo inicial o sobreinfección por microorganismos diferentes. En estos pacientes hubo que retirar los implantes para conseguir curar la infección (fig. 3). Durante el período de seguimiento no se objetivó ningún caso de seudoartrosis ni complicación derivada de la infección.
Se describen a continuación los 6 pacientes con fracaso a estrategia DAIR, mostrando los aspectos más relevantes (tabla 2). Todos comenzaron en los primeros 6 meses tras DAIR, y todos acabaron necesitando la extracción del material a pesar de optimización antimicrobiana.
Pacientes con fracaso a DAIR
| 1 | 2 | 3 | 4 | 5 | 6 | |
|---|---|---|---|---|---|---|
| Edad | 64 a | 72 a | 29 a | 76 a | 80 a | 82 a |
| Cirugia inicial | DL | DL | DL | Metástasis | DL | DL |
| Factor de riesgo | Neoplasia | NC | NC | Neoplasia | DM | DM, ID |
| Microbiología | S. aureus | Polimicrobiana | S. aureus (+bacteriemia) | P. aeruginosa | P. mirabilis (+bacteriemia) | Polimicrobiana |
| Persistencia | S. aureus | Polimicrobiana | S. aureus | No | No | No |
| Sobreinfección | No | No | No | E. faecium | P. aeruginosa | Polimicrobiana |
DAIR: Debridement, Antibiotics and Implant Retention; DL: degenerativa lumbar; DM: diabetes mellitus; ID: inmunodepresión; NC: no conocidos.
Los antibióticos empíricos empleados mayoritariamente fueron glucopéptico/lipopétido (vancomicina o daptomicina) más beta-lactámico antiseudomónico (cefepime, piperacilina-tazobactam, meropenem) según nuestro protocolo de infección osteoarticular, durante una media de 7 días hasta resultados de cultivos y optimización de antibioterapia dirigida. La duración media de tratamiento antibiótico iv fue de 21 días. Los antibióticos orales más prescritos fueron quinolonas, rifampicina y cotrimoxazol. La duración total (fase intravenosa y secuenciación oral) del tratamiento de la IAIC precoz se prolongó durante una media de 86,4 dias (12,3 semanas). Ningún paciente precisó tratamiento supresor.
DiscusiónDentro de la naturaleza retrospectiva de nuestro estudio, podemos concluir que ser rigurosos con los protocolos clínicos/quirúrgicos y microbiológicos aseguran una alta rentabilidad diagnóstica y buen pronóstico clínico para los pacientes que sufren IAIC con una curación superior al 80%. Nuestro principal agente etiológico fue S. aureus (más del 30%) seguido de los bacilos gramnegativos y de la flora polimicrobiana. Los aspectos microbiológicos son muy valiosos para plantear tratamientos empíricos y guías locales de profilaxis acordes a la epidemiologia local.
En IAIC casi toda la información en cuanto a diagnóstico, tratamiento y manejo ha sido extrapolada de las guías y consensos nacionales e internacionales de infección de prótesis articular. No existen estudios prospectivos ni ensayos clínicos aleatorizados publicados para cirugía de columna, sino que la mayor parte de nuestro conocimiento proviene de estudios retrospectivos y heterogéneos, motivo por el cual, se hace interesante y necesario aportar datos sobre esta afección.
La prevalencia de las IAIC es variable dependiendo de factores intrínsecos al paciente, así como de la complejidad de la cirugía pudiendo oscilar en una horquilla amplia entre el 0,5-15%2. En nuestra revisión hemos obtenido una incidencia anual del 2,43% estando acorde con lo publicado. Con el cambio de profilaxis prequirúrgica realizada a partir del año 2014, en que se empezó a utilizar cefazolina + gentamicina tuvimos un ligero descenso de pacientes infectados (22 vs. 19 casos), pero manteniendo una incidencia similar en ambos períodos (2,61 vs. 2,25%). Esto podría demostrar, que en las cirugías de columna lumbar habría que ampliar la cobertura frente a gramnegativos, principales responsables etiológicos en forma de infección monomicrobiana o polimicrobiana. Aunque los consensos y las guías internacionales no establecen añadir aminoglucósido, cada vez hay más manuscritos y opiniones de expertos que recomiendan profilaxis dirigidas en función de la epidemiología local y circunstancias clínicas y quirúrgicas del paciente13,16,17. Sin embargo, para responder a esta pregunta serían necesarios estudios más amplios y controlados. No obstante, nuestro descenso puede estar influenciado por un efecto indirecto no medido tales como refuerzo de otras medidas higiénicas, preparación prequirúrgica, movilización precoz de los pacientes, retirada de pañal, estabilidad del personal sanitario.
En cuanto al diagnóstico microbiológico se recomiendan siempre entre 3-5 muestras intraoperatorias (criterios de Atkins et al.) y su procesamiento en medios aerobios, anaerobios y en frascos de hemocultivos, puesto que parece aumentar sensibilidad diagnóstica, manteniendo incubación hasta 2 semanas. En algunas series los cultivos negativos pueden llegar hasta el 20% por uso de antibióticos previos, falta de estandarización en toma de muestras o interferencias con el biofilm bacteriano teniendo que recurrir a PCR molecular y técnicas de sonicación si disponemos del implante18 para mejorar la sensibilidad9,10. La ausencia o el incorrecto diagnóstico microbiológico conlleva muchas veces un infradiagnóstico de estas infecciones, convirtiendo infecciones precoces en crónicas con peor pronóstico, y obligando a la retirada del material en la mayoría de los casos. En nuestro estudio todos los pacientes tuvieron diagnóstico etiológico, por lo que consideramos que la sensibilidad de nuestros procedimientos diagnósticos y microbiológicos fue alta17. Es importante, que en los centros se establezcan protocolos de trabajo y vías clínicas, así como equipos multidisciplinares para el abordaje precoz de estas infecciones19-21.
Si comparamos la etiología de nuestras IAIC con lo publicado en la literatura, es bastante similar con predominio de los cocos grampositivos, con S. aureus como patógeno principal, siendo responsable del 31,7% de las infecciones totales. En nuestra serie tuvimos un porcentaje importante de infecciones polimicrobianas que también estaría en concordancia con la zona anatómica más frecuentemente intervenida como es la zona lumbar15. Nuestras resistencias microbianas fueron acordes a nuestra epidemiologia local con una prevalencia de SAMR 17,6%, enterobacterias productoras de BLEE 5% y un no despreciable 19,2% de bacilos grannegativos resistentes a quinolonas.
La presentación clínica más frecuente fue la precoz, que comenzó entre 2-3 semanas tras la cirugía y según los consensos se acepta dentro de los 3 primeros meses. El tratamiento de elección fue una estrategia desbridamiento, antibióticos y retención de implantes (DAIR), lo que aseguró más de un 80% de curación. Nuestra revisión apoya estos resultados, con un diagnóstico precoz en un 92,6% de los pacientes, siendo tratados con DAIR y reintroducción del injerto tras lavado con gentamicina, y logrando curar la infección en el 84,2%, mantenido en un período de seguimiento clínico de 5 años.
La necesidad de retirar los injertos óseos es discutida. Grupos españoles como el del Hospital Regional de Málaga abogan por la retirada de los mismos en una revisión propia publicada en esta misma revista (Gómez Cáceres A. et al.)14. En cambio, el Consenso Internacional de Infecciones Músculo-esqueléticas (Philadelphia 2018) propone que el injerto óseo no necesita ser retirado rutinariamente después de la cirugía de limpieza y desbridamiento, sobre todo si se ha incorporado parcialmente. Sin embargo, el injerto suelto o purulento debe retirarse. En nuestro caso, los injertos óseos no se retiraron manteniendo la tasa de curación de los pacientes. Tuvimos una baja tasa de fracasos al DAIR (15,7%), tan solo 6 pacientes a los que hubo que retirar el implante para curar la infección. La mayoría presentaron algún factor de riesgo como inmunodepresión o bacteriemia secundaria a la infección como factor de gravedad y posible mala evolución. En nuestra serie los pacientes no presentaron complicaciones mayores derivados de la infección, pero en artículos similares sobre infección profunda en cirugía de columna en nuestro país, se señalan las no infrecuentes y serias complicaciones asociadas al fracaso del tratamiento de la infección, sobre todo en deformidad22,23, principalmente seudoartrosis que obligan a posteriores cirugías correctivas y uso prolongados de antibióticos, lo que aumenta la morbimortalidad de estos pacientes, así como el gasto sanitario. Posiblemente el disponer de un equipo multidisciplinar coordinado y entrenado nos permita optimizar el diagnóstico y el tratamiento de estas infecciones para mejorar nuestros resultados.
Otro aspecto importante es la duración total del tratamiento antibiótico, así como la vía de administración, es decir, si es posible la secuenciación oral en estas infecciones y en qué momento. En infección de prótesis articular disponemos al menos de un ensayo clínico español que valida los tratamientos más cortos de 8 semanas tras cirugía24. También disponemos del ensayo clínico inglés OVIVA donde se demuestra la no inferioridad en el tratamiento por vía oral durante las primeras 6 semanas en infecciones osteoarticulares complejas25. Sin embargo, en infección de columna existe poca evidencia, aunque nos aproximamos cada vez más al manejo que hacemos en otras infecciones osteoarticulares. Las recomendaciones en IAIC oscilan entre 8-12 semanas de tratamiento, pero cada vez son más las publicaciones que presentan buenos resultados con períodos más cortos9,16,17,26. Algunas publicaciones españolas de los 2 últimos años, como las de Bosch-Nicolau P. y Benavent E.27,28 muestran que 6-8 semanas serían suficientes en pacientes seleccionados. Billières J. et al., ya demostraron en su estudio que algunos factores como la duración del tratamiento antibiótico (2 semanas de tratamiento intravenoso y 8 semanas de tratamiento total) no tenían relación con la recurrencia, lo que sugiere que los factores de riesgo individuales podrían ser más importantes que la duración de la administración de antibióticos29. En otras publicaciones como el ensayo clínico de Benkabouche M. et al., se demuestra que incluso 4-6 semanas tras la retirada de implante son suficientes30. En nuestro estudio recordemos que los pacientes con infección precoz sometidos a DAIR, la duración media de tratamiento fue de 86,4 días (media de 12 semanas), muy en línea con lo que hasta ahora eran las recomendaciones internacionales hasta hace 2 años.
Como debilidades del estudio, presentamos un número limitado de pacientes que dificulta la inferencia estadística, pero no sin datos importantes que pueden respaldar conclusiones aportadas en estudios previos. En cambio, como fortaleza tenemos que todos los pacientes siempre fueron manejados por el mismo equipo médico de la unidad de infecciosas y del equipo de traumatología de columna siguiendo los protocolos establecidos en nuestro hospital para el manejo de esta afección, lo que proporciona homogeneidad en el manejo y en los resultados clínicos de estos pacientes.
ConclusionesUn seguimiento riguroso de los procedimientos diagnósticos y técnicas microbiológicas garantiza una alta sensibilidad diagnóstica en las IAIC, lo que añadido a una estrategia DAIR (con retención de injertos) y optimización de antimicrobianos conlleva un éxito terapéutico por encima del 80%, en las infecciones precoces tras cirugía instrumentada de columna.
Es necesario revisar la duración de la antibioterapia a la luz de estudios relacionados publicados en los 2 últimos años, así como profundizar en la posible utilidad de una profilaxis antibiótica más optimizada a las características de la cirugía y de la epidemiología local para mejorar el curso de estas infecciones.
Es importante formar equipos multidisciplinares con los diferentes especialistas implicados en el manejo de la infección osteoarticular para mejorar el diagnóstico, el tratamiento y el pronóstico de estas infecciones.
Nivel de evidenciaNivel de evidencia II.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.