INVESTIGACIÓN
Estudio de la incorporación de tres tipos de hueso esponjoso (autoinjerto, aloinjerto congelado y liofilizado). Modelo experimental en corderos
Study of the incorporation of three types of cancellous bone graft (autograft, frozen allograft and lyophilized allograft). Experimental model in lambs
LÉNIZ, P., y FORRIOL, F.
Laboratorio de Ortopedia Experimental. Departamento de Cirugía Ortopédica y Traumatología.
Clínica Universitaria de Navarra. Facultad de Medicina. Pamplona.
Correspondencia:
Dr. F. FORRIOL.
Departamento COT.
Clínica Universitaria de Navarra.
Avda. Pío XII, s/n.
31080 Pamplona.
Premio Fundación SECOT 1998 de investigación básica en Cirugía Ortopédica y Traumatología.
RESUMEN: Al comparar la incorporación de tres tejidos de injertos de hueso trabecular (injertos autólogos, aloinjertos congelados a 80° C y aloinjertos liofilizados) que rellenan cavidades cilíndricas en el cóndilo femoral de 24 corderos de 4 a 6 meses de edad, los estudios radiológicos y morfológicos muestran una incorporación similar entre los injertos autólogos y aloinjertos y una importante reabsorción, con abundantes osteoclastos e infiltrado linfocitario en los injertos liofilizados. Esto se corrobora con la histomorfometría, donde el ancho y la superficie trabecular y el número de osteoblastos de los autoinjertos y los aloinjertos congelados son mayores que en los liofilizados, mientras que la erosión trabecular, el número de osteoclastos y de núcleos, así como el índice de reabsorción, son significativamente superiores en los aloinjertos de hueso liofilizado. El índice de reabsorción trabecular fue mayor en los aloinjertos liofilizados, menor en los aloinjertos congelados y mucho menor en los autoinjertos. La integración de los auto y los aloinjertos congelados a 80° C es muy semejante. Por el contrario, los injertos liofilizados son reabsorbidos en su totalidad y el hueso crece desde la periferia para rellenar la cavidad que dejan.
PALABRAS CLAVE: Injerto. Hueso esponjoso. Congelación. Liofilización.
ABSTRACT: A comparison was made of the incorporation of three types of trabecular bone graft (autologous grafts, allografts frozen to 0° C, and lyophilized allografts) used to fill cylindrical cavities in the femoral condyle of 24 lambs. Lambs ranged in age from 4 to 6 months. Radiological and morphological studies showed a similar incorporation of autologous grafts and allografts and intense resorption, with abundant osteoclasts and a lymphocyte infiltrate in the lyophilized grafts. These findings were corroborated by histomorphometry, which showed that trabecular thickness and surface area and the number of osteoblasts in the autografts and frozen allografts were greater than in the lyophilized grafts. Trabecular erosion, number of osteoclasts and nuclei, and the resorption index were significantly greater in the lyophilized bone grafts. The trabecular resorption index was highest for the lyophilized allografts, smaller for the frozen allografts, and much smaller for autografts. The integration of autografts and allografts frozen at 80° C was similar. In contrast, lyophilized grafts were completely reabsorbed and bone grew from the periphery to fill the cavity left by the grafts.
KEY WORDS: Graft. Cancellous bone. Freezing. Lyophilization.
El objetivo de los injertos óseos esponjosos es estimular la osteogénesis cuando sea insuficiente, esté inhibida o retardada, ya que tienen como funciones promover la osteogénesis, rellenar cavidades, estimular la unión en los retardos de consolidación e inmovilizar articulaciones.8 Lo que se pretende es que el material injertado sea sustituido completamente por hueso propio del paciente en el menor tiempo posible. El autoinjerto es la situación ideal; sin embargo, no siempre está disponible en las cantidades necesarias.
El objetivo del presente trabajo es analizar morfológica e histomorfométricamente el comportamiento de los injertos de hueso esponjoso congelados y liofilizados en comparación con los autólogos.
Material y Método
Se emplearon 24 corderos Ovis aries de 4 a 6 meses de edad y pesos comprendidos entre 20 y 25 kg. Con una trefina se crearon defectos óseos de 1 cm de diámetro y 2 cm de longitud en la porción externa de la epífisis distal del fémur izquierdo que fueron sometidos a tres tipos de reparación con ocho animales en cada grupo: a) Grupo I, injerto autólogo; b) Grupo II, aloinjerto congelado a 80° C, y c) Grupo III, aloinjerto liofilizado.
Los injertos autólogos se obtuvieron de la metáfisis distal del fémur con técnica estéril, resinsertándolo de forma invertida en la misma zona de donde fue retirado. Los aloinjertos congelados se extrajeron con la misma técnica. El material obtenido se introdujo en recipientes estériles y se congelaron a 80° C durante 6 semanas. Los injertos liofilizados se obtuvieron como en los casos anteriores. Los cilindros óseos se colocaron en recipientes estériles, se congelaron a 80° C durante 6 semanas y posteriormente se liofilizaron, extrayendo el 90% de agua mediante desecación a bajas temperaturas durante 36 horas con un liofilizador (Telstar®).
El sacrificio de los animales se efectuó a los 2 meses de la intervención mediante la inyección endovenosa de 5 mEq de cloruro potásico previa anestesia con 1,5 mg/kg de sódico. Más adelante se extrajo la extremidad distal del fémur libre de partes blandas.
Para la valoración de los resultados se realizaron radiografías de control anteroposterior y lateral de la rodilla intervenida inmediatamente después de la intervención y controles periódicos hasta el sacrificio del animal. Una vez extraída la pieza se realizó una radiografía de contacto. El estudio histológico se realizó en cortes de 4 mm en parafina, efectuando tinciones con tricrómico de Masson, Von Kossa y hematoxilina-eosina. El análisis de imagen se llevó a cabo en un equipo Leica Q 500 MC (Leica®), analizando los parámetros histomorfométricos (Tabla 1), que se estudiaron en ocho campos distintos en cada una de las cinco preparaciones obtenidas por animal, sobre la zona ocupada por el injerto.
Tabla 1. Parámetros histomorfométricos. |
| -- Ancho trabecular. |
| -- Superficie trabecular o área trabecular. |
| -- Superficie de erosión trabecular. |
| -- Índice de erosión trabecular. |
| -- Número de osteoblastos. |
| -- Ancho de osteoide. |
| -- Índice osteoide/trabecular. |
| -- Número de osteoclastos/campo. |
| -- Número de núcleos por osteoclastos. |
| -- Índice de reabsorción ósea o de núcleos por osteoclasto. |
En el estudio estadístico los grupos fueron comparados mediante las pruebas de Tukey B y LSD en el programa estadístico SPSS® versión 6.1.2.
Resultados
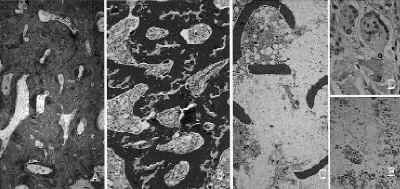
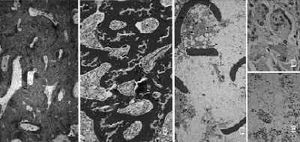
En los autoinjertos se observó abundante tejido trabecular con signos de vitalidad, representado por la cantidad de células osteoblásticas en la periferia del injerto con tejido fibroso abundante, especialmente en la periferia. En todas las muestras estudiadas se apreciaron pocos osteoclastos (Fig. 1).
Figura 1. Imagen comparativa de la evolución de los tres tipos de injertos. A: Injerto autólogo. B: Aloinjerto congelado. C: Aloinjerto liofilizado. D: Restos del injerto (h) rodeado por osteoclastos (o). E: Infiltrado linfocitario. (Tricrómico de Masson, *100.)
En la radiología de control de los aloinjertos congelados a los 15 días de la operación se vio una imagen de mayor densidad en relación al defecto creado, similar a la densidad del hueso que lo rodeaba y no apreciándose claramente los límites del defecto efectuado. Histológicamente, el tejido fibroso estaba presente entre las trabéculas, incluyendo la zona central del defecto, donde se vieron pequeñas zonas de osificación encondral. La imagen histológica fue muy semejante a lo visto en los injertos autólogos (Fig. 1).
En el grupo de aloinjertos liofilizados el estudio radiológico a los 15 días de la operación mostró una imagen de mayor densidad en relación al defecto creado y similar a la densidad del hueso que lo rodea, sin apreciarse claramente los límites del defecto. Histológicamente se vio escaso tejido trabecular, sin signos de vitalidad (Fig. 1), con numerosos osteoclastos gigantes multinucleados, principalmente en la periferia, a la vez que existía una abundante reabsorción ósea e infiltrados linfocitarios.
Los parámetros estudiados con la histomorfometría (Tabla 2) presentaron los siguientes resultados: a) en el ancho trabecular se encontraron diferencias muy significativas (p ¾ 0,01) entre los Grupos I (autoinjertos) y II (injertos congelados) con respecto al Grupo III (injertos liofilizados); b) en la superficie o área trabecular hubo diferencias altamente significativas (p ¾ 0,001) entre el Grupo III y los Grupos I y II; c) en cuanto a la superficie de erosión trabecular se apreciaron diferencias altamente significativas (p ¾ 0,001) del Grupo III con respecto a los otros; d) el índice de erosión trabecular objetivó diferencias significativas (p ¾ 0,05) entre todos los grupos de injertos utilizando el test de rango múltiple LSD, siendo mayor en el Grupo III, seguido del II y menor en el Grupo I; e) por lo que respecta al número de osteoblastos, no se detectaron diferencias significativas entre los Grupos I y II, que sí las mostraron, con una población significativamente mayor (p ¾ 0,001) que el Grupo III; f) en el ancho del osteoide no se encontraron diferencias (pruebas de rango múltiple: LSD y Tukey-B); g) el índice osteoide/trabecular fue mayor en el Grupo II y menor en los Grupos I y III, aunque sin apreciarse diferencias significativas en pruebas de rango múltiple (LSD y Tukey-B); h) al estudiar el número de osteoclastos/campo se encontraron diferencias significativas (p ¾ 0,05) entre el Grupo I y el III; i) cuando se contabilizó el número de núcleos por osteoclasto aparecieron diferencias altamente significativas (p ¾ 0,001) entre el Grupo III con respecto a los otros dos, y j) el índice de reabsorción ósea o de núcleos por osteoclasto mostró diferencias altamente significativas (p ¾ 0,001) entre el Grupo III y los otros. Salvo donde se ha indicado otra medotología, los estudios fueron mediante un análisis de variables individuales.
Tabla 2. Resultados histomorfométricos. | ||||||
| Autoinjerto | Injerto congelado | Injerto liofilizado | ||||
| X | DS | X | DS | X | DS | |
| Ancho trabecular (µm) | 209,84 | 83,77 | 204,35 | 72,17 | 123,22 | 50,22 |
| Área trabecular (µm2) | 104.407,30 | 46.486,80 | 141.352,10 | 23.433,50 | 37.203,7 | 64.074,10 |
| Área erosión trabecular (µm2) | 3.538,86 | 1.233,57 | 3.290,75 | 961,54 | 10.244,91 | 1.036,87 |
| Índice erosión trabecular | 1,82 | 3,46 | 20,88 | 5,81 | 46,60 | 12,52 |
| Osteoblastos | 17,65 | 5,36 | 18,35 | 6,44 | 5,20 | 1,82 |
| Anchura osteoide (µ) | 7,16 | 1,48 | 6,77 | 2,47 | 4,87 | 1,42 |
| Índice osteoide/trabecular | 3,51 | 1,19 | 3,80 | 1,37 | 3,22 | 1,27 |
| Osteoclastos | 1,00 | 0,29 | 1,40 | 0,31 | 1,60 | 0,48 |
| Núcleos/osteoclasto | 3,55 | 1,67 | 4,15 | 2,59 | 18,25 | 5,42 |
| Índice núcleo/osteoclasto | 3,74 | 1,35 | 3,14 | 1,24 | 12,87 | 4,04 |
Discusión
Un injerto de hueso esponjoso cumple tres funciones: procurar la osteoinducción, que induce producción de hueso localmente reclutando células formadoras de hueso; promover la osteoconducción, aportando un soporte para la deposición ósea, y por último, constituir la fuente de formación de células óseas. La incorporación del injerto óseo es un proceso secuencial que comienza con la inflamación y atraviesa por diferentes estadios de revascularización y osteogénesis hasta conseguir una estructura mecánicamente válida.17 Barth3 en 1983 postuló la teoría de la inducción, asumiendo que el injerto no sobrevive, pero estimula las células mesenquimales pluripotenciales del huésped para diferenciarse en células osteogénicas del injerto. Para ello es necesario un mediador químico capaz de reclutar células potenciales, propiedad que Urist24-26 atribuye a la BMP. Urist24 distingue en la incorporación de un injerto: a) la inflamación y proliferación de células en el lecho injertado, con una duración de minutos a horas; b) la respuesta osteinductiva de las células en el lecho del hueso injertado; c) la osteoconducción, neovascularización y neoformación ósea (de meses a años), y d) la función mecánica (de 2 a 20 años), que depende en cada caso de numerosos factores. El hueso esponjoso se revasculariza de forma más rápida que el hueso cortical,2 pues su estructura más porosa favorece la penetración de vasos que crecen gradualmente en los espacios medulares, llevando a una revascularización completa en un espacio de tiempo entre 2 y 3 semanas.13,27
Para Czitrom,7 siguiendo a autores como Chalmer,6 Hutchinson11 y Burwell,5 existen diferencias entre el auto y el aloinjerto, ya que en este último existe un rechazo por el huésped y considera que los estudios histológicos aislados ofrecen una visión parcial y a veces errónea. Sin embargo, para nosotros la cuantificación morfológica es una respuesta de lo que ocurre en la integración de un injerto y reflejo de los fenómenos inmunológicos que tienen lugar. Las células inmunogénicas de los aloinjertos residen en la médula ósea, lo que se comprueba porque los aloinjertos óseos corticales lavados y limpios de médula presentan una menor respuesta5,18 y porque los aloinjertos de hueso procedente de donantes genéticamente compatibles (quimeras) mejoran su curación y disminuyen la inmunogenicidad humoral.16 Dentro de las células de la médula con una mayor capacidad inmunogénita están, según Czitrom,7 los antígenos expresados de Clase II del complejo mayor de histocompatibilidad, identificadas como células mieloides de la línea granulocítica, que estimulan a la IL-2 y a las células T citotóxicas in vitro.
El autoinjerto es el método más natural en la reconstrucción de los defectos esqueléticos, pues tiene una conducta biológica óptica al mantener sus propiedades osteoconductivas y osteoinductivas, permitiendo un proceso normal de remodelación-reabsorción, siendo además histocompatible y carece del peligro de transferir enfermedades, aunque tiene como inconveniente que la cantidad disponible es limitada y existe riesgo de morbilidad en la zona donante. Las grandes ventajas que ofrecen los injertos
autólogos de hueso esponjoso son conocidos a partir de los trabajos de Matti,15 quien demostró su supervivencia después de un trasplante. En 1947, Abbott y cols.1 vieron que las células supervivientes eran osteoprogenitoras y que los osteocitos maduros de la cortical y del hueso esponjoso raramente sobreviven el trasplante. Siguiendo en esta línea, Segmüller23 ha demostrado que el autoinjerto óseo puede proliferar de forma que el tejido fibroso de granulación se diferencia formando hueso en un período mínimo de 35 días.
La actividad biológica de los aloinjertos es inferior a la presentada por los autoinjertos, pues requiere más tiempo para su integración, aunque siguen una secuencia histológica idéntica. Según Urist26 entre los factores que influyen en la actividad biológica de la BMP destacó las condiciones de conservación. Así, la congelación y la liofilización preservan su actividad, mientras que la esterilización por radiación superior a 2 mrads causaba la pérdida de actividad.22 Además se puede disponer en cualquier momento del tamaño y cantidad necesaria, por lo que es muy utilizado en cirugía ortopédica,14,20,21 aunque su obtención resulta un proceso laborioso, lleno de cuidados, que necesita cumplir una serie de requisitos de esterilización, conservación y observación de requisitos legales.
Entre el grupo de aloinjertos congelados y el de injertos autólogos no encontramos diferencias en su comportamiento morfológico, aunque destaca en los autólogos una mayor actividad de regeneración ósea con abundantes osteoblastos, sobre todo en la zona periférica del defecto, hecho señalado por varios autores.5,6,11,12 El autoinjerto presenta unas trabéculas rodeadas cada una de ellas por una banda clara de células dispuestas linealmente que se identifican como osteoblastos y los espacios intertrabeculares ocupados por un tejido medular rico en vasos y células sanguíneas. Los osteocitos, visibles en las trabéculas óseas, presentan un núcleo teñido que demuestra su viabilidad. En este tipo de injerto se aprecian zonas de reabsorción con células osteoclásticas periféricas, por lo que es un injerto de fácil adaptación que se integra rápidamente y sufre un proceso de reabsorción lento. El aloinjerto congelado, por su parte, presenta un número menor de osteoblastos sobre la superficie trabecular. Los osteocitos del aloinjerto muestran también sus núcleos teñidos. En cuanto a la integracióin de los injertos liofilizados, el comportamiento es muy distinto a los dos anteriores, ya que presentan abundante infiltrado linfocitario, señalado también por Kakiuchi,12 con reabsorción completa del injerto, quedando pequeños restos del mismo. El aloinjerto liofilizado ocupa el defecto y es reabsorbido mientras se va formando nuevo hueso desde la periferia.
El ancho y el área trabeculares no han presentado diferencias estadísticamente significativas entre el injerto autólogo y el aloinjerto congelado, que son muy evidentes en el grupo de aloinjertos liofilizados. Esto concuerda con los resultados obtenidos del área de erosión, que es en el grupo del injerto liofilizado tres veces superior al resto de los grupos. Los parámetros de erosión son mucho más significativos en los aloinjertos lifolizados. El índice de erosión trabecular o relación entre el área de erosión y el área total de la trabécula es del 50% en el grupo del aloinjerto liofilizado frente al 20% en el de aloinjertos congelados y el 10% en el de injertos autólogos, lo que está relacionado con el comportamiento de los osteoclastos, cuyo número es mayor en el grupo de aloinjertos liofilizados que en el de injertos autólogos y en el de aloinjertos congelados. El número de núcleos osteoclásticos y núcleos por osteoclasto en el grupo de aloinjertos liofilizados también presenta un valor muy superior a los otros grupos.
Según la literatura científica los injertos liofilizados preparados comercialmente mantienen su capacidad de influir en la diferenciación celular y en la regeneración de los tejidos. Sin embargo, la liofilización desnaturaliza las proteínas, lo que hace que el organismo receptor lo reconozca como un cuerpo extraño, explicando la reabsorción, el elevado número de osteoclastos y el infiltrado linfocitario que hemos encontrado en este tipo de injertos. El grupo de injertos liofilizados mantiene diferencias sustanciales con los otros grupos como son la importante reabsorción del tejido óseo injertado y la aparición de osteoclastos o células gigantes multinucleadas. En la bibliografía se pueden leer trabajos defendiendo sus propiedades como un injerto adecuado que conserva sus propiedades osteoinductoras,19,26 aunque surgen publicaciones que muestran los malos resultados tanto en estudios experimentales como en clínica.10,22 Herron y Newman9 tras evaluar el resultado de los injertos liofilizados en 37 pacientes de cirugía raquídea no recomiendan su uso.
Agradecimientos
A Purificación Ripalda por la realización de las preparaciones histológicas y coordinación del trabajo de laboratorio.
Bibliografía
1.Abbot, LC; Schottstaedt, ER; Sunders, JB, y Bost, FC: The evaluation of cortical and cancellous bone as grafting material. J Bone Joint Surg, 29: 381-385, 1947.
2.Albrektsson, T: The healing of autologuous bone grafts after varying degrees of surgical trauma. J Bone Joint Surg (A), 69: 403-407, 1980.
3.Barth, A: Uber histologische befunde nach knocheimplantationen. Arch Klin Chir, 46: 409-412, 1983.
4.Burwell, GR; Friedlander, GE, y Mankin, HJ: Current perspectives and future directions: The 1983 international conference on osteochondral allografts. Clin Orthop, 197: 141-157, 1985.
5.Burwell, GR: The fate of bone grafts. En: Apley, AG (Ed): Recent Advances in Orthopaedics. Londres: Churchill Ltd, 1969, 115-207.
6.Chalmer, J: Bone transplantation. Symposium Rissue Org Transplant. J Clin Path, 20: 540-550, 1967.
7.Czitrom, AA: Immunology of bone and cartilage allografts. En: Czitrom, AA, y Gross, AE (Eds): Allografts in Orthopaedic Practice. Baltimore. Williams & Wilkins, 1992, 15-25.
8.Friedlaender, GE: Bone allografts: The biological consequences of immunological events. J Bone Joint Surg (A), 73:1119-1121, 1991.
9.Herron, LD, y Newman, MH: The failure of ethylene oxide gas sterilized freeze dried bone graft for thoracic and lumbar spinal fussion. Comments. Spine, 16: 600-601, 1991.
10.Hopp, SG; Dahners, LE, y Gilbert, JA: A study of the mechanical strength of long bone defects treated with various bone autograft substitutes: An experimental investigacion in the rabbit. J Orthop Res, 7: 579-584, 1989.
11.Hutchinson, J: The fate of experimental bone autografts and homografts. Br J Surg, 39: 552, 1952.
12.Kakiuchi, M, y Ono, K: Preparation of bank bone using defatting, freezedrying and sterilisation with ethylene oxide gas. Part II. Clinical evaluation of its efficacy and safety. Int Orthop, 20: 147-152, 1996.
13.Kirkeby, OJ: Revascularisation of bone grafts in rats. J Bone Joint Surg (B), 73: 501-505, 1991.
14.Makley, ST: The use of allografts to reconstruct intercalary defects of long bones. Clin Orthop, 197: 58-75, 1985.
15.Matti, H: Uber freie transplantation von konochenspongiosa. Langenbecks Arch Klin Chir, 168: 236-242, 1936.
16.Maximow, AA: Morphology of the mesenchymal reactions. Arch Pathol, 4: 557-606, 1927.
17.McDowell, F: Kiel bone grafts. Plast Reconstr Surg, 41: 370-371, 1968.
18.Muscolo, DL; Kawai, S, y Ray, RD: Cellular and humoral immune response analysis of bone-allografted rats. J Bone Joint Surg (A), 58: 826-831, 1976.
19.Orell, S: Studien über knochenimplantation und knochen-neubildung, implantation von os purum sowie transplantation von os novum. Acta Chir Scand, 74: 31-36, 1934.
20.Ottolenghi, CE: Massive osteo and osteo-articular bone grafts. Clin Orthop, 87: 156-164, 1972.
21.Parrish, FF: Treatment of bone tumors by total excision and replacement with massive autologous and homologous grafts. J Bone Joint Surg (A), 48:968-990, 1966.
22.Pelker, RR, y Friedlaender, GE: Biomechanical aspects of bone autografts and allografts. Orthop Clin North Am, 18: 235-239, 1989.
23.Segmüller, G: Bone repair and internal fixation. Prog Surg, 5: 155-160, 1966.
24.Urist, MR, y Dawson, E: Intertransverse process fusion with the aid of chemosterilized autolyzed antigen-extracted allogeneic (AAA) bone. Clin Orthop, 154: 97-113, 1981.
25.Urist, MR: Bone: Formation by autoinduction. Science, 150: 893-899, 1965.
26.Urist, MR: Practical applications of basic research on bone graft physiology. AAOS Apr Report No, 25: 1-26, 1976.
27. Wozney, JM; Rosen, V, y Celeste, AJ: Novel regulators of bone formation: Molecular clones and activities. Science, 242: 1528-1534, 1988.