La toma de decisiones en pacientes con metástasis vertebral es de gran complejidad. En ella intervienen distintos factores del paciente, de su enfermedad oncológica y de las opciones de tratamiento. Los esquemas y estrategias de tratamiento se han ido modificando con la propia evolución del conocimiento y tratamiento de la enfermedad oncológica diseminada. En este trabajo se analiza la bibliografía que se ha empleado para la toma de decisiones en las tres últimas décadas, así como la evolución a los esquemas que podríamos considerar contemporáneos.
Decision-making in patients with vertebral metastases is highly complex. Different factors of the patient, their cancer disease and treatment options are involved in it. Treatment schemes and strategies have been modified with the evolution of knowledge and treatment of disseminated oncological disease. This paper analyzes the bibliography that has been used for decision-making in the last three decades, as well as the evolution to the schemes that we could consider contemporary.
Los contextos clínicos por los que el especialista en Cirugía Ortopédica y Traumatología (COT) tiene que tomar decisiones en pacientes con metástasis vertebral (MV) son variables, pero pueden agruparse principalmente en dos.
El primero es la lesión medular con déficit neurológico agudo por una MV, contexto en el que urge tomar una decisión y en el que en ocasiones no se dispone de toda la información clínica relevante, como un estudio de extensión completo o incluso el conocimiento del tumor primario. En este contexto hay que plantear una actuación quirúrgica o recurrir a un tratamiento de radioterapia convencional urgente. No es objetivo de este artículo profundizar en los detalles de las decisiones a tomar en este contexto.
El segundo contexto, más amplio y frecuente, agrupa todas las demás situaciones en las que la decisión puede ser tomada con más tiempo para poder recabar toda la información clínica necesaria. Incluye, entre otros, pacientes con situaciones de compresión medular (CM) sin déficit neurológico y pacientes con fracturas vertebrales patológicas. Puede que en algunos de estos pacientes la MV sea el comienzo de su enfermedad oncológica. El objetivo de este artículo es revisar la bibliografía relevante de la toma de decisiones de este segundo contexto en los últimos 30 años, y la evolución hasta los esquemas contemporáneos.
Durante años las decisiones de tratamiento que se establecían con los algoritmos más difundidos se limitaban a la necesidad o no de tratamiento quirúrgico, y dentro de este a la indicación de una cirugía más o menos agresiva1,2. Estos esquemas tenían un principio de proporcionalidad que se establecía mediante la estimación de la supervivencia teórica del paciente con MV. La evolución del conocimiento y de las opciones de tratamiento de la enfermedad oncológica diseminada ha cambiado el paradigma y los esquemas de manejo del paciente con MV.
Se ha dividido en tres bloques que siguen una secuencia cronológica y que suponen una evolución.
Toma de decisiones basadas en la estimación de la supervivenciaA principios de los años 90 se publicó una de las escalas de supervivencia más difundidas y sobre las que más se ha escrito, la escala de Tokuhashi3. Esta escala analizaba 6 aspectos relevantes del paciente con MV: el estado general del paciente, el número de metástasis óseas, el número de MV, la presencia de metástasis viscerales, el estado neurológico y el tumor primario. Cada uno de estos 6 aspectos era puntuado de 0 a 2, y se proponía una estrategia de tratamiento en función de la puntuación total obtenida (de 0 a 12 puntos), que se espera que estuviese relacionada con la potencial supervivencia del paciente. Solo los pacientes con puntuaciones más altas (9-12 puntos) eran candidatos a las cirugías escisionales (resecciones en bloque). Los pacientes con pronóstico muy comprometido (0-5 puntos) no eran candidatos a cirugía y se tratarían con cuidados paliativos. Los pacientes con puntuaciones intermedias (5-9 puntos) estarían orientados a cirugías poco agresivas.
Esta escala, y la distribución de puntuaciones de cada ítem, se había configurado con una serie retrospectiva de pacientes intervenidos y tratados por sus autores durante los años 80.
A los pocos años de su publicación, otros autores apuntaron la existencia de un contexto clínico no tenido en cuenta correctamente por la escala4. Los pacientes que comenzaban con una MV sin tumor primario conocido tenían peor pronóstico que el categorizado por la escala original de Tokuhashi, que le otorgaba a este contexto una puntuación intermedia en la categoría del tumor primario (1 punto, junto al cáncer de riñón, hígado y útero).
Esta cuestión fue revisada por el grupo de Tokuhashi en la segunda versión de esta escala, publicada en 20051. En esta ocasión se amplió la categoría del tumor primario, pasando de 3 opciones (0-2 puntos) hasta 5 opciones en función del pronóstico (0-5 puntos) e incluyendo el contexto del tumor primario desconocido entre las peores puntuaciones (1 punto) (tabla 1). Esta versión revisada fue evaluada por los propios autores de forma retrospectiva con 246 pacientes, parte incluidos en la serie de la versión original de la escala, y de forma prospectiva en 118 pacientes. La escala proporcionaba una puntuación (0-15 puntos) que orientaba a la supervivencia teórica del paciente, lo que ayudaría a tomar la decisión de tratamiento (fig. 1). Según este trabajo los pacientes con puntuaciones de 0-8 puntos tenían un pronóstico inferior a los 6 meses de vida, los pacientes con puntuaciones altas de 12-15 puntos tenían el pronóstico más elevado, por encima del año. El grupo de puntuaciones intermedias de 9-11 puntos tenían un pronóstico superior a los 6 meses. En el trabajo de la escala revisada se comunican un éxito de predicción del 85% en el grupo de peor pronóstico y un éxito del 95,5% en el grupo de mejor pronóstico. Esta eficacia en la estimación de la supervivencia de la escala revisada de Tokuhashi fue revalidada por los mismos autores en 20095.
Escala revisada de Tokuhashi
| Estado general (escala de Karfnosky) | |
|---|---|
| Pobre (10-40%) | 0 |
| Moderado (50-70%) | 1 |
| Bueno (80-100%) | 2 |
| N.o de metástasis óseas no raquis | |
|---|---|
| ≥3 | 0 |
| 1-2 | 1 |
| 0 | 2 |
| N.o de metástasis vertebrales | |
|---|---|
| ≥3 | 0 |
| 1-2 | 1 |
| 0 | 2 |
| Metástasis viscerales | |
|---|---|
| Irresecables | 0 |
| Resecables | 1 |
| Sin metástasis visceral | 2 |
| Tumor primario | |
|---|---|
| Pulmón, osteosarcoma, estómago, vejiga, esófago, páncreas | 0 |
| Hígado, vesícula biliar, no identificado | 1 |
| Otros | 2 |
| Riñón, útero | 3 |
| Recto | 4 |
| Tiroides, mama, próstata, tumor carcinoide | 5 |
| Lesión neurológica | |
|---|---|
| Completa | 0 |
| Incompleta | 1 |
| Sin déficit | 2 |
Cada uno de los 6 aspectos valorados recibe una puntuación, que sumada permite ponderar la agresividad del tratamiento en función de la supervivencia estimada.
Fuente: Tokuhashi et al.1.
Propuesta de tratamiento del trabajo de Tokuhashi para el paciente con MV1.
En paralelo se había publicado en 2001 una estrategia de manejo de la MV propuesta por Tomita et al.2. El diseño de este instrumento partía del análisis de una cohorte retrospectiva de 67 pacientes tratados por su grupo entre 1987 y 1991 en los que calcularon el riesgo relativo (RR) relacionado con el pronóstico de algunos aspectos que consideraron relevantes, para posteriormente atribuir unas puntuaciones ponderadas al RR. La segunda fase del diseño fue la evaluación en una cohorte prospectiva de 61 pacientes tratados entre 1993 y 1996. El esquema de Tomita únicamente toma en consideración 3 aspectos (tabla 2): el tipo de tumor primario, la presencia de metástasis viscerales y la presencia de metástasis óseas. La propuesta de tratamiento, proporcional a la supervivencia teórica, incluye un espectro de opciones de mayor o menor agresividad y complejidad quirúrgica (tabla 3).
Escala de Tomita
| Puntuación | Tumor primario | Metástasis visceral | Metástasis óseas |
|---|---|---|---|
| 1 | Bajo crecimiento(mama, tiroides…) | Solitaria | |
| 2 | Crecimiento moderado(riñón, útero…) | Resecable | Múltiples |
| 4 | Crecimiento rápido(pulmón, estómago) | Irresecable |
Se valoran tres aspectos, que reciben una puntuación, de manera que una menor puntuación total implica un mejor pronóstico.
Fuente: Tomita et al.2.
Propuesta de tratamiento del trabajo de Tomita
| Puntuación | Supervivencia | Objetivo del tratamiento | Estrategia quirúrgica |
|---|---|---|---|
| 2 | 50 meses | Largo plazo | Cirugía de resección amplia marginal |
| 3 | Control local | ||
| 4 | 25 meses | Medio plazo | Cirugía de resección marginal o intralesional |
| 5 | Control local | ||
| 6 | 15 meses | Corto plazo | Cirugía paliativa |
| 7 | Paliativo | ||
| 8 | <6 meses | Terminal | Soporte médico y analgésico |
| 9 | Paliativo | Cuidados paliativos | |
| 10 |
Se exponen las distintas puntuaciones que se pueden obtener, las supervivencias que se obtuvieron y la propuesta de tratamiento.
Fuente: Tomita et al.2.
En 2005, en el mismo número de Spine en el que se publicaba la escala revisada de Tokuhashi1, el grupo de Boriani hacía un comentario sobre el uso de estas escalas basadas en la supervivencia6. Estos esquemas no consideraban dos cuestiones fundamentales del paciente con MV, que son la presencia de comorbilidades que pueden determinar la evolución y la capacidad de respuesta a otros tratamientos no quirúrgicos, haciendo referencia a la evolución de los tratamientos oncológicos en rápido desarrollo.
Durante años se publicaron diversos trabajos comparando la utilidad o eficacia de estas escalas pronósticas, comparando versiones, distintas escalas e incluso llegando a compararse 7 escalas diferentes7. El grupo germano liderado por Benjamin Ulmar fue uno de los primeros en valorar positivamente la eficacia de las escalas de Tokuhashi y Tomita aplicándolas retrospectivamente a una serie de pacientes tratados en su centro entre 1984 y 20058–10. El trabajo danés publicado por Wang et al. también valoró positivamente la utilidad de la escala revisada de Tokuhashi, aplicada a 448 pacientes quirúrgicos entre 1992 y 200911. Sin embargo, este trabajo, que ponía en valor la escala, comunicaba una eficacia global del 64,7%, sensiblemente inferior a la comunicada por Tokuhashi, y que era menor del 60% en el grupo de peor pronóstico1,5.
Pointillart et al., del grupo de Burdeos, también objetivaron que en su población de 142 pacientes quirúrgicos que el uso de la escala revisada de Tokuhashi no mostraba tanta eficacia en la estimación de la supervivencia como la comunicada por los autores de la misma12. Este grupo explicó en su artículo que su toma de decisiones de la MV está integrada por distintos aspectos, como la sintomatología que tiene el paciente, la inestabilidad mecánica de la MV, o la presencia o no de CM, relegando la escala pronóstica a un papel menos relevante.
En nuestro entorno también se evaluó la eficacia predictiva de la escala revisada de Tokuhashi, obteniéndose datos de menor capacidad pronóstica que la originalmente comunicada por el grupo de Tokuhashi y con peores resultados en las categorías de pronóstico intermedio y de peor pronóstico13.
En 2016 se publicó una revisión de la literatura sobre la eficacia pronóstica de la escala revisada de Tokuhashi14. Este trabajo agrupaba y analizaba las principales series publicadas sobre esta cuestión, incluyendo finalmente 10 trabajos de los cuales se han citado 5 previamente5,9,11–13. Los datos de predicción del trabajo original de Tokuhashi5 son los que ofrecen una mayor eficacia (88% globalmente), seguida por el trabajo de Ulmar et al.9 (71%), teniendo el resto de los trabajos una menor capacidad pronóstica. El análisis estadístico de las 10 series, que agrupan 1686 pacientes, muestra un éxito de predicción global del 63%, a expensas de una mayor capacidad predictiva del grupo de mejor pronóstico (77,21%) y menor de los grupos intermedios (55,32%) y de peor pronóstico (64,10%). Además, destacan la heterogeneidad de las series, con una predominancia de series plenamente quirúrgicas, lo que puede conllevar un sesgo de selección en las características del paciente. Concluyen que existe una evidente pérdida de precisión pronóstica de este instrumento.
Entre los motivos de esta pérdida de eficacia de las escalas pronósticas, el que cobra más peso es el avance en el tratamiento de la enfermedad oncológica diseminada, que ha mejorado la supervivencia de algunos tumores con MV. El cáncer de pulmón tiene la peor puntuación posible en la escala revisada de Tokuhashi (0 puntos en un ítem puntuado de 0 a 5). El grupo alemán de Christian Hessler constató que los pacientes con MV secundaria a un cáncer de pulmón que seguían opciones de tratamiento oncológico actuales tenían una mejor supervivencia que la esperada por la escala revisada de Tokuhashi15. Estos autores alertaban del riesgo de infraestimar la supervivencia y tomar decisiones terapéuticas condicionadas por esta cuestión.
Esta reflexión sobre la infraestimación de la supervivencia fue considerada por otros grupos, que cuestionaban la vigencia de unas escalas pronósticas diseñadas con series de pacientes tratados antes del 2005, que no habían tenido la oportunidad de ser tratados con opciones actuales como la inmunoterapia16.
Además, el mayor conocimiento del comportamiento y variantes de los distintos tumores primarios ha ayudado a conocer que el pronóstico es variable dentro de cada categoría, en función de su biología molecular y sus marcadores, como es el caso del cáncer de mama17.
Pese a la controversia sobre la variabilidad de la eficacia predictiva hay autores que siguen defendiendo el uso de estos instrumentos pronósticos como parte de la toma de decisiones18.
Toma de decisiones basadas en características relevantes de la metástasis vertebral y en las alternativas de tratamientoAdemás de la supervivencia hay otros dos aspectos que han ido cobrando importancia, ambos citados por Pointillart et al., como son la presencia de inestabilidad mecánica y el grado de CM12. La inestabilidad se define como la pérdida de la capacidad de soportar cargas fisiológicas sin deformación y puede estar relacionada con el dolor que padece el paciente con MV o con la compresión neurológica. También puede ser causa de una fractura patológica, ante mínimas cargas o gestos. El instrumento más empleado para valorarla es el Spinal Instability Neoplastic Score (SINS), que ha demostrado una gran utilidad y que consiste en la valoración de 6 aspectos importantes de la MV, algunos de los cuales evaluaremos en pruebas radiológicas como la tomografía computarizada (tabla 4)19,20. Con menos de 6 puntos se establece que la MV es estable, con 13 o más se establece una inestabilidad grave, y de 7-12 puntos es una potencial inestabilidad.
Escala SINS de la inestabilidad mecánica de la MV
| Localización de la lesión en el raquis | |
|---|---|
| En tránsito o charnela (occípito-C2, C7-T2, T11-L1, L5-S1) | 3 |
| Raquis móvil (C3-C6, L2-L4) | 2 |
| Raquis semirrígido (T3-10) | 1 |
| Raquis rígido (S2-S5) | 0 |
| Presencia de dolor con la carga axial o movimiento | |
|---|---|
| Sí | 3 |
| No (ocasional pero no dolor mecánico) | 1 |
| Ningún dolor | 0 |
| Tipo de lesión | |
|---|---|
| Lítica | 2 |
| Mixta (lítica/blástica) | 1 |
| Blástica | 0 |
| Alineación radiológica del raquis | |
|---|---|
| Subluxación o traslación presente | 4 |
| Deformidad de novo (cifosis/escoliosis) | 2 |
| Alineación normal | 0 |
| Colapso del cuerpo vertebral | |
|---|---|
| >50% de colapso | 3 |
| <50% de colapso | 2 |
| Ningún colapso con>50% del soma afectado | 1 |
| Ninguno de los anteriores | 0 |
| Afectación de las estructuras posterolaterales de la columna (pedículo, faceta o articulación costovertebral) | |
|---|---|
| Bilateral | 3 |
| Unilateral | 1 |
| Ninguna afectación | 0 |
De 0-5 puntos se estima estable, 13 o más puntos se considera inestable y 6-12 intermedia.
Fuente: Fisher et al.19.
El grado de CM es otro de los aspectos relevantes para poder tomar una decisión de manejo de la MV12. La escala de Bilsky describe el grado de CM y ha demostrado ser de gran utilidad (fig. 2)21,22.
Clasificación de Bilsky de la compresión medular21. La compresión neurológica puede describirse como leve (grado 0 y 1) o grave (grado 2 y 3). El grado 0 es una MV intraósea, contenida en el cuerpo vertebral. En el grado 1 no llega a deformarse el cordón medular, dividido a su vez en tres categorías, en la 1a existe un contacto de la MV con la duramadre, en la 1b hay un contacto asociado a deformación del contorno de la duramadre y en la 1c hay una deformación y colapso del espacio subaracnoideo, no siendo visible líquido cefalorraquídeo (LCR) en el lugar de la compresión. En el grado 2 se observa una compresión y deformación del cordón medular, pero todavía es visible LCR en algunas zonas no comprimidas. En el grado 3 el cordón se encuentra comprimido, desplazado y ya no se observa LCR en el espacio subaracnoideo.
La irrupción de nuevas alternativas de tratamiento ha ampliado el abanico de opciones para manejar la MV. La radioterapia convencional (RT) estaba condicionada o limitada por la radiación que se administraba a las estructuras adyacentes a la vértebra, como la médula espinal, y por la existencia de algunos tumores con resistencia al efecto de la radiación (clásicamente el cáncer renal, de tiroides, el carcinoma hepatocelular, el de colon, el de pulmón no-células pequeñas, los sarcomas y melanomas). Sin embargo, la aparición de la radioterapia esterotáxica extracraneal o SBRT (Stereotactic Body Radiation Therapy) ha cambiado este paradigma23. Entre sus potenciales ventajas se encuentra que la SBRT permite irradiar con más dosis que la RT, hasta dosis ablativa y con una precisión submilimétrica, lo que permite minimizar la irradiación de tejidos circundantes a la MV. Permite un mejor control local que la RT, y tiene más eficacia en aquellos tumores clásicamente resistentes a la RT. El espacio epidural puede ser causa de recurrencia local si está invadido de tumor, por lo que si hay invasión epidural (como CM tipo Bilsky 2-3) la SBRT debe estar precedida de un procedimiento quirúrgico orientado a la realización de una limpieza del espacio epidural suficiente. Esta cirugía es la denominada cirugía de separación24, que consiste en generar una cavidad ventral y segura al saco dural, con descompresión suficiente entre la MV y el saco dural, con un espacio circunferencial libre de unos 2-3mm. Se acompaña de una estabilización, en ocasiones percutánea. La cirugía de separación sumada a las nuevas técnicas de radioterapia ha conseguido buenos datos de control local y bajas tasas de recurrencia, con mejoría de la calidad de vida de los pacientes y sin tenerlos que someter a las cirugías demasiado agresivas.
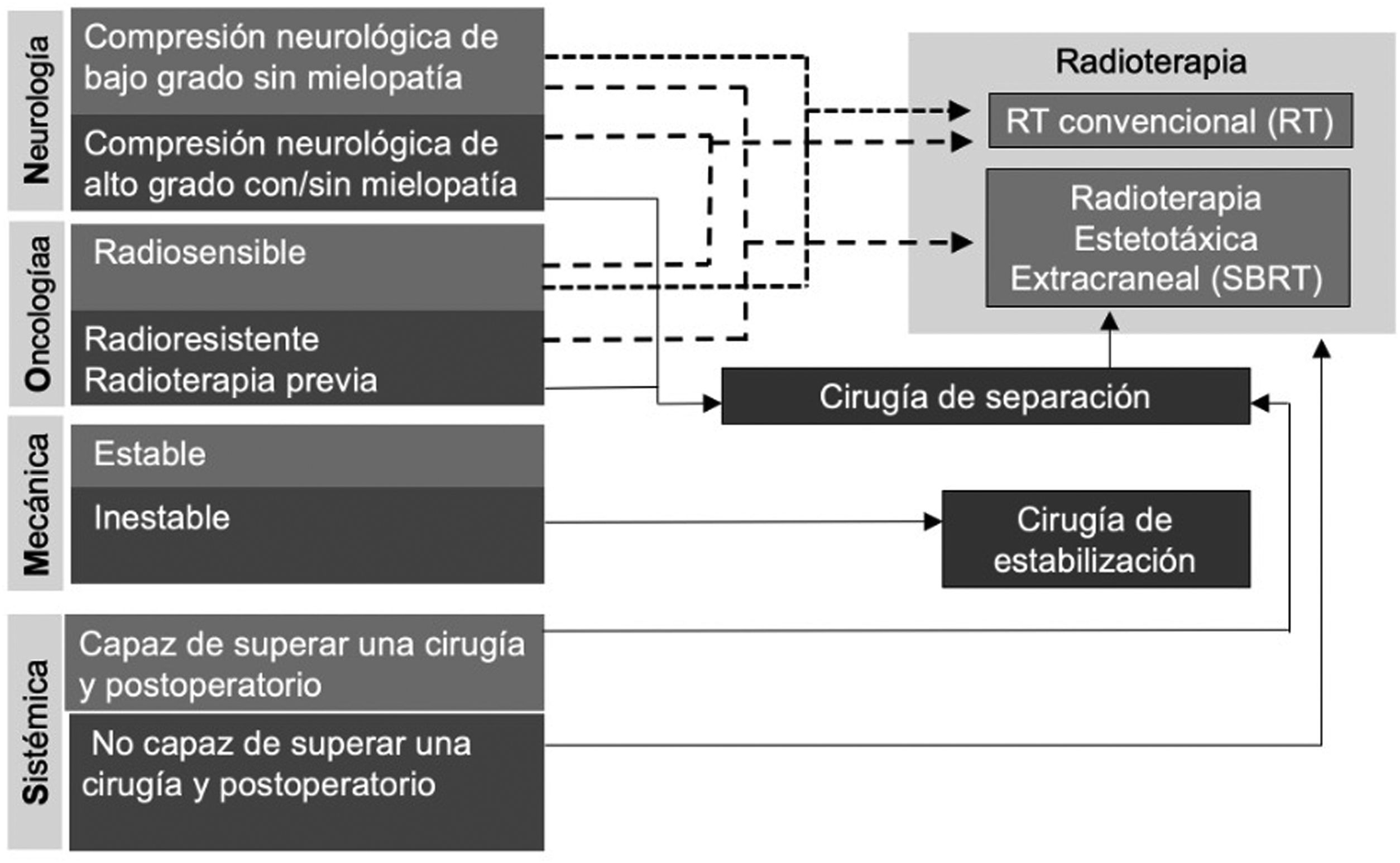
Estos avances en el conocimiento y la mayor disponibilidad de opciones terapéuticas, no solo de manejo quirúrgico, han generado que la toma de decisiones se haya ido abriendo a más variables que no sean exclusivamente la esperanza de vida teórica tras el diagnóstico de la MV. Se han ido publicando distintos algoritmos multidisciplinares para la toma de decisiones en la MV25,26. Uno de los más difundidos en la actualidad es el denominado NOMS, acrónimo de Neurología, Oncología, Mecánica y Sistémica (fig. 3)27. En este esquema el primer aspecto que debe ser valorado es el neurológico (N), y diferencia entre CM de bajo grado (Bilsky 0-1c) y de alto grado (Bilsky 2-3). El siguiente paso es valorar el aspecto oncológico (O), en el que se evalúa la radiosensibilidad de la lesión a la radioterapia convencional. Las MV de tumores clásicamente radiosensibles se beneficiarán del inicio de tratamiento con RT convencional. Las MV de los radiorresistentes con una compresión (Bilsky 0-1c) se beneficiarán de SBRT. Las MV de tumores radiorresistentes con compresiones importantes (Bilsky 2-3) se beneficiarán de una cirugía de separación junto con SBRT posterior a la cirugía. El tercer apartado o paso, la mecánica (M), valora la presencia de inestabilidad (SINS>12), que es una indicación de tratamiento quirúrgico, tenga o no compresión neurológica. Los contextos intermedios de inestabilidad (SINS 7-12) deben tomarse en consideración individualmente, dependiendo del resto del algoritmo. En el último apartado, el sistémico (S), se pondera el estado general del paciente y la capacidad de superar los tratamientos previamente citados, con ayuda de un especialista no quirúrgico (oncología médica o medicina interna).
Algoritmo NOMS para la toma de decisiones del paciente con MV27.
Otros algoritmos han incluido más opciones terapéuticas que las presentadas en el NOMS, como las ablaciones percutáneas y las cementaciones, y han tenido en cuenta otros escenarios clínicos. El esquema de toma de decisiones descrito por The Metastatic Spine Disease Multidisciplinary Working Group considera 5 escenarios clínicos habituales de la MV, dependiendo de la aparición o no de fracturas patológicas y ofrece distintas opciones de manejo actuales y los grados de recomendación de la evidencia científica (fig. 4)28.
Escenarios clínicos y opciones de tratamiento propuestas por el grupo internacional The Metastatic Spine Disease Multidisciplinary Working Group, con el grado de recomendación de la evidencia científica entre paréntesis28.
Desde hace años es habitual la existencia de comités de tumores en los centros hospitalarios. Estos comités nacieron para poder tener una visión global y una perspectiva multidisciplinar de una patología compleja, y además ofrecer a los pacientes respuestas colegiadas, consensuadas entre distintas especialidades.
La participación de las distintas especialidades permite individualizar y optimizar el tratamiento de los pacientes con MV29–31. Independientemente de la existencia de nuevos protocolos o algoritmos de toma de decisiones, existe una tendencia a que esta sea tomada en comité y con una perspectiva claramente multidisciplinar.
Esta práctica es muy dependiente de las características del centro, de sus recursos y de la cultura de toma conjunta de decisiones. Tiene como principal inconveniente la dificultad para recurrir al comité en contextos de urgencia, pero puede ser de gran utilidad para el resto de los contextos clínicos. La experiencia de centros de nuestro entorno es alentadora y nos demuestra que un enfoque multidisciplinar, en equipo y de forma conjunta, es probablemente el más enriquecedor y adecuado para una patología de gran complejidad, en la que las decisiones muchas veces deben ser individualizadas para cada paciente31.
DiscusiónLos recursos para tomar decisiones en MV han cambiado, como ha cambiado el modo de enfocar el tratamiento del cáncer: hacia la individualización y la personalización.
Los primeros instrumentos estaban basados exclusivamente en la potencial esperanza de vida del paciente, sin tener en cuenta aspectos que hoy nos parecen importantes1,2,7. El análisis de aquellos trabajos originales muestra series heterogéneas, retrospectivas y de tratamientos que hoy podríamos considerar obsoletos, un contexto diferente al actual. Es indudable que el concepto de proporcionalidad es fundamental para optimizar el manejo del paciente con MV, pero esa proporcionalidad debe construirse con más aspectos que la supervivencia. No debe olvidarse que la MV es una enfermedad oncológica diseminada, y lo que determinará fundamentalmente la supervivencia del paciente son las opciones de control de la enfermedad, habitualmente mediante tratamientos médicos con quimioterapia y/o inmunoterapia.
Además, la literatura nos muestra que la eficacia en el pronóstico ha ido disminuyendo con resultados variables e incluso pobres en algunas series12–14. Los motivos de estos resultados dispares son múltiples, siendo los más probables el mejor tratamiento de los pacientes en las series más tardías y la heterogeneidad entre series quirúrgicas o de manejo conservador. A la luz de los resultados de estas series y como recordaba Boriani, el mayor inconveniente que tienen es la no consideración de opciones alternativas de tratamiento5. En los últimos años han aparecido nuevas alternativas, que vienen a enriquecer el arsenal pero que dificultan proporcionar una receta única a las MV. La aparición de la cirugía de separación combinada con la SBRT se ha convertido en una poderosa herramienta, que permite un buen control local pero además desde la perspectiva puramente quirúrgica tiene la bondad de ser una cirugía reproductible, que se puede llegar a realizar en multitud de centros hospitalarios24. La realización de vertebrectomías o grandes reconstrucciones no está siempre al alcance de todos los cirujanos ni centros hospitalarios, pero la realización de una cirugía de separación sí aparenta ser un objetivo más universalizable.
La irrupción de procedimientos mínimamente invasivos como las ablaciones tiene especial interés en el paciente con enfermedad oligometastásica y además es combinable con la cementación percutánea, procedimientos que pueden ser ambulatorios28. Cabe reflexionar sobre cuántos pacientes de las series originales de las escalas podrían haberse beneficiado hoy de estas opciones, en vez de cirugías de cierta agresividad, con sus connotaciones de morbilidad asociada. Es indudable que estas opciones deben estar en nuestro árbol de decisiones.
Los protocolos NOMS y el descrito por The Metastatic Spine Disease Multidisciplinary Working Group enriquecen la toma de decisiones con aspectos que se han ido volviendo cada vez más relevantes27,28. El paso del tiempo y su evaluación nos dirá cómo de eficaces son para mejorar el control local y la calidad de vida de los pacientes con MV. La integración de estos protocolos en comités de expertos para la ayuda de toma de decisiones consensuadas y colegiadas parece la evolución natural que ha tomado esta cuestión. Sin embargo, todos estos aspectos a tener en cuenta requieren de tiempo, en el que recabar la información y procesarla en el comité. Por ello están principalmente orientados al paciente no urgente.
Bien distinta es la situación del paciente urgente, con una MV y una lesión medular con déficit neurológico agudo. En este contexto la variable «tiempo» es importante, casi tanto como la variable «recursos disponibles», entre los que pueden enumerarse varios, como la disponibilidad de pruebas diagnósticas urgentes como la RM, disponibilidad de equipo quirúrgico competente, la posibilidad de traslado de centro si precisa o especialistas a los que consultar. Este contexto se maneja de modo distinto dependiendo de los centros de nuestro entorno, la red sanitaria a la que pertenecen, o la existencia de equipos quirúrgicos de raquis de guardia. Y es importante recordar que ningún protocolo incluye los distintos escenarios que se pueden plantear relacionados con los recursos, por dicho motivo esta revisión de la bibliografía se ha centrado en el contexto más homogéneo, que puede que sea el paciente con MV no urgente.
En ese contexto sin urgencia, en el que se disponga de cierto margen de tiempo para recabar toda la información clínica necesaria, la toma de decisiones no puede basarse exclusivamente en las escalas de supervivencia clásicas, ya que han perdido vigencia para realizar un manejo de la MV en el contexto de la oncología médica y radioterápica actual.
Nivel de evidenciaNivel de evidencia IV.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.