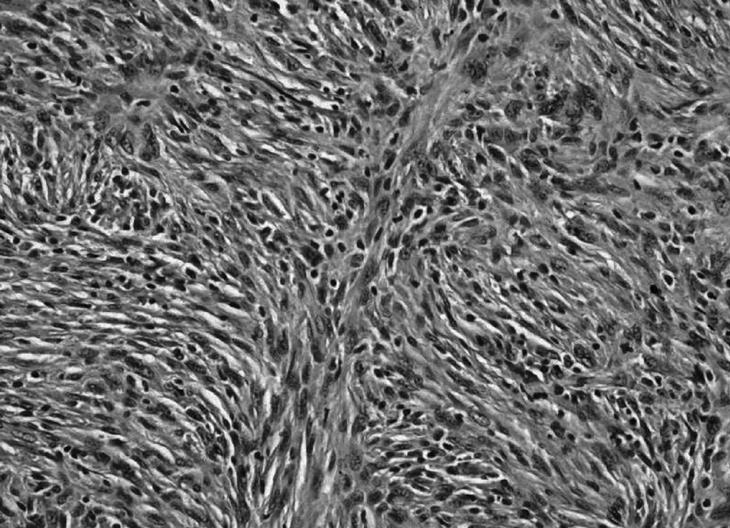
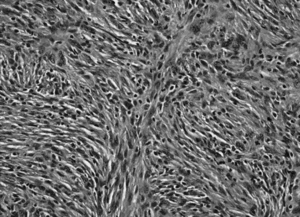
El histiocitoma fibroso maligno es en nuestro medio el segundo sarcoma de partes blandas más frecuente del sistema musculoesquelético después del liposarcoma. Procede de las células mesenquimales pluripotenciales capaces de diferenciarse hacia histiocitos, fibroblastos y miofibroblastos que encontramos en el tejido conectivo (fig. 1). Desde su descripción, en 1964 por O'Brien et al1, se ha considerado como una entidad clinicopatológica diferenciada del resto de los sarcomas de partes blandas. Sin embargo, no existe un criterio unánime en lo que a tratamiento y factores pronósticos se refiere. En los últimos 10 años los protocolos de tratamiento, que empezaron asociando la excisión a la radioterapia postoperatoria, han variado y, actualmente, la quimioterapia parece necesaria en cualquier protocolo terapéutico, aunque no todos los autores comparten su utilidad.
Figura 1. Histiocitoma fibroso maligno pleomórfico estoriforme. Tinción H-Ex 400.
Los factores que influyen en el pronóstico de la enfermedad son controvertidos. En la literatura hemos recogido los siguientes factores pronósticos preoperatorios2-4: grado histológico, grado de extensión, tamaño, localización, sexo, profundidad y edad. Por otra parte, como indicadores de recurrencia postoperatoria se han reconocido el tipo de cirugía realizada, los márgenes quirúrgicos y la terapia adyuvante asociada. No todos los autores coinciden en los mismos parámetros predictivos de la evolución.
Nuestro objetivo es analizar los resultados globales hallados en la casuística de nuestra institución, comparar las distintas pautas de tratamiento empleadas y valorar qué factores se asociaron al pronóstico de la enfermedad.
MATERIAL Y MÉTODO
Se realizó un estudio retrospectivo sobre 79 pacientes, 45 mujeres y 34 hombres con una edad media de 62 años (rango: 20-85), con diagnóstico histológico de histiocitoma fibroso maligno de partes blandas (fig. 1) intervenidos en nuestra unidad entre 1991 y 2001. Se realizó un seguimiento medio de 60 meses (rango: 12-119). Fallecieron 9 casos (13%) y 2 se perdieron (3%). En la primera consulta hemos clasificado los tumores como primarios, recidiva y metastásicos. En nuestro estudio hemos incluido únicamente los primarios excluyendo excisiones previas incompletas, o completas sin confirmación anatomopatológica de los márgenes que se nos habían remitido de otros centros. Los pacientes fueron valorados de forma protocolizada mediante historia clínica, exploración física, análisis bioquímico, estudio local (radiográfico, resonancia magnética nuclear [RMN] y biopsia tru-cut) y de extensión (radiografía de tórax, tomografía axial computarizada [TAC] torácica y gammagrafía ósea con Tc). Los controles clínicos y por técnicas de imagen se realizaron trimestralmente los dos primeros años, semestralmente del segundo al quinto año y anuales posteriormente.
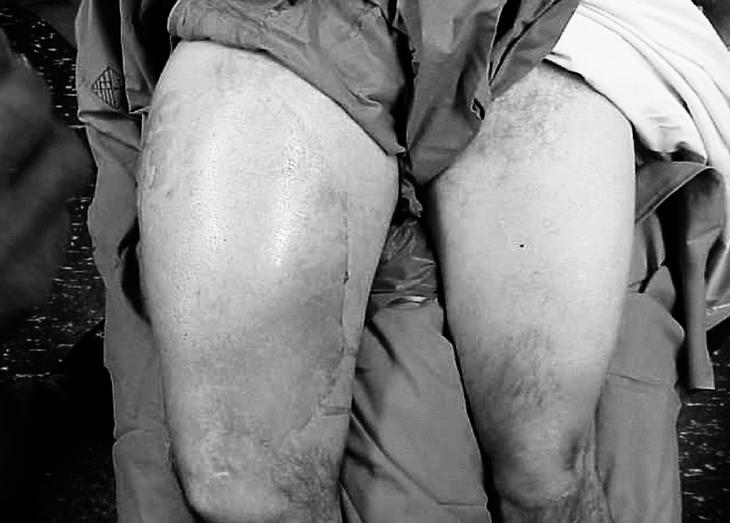
La distribución anatómica fue: muslo (figs. 2 y 3) en un 50%, siendo la localización más frecuente la pierna y el pie (19,2%), miembro superior (14,1%), región glútea (6,4%) y otros (9%). Según el grado de malignidad histológica, el 92% fueron clasificados de alto grado frente a un 8% de bajo grado correspondientes a la variante histológica angiomatoide. El estadiaje de Enneking5 que agrupa los conceptos de grado histológico y extensión tumoral distribuye nuestra serie como sigue: IA: 8%, IIA: 54% y IIB: 38%.
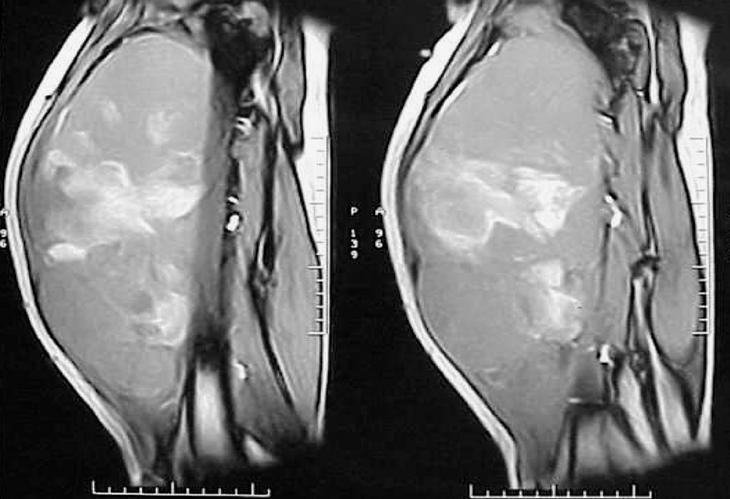
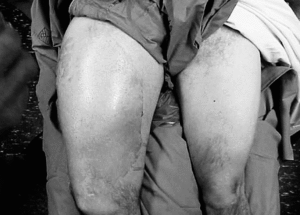
Figura 2. Imagen clínica de histiocitoma fibroso maligno en muslo.
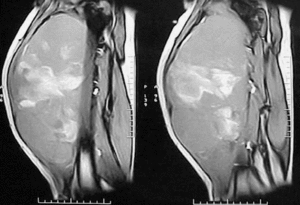
Figura 3. Resonancia magnética nuclear. Corte sagital del paciente de la figura 2.
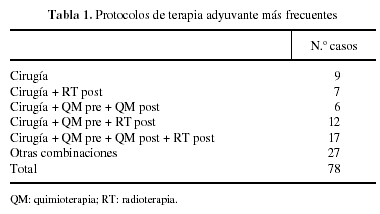
El tipo de resección realizada fue marginal (13%), amplia (55%), compartimental (12%), amputación (11%) y desarticulación (9%). La anestesia general se utilizó en un 76% de los casos y todos los pacientes recibieron profilaxis antibiótica y antitrombótica. Los protocolos de terapia adyuvante a la cirugía han variado a lo largo de estos últimos 10 años, y en la tabla 1 mostramos los utilizados con mayor frecuencia.
Los agentes quimioterápicos empleados fueron adriamicina, ifosfamida, cisplatino, vincristina y epirrubicina. Los protocolos de administración fueron variables, el número de ciclos y el fármaco/s utilizados no siguió un patrón uniforme.
Cuando se empleó radioterapia fueron utilizadas sesiones de 350 cGy hasta conseguir una dosis total entre 3.500 y 5.500 cGy dependiendo del tamaño y contaminación de los márgenes.
Tras la obtención y clasificación de los datos descriptivos se estudió la tasa de recidiva tanto local como a distancia, así como las complicaciones per y postoperatorias. Analizamos la supervivencia global (SG) y supervivencia libre de enfermedad (SLE) de nuestra serie a través del método Kaplan-Meier, y estudiamos la posible relación entre la SLE y las variables preoperatorias: edad, sexo, localización anatómica y estadio con la prueba de log rank. Asimismo correlacionamos la SLE entre los distintos protocolos de tratamiento en busca de diferencias significativas.
RESULTADOS
Hallamos 19 casos de recidiva local (24%), 4 casos a distancia (5%) y otros 4 de recidiva local y a distancia conjuntamente (5%). De los 8 casos con metástasis (10%), 7 fueron pulmonares y un caso extrapulmonar (cerebral).
Entre las complicaciones peroperatorias destacaron 5 casos (6%) de neurapraxia de grandes troncos, dos desarrollaron paresia residual y 8 casos (10%) de dislaceración arteriovenosa que fueron reparadas intraoperatoriamente.
De las complicaciones postoperatorias la anemia por sangrado fue la más frecuente requiriéndose transfusión sanguínea en el 50% de los postoperatorios. La ulceración cutánea tuvo lugar en 5 casos (6%) y se contabilizaron dos pacientes con infección de la herida (3%).
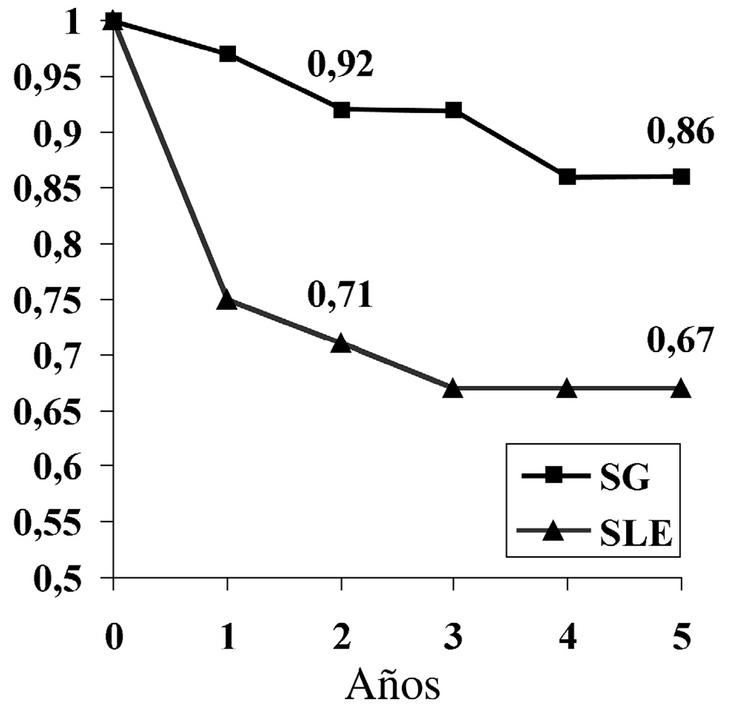
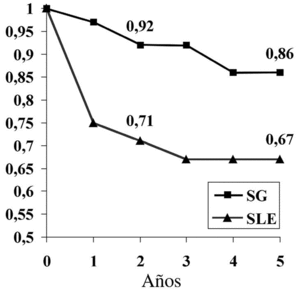
El análisis de supervivencia mostró una SG a los dos y 5 años del 92% y 86% respectivamente, mientras que la SLE a los 2 y 5 años fue del 71% y 67% respectivamente (fig. 4), lo que demuestra una supervivencia con enfermedad a los 2 y 5 años del 21% y 19% respectivamente.
Figura 4. Supervivencia global (SG) y libre de enfermedad (SLE) de nuestro estudio.
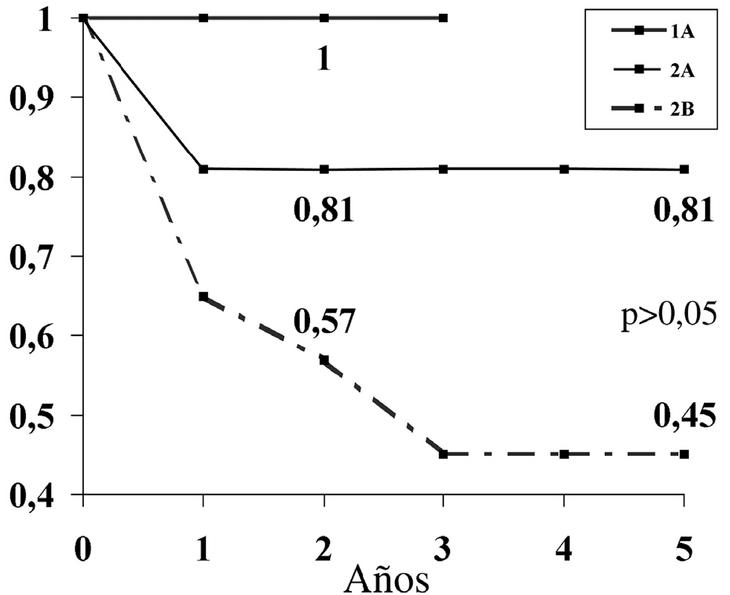
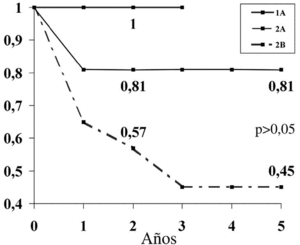
La edad mostró una supervivencia mayor para el grupo de mayores de 60 años. Nuestra serie muestra una similitud de ambos sexos a los 5 años. La localización con una SLE mas baja a 5 años (60%) ha sido la región glútea. Estas diferencias de SLE observadas en los grupos de edad, sexo y localización no han sido estadísticamente significativas (p > 0,05). Por el contrario, el estadio ha demostrado una relación estadísticamente significativa (p < 0,05) (fig. 5) obteniéndose una SLE a los 5 años del 100% para el estadio IA, frente al 45% a los 5 años para el IIB.
Figura 5. Supervivencia libre de enfermedad (SLE) y estadio de Enneking de nuestro estudio.
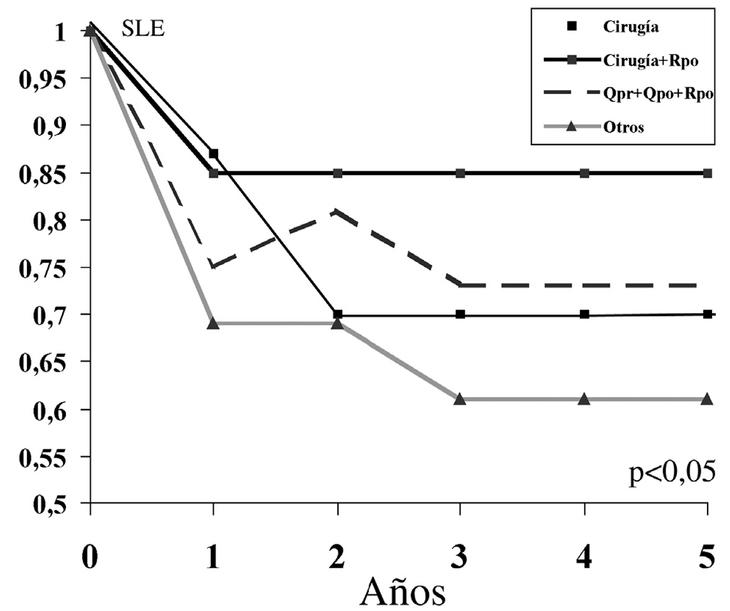
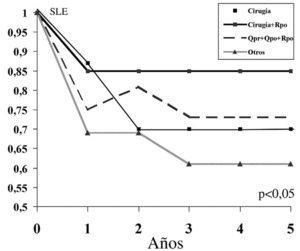
Encontramos la mayor SLE a 5 años en el grupo que asoció únicamente cirugía y radioterapia postoperatoria (SLE: 85%) (fig. 6) seguido del grupo que asociaba cirugía con quimioterapia preoperatoria y postoperatoria y radioterapia postoperatoria (SLE: 72%) aunque las diferencias no fueron significativas.
Figura 6. Supervivencia libre de enfermedad (SLE) y tratamiento adyuvante. Rpo: radioterapia postoperatoria; Qpr: quimioterapia preoperatoria; Qpo: quimioterapia postoperatoria.
DISCUSION
Nuestra serie presenta una gran homogeneidad en cuanto a estadio de malignidad, ya que fueron excluidos todos aquellos pacientes con un estudio de extensión positivo o con una recidiva local. Todos fueron tumores primarios y localizados. Cuando el estudio diagnóstico fue iniciado por nosotros, se realizó siempre la biopsia a través de tru-cut. Creemos que esta técnica obtiene el mayor rendimiento diagnóstico estando exenta de grandes riesgos, siendo de elección en tumores de partes blandas6.
El tipo de cirugía realizada, sabiendo que la enfermedad se encontraba localizada, ha intentado siempre preservar la extremidad salvo aquellos casos cuya localización lo impedía. La extensión de la resección ha pretendido ser amplia, con al menos 2 cm de bordes libres de tumor cuando las estructuras nobles lo permitían.
Los datos descriptivos como tamaño del grupo, edad y localización son similares a los obtenidos por otros estudios7,8, sin embargo hemos encontrado una mayor predilección del tumor por el sexo femenino, algo que es habitualmente inusual.
La evaluación de nuestros resultados debe realizarse con suma cautela, comparándose únicamente con aquellas series que incluyen tumores primarios, localizados, de extremidades y tronco (no retroperitoneales) y únicamente de partes blandas. Trabajos como los de Pritchard et al9 en los que se incluyen estadios III de Enneking o Barrios et al10 donde se introducen tumores óseos, o Kearney et al8 donde se incluyen tumores retroperitoneales deben ser interpretados teniendo en cuenta estas premisas.
Gibbs et al11 han publicado recientemente sus resultados sobre una serie de 126 pacientes con 4 años de seguimiento medio. El 95% eran locales en el momento del diagnóstico, sin embargo el 79% implicaban al retroperitoneo por lo que obtuvieron unas tasas de recidiva local, a distancia y combinada del 23%, 21% y 15% respectivamente, lo que significó unas tasas de supervivencia bajas (SG: 60% y SLE: 41% a 5 años). Belal et al12 en su estudio retrospectivo sobre 109 pacientes obtienen una SG del 50% y una SLE del 39% a los 5 años, justificadas por una recidiva local del 22% y 32% a distancia. Quizá la elevada tasa de márgenes positivos (37%) de la pieza resecada fue el factor determinante en la consecución de aquellos resultados.
El estadio de Enneking5 que reúne los conceptos de grado histológico y extensión ha sido el único parámetro estadísticamente predictivo de la evolución de la enfermedad en nuestra serie, no siendo así para el resto de los factores estudiados. Coincidimos por tanto con Barrios et al10 y Gibbs et al11, en el valor pronóstico que el grado histológico y la extensión tienen sobre la enfermedad.
Shinozaki et al2 estudian el grado de influencia de algunos factores con la recidiva local, metástasis y muerte a causa de la enfermedad. Encuentran que para la recurrencia local son la histología, la profundidad del tumor, el método quirúrgico y el sexo los factores de peor pronóstico, de tal forma que tumores de alto grado, de localización profunda intervenidos con cirugías marginales y en mujeres mostraban una alta probabilidad de recidiva. Las metástasis en los primeros 6 meses fue el parámetro más determinante en el pronóstico global de la enfermedad.
Creemos que los tipos de cirugía empleada son incomparables salvo que se cometa un sesgo de selección, ya que el tipo de cirugía realizada depende del estadio del tumor. Nuestro protocolo habitualmente implica cirugía amplia sobre estadios IIA y amputación sobre estadios IIB. Es obvio lo incorrecto de la comparación entre cirugía amplia y radical en este caso.
El manejo del histiocitoma fibroso maligno (HFM) es multidisciplinario y son numerosos los trabajos que avalan la utilidad de la radioterapia y la quimioterapia10,12,13. Nosotros realizamos en los últimos tres años un protocolo de quimioterapia neoadyuvante y coadyuvante con ifosfamida y adriamicina asociado a radioterapia (3.500-5.500 cGy) postoperatoria. Sin embargo, no hemos conseguido mejorar la SLE de estos pacientes en comparación con la de aquellos que recibían solamente cirugía y radioterapia postoperatoria (fig. 6). En nuestra experiencia la radioterapia ha resultado ser la mejor aliada de la cirugía frente al HFM localizado.
Algunos autores como Hiz et al13 alaban los beneficios de la quimioterapia afirmando que ayuda a madurar la pseudocápsula de la masa favoreciendo una mejor delimitación del tumor. Otros trabajos2,11 no encuentran beneficios en el empleo de radio o quimioterapia adyuvante. Compartimos con Belal et al12 que la mejor opción terapéutica frente al HFM es una resección amplia, con márgenes libres, seguida de radioterapia postoperatoria. Según nuestro criterio, la quimioterapia permanece todavía en investigación, a la espera de que nuevos trabajos prospectivos avalen la utilidad de su aplicación.
AGRADECIMIENTOS
Agradecemos la colaboración del Dr. I. Gich (Servicio de Epidemiología) y L. Martínez (Departamento de Archivo y Documentación) por su inestimable ayuda en el planteamiento y desarrollo del estudio. A la Dra. S. Bagué (Servicio de Anatomía Patológica) y a los Dres. J. Palmer y J. Llauger (Servicio de Radiodiagnóstico) por su permanente colaboración con el Comité Diagnóstico de nuestra Unidad de Cirugía Ortopédica Oncológica.
Conflicto de intereses. Los autores no hemos recibido ayuda económica alguna para la realización de este trabajo. Tampoco hemos firmado ningún acuerdo por el que vayamos a recibir beneficios u honorarios por parte de alguna entidad comercial. Por otra parte, ninguna entidad comercial ha pagado ni pagará a fundaciones, instituciones educativas u otras organizaciones sin ánimo de lucro a las que estemos afiliados.