INVESTIGACIÓN
Influencia de un hidrogel en la cicatrización del tendón. Estudio experimental con P(HEMA)
Influence of a hydrogel on tendon healing. Experimental study with P(HEMA)
PLASENCIA ARRIBA, M. A.*; SAN ROMÁN, J.**; LÓPEZ ALONSO, A.***; LÓPEZ BRAVO, A.****, y JÁTIVA SILVESTRE, F.*
Servicio de Traumatología y Cirugía Ortopédica. Hospital Universitario Príncipe de Asturias. Alcalá de Henares. Madrid.
* Hospital Príncipe de Asturias. Alcalá de Henares. Madrid. ** Instituto de Ciencia y Tecnología de Polímeros. Madrid.
*** Facultad de Medicina. Universidad de Alcalá de Henares. Madrid. **** Hospital Provincial de Ávila.
Correspondencia:
Dr. M. A. PLASENCIA ARRIBA.
Vicente Aleixandre, 10.
28022 Majadahonda (Madrid).
Recibido: Mayo de 1999.
Aceptado: Septiembre de 1999.
RESUMEN: Objetivo: Un hidrogel preparado por la polimerización del monómero metacrilato de 2-hidroxietilo P(HEMA) fue administrado localmente al tendón de Aquiles del conejo parcialmente seccionado con el objeto de evaluar su influencia y compatibilidad en el proceso de cicatrización.
Diseño experimental: Se estudiaron un total de 40 tendones distribuidos de forma uniforme en dos grupos, control y experimental, a los cuales se aplicó el hidrogel. Los animales fueron sacrificados a los 3, 7, 14 y 28 días para llevar a cabo una evaluación histológica. Después de 28 días de la lesión los especímenes fueron también estudiados con microscopio electrónico y se realizó un análisis biomecánico con objeto de determinar la fuerza necesaria para el fracaso de la cicatriz.
Resultados: Se ha constatado una ausencia de reacción tisular adversa al hidrogel, una limitada presencia de adherencias peritendinosas, así como una uniforme proliferación fibroblástica en los tendones tratados con el hidrogel. A nivel ultraestructural se observó la presencia de colágeno intracelular, fenómeno asociado con una síntesis acelerada de fibra colágena. El análisis biomecánico no logró establecer diferencias estadísticas con el grupo control.
Conclusiones: El hidrogel aplicado a un tendón puede prevenir la formación de adherencias peritendinosas y constituir un vehículo apropiado para la administración local de agentes farmacológicos que faciliten la reparación del tendón sin interferir con su cicatrización.
PALABRAS CLAVE: Tendón. Cicatrización. Hidrogel. HEMA.
ABSTRACT: Objective: A hydrogel prepared by polymerization of the 2-hydroxyethyl metacrylate monomer P(HEMA) was administered locally to the partially sectioned Achilles tendon of rabbits to evaluate its effect on the healing process.
Experimental design: A total of 40 tendons were distributed into two groups of 20, control and experimental, to which the hydrogel was applied. Animals were killed at 3, 7, 14 and 28 days for histological study. Twenty-eight days after injury, specimens were studied by electron microscopy and a biomechanical analysis was made to determine the force required to disrupt the healed tendon.
Results: No adverse tissue reaction to the hydrogel was observed. Peritendinous adhesion was limited and fibroblastic proliferation was uniform in tendons treated with hydrogel. Ultrastructurally, intracellular collagen was observed, a phenomenon associated with accelerated collagen-fiber synthesis. Biomechanical analysis showed no statistical differences between the experimental and control groups.
Conclusions: Hydrogel applied to a tendon may help to prevent the formation of peritendinous adhesions and could be an appropriate vehicle for local administration of pharmacological agents that facilitate tendon repair without interfering with healing.
KEY WORDS: Tendon. Healing. Hydrogel. HEMA.
La cicatrización del tendón se hace en condiciones de escaso aporte vascular y de necesidad de producir gran cantidad de colágeno. Por ello después de cualquier reparación o injerto tendinoso es imprescindible la inmovilización prolongada durante al menos 6 u 8 semanas.6 Sin embargo, la inmovilización produce importantes complicaciones como la atrofia muscular o la rígidez articular, dando lugar a una lenta recuperación, incluso a una severa limitación funcional para el paciente.
Con el objeto de aumentar la resistencia mecánica de la reparación, acelerar el proceso de cicatrización y limitar la excesiva formación de adherencias con los tejidos que le rodean, la investigación biomédica ha evaluado la influencia de distintos factores en la reparación del tendón. Entre ellos cabe destacar la movilización precoz,18 la aplicación local de corriente eléctrica,20 de ultrasonido10 y de ondas de choque.24 También ha sido analizado el efecto de ciertos fármacos sobre la reparación tendinosa; así, antinflamatorios no esteroideos,25 corticoides,11 esteroides anabolizantes,16 vitaminas,9 heparina27 y ácido hialurónico,14 o de agentes adhesivos como la fibrina13 y los cianoacrilatos.2,26 De todos ellos sólo la movilización pasiva ha demostrado que facilita la reparación intrínseca del tendón flexor en localización intrasinovial a partir de las células epitendinosas y disminuye la formación de adherencias.7,8 La disparidad de resultados existente entre los distin-tos autores y la posible interferencia en la reparación tendinosa hace que el resto de los agentes no hayan demostrado de forma concluyente su eficacia, por lo cual la inmovilización continúa siendo necesaria.
El hidrogel es una clase de polímero sintético que tienen la capacidad de hincharse en presencia de agua. La estructura química del hidrogel está constituida por una red tridimensional unida por enlaces covalentes, lo que permite la transferencia de solutos de bajo peso molecular, dotándole así de una característica permeabilidad. La preparación de geles hidrofílicos se realiza a partir de monómeros acrílicos mediante un proceso químico de polimerización. El monómero base más utilizado es el metacrilato de 2-hidroxietilo (HEMA). Además, el hidrogel puede emplearse como vehículo para la dosificación local de fármacos atrapados en su interior.17 Estudios previos realizados en cultivos celulares de fibroblastos,21 condrocitos23 y neuronas3 han demostrado la capacidad del hidrogel basado en el (HEMA) de favorecer el crecimiento celular y la organización del tejido. Esta propiedad de que un tejido natural crezca en el interior de la matriz de un hidrogel lo hace muy atractivo desde el punto de vista biomédico.
Ante la necesaria búsqueda de agentes y materiales que favorezcan la reparación del tendón y acorten el período de inmovilización se intentó evaluar desde un punto de vista histológico, ultraestructural y biomecánico la compatibilidad en el tejido tendinoso del hidrogel basado en el P(HEMA) y su posible influencia en el proceso de cicatrización.
Material y Método
Diseño experimental
Se utilizaron un total de 40 conejos machos de la raza Nueva Zelanda con un peso aproximado de 3 kg. Éstos se distribuyeron en dos grupos: control (n = 20) y experimental (n = 20), en el cual se aplicó el hidrogel. Tres tendones de cada grupo fueron evaluados a nivel histológico a los 3, 7, 14 y 28 días de la lesión. Ocho animales más de cada grupo se sacrificaron trascurridos 28 días y se destinaron dos al estudio con el microscopio electrónico de transmisión y seis al análisis biomecánico.
Preparación del hidrogel
El polímero hidrofílico se obtuvo por un proceso de polimerización mediante reacción de radical libre al mezclar el correspondiente monómero (HEMA) en una solución de N-N dimetilformamida (DMF) (Mon = 1 mol/l), usando azobisisobutironitrilo (AIBN) como iniciador [(I) = 1,5 * 102 mol/l]. La polimerización se realizó durante 5 horas, a alto vacío y temperatura de 50° C. El polímero fue aislado por la precipitación del medio de reacción en una mezcla de dietiléter-hexano (4:1, v/v) a baja temperatura. La muestra precipitada fue secada a temperatura ambiente y presión reducida hasta peso constante. Se preparó una película trasparente de 0,5 mm de grosor por lenta evaporación de una solución que contenía 0,3 g de muestra de polímero en 2 ml de DMF, secándose a continuación a presión reducida. La película así obtenida fue el producto aplicado en nuestro estudio. El producto fue esterilizado por exposición durante 2 horas a irradiación germicida ultravioleta y almacenado en frascos estériles hasta el momento de su utilización.
Procedimiento quirúrgico
La anestesia se logró mediante una inyección i.m. de 3 cc de una mezcla compuesta de ketamina (35 mg/kg) y xilacina (5 mg/kg). El abordaje del tendón de Aquiles se realizó con una incisión cutánea longitudinal de 3 cm. Ambos fascículos del tendón de Aquiles fueron seccionados transversalmente de forma subtotal a una distancia constante de 2 cm de su inserción en el calcáneo. En este momento se administró el hidrogel entre ambos extremos tendinosos. No se realizó la sutura del tendón seccionado para evitar interferencia en el proceso de cicatrización. El paratendón fue cerrado de forma continua con sutura reabsorbible, con objeto de contener el aporte del hidrogel. Finalmente, el miembro fue inmovilizado con un yeso que mantenía el tobillo en flexión plantar completa y la rodilla flexionada a 90°.
Microscopia óptica
Los animales fueron sacrificados con una inyección letal de pentobarbital para ser destinados al estudio histológico. Se llevó a cabo una resección completa del segmento tendinoso que contenían el tejido de reparación y las piezas obtenidas fueron fijadas inmediatamente en formol tamponado al 10%. Siguiendo el procedimiento habitual, los cortes seriados fueron teñidos con tres tipos de tinciones: hematoxilina-eosina, tricrómico de Masson y rojo picrosirio.22 Finalmente las muestras fueron observadas y micrografiadas con un microscopio de luz polarizada.
Microscopia electrónica de transmisión
Dos animales de cada grupo fueron anestesiados a los 28 días, según la técnica anteriormente descrita, con el objeto de llevar a cabo una fijación in situ de la pieza con glutalaldehído mientras se procedía a su extracción. Una vez extraídas, las piezas completaron su fijación en glutaraldehído al 4% en tampón cacodilato 0,1 M durante 24 horas. Tras el lavado de las piezas en solución tampón se realizó una posfijación de las mismas con tetraóxido de osmio al 1%. Las piezas fueron deshidratadas en soluciones de concentración creciente de alcohol etílico, se aclararon con óxido de propileno y se incluyeron en araldita. La sección de las muestras se realizó con un ultramicrotomo provisto de cuchillas de diamante, obteniéndose cortes ultrafinos de 50 µ que fueron montados sobre rejillas de cobre de 300 MESH. Finalmente se procedió al contrastado de las muestras con acetato de uranilo y con citrato de plomo. El examen y micrografiado de las muestras se hizo con un microscopio electrónico de transmisión Zeiss EM 109.
Estudio biomecánico
Un total de 12 animales (seis de cada grupo) fueron sacrificados a los 28 días, llevándose a cabo una resección de todo el complejo miotendinoso junto con el calcáneo. Las piezas fueron empaquetadas en bolsas individuales y almacenadas a 70° C hasta 4 horas antes de realizar el ensayo, momento en el cual todas las piezas fueron descongeladas a temperatura ambiente. Cada espécimen fue evaluado para determinar la fuerza necesaria para su rotura, en idénticas condiciones ambientales, mediante un sistema servohidraúlico de evaluación de materiales (Instron-MTS) con capacidad de generar fuerzas de distracción uniaxial. Se empleó una célula de carga de 50 kp y el ensayo se realizó a una velocidad constante de 1 cm/min. Se unieron ambos extremos de cada espécimen tendinoso con gel adhesivo a dos piezas de madera dentada y se montaron sobre unas mordazas especiales para permitir un correcto agarre del tendón.
Los resultados fueron analizados sobre la curva carga/deformación del osciloscopio. El punto de inflexión de la curva en el eje de ordenadas mostró la carga máxima necesaria para el fracaso del tendón, y la distancia desde este punto al inicio de la curva en el eje de abscisas, la elongación que soporta el mismo. Los datos obtenidos de ambos grupos fueron comparados mediante la «t» de Student para determinar la existencia de diferencias estadísticamente significativas. El límite de confianza fue predeterminado para un nivel de * = 0,05.
Resultados
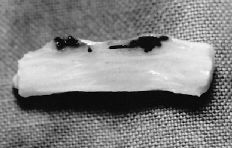
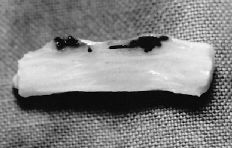
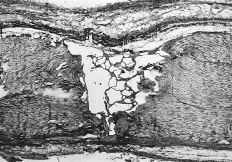
Trascurridos los tiempos propuestos para el sacrificio los animales no habían sufrido significativa pérdida de peso que pudiera indicar infección o intolerancia al tratamiento aplicado. La sección longitudinal de la pieza permitió observar una correcta cicatrización en ambos grupos. En los tendones tratados con el P(HEMA) destacó una superficie de deslizamiento lisa, con escasas adherencias al tejido circundante, lo que permitió su fácil disección (Fig. 1).
Figura 1. Sección sagital de un tendón tratado con P(HEMA) después de 28 días de la lesión. Se observa una correcta cicatrización con mínimo incremento de la distancia entre los extremos cortados.
Microscopia óptica
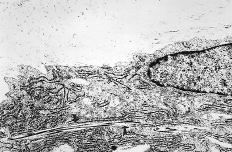
A los 3 días de la lesión el área de reparación estaba ocupado por una red de fibrina sin un patrón definido en cuyo interior se encontraban dispersos eritrocitos y células de la inflamación, principalmente monocitos. De forma característica, el aporte del P(HEMA) permitió la organización de la red de fibrina entorno suyo y la migración de fibroblastos epitendinosos, que parecían utilizarlo como soporte, para establecer así una temprana continuidad entre ambos extremos tendinosos (Fig. 2).
Figura 2. Tendón tratado con P(HEMA) (3 días): organización de la red de fibrina en torno al P(HEMA) ocupante del área lesional y proliferación de fibroblastos epitendinosos que intentan establecer un puente de unión entre ambos extremos del tendón. (HE, 25*.)
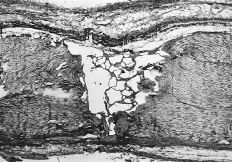
A los 7 días el área de reparación en el grupo control estaba ocupado por un tejido conectivo fibrovascular laxo que se disponía perpendicular al eje del tendón, constituyendo una densa banda celular y vascular próxima a su extremo seccionado. En el grupo tratado con P(HEMA) se pudo observar una importante proliferación fibroblástica y vascular, con presencia de abundantes mitosis en el área central de la cicatriz, y una tendencia de los fibroblastos a organizarse siguiendo el eje longitudinal del tendón. Además, en este grupo se demostró una temprana presencia de fibra colágena neoformada cercana al borde seccionado del tendón (Fig. 3).
Figura 3. Tendón tratado con P(HEMA) (7 días): presencia de temprana fibra colágena neoformada ocupando parte del área central de la cicatriz, así como la zona cercana al extremo seccionado del tendón. (Rojo picrosirio con luz polarizada, 50*.)
A los 14 días la red de fibrina había sido sustituida por una matriz extracelular colágena desorganizada en el grupo control. El elemento celular predominante fue el fibroblasto de aspecto pleomórfico, que alternaba con macrófagos y monocitos en el área central de la cicatriz. En los tendones con P(HEMA) el componente vascular y celular en el tejido de reparación era marcadamente superior respecto del grupo control. La cicatriz estaba ocupada en su totalidad y de forma uniforme por una densa matriz colágena escasamente organizada. En el centro de la cicatriz persistían pequeños restos de P(HEMA) en torno a los cuales no se observó la presencia de células multinucleadas que pudiera determinar reacción a cuerpo extraño.
A los 28 días de la lesión en el grupo control destacaba una importante participación de las células endotendinosas en el proceso de reparación y una abundante presencia de vasos-capilares en la cicatriz. La fibra colágena neoformada, aunque mantenía una aceptable continuidad con la del tendón seccionado, se mostraba poco organizada y formaba haces de pequeño grosor. En el grupo tratado con el P(HEMA), el componente celular y vascular en el interior del tejido de reparación había descendido de forma evidente. Fue posible determinar la presencia de gruesos haces de fibra colágena bien empaquetada, resultado de una correcta remodelación, principalmente en la zona más próxima al borde seccionado del tendón (Fig. 4). En este grupo destacaba además una zona de cicatrización bien delimitada del paratendón que la rodea, consecuencia de una escasa presencia de adherencias entre ambas estructuras.
Figura 4. Tendón tratado con P(HEMA) (28 días): tejido de reparación formado por gruesos haces de fibra colágena y presencia de fibroblastos fusiformes (flechas) resultado de una correcta remodelación en el área más cercana al tendón seccionado. (HE, 400*.)
Microscopia electrónica
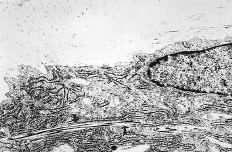
Las características morfológicas del fibroblasto responsable de la regeneración tendinosa no fue distinta en relación con el grupo estudiado. En el interior de la célula destacaba un núcleo en interfase, un desarrollado retículo endoplásmico rugoso y abundantes ribosomas, todo ello indicativo de una célula en activa síntesis proteica. El espacio extracelular estaba constituido por fibra colágena neoformada, de un diámetro aproximado de 30 nm, distribuidas de forma irregular. Sin embargo, en los tendones tratados con P(HEMA) se pudo determinar la presencia de espacios bien delimitados en el interior del citoplasma, en los que existía un número variable de fibras colágenas con su característica estriación, y de un diámetro similar a las del espacio extracelular (Fig. 5). Además, en estos espacios también se observó la presencia de microfilamentos dispersos de 10 nm de diámetro, que parecían incorporarse por aposición a la fibra colágena preexistente.
Figura 5. Micrografía electrónica obtenida de tendón tratado con P(HEMA). Fibroblasto que muestra un núcleo en interfase y un desarrollo RER. Presencia de espacio bien delimitado con fibra colágena en el interior del citoplasma (7.000*).
Estudio biomecánico
Durante el análisis biomecánico todos los tendones presentaron su rotura por la zona de reparación (Fig. 6), a excepción de dos pertenecientes al grupo experimental, que lo hicieron por la unión miotendinosa. La evaluación de los resultados ha permitido determinar que la mayor fuerza necesaria para el fracaso del tendón, expresada en Newton (N), correspondió a los tendones tratados con el P(HEMA) (83,5 ± 12,2 N) en comparación con el grupo control (78,8 ± 5,9 N), si bien no se obtuvieron diferencias estadísticamente significativas entre ambos grupos (Tabla 1).
Tabla 1. Fuerza necesaria para la rotura del tendón en cada uno de los tendones estudiados y su correspondiente elongación. | ||||
| Muestra | Control | Experimental | ||
| Fuerza (N) | Elongación (mm) | Fuerza (N) | Elongación (mm) | |
| 1 | 88,2 | 1,6 | 76,4 | 1,4 |
| 2 | 80,3 | 1,3 | 89,2 | 1,3 |
| 3 | 72,5 | 1,4 | 88,2 | 2,2 |
| 4 | 74,5 | 0,85 | 86,3 | 1,7 |
| 5 | 73,5 | 0,95 | 77,5 | 2,1 |
| 6 | 84,2 | 1,35 | 83,3 | 2 |
| Media | 78,8 | 1,24 | 83,5 | 1,78 |
| DS | 5,9 | 0,2 | 12,2 | 0,4 |
| No existen diferencias significativas (* = 0,05). | ||||
Figura 6. Rotura del tendón por la zona de separación durante el análisis biomecánico.
Discusión
Si bien las investigaciones realizadas con el hidrogel basado en el (HEMA) en modelos experimentales in vivo son muy escasas, los estudios desarrollados después de su implantación en tejido subcutáneo,4 en cartílago articular de la rodilla12 o en el interior del hueso19 han podido demostrar que éste es biocompatible. El objetivo de nuestro estudio fue analizar la influencia de este hidrogel en un tejido con alto contenido colágeno y pobremente vascularizado. Su administración no pareció interferir con el proceso general de reparación del tendón. No constatamos signos de reacción tisular adversa dada la limitada respuesta inflamatoria local similar a la del grupo control. No detectamos zonas de necrosis anómala que pudiera indicar fenómeno de encapsulación del implante. Por el contrario, observamos una restauración más anatómica del tendón, caracterizada por una respuesta celular ordenada, así como temprana aparición de nueva fibra colágena. Sin embargo, en algunas muestras se detectó la presencia de restos del polímero en la profundidad de la lesión al final del período de estudio, con lo cual la biodegradabilidad no ha podido ser claramente establecida.
Estos hallazgos son similares a los observados por otros autores cuando macromoléculas ocupantes de espacio, como la fibrina13 o el ácido hialurónico,14 se aportaron de forma tópica a un tendón seccionado. Todas estas sustancias actuarían como soporte para permitir una rápida reorganización del tejido de reparación. El mecanismo por el cual el P(HEMA) es capaz de facilitar la reparación del tendón no es conocido. Cabe pensar que, al tratarse de una sustancia hidrofílica con capacidad para absorber agua, tendría la propiedad de generar un gradiente de presión osmótica que arrastraría hacia sí a los fibroblastos tendinosos y facilitar, por tanto, su organización.
La aplicación local del P(HEMA) dio lugar a un tendón escasamente adherido a planos superficiales bajo visión directa y a una limitada presencia de adherencias del tejido cicatricial con el paratendón que lo cubre a nivel histológico. Varias hipótesis pueden explicar el limitado desarrollo de adherencias peritendinosas. La propiedad del hidrogel de neutralizar productos de degradación procedentes de la fagocitosis podría interferir en el necesario estímulo bioquímico para la presencia de células de la inflamación en la zona de cicatrización. También la presencia del polímero podría bloquear, a modo de barrera física, la migración de neutrófilos periféricos, creando así las condiciones óptimas para la respuesta celular intrínseca del tendón. Un reciente estudio parece confirmar este hecho al poner de manifiesto la capacidad del (HEMA) de limitar la formación de adherencias cuando es utilizado como plastia de la duramadre1.
Nuestros resultados biomecánicos no han demostrado de forma concluyente una mayor resistencia a la rotura en los tendones tratados con el hidrogel. Enwemeka6 no encontró diferencias significativas en el grupo sometido a carga precoz y analizado a los 28 días de la tenotomía, lo que atribuyó a una suficiente remodelación desarrollada en los tendones inmovilizados trascurrido este tiempo. La realización del análisis biomecánico a los 28 días de la lesión también ha podido condicionar nuestros resultados. Sin embargo, las observaciones histológicas en los tendones tratados con el P(HEMA) han permitido constatar una temprana aparición de fibra colágena y un aparente mejor empaquetamiento de la misma en el tejido de reparación durante las etapas iniciales de la cicatrización.
A nivel ultraestructural, la presencia de colágeno intracitoplasmático observada en los tendones tratados con el P(HEMA) podría implicar un incremento de la actividad sintética de proteína colágena por el fibroblasto. Para algunos autores, el colágeno intracitoplasmático representa una sobreproducción de precursores del colágeno que excede la capacidad de transporte al exterior por el fibroblasto, de tal forma que su polimerización se realizaría en el interior de la célula.5,15 Por tanto, son necesarios futuros estudios que evalúen desde un punto de vista bioquímico e inmunohistoquímico la concentración de colágeno formado tras el empleo del P(HEMA).
Podemos concluir que la aplicación de un P(HEMA) a un tendón no interfirió en su proceso de cicatrización, permitió una correcta organización de la respuesta celular y limitó la formación de adherencias peritendinosas, si bien no contribuyó a incrementar de forma evidente su resistencia. Pensamos que el P(HEMA) puede constituir en un futuro un sistema idóneo como vehículo de administración local de factores específicos de crecimiento que tengan la capacidad de acelerar el proceso de cicatrización con objeto de acortar el período de inmovilización necesaria para la reparación del tendón.
Bibliografía
1.Bhatia, S; Bergethon, P; Blease, S; Kemper, T; Rosiello, A, y Zimbardi, GP: A synthetic dural prosthesis constructed from hydroxyethylmethacrylate hydrogels. J Neurosurg, 83: 897-902, 1995.
2.Bonutti, PH; Weiker, GG, y Andrish, JT: Isobutyl cyanoacrylate as a soft tissue adhesive. An in vitro study in the rabbit achilles tendon. Clin Orthop, 229: 241-247, 1988.
3.Carbonetto, ST; Gruver, MN, y Turner, DC: Nerve fiber growth on defined hydrogel substrates. Science, 216: 897-899, 1982.
4.Chirila, TV; Constable, IJ; Crawford, GJ; Vijayasekaran, S, y cols.: Poly (2-hydroxyethyl methacrylate) sponges as implant materials: In vivo and in vitro evaluation of celular invasion. Biomaterials, 14: 26-38, 1993.
5.Enwemeka, CS: Membrane-bound intracellular collagen fibrils in fibroblasts and myofibroblasts of regenerating rabbit calcaneal tendons. Tissue-Cell, 23: 173-190, 1991.
6.Enwemeka, CS: Functional loading augments the initial tensile strength and energy absorpcion capacity of regenerating rabbit achilles tendons. Am J Phys Med Rehabil, 71: 31-38, 1992.
7.Gelberman, RH; Vande Berg, JS; Lundborg, GN, y Akeson, WH: Flexor tendon healing and restoration of the gliding surface. J Bone Joint Surg, 65A: 70-80, 1983.
8.Gelberman, RH; Vande Berg, JS; Manske, PR, y Akeson, WH: The early stages of flexor tendon healing: A morphologic study of the first fourteen days. J Hand Surg, 10A: 776-784, 1985.
9.Greenwald, DP; Sharzer, LA; Padawer, J; Levenson, SM, y Seifter, E: Zone II flexor tendon repair: Effects of vitamins A, E, ß-carotene. J Surg Res, 49: 98-102, 1990
10.Jackson, BA; Schwane, JA, y Starcher, BC: Effect of ultrasound therapy on the repair of achilles tendon injuries in rats. Med Sci Sports Exerc, 23: 171-176, 1991.
11.Kapètanos, G: The effect of the local corticosteroids on the healing and biomechanical properties of the partially injured tendon. Clin Orthop, 163: 170-179, 1982
12.Kon, M, y De Visser, AC: A poly (HEMA) sponge for restoration of articular cartilage defects. Plast Reconstr Surg, 67: 289-293, 1981.
13.Lusardi, DA, y Cain, JE, Jr: The effect of fibrin sealant on the strength of tendon repair of full thickness tendon lacerations in the rabbit Achilles tendon. J Foot-Ankle Surg, 33: 443-447, 1994.
14.Meyers, SA; Seaber, AV; Glisson, RR, y Nunley, JA: Effect of hyaluronic acid/chondroitin sulfate on healing of full thickness tendon lacerations in rabbits. J Orthop Res, 7: 683-689, 1989.
15.Michna, H: Intracellular collagen fibrils: Evidence of an intracellular source from experiments with tendon fibroblasts and fibroblastic tumour cells. J Anat, 158: 1-12, 1988.
16.Michna, H: Tendon injuries induced by exercise and anabolic steroids in experimental mice. Int Orthop, 11: 157-162, 1987.
17.Montheard, JP; Chazzopoulos, M, y Chappard, D: 2-hydroxyethyl methacrylate (HEMA): Chemical properties and applications in biomedical fields. Rev Macromol Chem Phys, 32: 1-34, 1992.
18.Murrell, GAG; Lilly, EG; Collins, A; Seaber, AV; Goldner, RD, y Best, TM: Achilles tendon injuries: A comparison of surgical repair versus no repair in a rat model. Foot Ankle, 14: 400-406, 1993.
19.Netti, PA; Shelton, JC; Revell, PA; Pirie, C; Smith, S, y cols.: Hydrogels as an interface between bone and an implant. Biomaterials, 14: 1098-1104, 1993.
20.Owoeye, I; Spielhol, NI; Fetto, J, y Nelson, AJ: Low-intensity pulsed galvanic current and the healing of tenotomized rat achilles tendons: Preliminary report using load-to-breaking measurements. Arch Phys Med Rehabil, 68: 415-418, 1987.
21.Packer, DL; Dombi, GW; Yu, PY; Zidel, P, y Sullivan, WG: An in vitro model of fibroblast activity and adhesion formation during flexor tendon healing. J Hand Surg, 19A: 769-776, 1994.
22. Rabau, MY, y Dayan, D: Polarization microscopy of picrosirius red stained sections: A useful method for qualitative evaluation of intestinal wall collagen. Histol Histopath, 9: 525-528, 1994.
23.Reginato, AM; Iozzo, RV, y Jiménez, SA: Formation of nodular structures resembling mature articular cartilage in long-term primary cultures of human fetal epiphyseal chondrocytes on a hydrogel substrate. Arthr Rheum, 37: 1338-1349, 1994.
24.Rompe, JD; Kirkpatrick, CJ; Kullmer, K; Schwitalle, M, y Krischek, O: Dose-related effects of shock waves on rabbit tendo Achillis. J Bone Joint Surg, 80B: 546-552, 1998
25.Thomas, J; Taylor, D; Crowell, R, y Assor, D: The effect of indomethacin on achilles tendon healing in rabbits. Clin Orthop, 272: 308-311, 1991.
26.Trail, JA; Powell, ES; Noble, J, y Crank, S: The role of an adhesive (histoacryl) in tendon repair. J Hand Surg, 17B: 544-549, 1992.
27. Williams, IF; Nicholls, JS; Goodship, AE, y Silver, IA: Experimental treatment of tendon injury with heparin. Br J Plast Surg, 39: 367-372, 1986.