Los sarcomas de partes blandas (SPB) multicéntricos constituyen una rara entidad patológica que se produce en aproximadamente el 1% de todos los casos de SPB1,2. El concepto de multicentricidad en los SPB se define como la aparición del sarcoma en dos o más localizaciones anatómicas diferentes antes de que el tumor se extienda a regiones donde es más frecuente encontrarlo como metástasis, como, por ejemplo, los pulmones, el hígado o el esqueleto1-3. Un aspecto controvertido y no demostrado es si este patrón de presentación se debe verdaderamente a un origen multicéntrico a partir de la transformación tumoral espontánea de células en diferentes localizaciones o, por el contrario, se trata de una forma rara de metastatizar y cuya causa, en todo caso, desconocemos1-3.
CASO CLÍNICO
Se presenta el caso de una mujer de 28 años de edad que acudió al Servicio de Urología de su hospital de referencia con un cuadro clínico de 6 meses de evolución, que consistía en sensación de ocupación abdominal, con gran incomodidad a ese nivel, saciedad precoz y adelgazamiento progresivo.
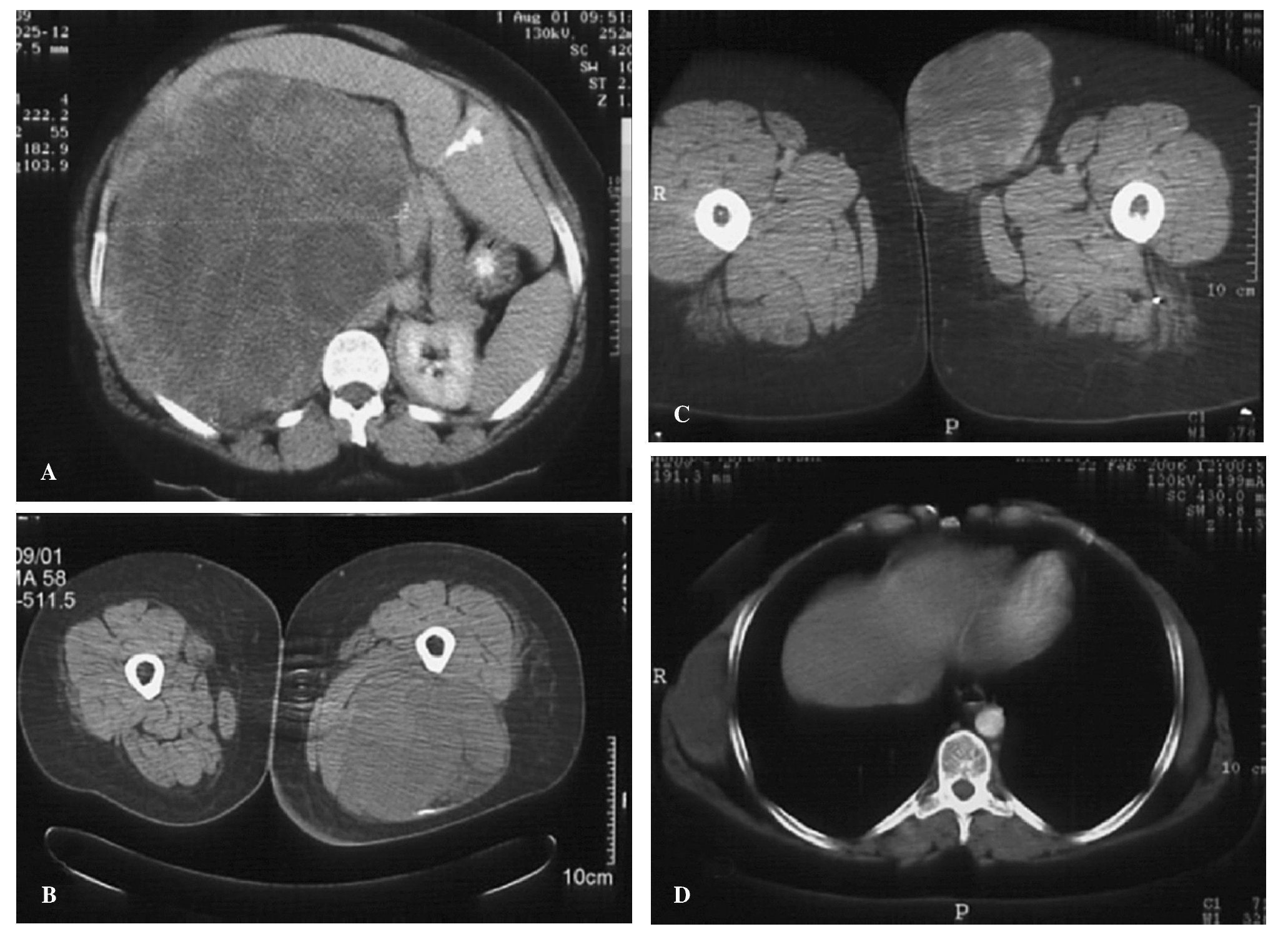
En la exploración física se objetivó la presencia de una masa de consistencia dura en el vacío derecho. Entre las pruebas complementarias que se le realizaron se hizo una tomografía computarizada (TC) de abdomen. En ella se apreció una lesión expansiva de grandes dimensiones en el retroperitoneo derecho. El tumor comprimía el hígado, la vena cava y el riñón derecho (fig. 1A). La biopsia por punción-aspiración con aguja fina (PAAF) de la masa fue informada como compatible con sarcoma.
Figura 1.(A) Tomografía computarizada (TC) abdominal en la que se muestra el primer tumor diagnosticado a la paciente, que se localizaba en el retroperitoneo del lado derecho y que ocasionaba compresión y desplazamiento de todas las vísceras hacia el lado opuesto. (B) Imagen de TC del tumor localizado en la región posterior del muslo izquierdo, que englobaba parte del nervio ciático. (C) TC del tercio proximal del muslo en la que se aprecia el tumor localizado en la base del triángulo de Scarpa del lado izquierdo. (D) TC de tórax en la que se muestra el tumor localizado en el hemitórax derecho inmediatamente por debajo del plano del dorsal ancho.
La paciente fue intervenida en septiembre de 2001 por el Servicio de Urología de su centro de origen y se le extirpó una masa de 32 x 22 x 16 cm. En esta cirugía fue preciso realizarle también la nefrectomía del riñón derecho debido a la infiltración tumoral del mismo. La biopsia del tumor fue informada como liposarcoma mixoide de grado II.
En la segunda semana del postoperatorio de esta prime-ra intervención, la paciente presentó un dolor neuropático que lentamente progresó hasta establecerse en el muslo, la pierna y el pie izquierdo. En pocos días se puso de manifiesto una afectación motora de la extremidad compatible con una lesión del nervio ciático. En la exploración física se apreciaba una gran tumoración en la parte posterior del muslo izquierdo y se encontró otra de 2,5 cm de diámetro en la base derecha del cuello y otra de 4 cm en la axila izquierda. Se realizó una nueva TC y se delimitó una gran masa que ocupaba la celda posterior del muslo y englobaba el nervio ciático (fig. 1B). También se confirmaron las masas de la base del cuello y de la axila. Las PAAF de estas lesiones se informaron como compatibles con sarcomas.
La paciente fue remitida a nuestro centro para tratamiento oncológico con el diagnóstico de liposarcoma mixoide en estadio IV.
Se hizo quimioterapia neoadyuvante con 6 ciclos de adriamicina, con la que se logró una buena respuesta, de modo que se logró reducir el volumen de todas las masas.
En abril de 2002 se realizó una escisión amplia del tumor de la celda posterior del muslo izquierdo que englobaba parte del nervio ciático mayor izquierdo, que fue preciso resecar de forma parcial. La histología de la pieza de resección de 15 x 13 x 8 cm fue informada como condrosarcoma mixoide bien diferenciado, con extensas áreas de tejido necrótico y pocas mitosis. Se decidió seguir administrando quimioterapia a la paciente, dada la buena respuesta, y en la revisión de enero de 2003 presentó una remisión de todas las masas, de modo que se siguieron realizando controles sin tratamiento.
En el control de diciembre de 2003 se observó crecimiento tumoral en la ingle izquierda (en la base del triángulo de Scarpa), hemitórax izquierdo (parrilla costal, por debajo del pectoral mayor) y hemitórax derecho (parrilla costal, por debajo del ángulo de la escápula y profundo respecto al músculo dorsal ancho). En estas circunstancias se decidió volver a administrar quimioterapia y valorar la realización de cirugía según la evolución. Como en los casos anteriores, la respuesta al tratamiento resultó muy favorable, produciéndose una reducción del volumen de todos los tumores.
Entre enero y agosto de 2004 se produjo una pérdida de seguimiento de la paciente, tiempo en el que estuvo sin control ni tratamiento por parte del Servicio de Oncología Médica. La paciente había presentado hasta ese momento muy buena respuesta a la quimioterapia administrada, y se estaba planteando la posibilidad de realizarle una resección del tumor de la región del triángulo de Scarpa izquierdo.
En agosto de 2004 la paciente volvió a acudir a revisión con el Servicio de Oncología Médica. Se realizó una nueva evaluación mediante TC y se observó un crecimiento muy importante de todas las masas conocidas en la última revisión (ingle izquierda, pectoral izquierdo y subescapular derecha), destacando sobre todo el crecimiento de la masa de la ingle izquierda (fig. 1C). Se completó la evaluación con un estudio de extensión que reveló que la paciente seguía libre de metástasis en pulmón, hígado, esqueleto u otras estructuras. Se administró un nuevo ciclo de quimioterapia y nuevamente se produjo una respuesta favorable con reducción del volumen de todas las masas.
En octubre de 2004 se extirpó la masa de la región inguinal izquierda que presentaba un volumen de 14 x 10 x 8 cm. La biopsia de esta lesión fue informada como liposarcoma de célula redonda de grado II.
La paciente siguió recibiendo tratamiento quimioterápico, lo que logró controlar el crecimiento de las masas restantes hasta mayo de 2006, cuando se decidió extirpar la masa subescapular derecha (fig. 1D). El diagnóstico histológico de la pieza (15 x 11 x 5 cm) fue de liposarcoma desdiferenciado con áreas de degeneración condroide grado 3, compatible con liposarcoma de célula redonda. Tras esta última intervención se siguió administrando tratamiento quimioterápico.
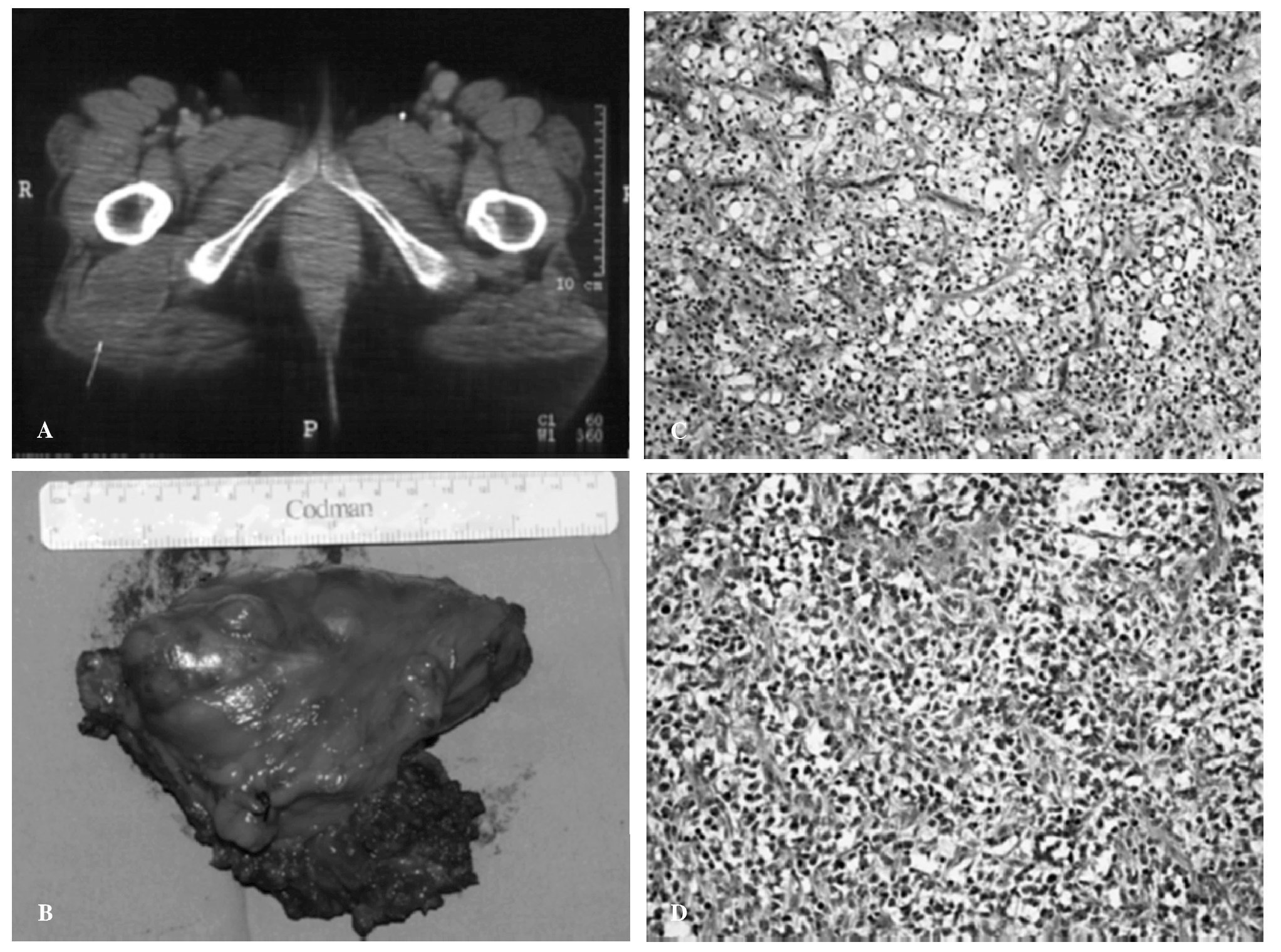
En un control de TC en junio de 2006 se apreció una nueva masa en la región de los glúteos del muslo derecho, inmediatamente posterior a la región trocantérea del fémur (fig. 2A). La paciente fue intervenida otra vez en octubre de 2006, resecándose un tumor de 12 x 12 x 5 cm (fig. 2B). El diagnóstico anatomopatológico del tumor reveló una histología de liposarcoma desdiferenciado compatible con sarcoma de célula redonda.
Figura 2.(A) Tomografía computarizada (TC) de pelvis en la que puede verse el tumor localizado en la región glútea del lado derecho de la paciente. (B) Imagen de la pieza de tumorectomía de la lesión anterior. (C) Aspecto histológico del liposarcoma mixoide (x20). (D) Aspecto histológico del liposarcoma de células redondas (x20).
En junio de 2007 se intervino de nuevo a la paciente y se le extirpó un tumor de 8 x 7 x 6 cm de la región pectoral izquierda. El diagnóstico de esta nueva pieza de tumorectomía fue de liposarcoma mixoide.
En la fecha actual (octubre de 2007) no se ha producido recidiva en ninguna de las lesiones extirpadas ni se ha detectado metástasis. La paciente realiza controles periódicos en el Servicio de Oncología y puede realizar una vida normal, teniendo en cuenta las secuelas debidas al crecimiento tumoral, el tratamiento con quimioterapia y las intervenciones quirúrgicas realizadas: nefrectomía del riñón derecho (que si bien en este momento no tiene relevancia clínica, puede condicionar más adelante la pauta terapéutica si en algún momento se ve afectada la función renal de la paciente) y la parálisis del nervio ciático, que se encontraba infiltrado por el tumor del muslo izquierdo y que fue preciso resecar parcialmente.
Detección de la translocación TLS-CHOP
La marca genética del liposarcoma mixoide es la translocación t(12;16)(q13;p11), que parece ser altamente específica para este tumor y está presente en más del 85% de los casos. Esta translocación lleva al reordenamiento de los genes CHOP y TLS (también conocido como FUS) en 12q13 y 16p11, respectivamente, generando un gen híbrido TLS-CHOP que codifica un regulador transcripcional aberrante3,4. Se ha confirmado recientemente la fuerte especificidad del reordenamiento genético TLS-CHOP para la entidad del liposarcoma mixoide y de célula redonda4.
Como en otras translocaciones, los puntos de rotura del genoma para la translocación t(12;16) están dispersos en intrones específicos de los genes TLS y CHOP, y hacen que un tumor sea genéticamente diferente de otro. De este modo, se ha sugerido que determinando el origen clonal de las células de cada tumor en un paciente con liposarcoma multicéntrico, podría determinarse el origen metastásico de los mismos, en el caso en que ese clon celular fuera el mismo3,5.
Se realizó el estudio molecular de los tumores extirpados a la paciente que presentamos en el Laboratorio de Oncología Molecular del Hospital Universitario Central de Asturias. Utilizamos para ello muestras de tejido en congelación procedentes del Banco de Tumores y del Servicio de Anatomía Patológica de nuestro centro. La intención del estudio era comprobar si todos los tumores eran portadores de la translocación t(12;16), dado que en el estudio histológico de las muestras no se pudo determinar con exactitud si se trataba de un liposarcoma en todos los casos o no; también pretendíamos comprobar si la localización de la translocación en el ADN es la misma en todos los tumores, lo cual permitiría orientar el caso hacia la posibilidad de que el origen de los mismos sea un mismo clon celular. No se pudo utilizar material tumoral procedente de la primera masa extirpada debido a que ese procedimiento fue realizado en otro hospital.
El resultado de este estudio fue que todas las muestras analizadas presentaban la misma translocación TLS-CHOP y en el mismo segmento de ADN del tumor, por lo que pensamos que el origen más probable de los tumores de la paciente sea monoclonal, es decir: en todos los casos se trata de un liposarcoma mixoide y todos ellos proceden de un mismo clon celular.
DISCUSIÓN
El SPB multicéntrico ha sido descrito de forma intermitente en la literatura desde los primeros años del siglo XX, siendo la primera cita conocida la de Siegmund en el año 19346. Las primeras referencias se basaron en datos obtenidos de autopsias, por lo que aportan poco acerca de los aspectos clínicos de esta enfermedad1,6,7. La serie más amplia recogida en la literatura es un estudio de 20 casos publicado por Enzinger y Winslow en el año 1962 basado en datos procedentes del Armed Forces Institute of Pathology, pero sin seguimiento clínico7. Más recientemente se han publicado casos clínicos que tampoco permiten aclarar los aspectos más controvertidos de esta patología1,8,9. Hasta el año 2000 se conocen menos de 50 casos recogidos en la literatura1,3.
El liposarcoma es el tipo histológico más frecuentemente identificado en los casos de SPB multicéntricos, y dentro de éstos, la variedad más frecuente es el liposarcoma mixoide (fig. 2C)3,7.
El liposarcoma mixoide es también el subtipo más frecuente de liposarcoma, presentándose según las series hasta en el 50% de los casos3. Es un tumor con tendencia a recidivar localmente y aproximadamente un tercio de los casos desarrolla metástasis a distancia3. Es frecuente entre este tipo de tumores la progresión a un grado de menor diferenciación histológica: sarcoma de célula redonda (fig. 2D). Este tipo histológico se asocia con un pronóstico mucho peor que el tipo mixoide, que ya es de por sí malo10,11.
Se ha publicado que los SPB solitarios tienen una incidencia de metástasis pulmonares del 21% y un 75% de supervivencia a los 5 años1,12-14. Los pacientes con SPB multi-focal desarrollan en un 63% metástasis pulmonares y tienen una supervivencia media a los 5 años del 36%1. De esta forma se podría asegurar que los pacientes con SPB multicéntricos tienen claramente un peor pronóstico que aquellos que presentan lesiones solitarias, como cabría esperar.
Un aspecto que debe llamar la atención de la paciente que presentamos es que lleva más de 5 años desde que se detectó el primer tumor. Desde entonces se le han detectado hasta 5 masas más de gran tamaño que han sido extirpadas (celda posterior del muslo izquierdo, ingle izquierda, hemitórax derecho, región glútea derecha, pectoral izquierdo), presentando en todos los casos histologías compatibles con un liposarcoma de alto grado. Salvo las complicaciones ocasionadas por la quimioterapia y las secuelas producidas por el crecimiento local del tumor, la paciente tiene un estado general óptimo y puede llevar a cabo una vida normal.
La supervivencia prolongada de esta paciente la atribuimos a la buena respuesta y tolerancia al tratamiento quimioterápico administrado (adriamicina, caelyx y gemitalina) y a no haber desarrollado metástasis viscerales ni en el esqueleto. Del mismo modo, la cirugía realizada ha permitido erradicar el tumor en aquellas localizaciones en que se ha intervenido.
Sólo con los datos clínicos o anatomopatológicos es difícil determinar en cada caso específico si un tumor localizado en una zona inusual para metástasis pero habitual para un tumor primario se trata de una metástasis o de un segundo primario. La única forma de separar el origen multifocal de esta enfermedad del metastático es la realización de un estudio a nivel molecular y genético3.
En el estudio de Antonescu et al3 se establece el origen monoclonal de los tumores hallados en cada paciente en 6 casos con SPB multicéntrico, siendo en todos ellos del tipo liposarcoma mixoide. En nuestro trabajo hemos empleado una estrategia de laboratorio diferente, pero que nos ha llevado a la misma conclusión que la citada por el grupo de Antonescu et al3, considerando como la opción más probable la metastásica.
Todas las muestras procedentes de tumores extirpados en nuestro centro a la paciente eran portadoras de la misma translocación genética y en el mismo segmento de ADN. De este modo se confirma, por un lado, que en todas las tumorectomías el material genético de las células tumorales se identificaba con el de un liposarcoma de su variedad mixoide. La explicación de por qué el diagnóstico dado por los patólogos no se corresponde en todos los casos con el de liposarcoma mixoide se debe a que el que nos ocupa se trata de un tumor de comportamiento agresivo, que progresa rápidamente hacia grados histológicos de mayor celularidad, de modo que a partir de un liposarcoma mixoide se desarrolla un liposarcoma de célula redonda10. Por otro lado, el segundo de los tumores tratados en nuestro centro fue identificado inicialmente como condrosarcoma debido a la aparición de extensas áreas de tejido cartilaginoso. Una revisión de los cortes histológicos de esa pieza realizada con los patólogos del centro nos llevó a concluir que la acción de la quimioterapia había llevado a producir una metaplasia cartilaginosa en el seno de otro liposarcoma mixoide, dando lugar a un diagnóstico inicial confuso.
El hecho de que en todos los tumores analizados la translocación esté contenida en el mismo segmento de ADN nos lleva a pensar que efectivamente estamos ante un mismo clon celular, es decir, a partir de un tumor primario se han producido metástasis, de forma análoga a lo que han descrito otros autores en casos semejantes3.
La dificultad para comprobar la verdadera fisiopatología de los sarcomas multicéntricos radica en su baja frecuencia de presentación, que impide reunir series de pacientes suficientemente numerosas. Estudios recientes basados en análisis de biología molecular apuntan a que lo más probable es que se deba a metástasis a partir de un tumor pri-mario3. Sin embargo, queda por aclarar cuál es la propiedad que determina este extraño patrón de metástasis que se distribuyen por el organismo sin afectar a los órganos que en teoría son más susceptibles. Es probable que las células tumorales tengan una menor afinidad por el tejido pulmonar por alguna causa que no conocemos, pero tampoco puede descartarse que se deba a una casualidad caprichosa. En todo caso consideramos necesaria la realización de más estudios en el futuro.
AGRADECIMIENTOS
A la Dra. Milagros Balbín Felechosa (Laboratorio de Oncología Molecular del Hospital Universitario Central de Asturias) y a la Dra. Aurora Astudillo González (Servicio de Anatomía Patológica del Hospital Universitario Central de Asturias).
Declaración de conflicto de intereses
Los autores han declarado no tener ningún conflicto de intereses.
Correspondencia:
E. López-Anglada Fernández.
Servicio de Cirugía Ortopédica y Traumatología. Hospital Universitario Central de Asturias (HUCA).
C/ Celestino Villamil, s/n.
33006 Oviedo (Asturias). España.
Recibido: febrero de 2007.
Aceptado: marzo de 2008.