El objetivo principal de este estudio es comprobar la inocuidad del marcaje de células madre mesenquimales derivadas de tejido adiposo con partículas de hierro superparamagnético (SPIO) en términos de proliferación y multipotencialidad celular. El objetivo final es posibilitar el seguimiento celular in vivo mediante resonancia magnética con vistas a una posible aplicación en técnicas de terapia celular e ingeniería tisular en el área de la Cirugía Ortopédica y Traumatología.
MétodoMediante protocolos estandarizados se aislaron y cultivaron células mesenquimales procedentes de 10 muestras de tejido graso. En pases 1P y 2P, dichas células fueron marcadas con SPIO, empleando sulfato de protamina como agente transfectante. Tras comprobar la eficiencia del marcaje mediante tinción con azul de Prusia, se analizó el efecto del mismo sobre el crecimiento y la multipotencialidad de las poblaciones celulares mediante el estudio de su crecimiento in vitro y su capacidad de diferenciación hacia diferentes estirpes celulares. Finalmente, se estudió la posibilidad de localizar las poblaciones celulares marcadas mediante resonancia magnética de 3 Teslas.
Resultados y conclusiónLas poblaciones celulares aisladas a partir de las muestras de grasa subcutánea marcadas con SPIO, muestran patrones de crecimiento y multipotencialidad similares a las poblaciones control. Dichas células son visibles mediante imagen por resonancia magnética una vez implantadas en una pieza ósea de control. Los resultados obtenidos en este estudio indican que esta metodología podría aplicarse a la monitorización de las células implantadas en defectos óseos.
The aim of this study was to study the viability and multipotential capacity of adipose derived mesenchymal stem cells, after being labelled with superparamagnetic iron oxide particles. The final aim is to monitor stem cells after being implanted by cellular therapy and tissue engineering techniques in the field of Orthopaedics and Traumatology.
MethodTen biopsies of adipose tissue were processed in order to isolate adipose derived mesenchymal stem cells, which were cultured under standard in vitro culture conditions until pre-confluent state. Cells in 1P and 2P were labelled with superparamagnetic iron oxide particles (SPIO), using protamine sulphate as a transfection agent. After confirming labelling efficiency with Prussian blue staining, we studied the labelling effect on the growth and multipotency of stem cells by analysing their in vitro growth curves and their capacity to differentiate into adipogenic, osteogenic and chondrogenic cell lines. We also tried to view the labelled stem cells using 3 Tesla magnetic resonance imaging.
Results and conclusionAdipose derived stem cells labelled with SPIO showed a proliferation and differentiation capacity similar to control stem cells. These cells were visible on MR images after been implanted in a bone piece. Therefore, in vitro cell labelling of adipose derived mesenchymal stem cells with SPIO could be useful for in vivo cell tracking by MRI in bone tissue engineering.
En los últimos años, la terapia celular y la ingeniería tisular basada en células madre mesenquimales han adquirido una gran importancia en el desarrollo de nuevas estrategias terapéuticas dirigidas al tratamiento de diversas patologías del sistema esquelético1. Sin embargo, aún son muchas las preguntas sin respuesta que acompañan a este tipo de técnicas. Una de las cuestiones que más inquieta a investigadores y clínicos es la que se refiere a la biodistribución de estas células una vez implantadas2–4.
El estudio de la localización y distribución de las células madre mesenquimales implantadas es esencial para poder concretar la seguridad y eficacia de estas técnicas. Además, asegurar la viabilidad y permanencia de las células en el lugar del implante es fundamental para garantizar su posible efecto terapéutico2–4. Con esos fines se han diseñado diversos métodos de marcaje y localización celular, entre ellos el marcaje con fluorocromos como la proteína verde fluorescente, o la transfección con plásmidos que codifican proteínas fluorescentes2,5. Otras técnicas emplean radioisótopos5 o el implante de células madre de un donante de diferente sexo o especie al del receptor, utilizando el cromosoma Y como marcaje «natural»6. Éstos y otros métodos, aunque han resultado ser útiles en la localización de las poblaciones celulares implantadas, presentan algunas limitaciones, como la necesidad de tomar biopsias de los tejidos para su posterior análisis dada la imposibilidad de hacer un seguimiento en vivo.
La tecnología de la imagen basada en la resonancia magnética (RM), por el contrario, permite la obtención in vivo de imágenes sumamente sofisticadas a tiempo real. Además, es una técnica sensible, con bastante especificidad y no invasiva, que puede realizarse en un tiempo relativamente corto4,5. Por todo ello, es una buena opción a la hora de diseñar técnicas de seguimiento en vivo que puedan ser aplicadas en humanos.
Para su seguimiento por RM, las células a implantar deben ser previamente marcadas con partículas magnéticas biocompatibles, lo que se ha realizado con anterioridad utilizando partículas de hierro superparamagnético (SPIO) de forma experimental en áreas de cirugía cardiaca5, neurocirugía7 y en patología intervertebral8.
Considerando que la técnica de la monitorización celular con marcaje paramagnético no se ha aplicado en el sistema esquelético, hemos estudiado su inocuidad en poblaciones de células madre adultas derivadas de tejido adiposo (ADMSCs), dada su fácil obtención y gran disponibilidad, así como analizado la posibilidad de localizar, mediante imagen por RM, la población de células marcadas una vez implantadas en el tejido óseo.
Material y métodoObtención de las muestras de tejido adiposoLas muestras de tejido adiposo se obtuvieron de ovejas adultas de raza Asaaf sacrificadas tras su empleo en protocolos experimentales que no interferían con el presente estudio. En quirófano y bajo estrictas condiciones de asepsia, se recogieron entre 5 y 10 gramos de tejido adiposo procedentes de la cola de 10 animales. Las muestras se mantuvieron durante 6-8 horas a temperatura ambiente en solución esterilizante constituida por Dulbecco¿s modified eagles medim (DMEM-PAA Laboratorios GMBH) suplementado con antibióticos y antifúngicos (vancomicina –Normon–, tobramicina –Braun–, sulfametoxazol –Almirall– y anfotericina B –Sigma–).
Obtención de las muestras de sangre y elaboración de matricesPara la posterior diferenciación condrogénica de las células en matriz de fibrina, durante la cirugía de extracción de tejido adiposo se recogieron también muestras de sangre ovina en tubos de extracción de sangre conteniendo citrato sódico como agente anticoagulante. Dichos tubos fueron sometidos a un ciclo de centrifugación a 700g. A continuación se recogió la fracción plasmática, que fue preservada a -20°C hasta el momento de su utilización.
Para la formación de la matriz se descongeló la fracción plasmática, se le adicionó medio de cultivo, cloruro cálcico y ácido tranexámico junto con la suspensión celular, manteniéndose a 37°C hasta su polimerización.
Aislamiento y cultivo de ADMSCsTras el correspondiente período de esterilización, una vez en el laboratorio de cultivos celulares, las muestras de tejido adiposo fueron procesadas para la obtención de ADMSCs. Brevemente, el procedimiento empleado consistió en varios lavados con solución salina tamponada (PBS), seguidos de digestión mecánica y, finalmente, digestión enzimática con colagenasa tipo I (Sigma) 2mg/ml en DMEM a 37°C hasta la completa digestión del tejido (20-24 horas). Las muestras así obtenidas se centrifugaron a 720g durante 10 minutos y la fracción del estroma vascular (SVF) se resuspendió en medio de cultivo de ADMSCs estándar, consistente en DMEM suplementado con 10% de suero bovino fetal (SbF-Linus-), 1% penicilina/streptomicina (PAA Lab.) y 1% glutamina (PAA Lab), suplementado con 2,5 ng/ml de factor de crecimiento fibroblástico (FGFb) (Sigma). Se cuantificó la población celular mediante el método azul tripán en cámara Neuvawer. Finalmente, las suspensiones celulares se sembraron en placas de cultivo de 24 pocillos (2cm2) (Becton Dickinson) a una densidad de 30.000 células/cm2 constituyendo el cultivo primario (0P) y se incubaron a 37°C y 5% de CO2 en atmósfera con 95% de humedad. Transcurridas 48 horas, los cultivos fueron sometidos a un lavado con PBS para eliminar el componente eritrocitario, quedando en los pocillos únicamente las células capaces de adherirse a ellos (ADMSCs).
Las células en cultivo fueron observadas diariamente y cada 2-3 días se cambió el medio de cultivo. Cuando las células se encontraron en estado de preconfluencia, se tripsinizaron y subcultivaron en placas de 24 pocillos. Brevemente, se eliminó el medio, se lavó el pocillo con DMEM y se añadió tripsina/EDTA (0,05/0,02%) (PAA Lab.), que se dejó actuar a 37°C durante dos minutos. Las células se recuperaron, se neutralizaron y se centrifugaron a 720g.
Para posteriores estudios, los cultivos secundarios (1P y 2P) se sembraron a una densidad de 5.000 células/cm2 en superficies de 2cm2.
Marcaje de las poblaciones celulares con SPIOUna vez que los cultivos primarios alcanzaron el estado de preconfluencia y previamente a su subcultivo, las poblaciones celulares fueron marcadas con SPIO (Endorem® –Laboratorios Guerbet–). Para ello, se incubaron con solución de marcaje consistente en 50μl/ml de Endorem® en DMEM y 6mg/ml de sulfato de protamina, utilizando éste como agente transfectante para favorecer la internalización de las partículas de hierro por parte de las células en cultivo9. Tras un período de incubación de 12 horas a 37°C, los pocillos fueron lavados con PBS y 10 μ/ml de heparina para eliminar los restos de marcaje que no hubieran penetrado en el interior celular. Para comprobar la efectividad del marcaje, un pocillo de cada caso experimental fue sometido a tinción azul de Prusia y, tras la correspondiente fijación con paraformaldehído al 4% a 4°C durante 30 minutos, se añadió una solución de ferrocianuro potásico al 10% en ácido clorhídrico al 20% durante 30 minutos. Tras contrastar los núcleos celulares con el agente Nuclear Fast Red se observó bajo microscopía de contraste de fases la presencia de partículas azules en el interior de las células sometidas al procedimiento de marcaje con SPIO.
Inocuidad del marcaje con SPIOPara comprobar la inocuidad del marcaje férrico en las ADMSCs in vitro, se estudiaron los patrones de crecimiento y diferenciación de las poblaciones celulares marcadas y se compararon con los obtenidos en los cultivos control (no marcados). Dichos estudios se realizaron en los pases 1P y 2P de cada una de las muestras analizadas.
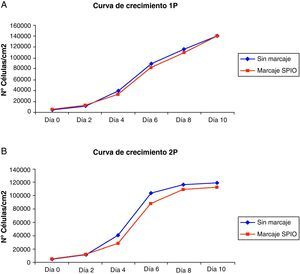
Para estudiar el patrón proliferativo, se establecieron curvas de crecimiento en pocillos de 2cm2 de superficie a una densidad inicial de 5.000 células/cm2 y se mantuvieron bajo condiciones estándar de cultivo. Durante 10 días se tripsinizaron los pocillos por duplicado cada 48 horas y se evaluó el número de células mediante el método azul de Tripán. Para el tratamiento estadístico de los datos de proliferación celular de los cultivos marcados con SPIO y de los cultivos control se utilizó el programa SPSS v.17.0.
Para el estudio de la multipotencialidad de las poblaciones celulares objeto de estudio, se procedió a la inducción adipogénica, osteogénica y condrogénica de las ADMSCs marcadas con SPIO y de las poblaciones control. Para ello, las células fueron cultivadas en medio de cultivo estándar suplementado con aditivos específicos y posteriormente caracterizadas mediante tinciones básicas.
Para la diferenciación hacia células de fenotipo adipocítico, las ADMSCs se cultivaron en medio base suplementado con 1μM dexametasona (Sigma), 0,5mM IBMX (Sigma), 10μM insulina (Sigma) y 200μM indometacin (Sigma). Tras 7 días de inducción se realizó una tinción Oil Red O (Sigma).
Para la inducción osteogénica, las células fueron cultivadas en medio base con 5% suero bovino fetal y 10μM dexametasona, 150mM ácido L-ascórbico (Biomedia) y 10mM ß-glicerolfosfato (Sigma), completando la inducción con la adición al medio durante las primeras 48 horas de 10 ng/ml de proteína morfogenética 2 (BMP2) (Sigma). Tras 21 días de inducción se realizó una tinción con Alizarin Red (Sigma).
Finalmente, para su inducción condrogénica, 1·106 ADMSCs fueron sembradas en 100μl de matriz de fibrina elaborada a partir de plasma ovino. Dichas matrices fueron cultivadas en medio de cultivo condrogénico, consistente en medio estándar suplementado con 50μg/ml ácido ascórbico, 6,25μg/ml insulina y 10 ng/ml TGF ß1 (Sigma) durante 21 días. La caracterización de la diferenciación condrogénica se realizó mediante la observación al microscopio de la morfología celular, y mediante el estudio sobre secciones histológicas de las matrices, sometidas a tinción azul Alcián.
Visualización de las poblaciones celulares marcadas mediante RMLas células marcadas procedentes del 1P fueron tripsinizadas y transportadas en medio de cultivo a las instalaciones de la Universidad de León para comprobar su visibilidad mediante RM.
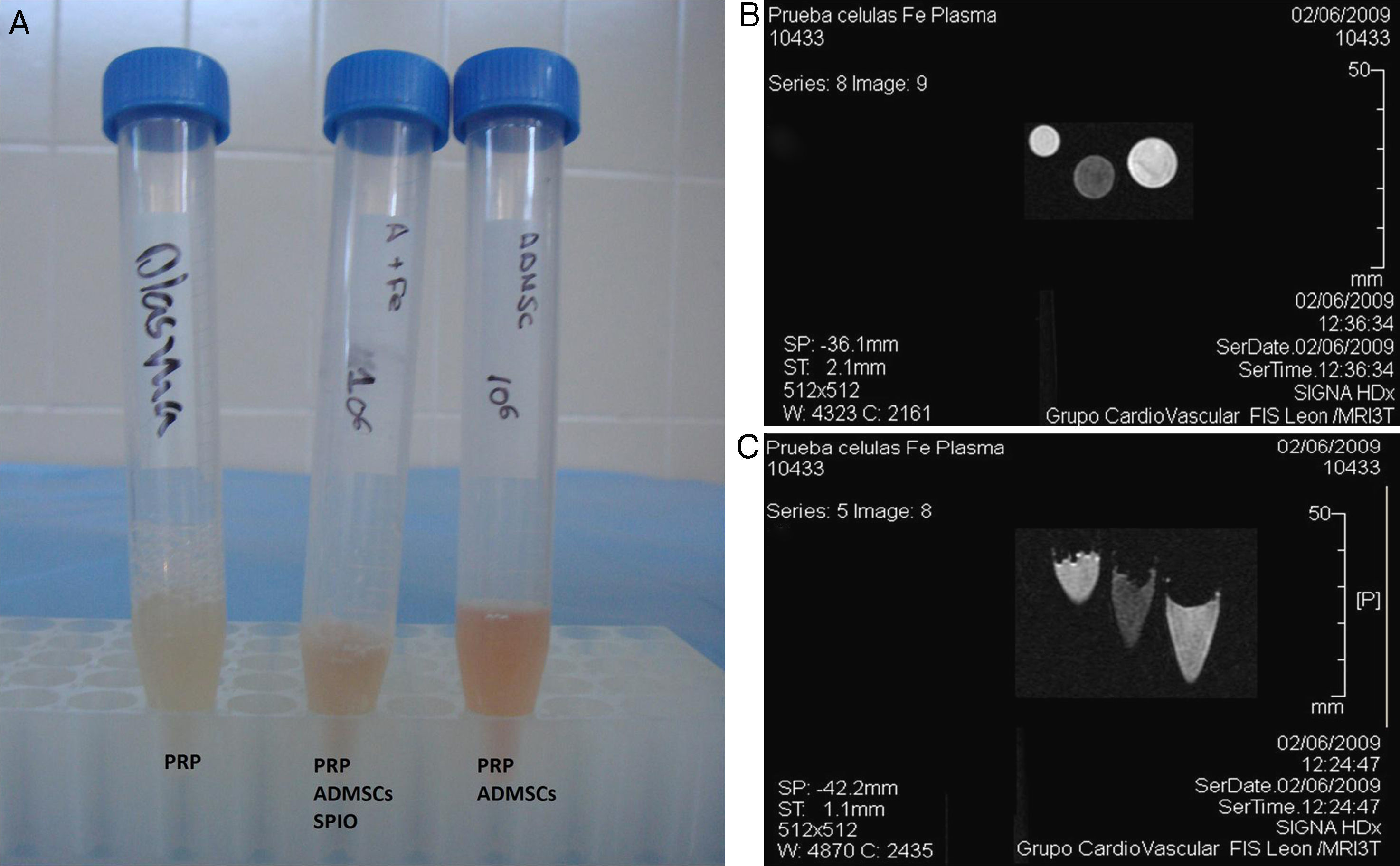
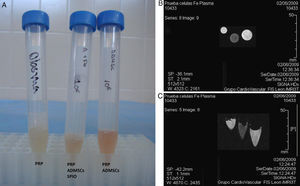
En un primer ensayo se estudiaron las diferencias entre las imágenes obtenidas a partir de células marcadas embebidas en plasma rico en plaquetas (PRP), células no marcadas embebidas en PRP y el propio PRP. Para ello, se mezclaron las células con plasma ovino y se provocó su coagulación con cloruro cálcico en tubos de ensayo. Las muestras, por triplicado, fueron introducidas en una RM de 3 Teslas.
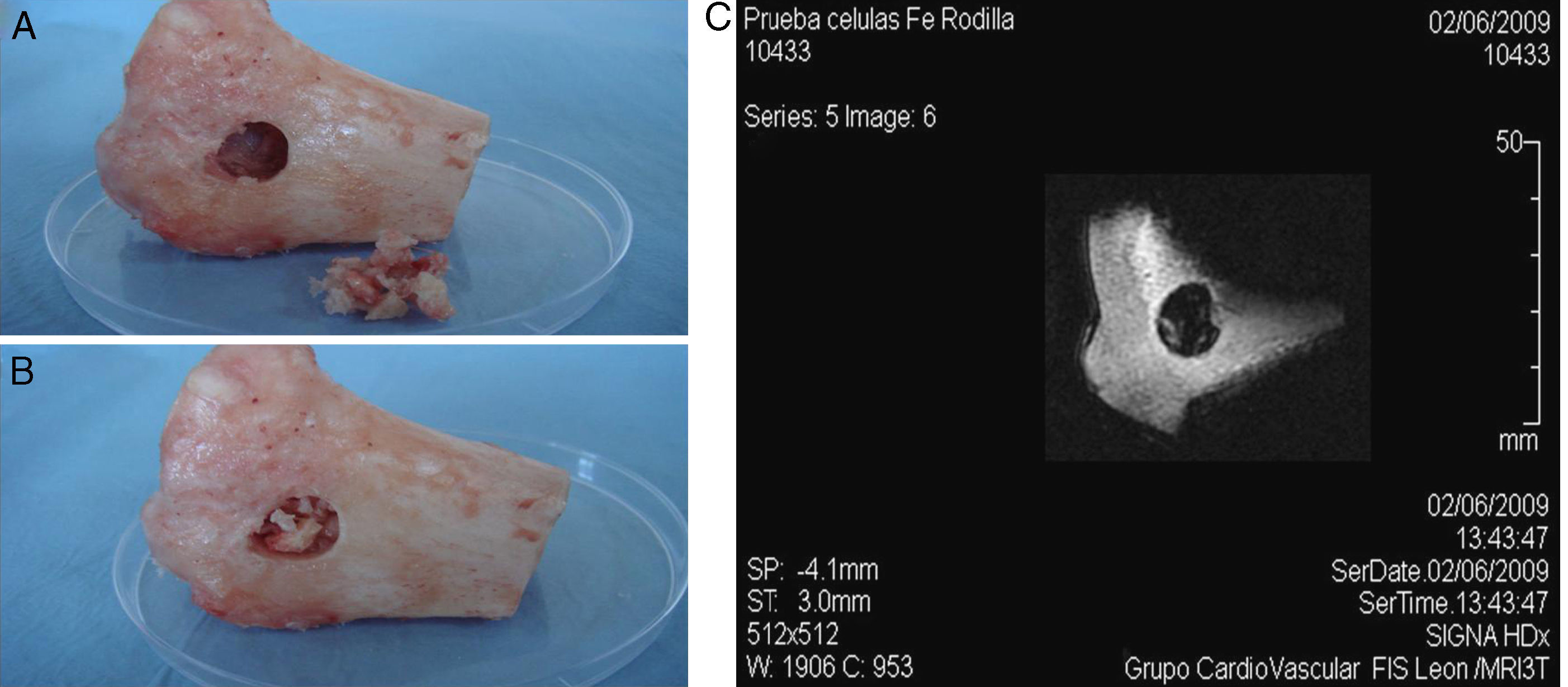
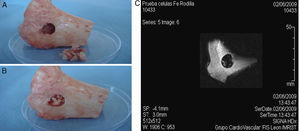
En segundo lugar, se realizaron tres defectos de tipo cavitario de 13 × 11mm en el lado interno de sendas mesetas tibiales procedentes de ovejas adultas que habían sido sacrificadas tras otros ensayos experimentales10. En el interior del defecto óseo se implantaron 1,5 × 106 ADMSCs marcadas y embebidas en PRP y xenoinjerto óseo liofilizado, intentando reproducir las condiciones ideales de tratamiento de este tipo de patologías mediante técnicas de ingeniería tisular11. Inmediatamente después se trató de localizar la población celular marcada en el interior del defecto óseo mediante imagen por RM.
ResultadosAislamiento de ADMSCs y cultivo primarioDe las 10 muestras de tejido adiposo ovino obtenidas, tres fueron desechadas por contaminación bacteriana. A partir de las 7 muestras restantes se obtuvo un rendimiento celular medio de 172±132 células por mg de tejido digerido, dando lugar al mismo número de cultivos primarios viables.
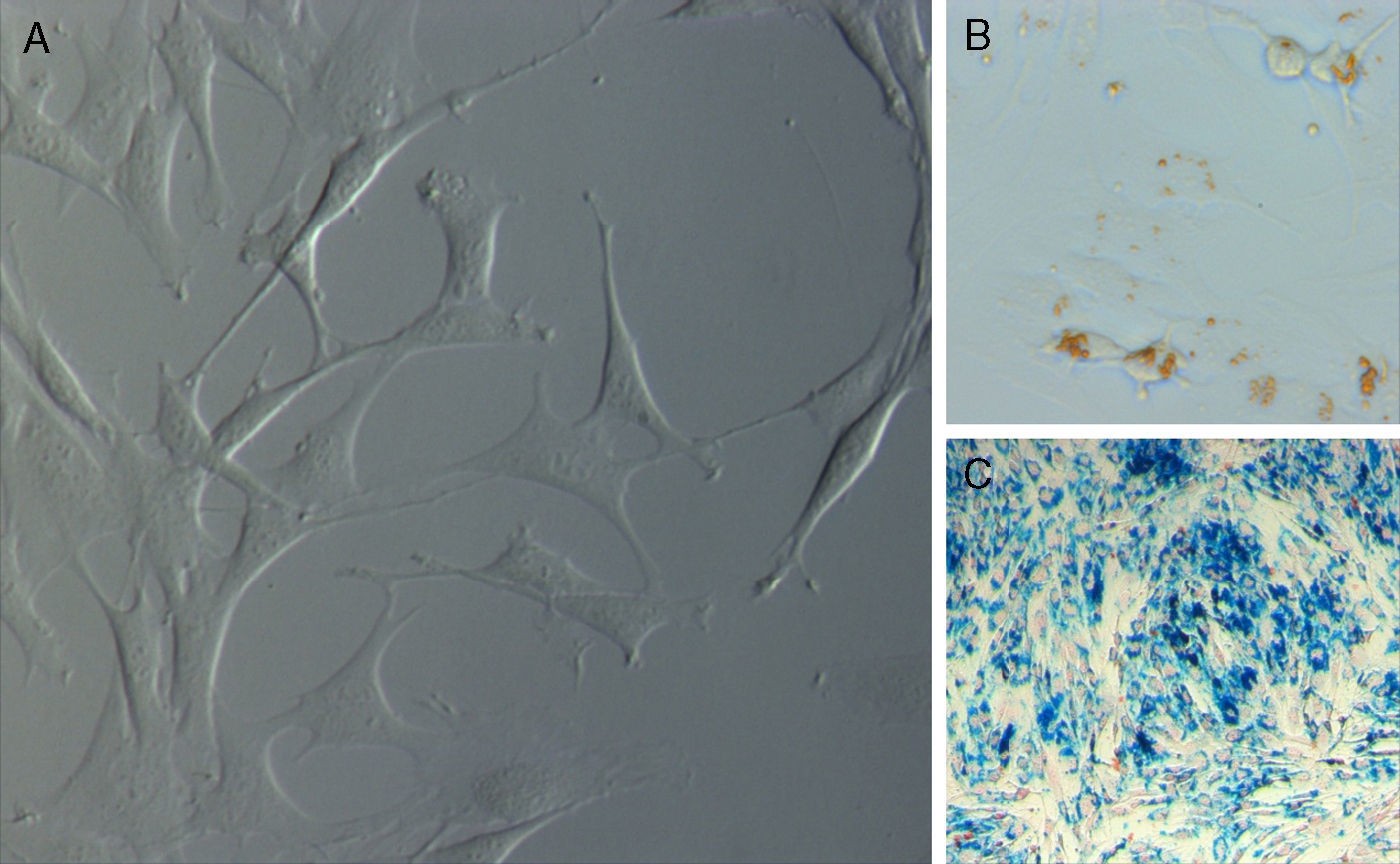
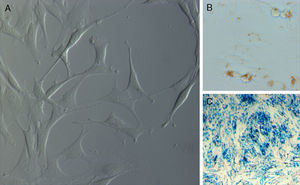
Tras el lavado de los pocillos a las 48 horas del establecimiento del cultivo primario, las células adherentes evolucionaron de una morfología redondeada hacia una fusiforme, bipolar o tripolar, con largas prolongaciones citoplasmáticas, y proliferaron uniformemente, sin formar colonias, hasta conformar una monocapa (fig. 1A).
Los cultivos primarios tardaron una media de 9 días en alcanzar el estado de preconfluencia obteniéndose una tasa de expansión media de 4 veces el número de células originales.
Marcaje de ADMSCs con SPIOEl método de marcaje utilizado resultó ser efectivo. Dicho marcaje era visible mediante microscopio de contraste de fases observándose como partículas oscuras de color parduzco en el interior de las células en cultivo.
La tinción azul de Prusia confirmó la presencia de partículas de hierro en el interior de más del 90% de las células en cultivo, observándose éstas como partículas de color azul (fig. 1B y C).
Inocuidad del marcaje con SPIOLos patrones de crecimiento y multipotencialidad de las poblaciones de ADMSCs no se vieron alterados por el marcaje intracelular con SPIO.
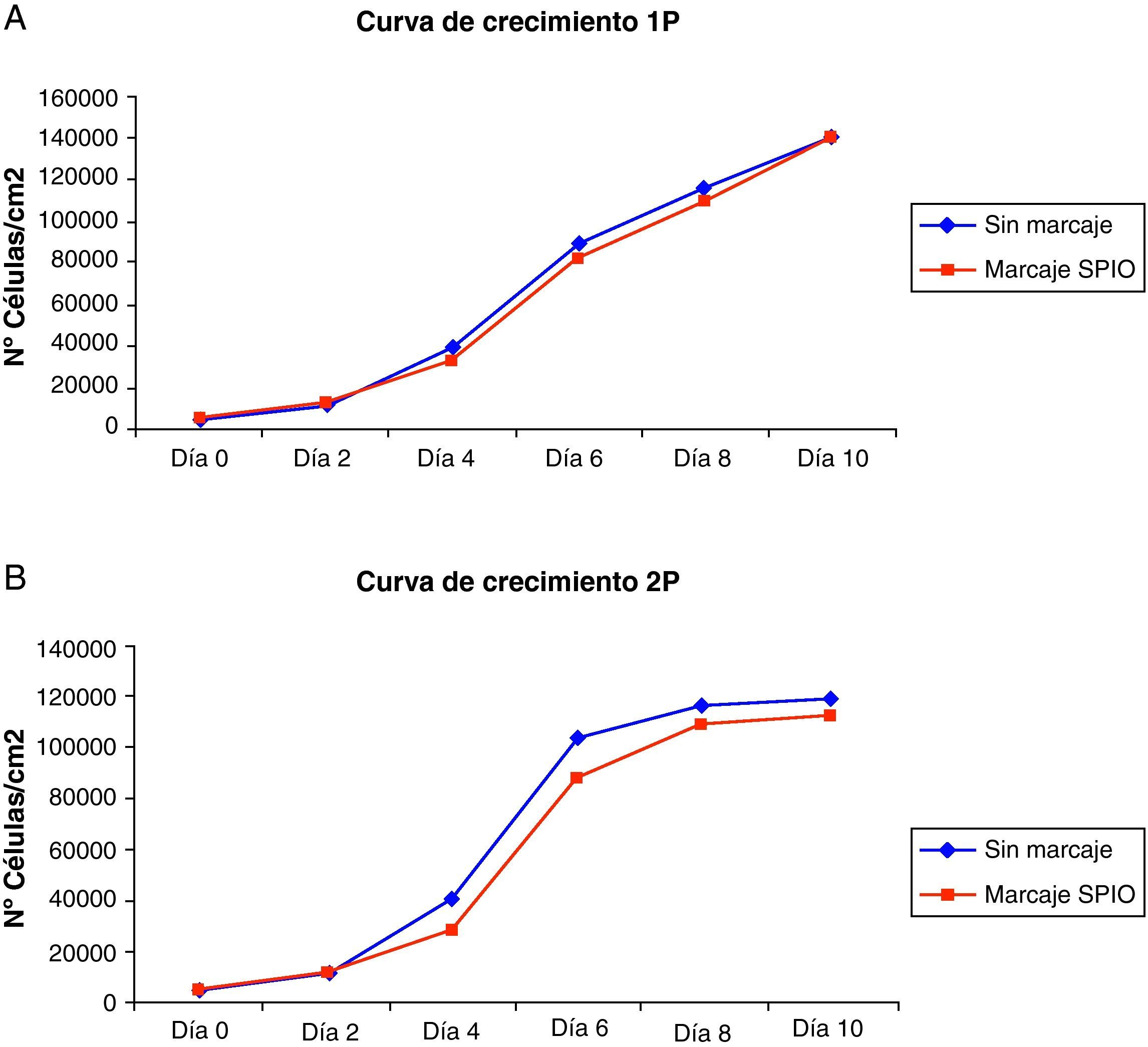
Las curvas de crecimiento de los cultivos de ADMSCs marcados con SPIO mostraron un patrón estándar en el que se observaba una corta fase de latencia seguida de una fase de crecimiento exponencial hasta alcanzar la fase estacionaria al cabo de 8-10 días. No se observaron diferencias estadísticamente significativas con respecto a las poblaciones celulares control. No obstante, tras el procedimiento de marcaje con SPIO se observó un leve descenso en el número de células respecto a los pocillos control debido a que los lavados para eliminar el hierro no internalizado arrastraron algunas de las células en cultivo (fig. 2).
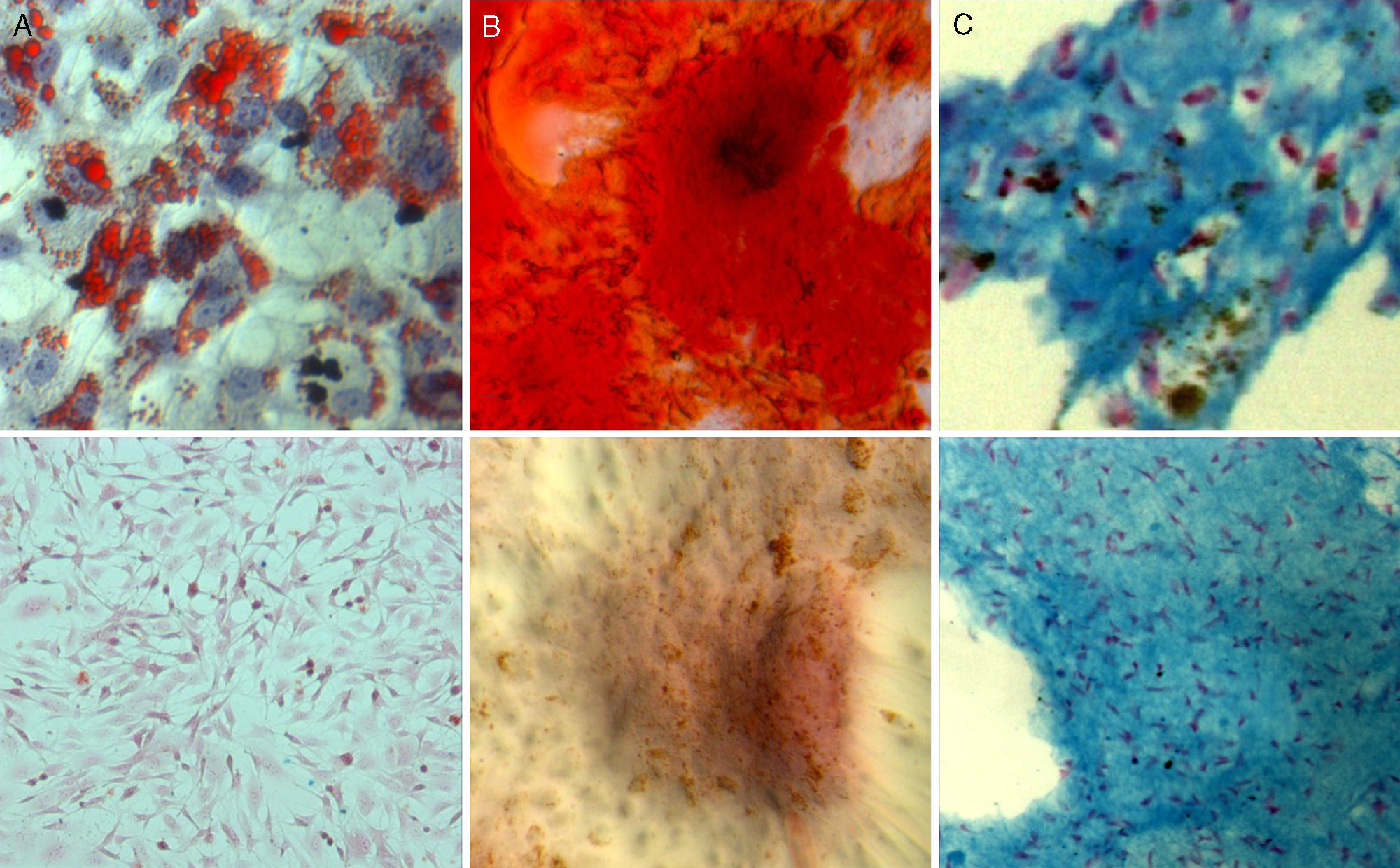
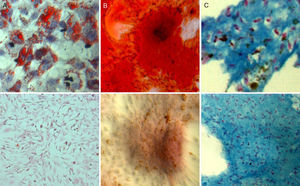
Con respecto a la multipotencialidad, las poblaciones celulares marcadas mantuvieron su capacidad de diferenciación hacia diferentes estirpes celulares de manera similar a las poblaciones control (fig. 3).
- 1.
Diferenciación adipogénica: al cabo de tres días de inducción adipogénica se observó un cambio en la morfología de las células en cultivo, que pasaron de mostrar una morfología fibroblástica con finas prolongaciones a una morfología más estrellada. Tras 7 días de cultivo en medio adipogénico, la tinción Oil Red O puso en evidencia la formación de vacuolas lipídicas en el interior de las células marcadas.
- 2.
Diferenciación osteogénica: el cultivo de ADMSCs marcadas con SPIO en medio osteogénico provocó un cambio en el patrón de crecimiento y distribución de las células en cultivo que se tradujo en la formación de nódulos celulares que mostraron signos de mineralización tras la tinción con Alizarin Red. Dicha mineralización comenzó a ser evidente a los 7 días de inducción y fue más intensa a los 14 y 21 días de cultivo en medio osteogénico.
- 3.
Diferenciación condrogénica: el cultivo tridimensional en matriz de fibrina de las poblaciones celulares marcadas en medio condrogénico durante 21 días provocó un cambio de la morfología celular que pasó de una forma fusiforme a otra redondeada. Las células se dispusieron en lagunas dentro de la matriz, y la tinción azul Alcian puso de manifiesto la presencia de proteoglicanos en las zonas de la matriz cercanas a las células diferenciadas.
En la figura 4 se muestra la imagen obtenida mediante RM de las poblaciones celulares marcadas y las poblaciones celulares control embebidas en plasma ovino. Se observa claramente que las poblaciones celulares marcadas con SPIO mostraron una señal hipotensa respecto al músculo en T2/T2*, mientras que en los tubos que contenían poblaciones celulares no marcadas no se aprecian cambios en la intensidad de la señal.
De manera similar, al implantar las células marcadas con SPIO junto con plasma ovino y xenoinjerto óseo liofilizado en un defecto de tipo cavitario realizado en la pieza ósea, fue posible localizar las poblaciones celulares marcadas mediante RM, mostrando una señal hipotensa en T2/T2* (fig. 5).
Pruebas de RMN. A) Meseta tibial ovina con defecto óseo de tipo cavitario. B) En la lesión se introduce hueso esponjoso liofilizado embebido en PRP conteniendo la población celular marcada con SPIO (constructo). C) Imagen de RMN de la pieza ósea tras el implante del constructo en la lesión.
En los últimos años, la sociedad médica y científica ha experimentado un enorme interés por las células madre adultas y su potencial terapéutico. En el campo de la cirugía ortopédica se ha aplicado en el tratamiento de necrosis avasculares de la cabeza femoral12 y cóndilos femorales13, en la reconstrucción de defectos óseos tras cirugía tumoral14 o en la consolidación de fracturas15. Sin embargo, la aplicación de técnicas de ingeniería tisular con células madre adultas para el tratamiento de lesiones del sistema óseo está aún en sus comienzos, dado que todavía no conocemos los mecanismos por los que la terapia celular influye en el tratamiento de la enfermedad.
El estudio de la biodistribución y permanencia de las células madre adultas una vez implantadas en el organismo vivo es esencial para garantizar la seguridad y eficacia de cualquier terapia basada en el empleo de células madre2–4. Diversas técnicas han sido utilizadas con este objetivo, como han sido los rayos X, la tomografía (tomografía computarizada, la tomografía por emisión de positrones o la tomografía computarizada por emisión de fotón único)3,5, o métodos ópticos basados en moléculas fluorescentes o bioluminiscentes2,5.
La resonancia magnética es una modalidad de obtención de imágenes cuya utilidad en el seguimiento de células en el organismo vivo es especialmente interesante, dado que permite obtener imágenes multiplanares a tiempo real con una gran resolución de contraste y de manera no invasiva4,5. Además, permite hacer un seguimiento a largo plazo sobre la posible proliferación y migración de las células implantadas.
Para el seguimiento de las poblaciones celulares implantadas, éstas deben ser previamente marcadas con un agente visible en imagen por RM.
Los agentes de contraste pueden clasificarse en función de que produzcan contraste en T1 o en T2/T2*. Los agentes de contraste en T1 utilizan gadolinio, que permite realizar un seguimiento de las poblaciones celulares implantadas de hasta 6 semanas, pero que requiere de altas concentraciones para ser visible5. Los agentes de contraste en T2/T2* son los más ampliamente utilizados para el seguimiento celular por RM dado que el empleo de SPIO permite la detección de un pequeño número de células durante 12 semanas5. Además, su uso en humanos ha sido aprobado por la FDA, dado que es biocompatible, seguro y no tóxico4,16.
El presente estudio analiza la efectividad del marcaje de células madre adultas derivadas de tejido adiposo ovino con SPIO (Endorem®), así como su efecto sobre la viabilidad y multipotencialidad celular.
Sobre la metodología de marcaje utilizada en el estudio, se emplea una baja concentración de hierro (50μl/ml) y sulfato de protamina como agente trasfectante, produciendo una alta tasa de internalización de las SPIO al cabo de 12 horas de incubación, similar a la obtenida con otros agentes como la lipofectamina17 o la polilisina18.
En cuanto a la inocuidad del marcaje, los resultados del estudio demuestran que las SPIO no afectan a la viabilidad ni a la multipotencialidad de las ADMSCs ovinas, de manera similar a lo ya descrito por otros grupos con otros tipos celulares como miofibroblastos y células mononucleares de médula ósea8,19 o incluso ADMSCs de origen humano20. Las poblaciones celulares marcadas mantienen patrones de proliferación similares a las poblaciones control, y son capaces de diferenciarse hacia células maduras de distintas estirpes celulares (de tipo adipocítico, condrocítico y osteoblástico) de manera análoga a lo descrito por Arbab et al. para otros tipos celulares21.
La observación mediante RM de las poblaciones celulares marcadas embebidas en plasma gelificado demuestra que son perfectamente distinguibles de las poblaciones celulares control. Como en estudios previos3,4,7,8,16, el marcaje produce un descenso en la intensidad de señal en T2/T2*, haciendo posible la técnica para realizar seguimientos en vivo de las poblaciones celulares implantadas en el tejido óseo de manera similar a lo ya descrito en tejido cardiaco5, cerebral7 e intervertebral8.
ConclusiónA la vista de los resultados del presente estudio, podemos concluir que el marcaje de poblaciones de ADMSCs ovinas con SPIO y sulfato de protamina es inocuo y permite que las poblaciones celulares proliferen y se diferencien de manera similar a las poblaciones control. Dicho marcaje es visible mediante imágenes de RM y permite la monitorización de células implantadas en defectos óseos.
De tal forma, los resultados del presente estudio proporcionan datos suficientes para continuar la investigación con estudios en animal de experimentación que posibiliten la monitorización de las células implantadas en defectos óseos mediante técnicas de imagen basadas en RM.
Nivel de evidenciaEstudio experimental II.
FinanciaciónExcma. Diputación Provincial de León, Obra Social de Caja España.
Protección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Excma. Diputación Provincial de León, Obra Social de Caja España.