Los defectos óseos son una de las principales limitaciones en cirugía ortopédica y traumatología. Por ello, se han desarrollado múltiples sistemas de sustitución ósea, ya sea mediante implante protésico o mediante sustitución con sustancias osteoformadoras, cuyas limitaciones son su supervivencia y falta de estructuralidad, respectivamente. El objetivo del presente trabajo es la generación de un nuevo material para la creación de estructuras biológicamente activas que dispongan de la resistencia a la tracción suficiente como para mantener la estructura durante la remodelación.
Material y métodosSe diseñó un nuevo filamento basado en la fusión de ácido poliláctico (PLA) natural en polvo para la generación de piezas mediante el modelado por deposición fundida (FDM) sobre las que se realizaron ensayos mecánicos a tracción de material de osteosíntesis. Se analizaron un total de 13 grupos con distinto grosor cortical, relleno y altura de capa, con 10 ensayos de tracción en cada grupo, definiendo el límite de rotura a la tracción para cada grupo. Se determinaron las rectas de regresión para cada grupo y su resistencia mecánica a la tracción sobre el filamento empleado.
ResultadosEl ratio de filamento por unidad de superficie de contacto con la osteosíntesis empleada fue el principal determinante de la resistencia mecánica a la tracción, ya sea a expensas del aumento del grosor cortical o por el aumento en el porcentaje de relleno del hueso esponjoso. La altura de capa tuvo un efecto menor sobre la resistencia a la tracción. El valor de regresión fue alto para el grosor cortical y el relleno de esponjosa, siendo elementos con un comportamiento biomecánico predecible.
ConclusionesLa nueva metodología permite crear matrices óseas personalizadas de PLA neutro implantable para la reconstrucción de grandes defectos óseos mediante impresión 3D por FDM con una resistencia mecánica a la tracción mayor a la de estructuras biológicas de soporte actuales.
Bone defects are one of the main limitations in orthopedic surgery and traumatology. For this reason, multiple bone replacement systems have been developed, either by prosthetic implant or by substitution with osteoforming substances, whose limitations are their survival and lack of structurality, respectively. The objective of this work is the generation of a new material for the creation of biologically active structures that have sufficient tensile strength to maintain the structure during remodeling.
Material and methodsA new filament based on the fusion of natural polylactide acid (PLA) powder was designed for the generation of pieces by means of fused deposition modeling (FDM) on which to carry out tensile mechanical tests of osteosynthesis material. A total of 13 groups with different cortical thickness, filling and layer height were carried out, with 10 tensile tests in each group, defining the tensile breaking limit for each group. The regression lines for each group and their mechanical resistance to traction on the filament used were determined.
ResultsThe filament ratio per contact surface unit with the osteosynthesis used was the main determinant of the mechanical resistance to traction, either at the expense of the increase in cortical thickness or by the increase in the percentage of cancellous bone filling. Layer height had a minor effect on tensile strength. The regression value was high for cortical thickness and cancellous filling, being elements with a predictable biomechanical behavior.
ConclusionsThe new methodology allows the creation of personalized neutral and implantable PLA bone matrices for the reconstruction of large bone defects by means of 3D printing by FDM with a mechanical resistance to traction greater than that of current biological support structures.
Los defectos óseos son una de las principales limitaciones para la reconstrucción en cirugía ortopédica y traumatología1. Existen múltiples técnicas de reconstrucción cuando hay presente un defecto óseo, desde aloinjertos hasta megaprótesis incluyendo técnicas de transporte óseo, autoinjertos vascularizados, generación de seudomembranas, entre otros2–8. La principal complicación de las técnicas biológicas (uso de sustitutos óseos o técnicas de neoformación ósea) son la infección (especialmente en aloinjertos) y la ausencia de consolidación, mientras que en las técnicas no biológicas (sustitución metálica) la principal limitación es la supervivencia. La ventaja de la sustitución protésica incluye la mayor rapidez de la técnica y de la recuperación, mientras que la principal ventaja del uso de técnicas biológicas es la mayor supervivencia si no hay complicaciones durante el proceso.
Existen decenas de materiales osteoinductores que permiten la neoformación ósea, desde polímeros a cerámicas sintéticas, que permiten recuperar la estructuralidad en grandes defectos óseos3,9. Su principal limitación es su resistencia mecánica ya que la mayoría de estos sistemas, una vez aplicados al paciente, no permiten soportar la carga necesaria para mantener un segmento corporal funcional.
La impresión por fabricación aditiva es una técnica de fabricación que permite obtener estructuras tridimensionales mediante el modelado por deposición fundida (FDM) empleando un material termoplástico y siguiendo una morfología definida mediante código numérico10. Gracias a la liberación de la patente de esta metodología de fabricación, la segunda década del siglo xxi ha experimentado un crecimiento exponencial de máquinas de impresión mediante esta tecnología. De igual modo, se ha mejorado el software de diseño, hasta el punto de que actualmente existen en el mercado impresoras de estructuras tridimensionales (3D) domésticas, usadas habitualmente por la población general. Estos dispositivos, emplean un filamento de diámetro variable (en función de la impresora), siendo el más habitual de 1,75mm, con el que se pueden generar objetos con prácticamente cualquier morfología.
El ácido poliláctico (PLA) es uno de los materiales biocompatibles más utilizados para el diseño de implantes6,11,12. Además, el PLA es el material más habitualmente empleado para la impresión 3D doméstica, ya que su temperatura de fusión es óptima para las impresoras 3D por FDM (entre 180 y 220° según su composición). Su forma natural tras la extracción es de polvo termosensible y la limitación para el uso de filamentos de PLA ya en el mercado es la presencia de sustancias que pueden interferir en el proceso de osteoinducción, aunque ya existan algunos que cuenten con el marcado ISO 10993-1 de biocompatibilidad.
No existe en el mercado ningún filamento compuesto únicamente por PLA natural, ya que, por su uso para el modelado de piezas, se acompaña de distintas sustancias que aumentan su apariencia estética y su facilidad de uso. Sin embargo, los aditivos contraindican su uso para sintetizar productos implantables. Por otra parte, el problema del uso de bioimpresoras para la generación de matrices óseas es su precio y la baja resistencia mecánica de sus productos6.
El objetivo del presente trabajo es la generación de un filamento que pueda ser empleado por un sistema de impresión 3D por FDM que permita obtener estructuras mecánicamente competentes para dotar de estructuralidad a los compuestos osteoinductores habituales empleados actualmente en defectos óseos, y revisar otras aplicaciones potenciales de estas matrices óseas en la práctica clínica como la formación o la planificación.
Material y métodosEstudio prospectivo experimental desarrollado en condiciones in vitro.
Descripción del dispositivo para la generación de filamentoEl primer punto clave del proyecto fue la generación de un filamento de diámetro constante entorno a 1,75mm que fuera implementable en una impresora 3D de fabricación por FDM. Para ello, diseñamos específicamente un mecanismo para la síntesis PLA neutro a partir de su forma natural en polvo.
El dispositivo constó de 3 segmentos independientes:
- a)
Segmento de fusión del polvo: controlado mediante sensores de temperatura y una resistencia térmica, era posible ajustar la temperatura de fusión. En el extremo distal del fusor, se implementó una boquilla de 1,75mm para la generación de un filamento de diámetro constante.
- b)
Segmento de extrusión del polvo: el polvo fue arrastrado por un tornillo sin fin movido por un motor paso a paso controlado por mediante software Arduino® (Arduino® v.1.8.18 Windows). El tornillo sin fin recogió el polvo depositado en la tobera y lo arrastró hasta el fusor.
- c)
Sistema de recolección del filamento: una vez fundido el polvo, se realizó una recolección y embobinado mediante una bobina controlada por código numérico con un motor paso a paso (Arduino® v.1.8.18 Windows) (fig. 1).
Se definieron la velocidad de los motores del extrusor y de la bobina de recolección para obtener un filamento de diámetro constante de 1,75mm. Para evaluar la tolerancia del filamento se realizaron 10 mediciones del grosor con un calibrador, siendo el intervalo entre los puntos de 20cm. Se definió el diámetro medio del filamento y la desviación estándar entre las mediciones. El diámetro objetivo fue de 1,75mm con una tolerancia de error ±0,1mm.
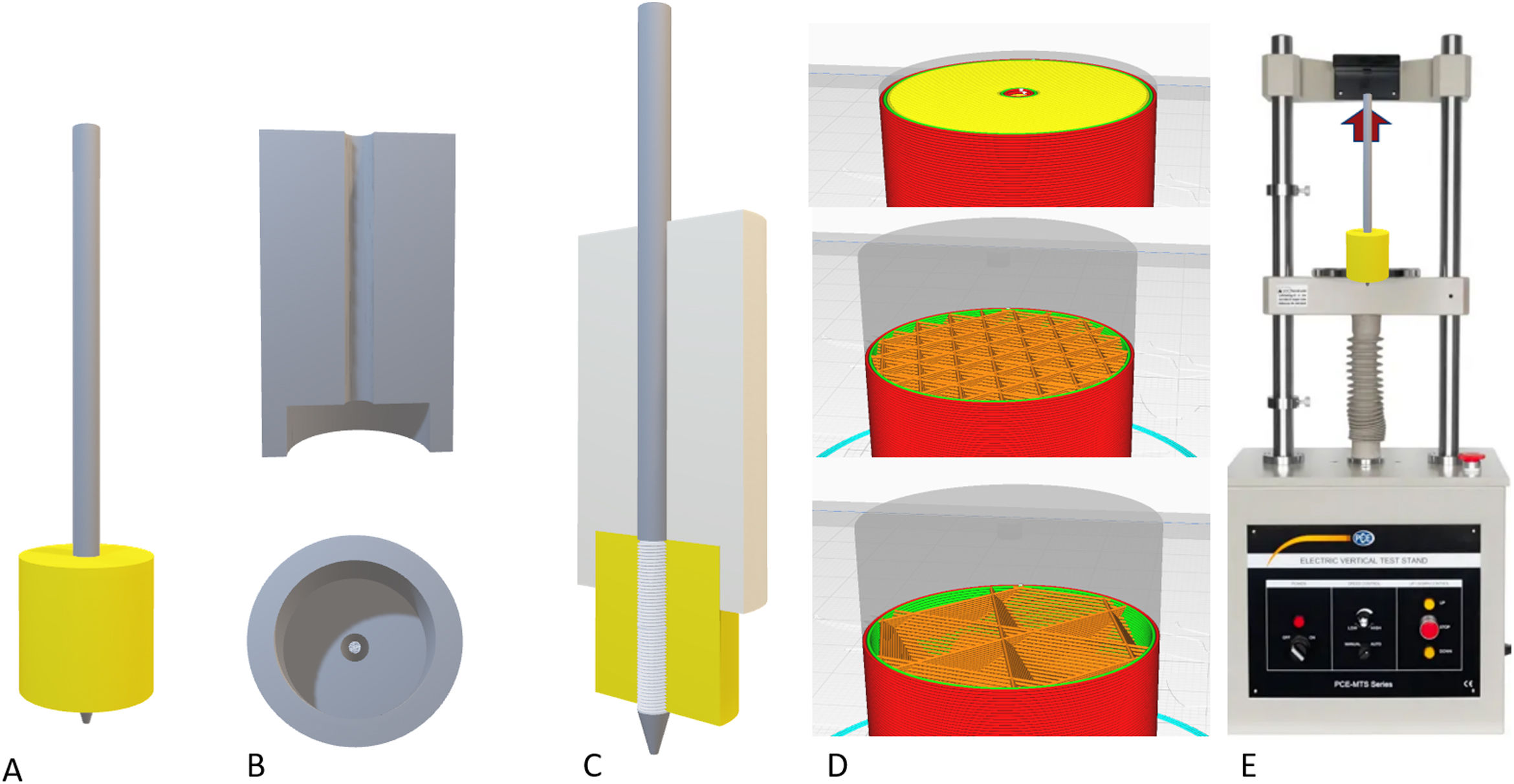
Evaluación biomecánica del filamentoTras la generación del filamento y la determinación de un diámetro y tolerancia adecuados, se realizó la impresión de distintas piezas cilíndricas para evaluar la resistencia mecánica a la tracción de un tornillo de osteosíntesis insertado en las piezas impresas de forma bicortical (fig. 2).
Montaje de los modelos para los ensayos de carga. A) Montaje definitivo con la espira (30mm) completamente insertada en el modelo. B) Sistema empleado para la introducción del pin de forma perfectamente perpendicular al modelo. C) Montaje definitivo del pin sobre el modelo, manteniendo la pieza de inserción. D) Ejemplos del patrón cortical (arriba), esponjosa con un 30% de relleno (centro) y con un 10% de relleno (abajo). E) Muestra del escenario para el ensayo de tracción.
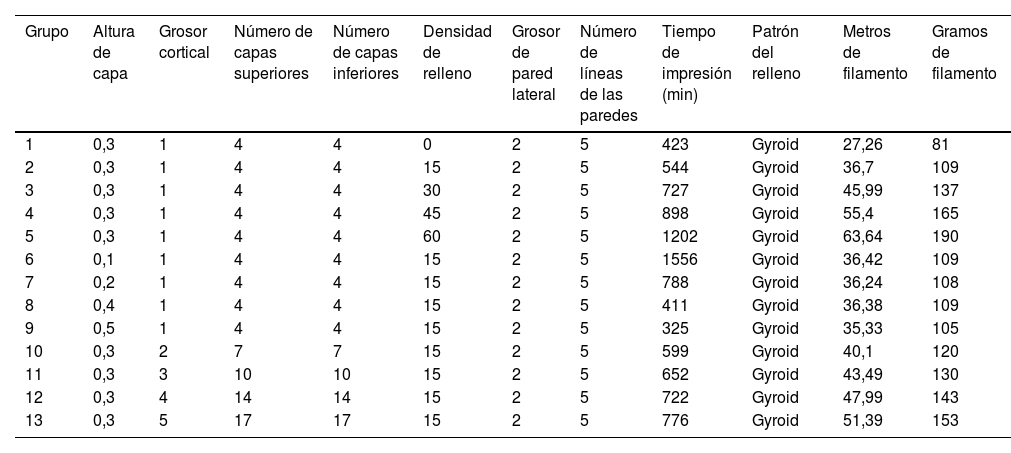
Se diseñaron un total de 13 grupos de piezas en las que se modificaron la altura de capa, el porcentaje de relleno y el grosor de las paredes (tabla 1), y se recogió el tiempo de impresión para cada grupo (tabla 1). Se realizó la impresión de 10 piezas por grupo, siendo un total de 130 ensayos mecánicos. El efecto del hueso esponjoso sobre la resistencia a la tracción se evaluó mediante la modificación del relleno del modelo, comparando los grupos 1 a 5. Para evaluar el efecto de la altura de capa, se comparó la resistencia a la tracción entre los grupos 6 a 9 y para evaluar el efecto del grosor cortical se compararon los grupos 10 a 13 (tabla 1).
Descripción de los parámetros de los grupos empleados para el análisis biomecánicoA, B
| Grupo | Altura de capa | Grosor cortical | Número de capas superiores | Número de capas inferiores | Densidad de relleno | Grosor de pared lateral | Número de líneas de las paredes | Tiempo de impresión (min) | Patrón del relleno | Metros de filamento | Gramos de filamento |
|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 0,3 | 1 | 4 | 4 | 0 | 2 | 5 | 423 | Gyroid | 27,26 | 81 |
| 2 | 0,3 | 1 | 4 | 4 | 15 | 2 | 5 | 544 | Gyroid | 36,7 | 109 |
| 3 | 0,3 | 1 | 4 | 4 | 30 | 2 | 5 | 727 | Gyroid | 45,99 | 137 |
| 4 | 0,3 | 1 | 4 | 4 | 45 | 2 | 5 | 898 | Gyroid | 55,4 | 165 |
| 5 | 0,3 | 1 | 4 | 4 | 60 | 2 | 5 | 1202 | Gyroid | 63,64 | 190 |
| 6 | 0,1 | 1 | 4 | 4 | 15 | 2 | 5 | 1556 | Gyroid | 36,42 | 109 |
| 7 | 0,2 | 1 | 4 | 4 | 15 | 2 | 5 | 788 | Gyroid | 36,24 | 108 |
| 8 | 0,4 | 1 | 4 | 4 | 15 | 2 | 5 | 411 | Gyroid | 36,38 | 109 |
| 9 | 0,5 | 1 | 4 | 4 | 15 | 2 | 5 | 325 | Gyroid | 35,33 | 105 |
| 10 | 0,3 | 2 | 7 | 7 | 15 | 2 | 5 | 599 | Gyroid | 40,1 | 120 |
| 11 | 0,3 | 3 | 10 | 10 | 15 | 2 | 5 | 652 | Gyroid | 43,49 | 130 |
| 12 | 0,3 | 4 | 14 | 14 | 15 | 2 | 5 | 722 | Gyroid | 47,99 | 143 |
| 13 | 0,3 | 5 | 17 | 17 | 15 | 2 | 5 | 776 | Gyroid | 51,39 | 153 |
| Grupo | Área de contacto cortical bicortical | Área de contacto cortical monocortical | Área de contacto esponjosa | Área de contacto total bicortical | Área de contacto total monocortical |
|---|---|---|---|---|---|
| 1 | 18,84 | 9,42 | 0 | 18,84 | 9,42 |
| 2 | 18,84 | 9,42 | 79,128 | 97,968 | 88,548 |
| 3 | 18,84 | 9,42 | 158,256 | 177,096 | 167,676 |
| 4 | 18,84 | 9,42 | 237,384 | 256,224 | 246,804 |
| 5 | 18,84 | 9,42 | 316,512 | 335,352 | 325,932 |
| 6 | 18,84 | 9,42 | 79,128 | 97,968 | 88,548 |
| 7 | 18,84 | 9,42 | 79,128 | 97,968 | 88,548 |
| 8 | 18,84 | 9,42 | 79,128 | 97,968 | 88,548 |
| 9 | 18,84 | 9,42 | 79,128 | 97,968 | 88,548 |
| 10 | 37,68 | 18,84 | 73,476 | 111,156 | 92,316 |
| 11 | 56,52 | 28,26 | 67,824 | 124,344 | 96,084 |
| 12 | 75,36 | 37,68 | 62,172 | 137,532 | 99,852 |
| 13 | 94,2 | 47,1 | 56,52 | 150,72 | 103,62 |
Para definir la fuerza de tracción, se sometió a un ensayo de tracción en una máquina de ensayos (PCE MTS500, PCE Ibérica®) y se evaluó el límite de rotura mediante dinamometría (PCE-DFG N 5K), definiendo como variable de interés la fuerza máxima soportada con una resolución de 1N y una precisión de ±0,1%.
Se evaluó el área de contacto del tornillo con el filamento, teniendo en cuenta una sección constante de 6mm y una longitud del tornillo de 30mm. De esta forma, se determinó la presión soportada por unidad de superficie en cada una de las configuraciones.
Análisis estadísticoSe estableció un análisis descriptivo de la media y desviación estándar en cada uno de los grupos. El análisis estadístico se realizó para un error β de 0,2, un error α de 0,05, una precisión para la detección de variación entre grupos de 2.000kPa y una desviación estándar de un 5% respecto la media, de acuerdo con estudios exploratorios previos.
Se analizó el comportamiento «Normal» o «No normal» de los datos mediante el test de Lilliefors, asumiendo «Normalidad» con p-valores superiores a 0,05.
Para el análisis de la relación entre el valor de relleno, altura de capa y grosor de las corticales, con la fuerza soportada, se empleó un test de regresión lineal, ya que los datos se comportaron de forma «Normal». Por ello, se realizó una ecuación de predicción biomecánica en función del parámetro evaluado.
La estadística fue realizada mediante el software R statistics v. 4.2.1 «Funny-Looking Kid».
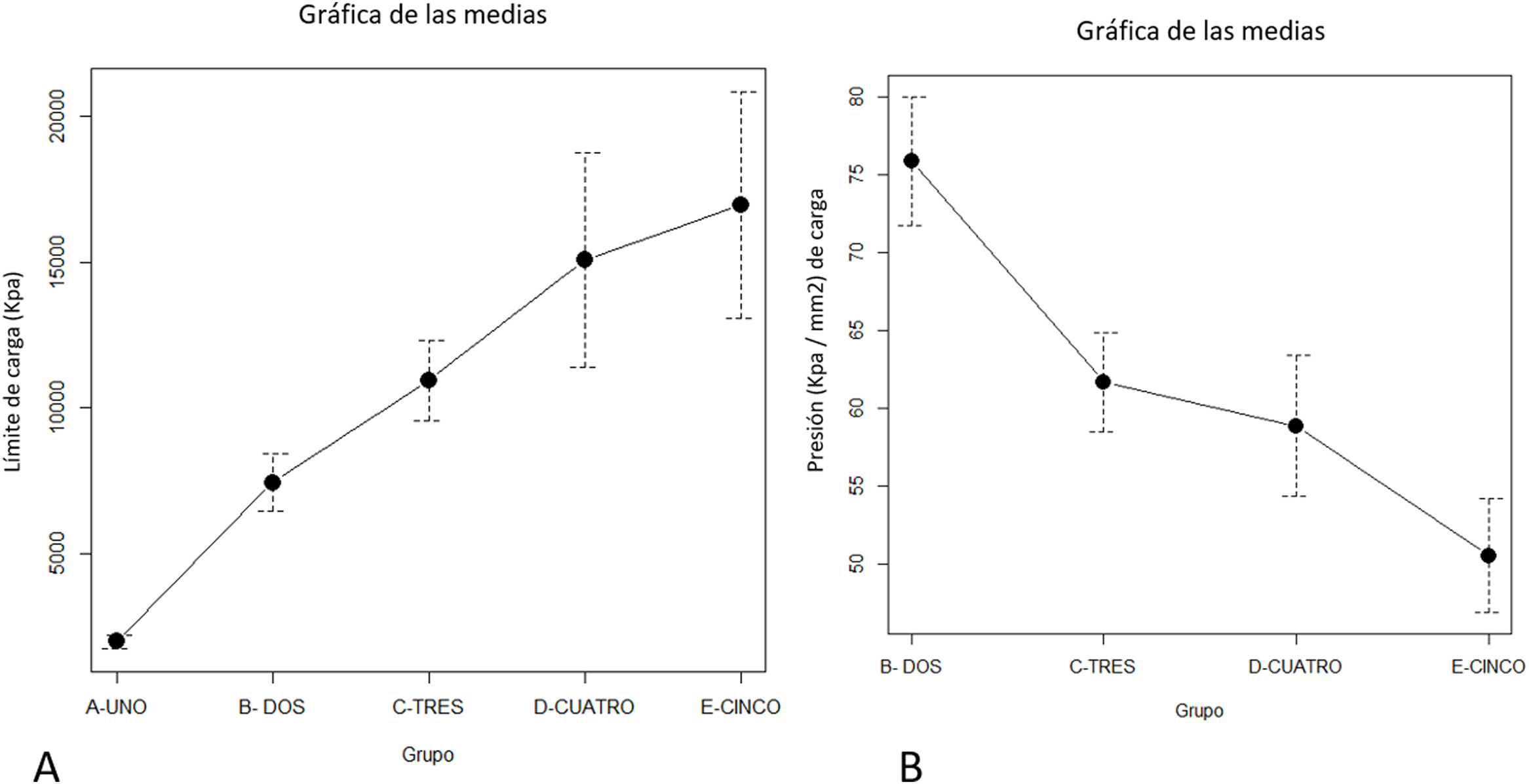
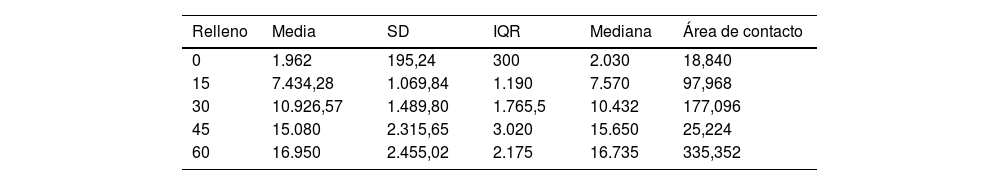
ResultadosEl aumento progresivo del relleno del biomodelo produjo un aumento lineal de la resistencia a la tracción, siendo el comportamiento lineal y el modelo predictor (R2=0,89; p valor <0,01; tabla 2A y fig. 3A). La desviación estándar de los grupos fue significativamente mayor con el aumento de la fuerza de tracción necesaria para producir el fallo mecánico (p valor <0,01).
Descripción de los parámetros de los grupos empleados para el análisis biomecánico
| Relleno | Media | SD | IQR | Mediana | Área de contacto |
|---|---|---|---|---|---|
| 0 | 1.962 | 195,24 | 300 | 2.030 | 18,840 |
| 15 | 7.434,28 | 1.069,84 | 1.190 | 7.570 | 97,968 |
| 30 | 10.926,57 | 1.489,80 | 1.765,5 | 10.432 | 177,096 |
| 45 | 15.080 | 2.315,65 | 3.020 | 15.650 | 25,224 |
| 60 | 16.950 | 2.455,02 | 2.175 | 16.735 | 335,352 |
| Relleno | Media | SD | IQR | Mediana |
|---|---|---|---|---|
| 0 | 104,14013 | 10,363240 | 15,923567 | 107,74947 |
| 15 | 75,88484 | 10,920321 | 12,146823 | 77,27013 |
| 30 | 61,69858 | 8,412419 | 9,969169 | 58,90590 |
| 45 | 58,85475 | 9,037627 | 11,786562 | 61,07937 |
| 60 | 50,54391 | 7,320732 | 6,485722 | 49,90279 |
IQR: interquartile range; SD: standard deviation.
A: fuerza máxima media (Kpa) de los distintos grupos. B: presión máxima media (fuerza por unidad de superficie) soportada por cada uno de los grupos.
La relación entre la fuerza soportada por unidad de superficie se mantuvo similar entre los grupos con relleno variable (p valor=0,34; tabla 2B y fig. 4B), con excepción del grupo 1, en el que la fuerza por unidad de superficie fue significativamente mayor al resto de los grupos (p valor 0,034).
A) Gráfica de las medias de la fuerza a la tracción en cada uno de los grupos con distinto grosor cortical. B) Relación de la fuerza por superficie entre los grupos con relleno variable y grosor cortical variable. El grosor cortical tuvo una mayor influencia sobre la resistencia a la tracción.
El aumento de la cortical fue el gesto que mayor aumento a la resistencia de tracción entre grupos (p valor <0,01) de modo que el aumento menor a un 10% produjo un aumento en la resistencia de tracción de prácticamente el doble (tabla 1 y fig. 4). El comportamiento entre los mm de grosor cortical y la resistencia a la tracción presentó un comportamiento lineal con un nivel alto de correlación (R2=0,89; p valor <0,01), produciendo el nivel máximo de fuerza definido previo al estudio en el tercer grupo de ensayo con un grosor de cortical de 3mm (fig. 4).
El aumento en la altura de las capas redujo la resistencia mecánica a la tracción con una relación lineal y un grado de predicción bajo (R2=0,57; p valor <0,001). Los gramos de filamento empleados para cada grupo no presentaron diferencias significativas, mientras que el tiempo empleado para cada grupo sí fue estadísticamente mayor (p valor <0,01).
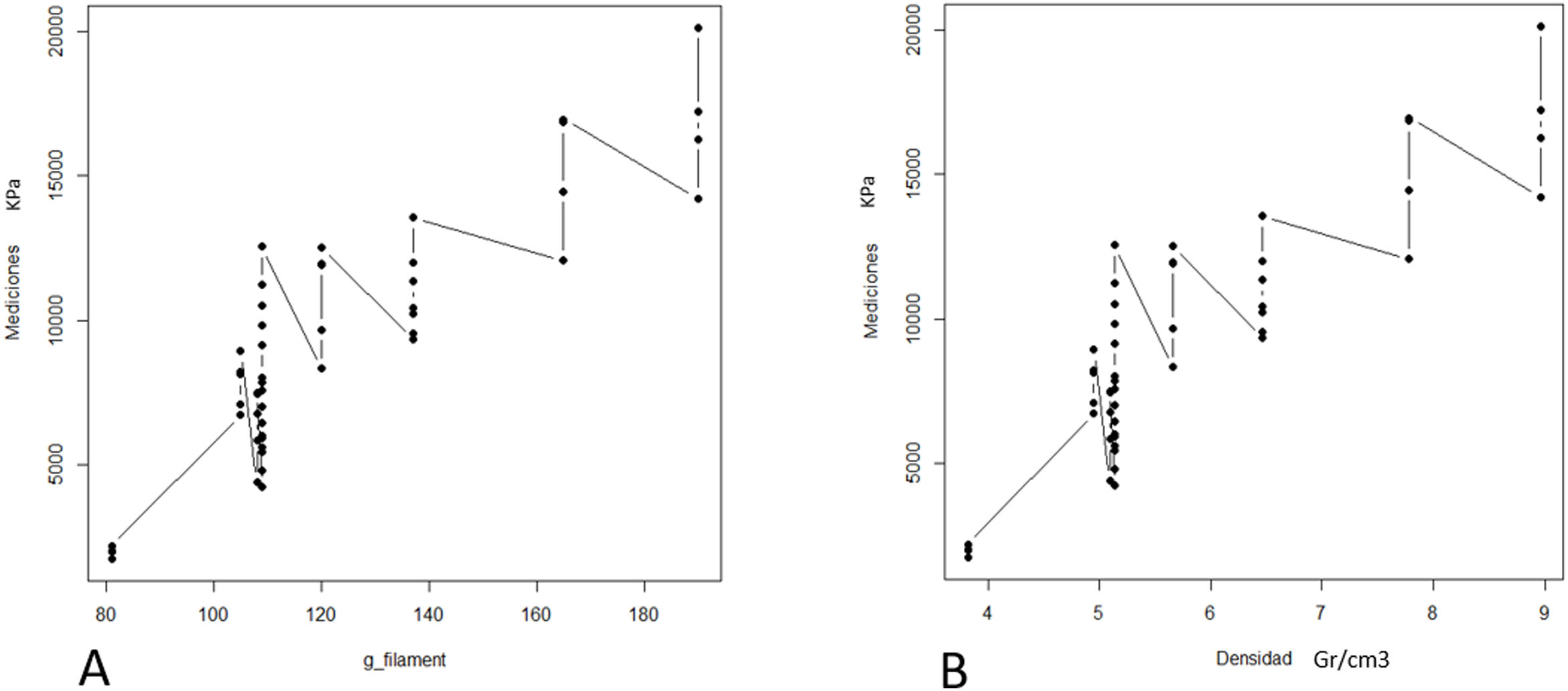
El aumento en la resistencia a la tracción se relacionó directamente con el área de contacto entre el tornillo y el filamento, independientemente de si el contacto se encontraba en el área esponjosa (relleno) o cortical (R2=0,76; p valor <0,01, fig. 5).
A) Diagrama de puntos entre el aumento del filamento empleado para la construcción del modelo y resistencia a la tracción, inpdendientemente de la disposición del filamento. B) Diagrama de puntos entre la densidad (g/cm3) del modelo y a resistencia a la tracción, independientemente de su disposición.
La resistencia mecánica de matrices impresas por FDM de PLA está directamente relacionada con los parámetros de impresión empleados, siendo el principal factor determinante de su resistencia el ratio de filamento por unidad de superficie de contacto con la osteosíntesis empleada. Podemos aumentar el cociente aumentando el contenido de filamento en la zona central o en la zona cortical, siendo equivalentes en cuanto a su efecto sobre la resistencia a la tracción.
La resistencia máxima conseguida mediante el sistema de fabricación propuesta es de cerca de 20.000kPa, lo que supone una resistencia similar a la del tejido óseo sano, siendo por lo tanto esta resistencia a la tracción suficiente para el uso clínico13. De esta forma, la matriz generada mediante el filamento podría dar estructuralidad al resto de elementos que se combinarían en el interior de la malla. Debido a que mediante la fabricación por FDM se puede generar prácticamente cualquier morfología, se podrían diseñar mallas que dieran soporte a cualquier osteoinductor de los presentes en el mercado, aportando la malla la estructura y la sustancia osteoinductora la función.
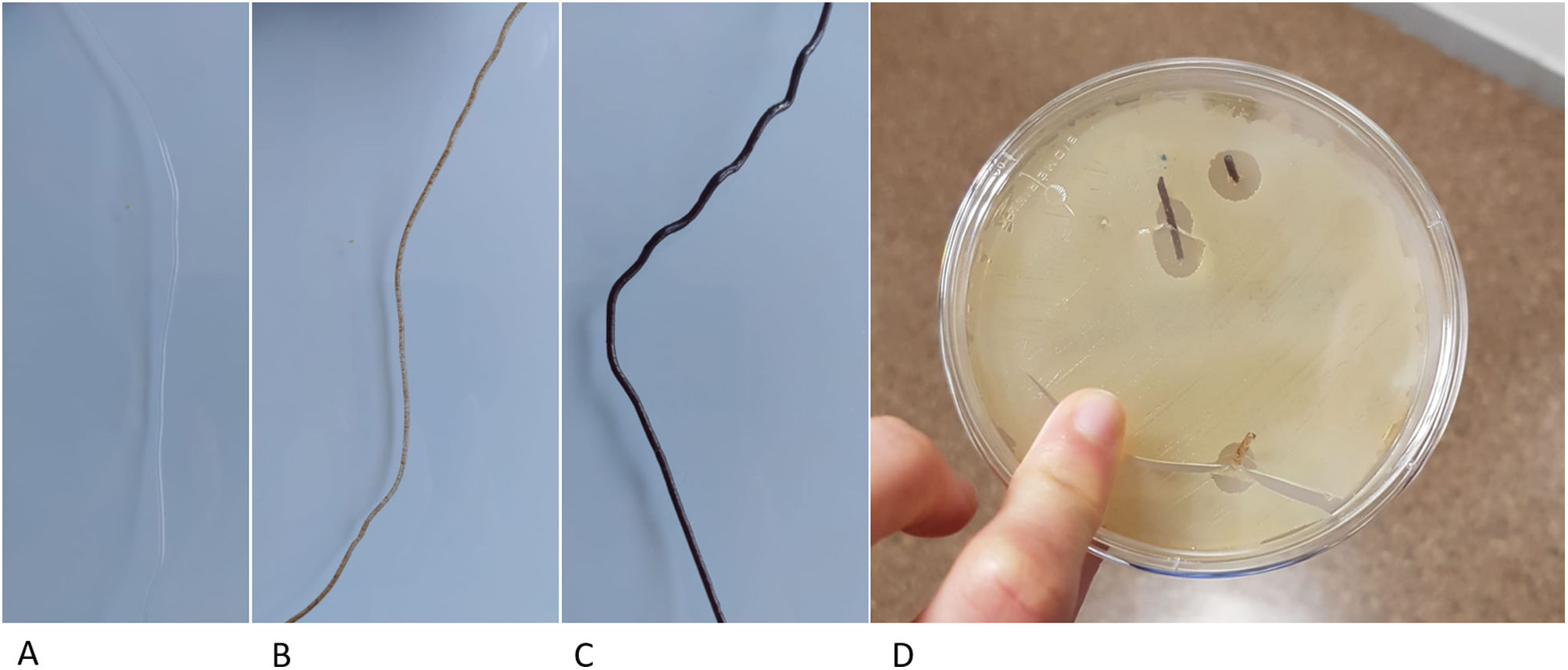
En estudios previos se han desarrollado otros sistemas para la síntesis de matrices basadas en PLA y construidas mediante tecnología FDM14, que generan la estructura directamente a partir del polvo, que es extruido a través de fusores específicos de bioimpresoras15 y contiene sustancias que pueden interferir en el proceso de osteoinducción. En cambio, nuestro protocolo propone la generación de un filamento de PLA neutro y por ello implantable, de diámetro constante, mediante un dispositivo específicamente diseñado para tal fin. Este filamento tiene unos resultados de resistencia biomecánica mejores y además permite ser empleado en impresoras 3D convencionales, reduciendo significativamente el precio de fabricación y, por lo tanto, mejorando su accesibilidad en la práctica clínica. Otra ventaja añadida del uso de PLA neutro es la capacidad de incorporar sustancias biológicamente activas a una matriz que le proporcione estructuralidad, como sustancias osteoinductoras, antibióticos y antineoplásicos. Mediante el control de la porosidad y la estructura interna, es posible personalizar el contenido de la matriz, siendo una oportunidad para nuevas líneas de investigación (fig. 6).
Filamento de PLA cargado con distintas sustancias. A) Filamento PLA neutro. B) Filamento con un 10% de contenido en hidroxiapatita, listo para emplearse para la creación de matrices con impresoras por FDM. C) Filamento con un 30% de hidroxiapatita. D) Filamento cargado con vancomicina en una placa Petri con patógenos sensibles a la vancomicina.
Existen trabajos previos sobre el uso del PLA como base para la incorporación de sustancias biológicamente activas como por ácido hialurónico14 o bioviodrio15, con resultados prometedores acerca del mantenimiento de la actividad de las sustancias incorporadas. La principal ventaja del uso de la tecnología FDM a partir de un filamento de PLA natural es la simplicidad a la hora de realizar la impresión, lo que repercute directamente en su coste, siendo una metodología accesible a nivel hospitalario. Por ello, esta tecnología resulta prometedora a la hora de la reconstrucción de grandes defectos óseos y para el tratamiento con terapias farmacológicas locales.
Por otra parte, el uso de biomodelos 3D para la planificación preoperatoria es de utilidad a la hora de predecir la suficiente estabilidad de un constructo de osteosíntesis. El uso de simulaciones por mecanismos de elementos finitos es complejo, ya que para ello son necesarias largas series de pacientes similares para poder establecer un modelo matemático, lo cual es complejo en traumatología por la gran cantidad de patrones distintos de fracturas y de pacientes que podemos encontrar16. Es por ello, que la mayoría de estudios siguen recomendando el uso de simulaciones sobre modelos reales17. Mediante el uso de los protocolos de impresión definidos, es posible la generación de biomodelos mecánicamente similares a la resistencia de un paciente concreto, pudiendo realizar ensayos mecánicos para determinar la configuración de osteosíntesis óptima previo a la cirugía13. Gracias a las nuevas técnicas de imagen, podemos realizar una estimación fiable de la resistencia mecánica del hueso de un paciente, adaptando la configuración del biomodelo impreso a los datos obtenidos mediante técnicas de imagen18,19.
Las principales limitaciones del presente trabajo son, por una parte, la falta de evaluación biomecánica en ciclos largos de carga, y por otra, la falta de ensayos de compresión y rotación. Nuestro objetivo es generar matrices que se comporten de forma similar al hueso sano, y dada la carencia de estudios biomecánicos con ciclos de repetición en huesos sanos, optamos por la evaluación de un ensayo de tracción único para así poder realizar una comparación cualitativa con los datos presentes, aunque el comportamiento in vivo es mucho más complejo20. Por otra parte, la resistencia a la compresión axial y a la rotación es determinante para cualquier implante. No obstante, las matrices que proponemos quedan fijadas a la zona de defecto mediante material de osteosíntesis, que soportaría la mayor parte de la resistencia mecánica hasta la consolidación. Por ello, no hemos realizado ensayos mecánicos en los 3 ejes del espacio, aunque sería interesante para futuros estudios.
Este es el primer estudio de validación mecánica en el filamento que presentamos, siendo su utilidad clínica todavía muy lejana. En futuros estudios, evaluaremos la influencia que pueda tener la degradación del PLA de nuestra matriz sobre los componentes osteoinductores que se introduzcan en ella, así como en fármacos implantables.
En conclusión, describimos en este estudio una nueva metodología para la creación de mallas personalizables para la reconstrucción de grandes defectos óseos mediante el uso de tecnología de impresión 3D por FDM, empleando PLA neutro implantable, con una resistencia mecánica a la tracción mayor a las estructuras de soporte actuales.
Nivel de evidenciaNivel de evidencia III.
FinanciaciónEl trabajo ha recibido financiación de la Sociedad Española de Cirugía Ortopédica y Traumatología mediante las becas de introducción a la investigación (2020) y de la Fundación AO mediante sus becas para la investigación (2021). Proyecto financiado mediante fondos nacionales para la investigación del centro para el desarrollo industrial (CDTI) en colaboración con el departamento de innovación y desarrollo de Surgival SA.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses en el presente trabajo.