La sustitución del tejido óseo es objeto de investigación por su interés en la cirugía reconstructiva osteoarticular, debido a la necesidad de sustituir el tejido óseo como consecuencia de traumatismos, infecciones, tumores y malformaciones, que suponen graves problemas tanto para el paciente como para el cirujano.
Actualmente se considera el injerto óseo esponjoso autólogo como material idóneo para la reconstrucción ósea, ya que proporciona los tres elementos requeridos para la regeneración ósea: osteoconducción, osteoinducción y osteogénesis. Sin embargo, el injerto óseo autólogo va asociado a complicaciones como la limitada cantidad de hueso disponible, y la morbilidad en el lugar de extracción, que llega a ser del 20% (dolor, infección, hematoma, hernias abdominales, fracturas de estrés de espina ilíaca ántero-superior o síndrome fémoro-cutáneo)1. En las últimas décadas se han estudiado diferentes alternativas al tejido óseo: aloinjertos óseos de cortical y esponjosa, cerámicas, matriz ósea desmineralizada, materiales biológicos de médula ósea (células madre y progenitoras), diversos compuestos y materiales osteoinductivos químicos o físicos (factores de crecimiento, estimulación eléctrica y ultrasónica), etc. Sin embargo, ninguna de ellas proporciona los tres componentes necesarios para la regeneración ósea.
Nuestro grupo de investigación ha desarrollado un biomaterial denominado "espuma de hidroxiapatita", obtenida mediante un procedimiento novedoso denominado gel-casting2-4, que emplea la formación de espuma en suspensión antes de producirse la polimerización de los monómeros orgánicos contenidos en su composición, consiguiendo un material cerámico con las propiedades ya conocidas de la hidroxiapatita y con una elevadísima porosidad (próxima al 90%), muy por encima de todas las desarrolladas en los últimos años, que no llegaban al 70%5-8.
En este trabajo estudiamos la respuesta ósea al implante de hidroxiapatita, valorando la naturaleza e intensidad. Además, pretendemos determinar si dicho material demuestra capacidad osteogénica, de osteointegración, además de ser biocompatible, osteoconductor y, por tanto, si es idóneo para su utilización como sustituto de los injertos óseos.
MATERIAL Y MÉTODO
La espuma de hidroxiapatita ha sido creada en el Hospital Imperial College of Science, Technology and Medicine de Londres por los profesores Sepúlveda P, Meseguer L y Bressiani AH.
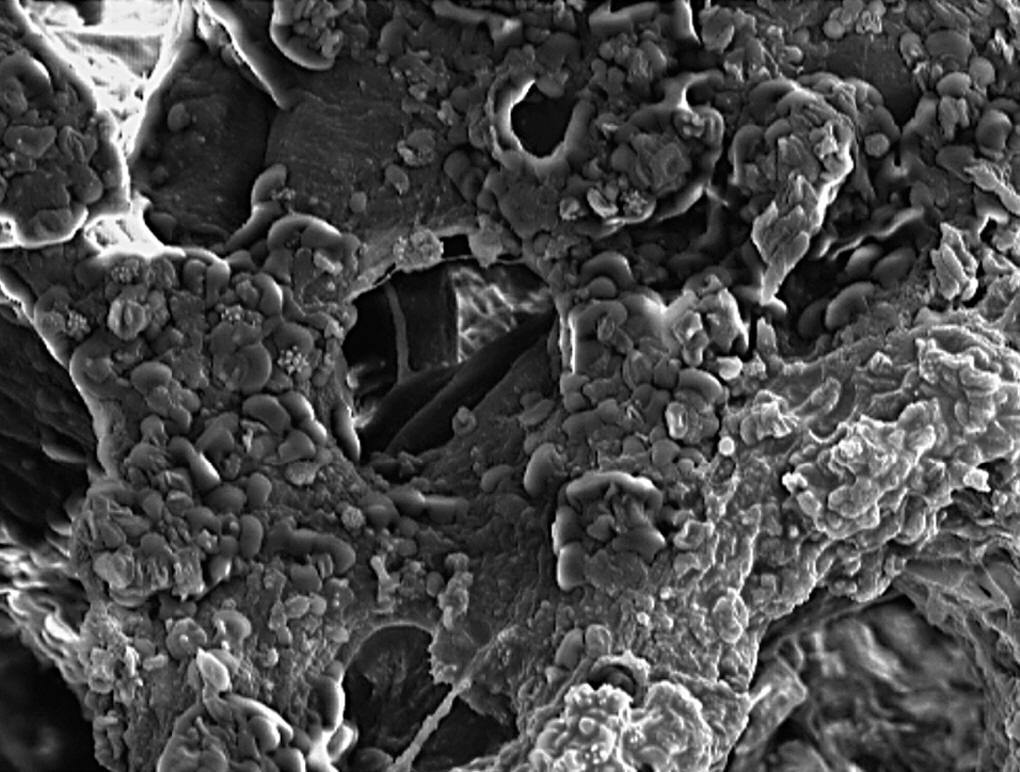
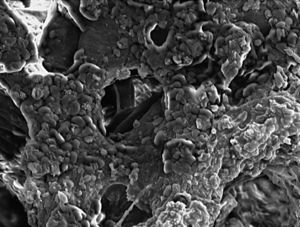
Se trata de una espuma de porosidad abierta de HA (02) (Gelcasting)2-4 con poros esféricos de 300 μm de tamaño, interconectados a través de pequeñas ventanas (10μm), y separadas por una pared denominada puntal (fig. 1), presentando un rango de porosidad relativa del 0,892 y con una resistencia a la compresión de 1,58 ± 0,04.
Figura 1. Microfotografía electrónica de barrido (MEB). Detalle MEB de espuma HA, en el que observamos los poros de superficie, los puntales (p) y las ventanas (↑) que comunican con el interior (250 x).
Preparación de las espumas
Los pasos que se siguen para su producción comienzan con:
1) Suspensión acuosa conteniendo un 65% de HA en polvo, derivados de poliacrilato como agentes dispersantes (Dispex A40, Allied colloids Ltd, Bradford, Reino Unido) y monómeros acrílicos.
2) La espuma se forma por agitación por medio de un mezclador de doble hoja.
3) Se añadió un surfactante no iónico (Tergitol TMN10, Aldrich Chemical Co., Milwaukee. Wi EE.UU.) para estabilizar la espuma, utilizándose en varias concentraciones para generar diferentes niveles de espuma y densidades.
4) La gelación de la suspensión espumosa se llevó a cabo con la adición de pequeñas alicuotas de reactivos químicos específicos (APS, TEMED, Aldrich Chemical Co.) que iniciaron la polimerización del monómero in situ.
5) Después las muestras fueron secadas a 100 ºC.
6) Las muestras fueron calentadas a 1.350 °C durante 2 horas para la consolidación de la matriz.
Utilizamos 12 conejos albinos Nueva Zelanda de 3.900-4.500 g, de 30-35 semanas de edad. En este estudio se han utilizado las dos tibias de cada animal, colocando 24 implantes en total.
Técnica quirúrgica
Bajo anestesia general con clorhidrato de ketamina (50 mg/kg/im) (Imalgen 1000®, Merial, Méjico), clorpromacina (10 mg/kg/im) (Largactil®, Aventis Pharma) y Atropina (0,3 mg/kg/im) (Atropina Braun®, Braun Medical) y previa profilaxis antibiótica mediante amoxicilina (Clamoxyl* LA®, Pfizer) (0,1ml/kg peso), se realizó el abordaje interno en la zona metáfiso-diafisario proximal de la tibia, a 4-5 milímetros por debajo de la tuberosidad tibial anterior, donde realizamos un defecto óseo de aspecto cilíndrico y de 4,5 mm de diámetro utilizando una broca quirúrgica de este tamaño. Posteriormente introducíamos un bloque cilíndrico de espuma de HA de 4 mm x 3,5 mm al interior de la médula. Los animales fueron sacrificados con una sobredosis de thiopental intravenoso (Tiobarbital Braum®, Braun Medical), tres conejos por cada grupo: a 1 semana (grupo I), 1 mes (grupo II), 5 meses (grupo III) y 8 meses (grupo IV) después de la implantación.
Estudios realizados
El estudio radiológico se realizó en las dos proyecciones habituales (anteroposterior y lateral), con una técnica mamográfica Mammodiagnost UC (Philips, Best, Países Bajos) con película Kodak Min-R Screen (Hemel Hempstead, Reino Unido), realizándose radiografías óseas iniciales con 32 Kv, 40 mA, foco grueso y exposición automática, para proceder posteriormente a la obtención de imágenes magnificadas 1: 1,7 con 20 Kv, 16 mA, foco fino y expositometría automática sín rejilla antidiafragma.
Para el estudio anatomopatológico, las tibias se fijaron en formol neutro tamponado a 10°, y utilizando una sierra oscilante se realizaron varios cortes de 1-2 mm, obteniendo de esta forma 3-4 piezas de cada período. Posteriormente fueron decalcificadas utilizando dos métodos (obteniendo de esta forma dos muestras en cada período): a) el método tradicional con formol nítrico al 10º. b) mediante la técnica del TBD, utilizado en diversos servicios de anatomía patológica de forma habitual (Termo-Shandon SA, Pittsburgh, EE.UU.) con el que se mantuvieron las muestras durante 2 horas con el decalcificador TBD-I (ácido hidroclórico 14% y polyvinylpyrrolidone), y posteriormente utilizamos el TBD-II (ácido fórmico 26% + citrato sódico 8,5% + polyvinypyrrolidone) durante 17 días, realizando el cambio de líquido cada 24 horas. A continuación se incluyeron en parafina, obteniéndose secciones de 5 μm que fueron teñidas con Hematoxilina-Eosina, tricrómico de Masson, y con la técnica de Gordon-Sweet para fibras de reticulita. El estudio cuantitativo de la microscopia óptica se realizó mediante oculómetro milimetrado y por dos observadores que valoraran de 1 a 3 cruces, las variables consideradas en cada una de las secciones histológicas estudiadas.
Para el estudio con microscopia electrónica de barrido (MEB), las muestras fueron fijadas en glutaraldehído al 3% y posteriormente se realizó el recubrimiento con oro con un metalizador cool sputter coater (Newhaven, EE.UU.) por emisión iónicabio-rad polaron, y la observación de las muestras se realizó en microscopio electrónico de barrido (Jeol JSM-6.100, Tokio, Japón) con una aceleración de 15 a 20 Kv. Las imágenes se obtuvieron sobre película Kodak Plus-X Pan 5-PXP 120 (Hemel Hempstead, Reino Unido) o digitalizadas mediante un programa (LINK ISIS).
El estudio radiológico fue realizado de forma cuantitativa por dos observadores, quienes describieron las radiografías según las cuatro densidades radiográficas.
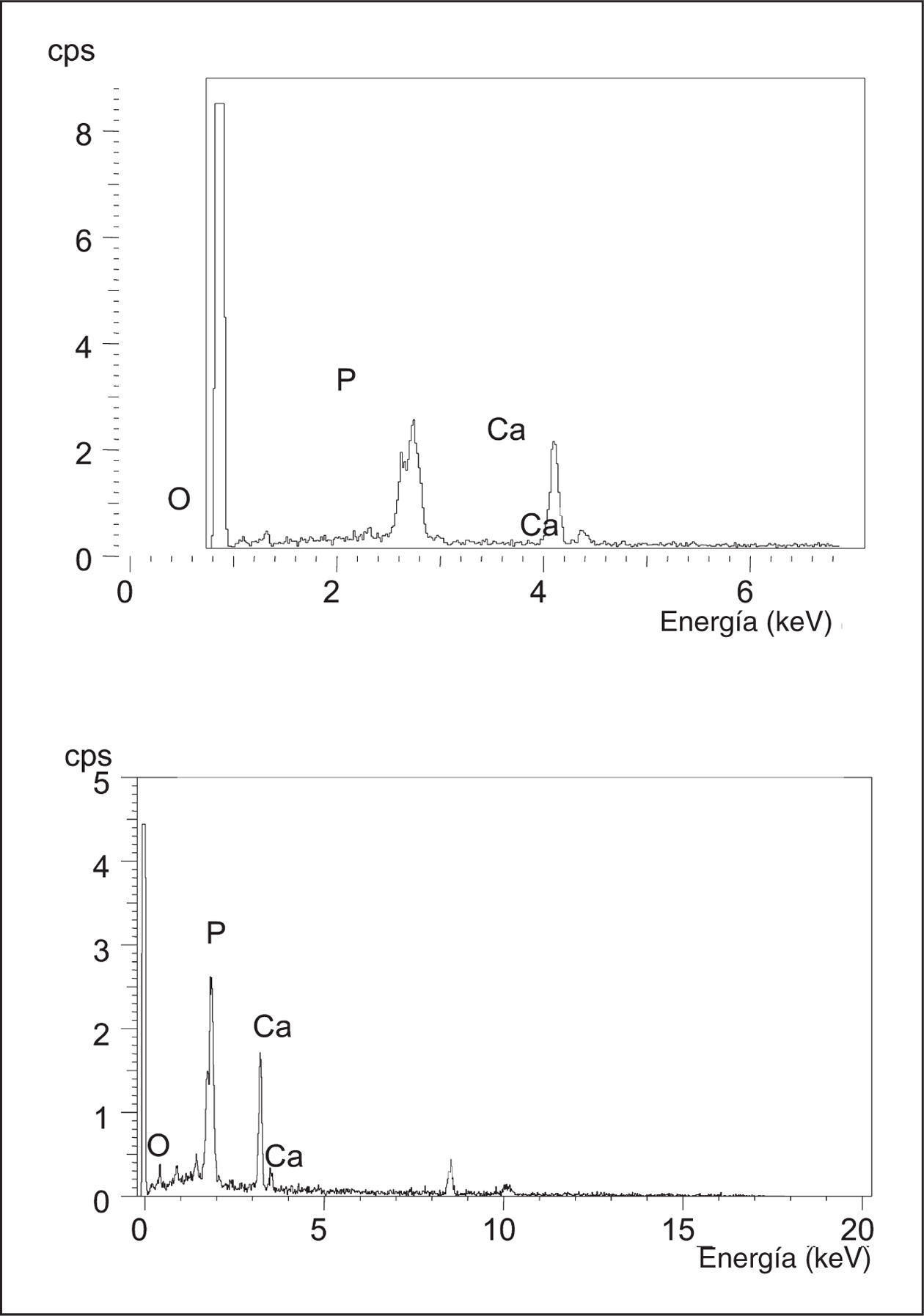
El microanálisis se realizó por el sistema de dispersión de energía (EDS), comparando el espectro que originaba el biomaterial antes y después de su implantación en cada uno de los períodos del estudio.
RESULTADOS
Las complicaciones postoperatorias han sido escasas, presentándose en el mismo animal (4 semanas del grupo II), dehiscencia de la herida con infección superficial. Al analizar el hueso, no observamos proceso infeccioso, utilizándolo por ello en el estudio.
Estudio radiológico y morfológico
Grupo I: (1 semana)
Estudio radiológico. Se observó solución de continuidad en la cortical de la zona metafisaria utilizada para la introducción del material. El implante presentó irregularidades en la superficie y se encontró totalmente adaptado en la cavidad, individualizándose perfectamente del tejido óseo adyacente.
Estudio morfológico. En el área del defecto óseo creado en la zona cortical se observó una costra fibrino-hemática que tapizaba la porción más externa del orificio, constituida por una malla de fibrillas, entre las que se observaron restos celulares rodeando a pequeños grupos de gránulos refringentes, distribuidos de forma irregular entre los poros correspondientes a restos del material implantado.
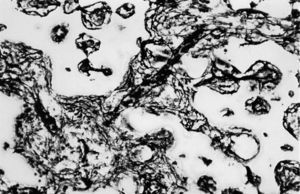
Los poros del implante se observaron parcialmente ocupados por tejido de granulación joven, constituido por numerosas yemas endoteliales y vasos sanguíneos de calibre capilar, así como abundantes células mesenquimales de morfología irregular de citoplasmas amplios, y numerosos fibroblastos dispuestos al azar en el seno de abundante sustancia fundamental. Las fibras colágenas se disponían de forma irregular y frecuentes macrófagos y linfocitos dispersos (fig. 2).
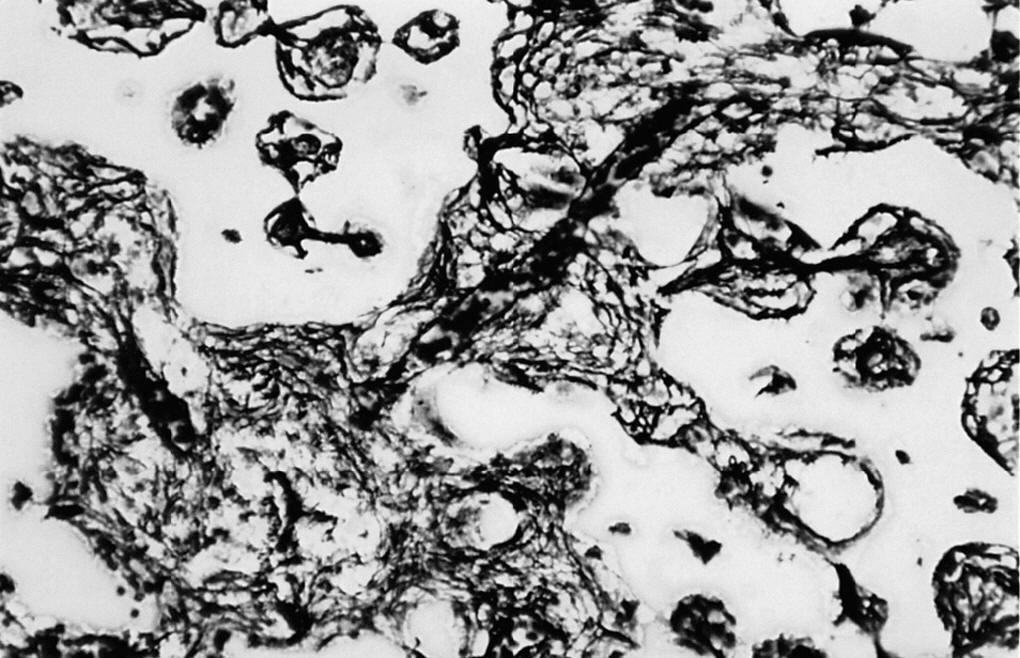
Figura 2. Tejido de granulación que ocupa los poros de la espuma (*) y trabéculas óseas (↑) (zona derecha) (HE, 312,5 x).
En el seno del tejido de granulación, en contacto con la cortical, así como en la periferia del material implantado, se observó escaso material osteoide, así como trabéculas óseas neoformadas, que eran más abundantes en las zonas adyacentes a la cortical. Los fenómenos de regeneración ósea afectaron entre el 10 y 15% del cilindro implantado y estaban constituidos por trabéculas óseas neoformadas, que delimitaban parcialmente al cilindro.
Las imágenes de MEB concuerdan con las de microscopia óptica, destacando en la cortical la costra fibrino-hemática. Por debajo de la cortical y rodeando al implante observamos tejido de granulación formado por fibras y abundante celularidad que ocupaba parcialmente los poros (fig. 3).
Figura 3. Población celular de aspecto osteoblástico rellenando los poros (750 x).
Grupo II: (4 semanas)
Estudio radiológico. El defecto óseo estaba completamente ocupado por el implante, pero con una densidad radiológica menor. La forma del material adquirió un contorno ovalado, en donde los límites con la cortical presentaron una mayor irregularidad. Se observó un aumento de densidad ósea en la cortical externa, pero que no cubre por completo el orificio de entrada del implante (fig. 4).
Figura 4. Radiografía de tibia. Destaca la continuidad de la cortical interna (→). El implante presenta bordes más redondeados (*).
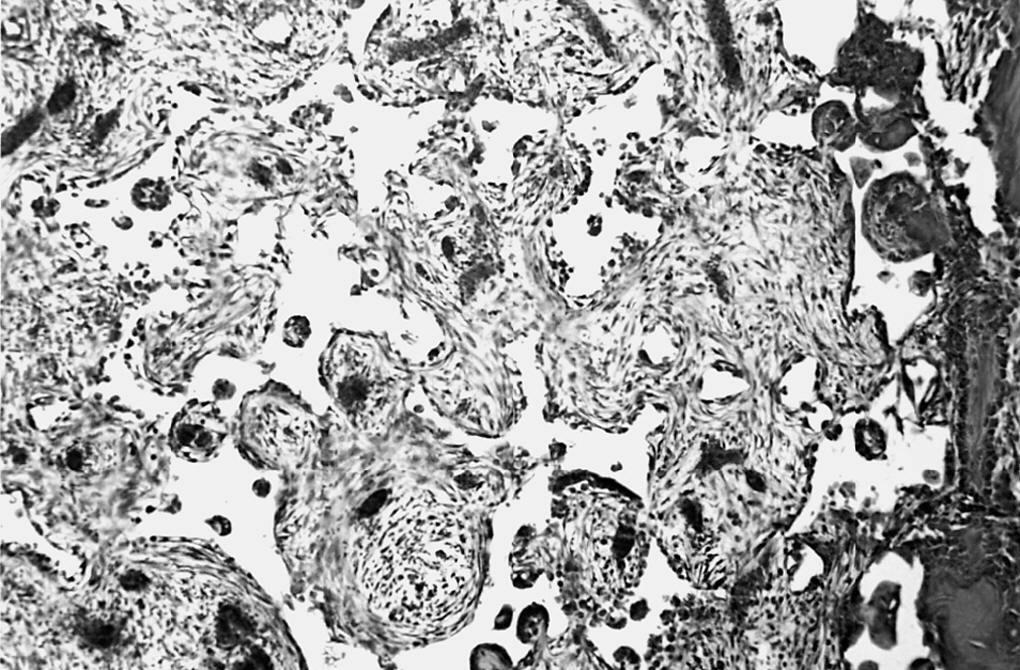
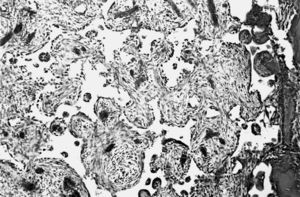
Estudio morfológico. La zona del implante mostró características superponibles al grupo anterior, destacando la sustitución casi total del tejido de granulación, que tapizaba el defecto óseo, con tejido óseo trabecular neoformado. También observamos una mayor sustitución del implante con trabéculas óseas, que representaban entre el 40-50% del volumen. Sólo vimos escasos restos del material con características similares a las anteriormente descritas (fig. 5).
Figura 5. Zona del implante en la porción superior central. Solución de continuidad de la cortical. Trabéculas óseas neoformadas alrededor y en el interior del implante (↑) (HE, 25 x).
Con microscopia óptica y con el MEB destacó, con respecto al grupo anterior, la mayor abundancia de tejido óseo alrededor del implante y en el interior de los poros.
Grupo III: (5 meses)
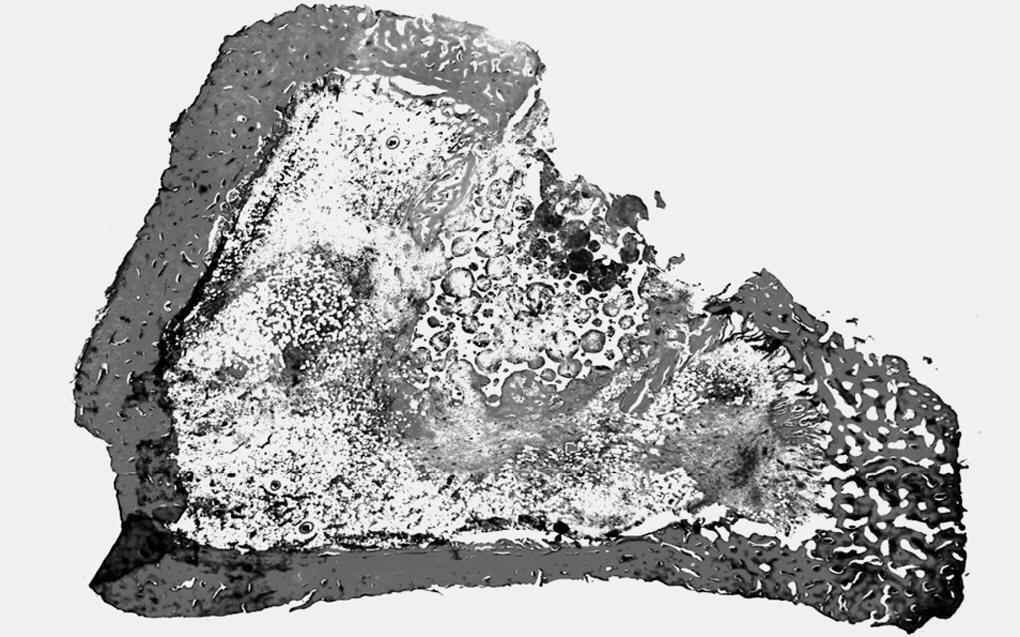
Estudio radiológico. Destacó la forma irregular con límites poco precisos del implante. La cortical externa reparada presentó una densidad ósea superior a la del período anterior. En algunas zonas se observó una continuidad de la cortical con el material implantado, no pudiendo delimitarse la interfaz del hueso con el implante.
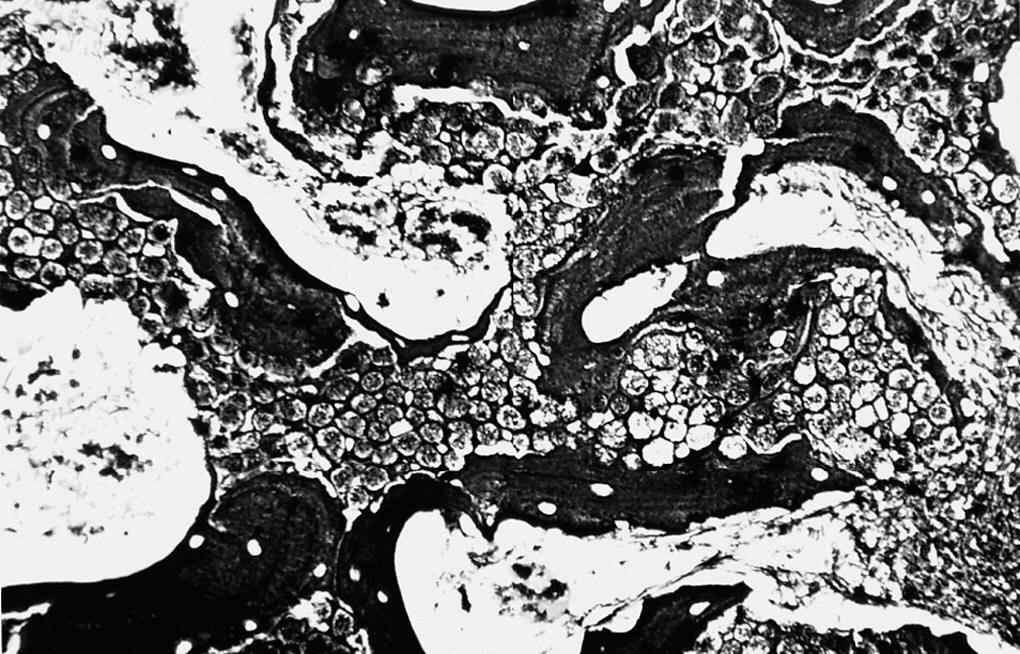
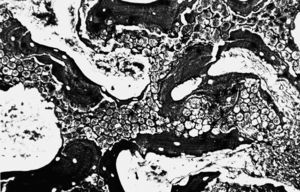
Estudio morfológico. En este grupo observamos la formación de hueso en uno de los bordes laterales del material implantado, que conectaba la cortical interna con la contralateral. Tanto alrededor del implante como en el interior de los poros se observaron escasos restos de tejido de granulación (15% aproximadamente). Asimismo, existía una sustitución de alrededor del 80% del material implantado por abundantes trabéculas óseas neoformadas de morfología irregular, que periféricamente lo envolvía en su totalidad, mientras que en las porciones centrales se observaron pequeñas trabéculas en íntimo contacto entre sí (fig. 6).
Figura 6. Detalle de la trama reticulínica (*) y vasos (v) que comunican los poros del implante entre sí (c) (Gordon Sweet, 500 x).
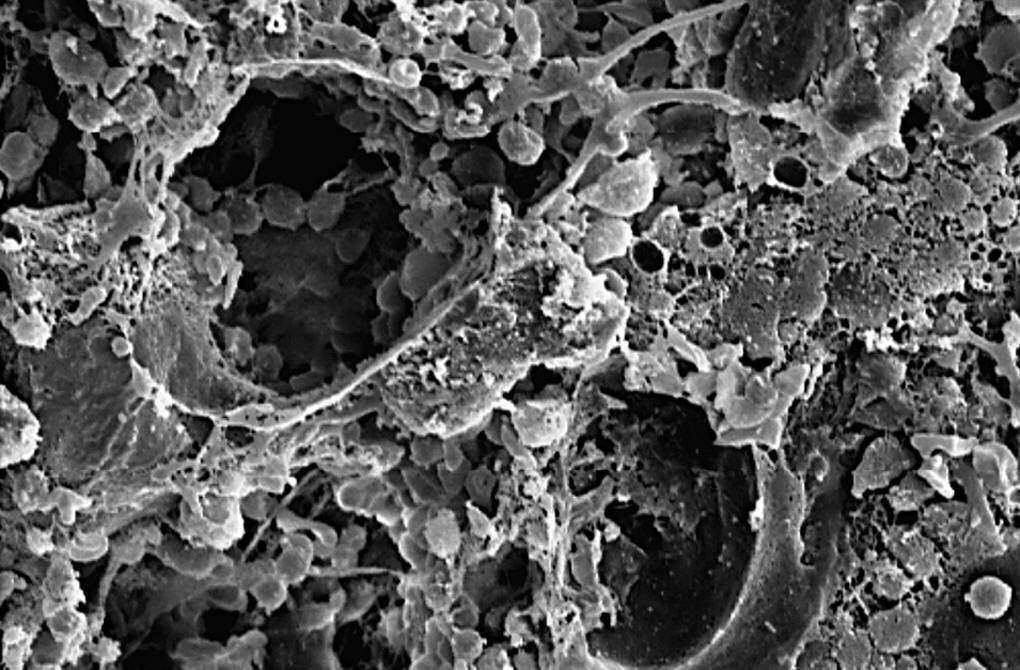
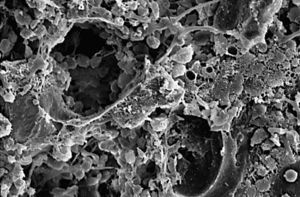
Mediante el MEB comprobamos que la mayor parte del volumen del implante estaba colonizado por tejido óseo maduro, persistiendo áreas ocupadas por osteoide (fig. 7).
Figura 7. Tejido de granulación y material osteoide ocupando los poros del implante (750 x).
Grupo IV: (8 meses)
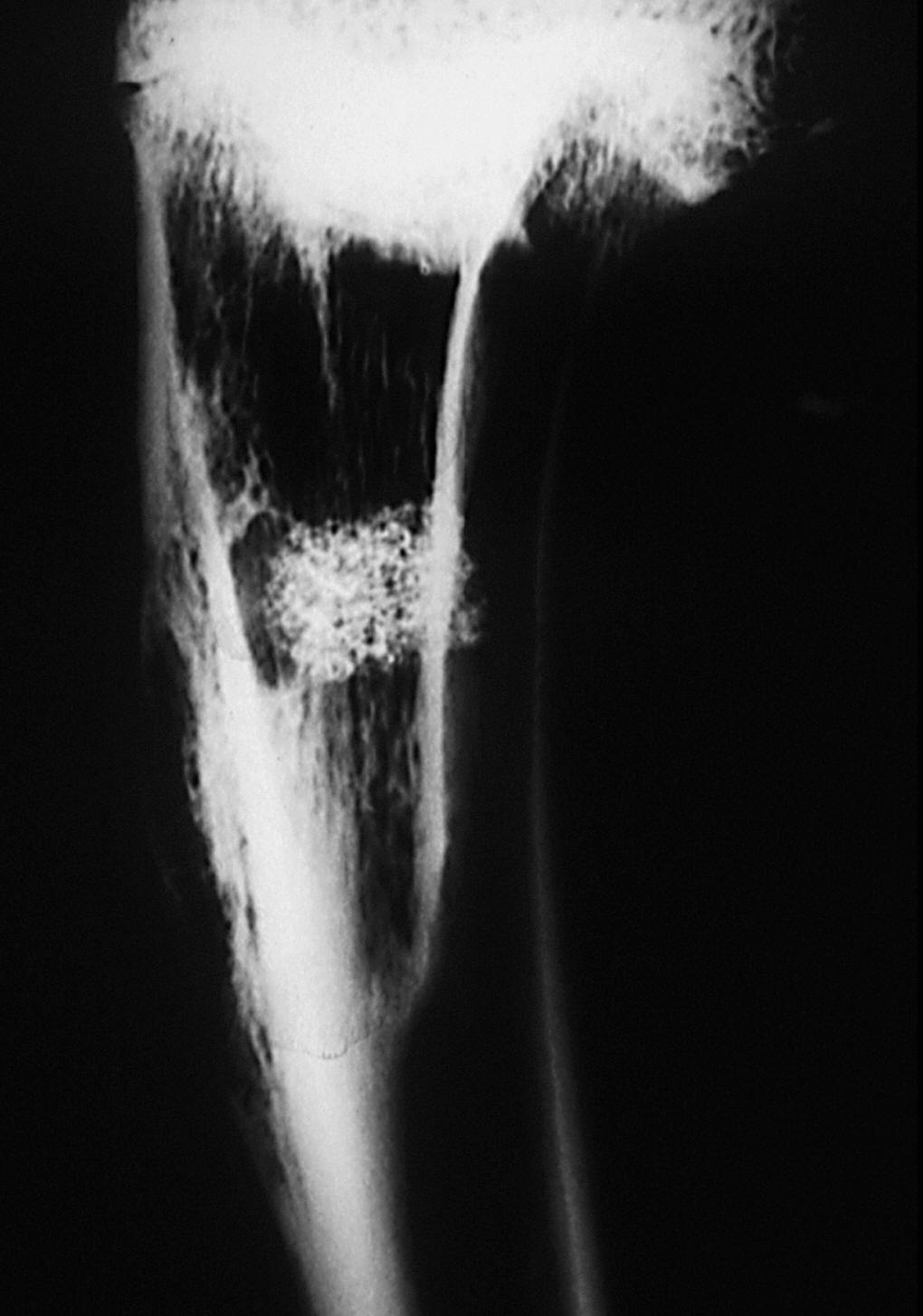
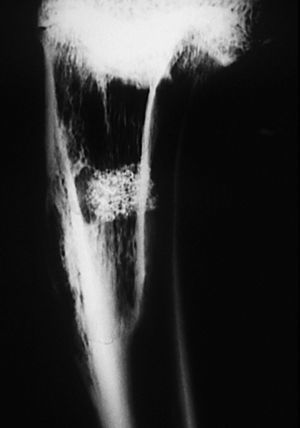
Estudio radiológico. La cortical externa presenta una densidad ósea igual a la cortical adyacente, siendo difícil reconocer el orificio de entrada. El implante junto a la cortical presentó una disminución de la densidad con respecto al grupo anterior, y una forma más ovalada con disminución de la densidad de calcio en su interior. No presenta límites radiológicamente bien definidos.
En algunas zonas existe una continuidad de la cortical con el material implantado, debido a imágenes de trabéculas óseas que parecen atravesarla. No se visualizaron límites radiográficos bien definidos (fig. 8).
Figura 8. Radiografía de tibia. Implante con disminución de tamaño y pérdida de su forma cilíndrica inicial. En algunas zonas se observan trabéculas óseas (↑) que parecen atravesar al implante (*).
Estudio morfológico. La característica distintiva de este último período del estudio fue la mayor ordenación y tamaño de las trabéculas óseas neoformadas. Asimismo, el tejido de granulación era muy escaso, menos del 10% en el implante, ya que en la periferia era sustituido por médula ósea hematopoyética de características normales. La cortical ósea estaba formada por tejido óseo compacto de características normales, que se continuaba con las trabéculas óseas que rodeaban el tejido de granulación de los poros (fig. 9).
Figura 9. Áreas de osificación encondral en el defecto de la cortical (*) (Gordon Sweet, 500 x).
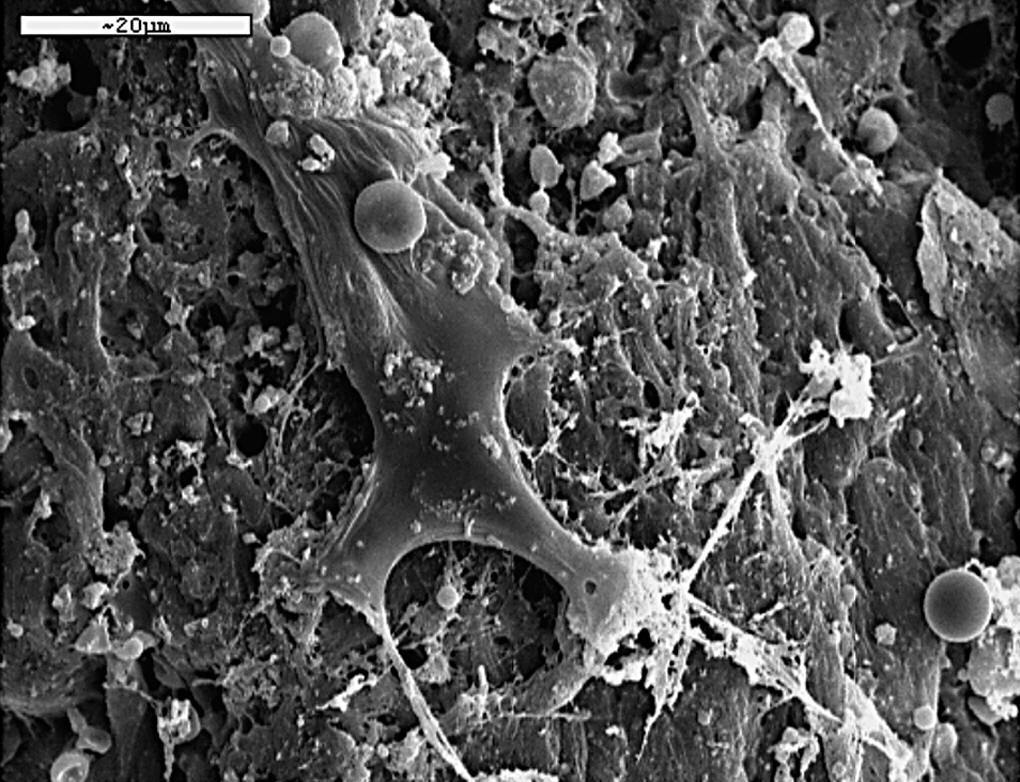
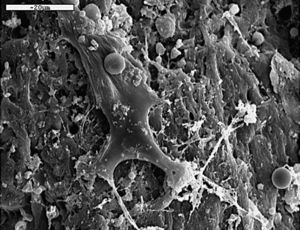
Con MEB destacamos la mayor actividad osteoblástica en las zonas periféricas del implante y en íntimo contacto con él (fig. 10).
Figura 10. Células de estirpe osteoblástica entre la red de fibras colágena (1.000 x).
Estudio microanalítico
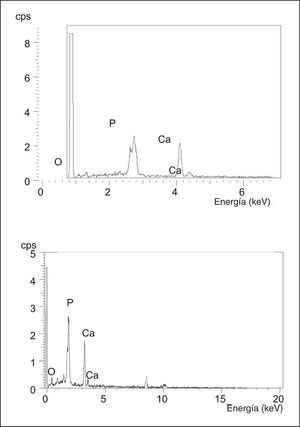
El microanálisis realizado por el EDS de la espuma de HA-02 implantada, en los cinco períodos del estudio experimental, mostró un espectro idéntico al del producto original antes de su implantación (fig. 11).
Figura 11. Espectro obtenido por el sistema de dispersión de energía (EDR) de las muestras preimplantación HA-02 (αc) y post-implantación (αd).
DISCUSIÓN
En el campo de los biomateriales se están diseñando nuevos materiales en los que se establece inicialmente una matriz colágena en red tridimensional, a la que se recubre con una fina capa de HA, resultando finalmente una red de poros completamente interconectados. Uno de ellos es la espuma de hidroxiapatita, que se define como una cerámica de HA de alto grado de porosidad (70-90%), obtenida por una nueva técnica que emplea la formación de espuma en suspensión antes de producirse la polimerización de los monómeros orgánicos contenidos en su composición, tal como hemos descrito en trabajos previos2-4.
Diversos autores han utilizado materiales con porosidad global muy inferior a la de nuestras espumas, destacando las cerámicas de HA desarrolladas por Itoh H, et al5 con una porosidad del 70%, y más recientemente la de Niu J, et al6 del 50 hasta 70%. Utilizando HA y polimetilmetacrilato (PMMA) en proporción 1:1, Li SH, et al7, obtuvieron una cerámica macropórica del 50%, pero, al aumentar la porosidad añadiendo más resina PMMA, se produjo la destrucción de la muestra. También Rodríguez-Lorenzo LM, et al8 obtuvieron una HA con porosidad del 45-70%, y Jun YK, et al9 del 75 al 90%.
La originalidad de nuestras espumas consiste no sólo en la porosidad global del 80-90%, sino en que presenta propiedades mecánicas importantes caracterizadas por su gran resistencia a las fuerzas de compresión, con valores de 1,58 ± 0,04 MPa para HA-02 y el doble para HA-09, incluso desde los primeros momentos de la implantación. Dicha resistencia aumentaría de forma exponencial tras la formación de tejido óseo trabecular, en el interior y alrededor, durante las primeras semanas, como se ha descrito recientemente10 también con otras formas de HA. Además, presenta un módulo de elasticidad similar al esponjoso (1,3-14,1 GPa) que va a permitir prevenir los defectos de protección de la carga tras su implantación.
La espuma de HA presenta poros esféricos con tamaño medio superior a 300 μm en la HA-02, con interconexión a través de pequeñas ventanas (porosidad abierta que permite una presión parcial de oxígeno en el interior del implante igual a la del exterior), favoreciendo el crecimiento óseo en su interior, como hemos demostrado en nuestro estudio. Dichos requisitos fueron propuestos para los implantes porosos de fosfato cálcico ya en los estudios clásicos11.
Por otra parte, tradicionalmente se ha utilizado el formol nítrico como técnica de decalcificación ósea; recientemente se está introduciendo la utilización de dos soluciones comerciales denominadas TBD-I® que contienen ácido hipoclorhídrico 14% y polivinilpirrolidona, y TBD-II® (ácido fórmico 26% + citrato sódico 8,5% + polivinilpirrolidona) que son de uso habitual desde hace unos años en la práctica clínica de diversos hospitales. En nuestro trabajo hemos utilizado ambos métodos, mostrando la técnica del TBD con características morfológicas de mayor calidad. Por ello, y a pesar de que son escasas las referencias existentes en la bibliografía12 sobre estudios con las soluciones TBD-I y II B, consideramos que el TBD constituye un método que presenta mejores resultados que el del formol nítrico en los estudios del tejido óseo.
En el estudio microscópico óptico, la zona del implante se caracterizaba por presentar espacios ópticamente vacíos que corresponden al material que ha sido disuelto, en su mayor parte durante el proceso de decalcificación, con los dos métodos de decalcificación utilizados en nuestro estudio.
Asimismo, nuestro experimento ha confirmado la biocompatibilidad y capacidad de osteointegración de la espuma, y sólo hemos observado la existencia de respuesta inflamatoria poco relevante durante la primera semana, y en ninguna de las secciones histológicas estudiadas ni en ninguno de los grupos hemos observado presencia de fibrosis entre la cerámica y el hueso huésped.
Hemos podido constatar la capacidad osteoconductora de la espuma de HA, puesto que observamos crecimiento óseo, en todas las muestras, desde la primera semana (grupo I) de forma centrípeta, comenzando desde la periferia hacia el interior del material. Dicha capacidad osteoconductora ha sido demostrada en la hidroxiapatita en numerosos experimentos anteriores13-25. Nuestro estudio confirma los resultados de Klawitter JJ y Hulbert SF11 y Schepers E, et al19 quienes consideraban que la existencia de comunicación entre los poros (superficie-profundidad) facilita el crecimiento óseo en su interior. Este hecho lo hemos podido constatar en nuestro experimento, al observar crecimiento óseo no sólo en los poros de la superficie, sino en los poros del interior del implante, también descrito recientemente en cerámica de HA10.
Durante el experimento el implante disminuía de volumen, y en el centro persistía el tejido de granulación, que era sustituido en zonas por médula ósea adiposa y hematopoyética, como observamos con la radiología y la microscopia, lo que demuestra la existencia de un fenómeno de reabsorción parcial y progresiva de la espuma HA-02, caracterizada, desde los primeros períodos del experimento, por una pérdida progresiva del aspecto cilíndrico del implante y la adquisición de una forma ovalada de bordes ligeramente irregulares que se hacía más patente a partir del quinto mes después de la implantación. Esta característica había sido descrita con anterioridad por otros autores17,25-26. Dicho proceso de reabsorción se realiza mediante un mecanismo de fagocitosis celular a través de macrófagos que se observaban en la periferia del implante. No obstante, otros estudios realizados29,30 concluyen que no hay modificaciones en las cerámicas utilizadas en sus estudios, durante el tiempo de implantación.
El microanálisis realizado mediante el EDS demostró un espectro semejante al producto original antes de su implantación, lo que sugiere que en el proceso de reabsorción de la espuma no se originan cambios en su composición, ni productos intermedios de la degradación.
Como conclusión, la espuma HA-02 se ha comportado en nuestro estudio como un material biocompatible, al provocar una respuesta inflamatoria leve y precoz, osteoconductor al permitir la rápida formación de tejido de granulación que es sustituido por tejido óseo trabecular, tanto en la periferia como en el interior del implante y biorreabsorbible. Sin embargo, creemos que son necesarios nuevos estudios con la espuma de hidroxiapatita en otros modelos experimentales, antes de poder ser utilizada en la clínica como sustituto del tejido óseo.
AGRADECIMIENTOS
Agradecemos la colaboración técnica del Dr. Víctor Bolarín Lucas, técnico en Anatomía Patológica.
Conflicto de intereses. Los autores no hemos recibido ayuda económica alguna para la realización de este trabajo. Tampoco hemos firmado ningún acuerdo por el que vayamos a recibir beneficios u honorarios por parte de alguna entidad comercial. Por otra parte, ninguna entidad comercial ha pagado ni pagará a fundaciones, instituciones educativas u otras organizaciones sin ánimo de lucro a las que estamos afiliados.