Se presenta una actualización del tratamiento del osteosarcoma convencional, con exclusión de las formas secundarias por malignización de otras patologías, así como las formas de osteosarcoma parostal-yuxtacortical. La supervivencia global es del 73%, aunque el protocolo sigue abierto y se evalúa la toxicidad y se plantean cambios en la forma de administrar las drogas para disminuir los efectos secundarios a corto y largo plazo.
An update on the conventional treatment of osteosarcoma, excluding secondary forms due to malignancies by other diseases, as well as the parosteal-juxtacortical forms. The overall survival is 73%, although the protocol is still open. The toxicity and changes established in the forms of administering the drugs to decrease the secondary effects in the short and long term are assessed.
Los sarcomas son tumores malignos del sistema musculoesquelético y del tejido conectivo así como del sistema nervioso periférico. Las características comunes a todos los sarcomas son su rareza respecto a los carcinomas, que inciden preferentemente en edades juveniles o infantiles y que afectan a cualquier estructura orgánica, siendo las extremidades y el retroperitoneo los lugares más frecuentes. En el esqueleto pueden aparecer sarcomas derivados de todas las estirpes celulares. Así, pueden encontrarse tumores de células redondas, como los linfomas óseos y el sarcoma de Ewing, o de los restos notocordales, como el cordoma. Sin embargo, la inmensa mayoría de los tumores primarios del esqueleto dependen de las tres variedades de células fusiformes que conforman la mayor parte de su volumen: de la matriz fibrosa derivan los fibrosarcomas, del cartílago derivan los condrosarcomas y del hueso derivan los osteosarcomas (OS).
Los OS o sarcomas óseos (SO) son los sarcomas del esqueleto, en todas las edades, más frecuentes, y su característica esencial es que no se ubican en el hueso, sino que se desarrollan a partir de las células progenitoras encargadas de generar el hueso normal. La referencia histológica de este origen, de la que depende el diagnóstico de certeza del OS, es la aparición de un tejido óseo formado de novo, en el propio seno del tumor. Este puede adoptar la forma de hueso, más o menos desorganizado, en distintas fases de madurez o, más frecuentemente, de osteoide. Incluso, es posible que estas células progenitoras se localicen excepcionalmente fuera del esqueleto, el llamado OS extraesquelético, del mismo modo que sucede con el tejido mamario supernumerario o con el tejido germinal extragonadal. Si alguna de estas células siguiera una vía de transformación maligna, daría lugar a un sarcoma, que sería de partes blandas por su anatomía y OS por su histología.
La gran mayoría de los SO son esporádicos y solo un porcentaje ínfimo cuenta en sus historia con factores predisponentes, como la radiación, la enfermedad de Paget o los trastornos hereditarios. Los SO son poco comunes en los adultos y mucho más frecuentes en edades más tempranas. Así, su lugar en la clasificación por frecuencia de todos los cánceres supera el vigésimo lugar en los adultos, pero está por debajo del quinto puesto si consideramos el grupo de edad menor de veinte años. Su curva de incidencia refleja un pico muy acusado entre los 11–20 años, y otro mucho menor entre los 60–80 años. Este pico coincide exactamente con el de la aceleración del crecimiento, hasta el punto de que la precocidad del desarrollo en las niñas se refleja fielmente en un adelantamiento de la incidencia de SO.
Los SO infantiles están íntimamente ligados al crecimiento y probablemente relacionados con errores mitóticos en los genes implicados en el control del crecimiento, quizá en las células progenitoras causantes del alargamiento y maduración óseos. De esta forma, los tumores de los niños se concentran en las zonas paraarticulares de los huesos largos, mientras que en el adulto, sin relación alguna con el crecimiento, aparecen con más frecuencia en el esqueleto axial.
Las zonas metafisarias de los huesos largos son las más afectadas. Por otro lado, mientras que los SO del niño son casi siempre de la variedad clásica, los del adulto pueden ser también atípicos, como parostales, mandibulares o extraesqueléticos. Es difícil pensar que, aun compartiendo histología y denominación, ambas entidades deban ser consideradas la misma enfermedad desde el punto de vista biológico. Y, sin embargo, gran parte de los conocimientos que usamos para pronosticar y tratar a los SO en adultos han sido directamente tomados de la evidencia del estudio de los SO infantiles, pues hay una gran carencia de estudios específicamente diseñados en los grupos de edad madura.
ClínicaLos síntomas del OS suelen ser insidiosos, y la norma es que el diagnóstico definitivo venga precedido por una larga historia de consultas y tentativas terapéuticas fallidas. El dolor es la más común de las quejas iniciales, a veces en relación con algún traumatismo reciente. La ausencia de signos específicos precoces, el bajo índice de sospecha tumoral en los grupos de edad juveniles y la altísima frecuencia de síndromes dolorosos benignos semejantes en las consultas de pediatras, médicos de asistencia primaria y traumatólogos de área se alían para que el sarcoma se camufle durante semanas o meses tras diagnósticos como dolores de crecimiento, tendinitis o sobrecarga muscular.
En el caso de las variedades atípicas e indolentes de los adultos no es excepcional que el diagnóstico tarde años en alcanzarse. La mayoría de las veces la sospecha de sarcoma surge cuando aparece un tumor al realizar una RM en el curso de la investigación de un dolor. Los OS de las extremidades dan lugar antes a tumores palpables, lo que adelanta su diagnóstico respecto a los OS de localización central.
Los valores de laboratorio suelen ser normales con la excepción de elevaciones de la fosfatasa alcalina, la LDH o la velocidad de sedimentación globular. Solo los valores más extremos de LDH se relacionan con un peor pronóstico.
Los SO del adulto están gravados por un peor pronóstico que los de los niños. El registro de la Clínica Mayo1 muestra un 70% de metástasis y el mismo porcentaje de mortalidad. Uno de cada tres tumores estaba en el esqueleto axial y uno de cada cinco tumores se diagnosticó como estadio iv desde el primer momento. La fractura patológica y la recaída local fueron dos circunstancias que marcaron un mal pronóstico. Todos los enfermos con recaída local y todos los fracturados en los que no se recurrió a la amputación inmediata acabaron por desarrollar metástasis y murieron. Los datos del Memorial Sloan Kettering Cancer Center2, aun siendo más actuales, no resultan más alentadores; el 66% de todos los diagnosticados falleció. No obstante, aquellos que habían recibido poliquimioterapia, sobre todo metotrexato en dosis altas, presentaban cifras de recaída y supervivencia más optimistas. Es posible que el pronóstico de los OS del adulto no sea esencialmente peor, caso a caso, que el de los niños o adolescentes, sino que las estadísticas globales reflejen una mayor proporción de sarcomas axiales que son de diagnóstico más difícil y tratamiento quirúrgico menos satisfactorio.
DiagnósticoEl diagnóstico de un OS se apoya en un protocolo basado en pruebas de imagen y de laboratorio que dan la orientación diagnóstica y se confirman con la biopsia y el estudio anatomopatológico de la tumoración. Tras la sintomatología clínica que sugiera la existencia de una tumoración ósea pondremos en marcha el estudio de imagen que consistirá en un radiografía de la zona afectada para evaluar la extensión macroscópica y el hueso afectado, su relación e implicación con las estructuras vecinas y la existencia, en ocasiones, de una fractura patológica3. Con esta primera orientación pasaremos al estudio de la TAC o RM. Cada una de estas técnicas tiene sus indicaciones. La TAC es una técnica rápida y fácil mientras que la RM requiere absoluta inmovilización durante un largo período de tiempo y, en el caso de los niños, requiere su colaboración, siendo a veces necesario sedarlos o anestesiarlos. En general, la técnica de elección es la RM, puesto que informa mejor de la extensión global del tumor, la infiltración de estructuras vecinas, el paquete vasculonervioso, etc., datos de interés para la posterior planificación del tratamiento quirúrgico y, además, cuantifica el tamaño tumoral, un dato pronóstico importante4. En el estudio inicial no podemos olvidar la práctica de una TAC pulmonar para descartar la existencia de diseminación metastásica a este nivel, que es la más frecuente.
La gammagrafía ósea con Tc99 ofrece la fijación del radioisótopo en el tumor primario e informa de la afectación de otros huesos. También sirve para detectar recidivas locales o metastásicas.
La opción de la PET se está imponiendo de forma progresiva, dada la gran rentabilidad de esta técnica para informar de las lesiones primarias y también para detectar lesiones múltiples en otros huesos, en ocasiones no evaluadas por otros estudios, y para las metástasis pulmonares. La práctica de una PET al inicio de la enfermedad sirve de base en el control evolutivo posterior, siendo una técnica que puede detectar focos tumorales no evaluables por otras exploraciones5,6.
Después de los estudios por imagen será necesario obtener una biopsia de la lesión. Los sarcomas osteogénicos se dividen por su origen en intramedulares y yuxtacorticales. Desde el punto de vista histológico, los intramedulares presentan variantes basadas en el tipo predominante en la lesión de células matrices y del estroma. La variante más común es la osteoblástica constituida por células malignas en forma de huso, productoras de material osteoide. Las formas condroblástica y fibroblástica suponen una cuarta parte de cada una de ellas. La variante telangiectásica se caracteriza histológicamente por la presencia de espacios ocupados por células sanguíneas y tumorales con poca cantidad de estroma y se asocia, con frecuencia, a fracturas patológicas por la gran fragilidad del tejido. La variante de célula pequeña y redonda de celularidad similar a la del sarcoma de Ewing requiere, en ocasiones, estudios específicos de inmunohistoquímica o marcadores genéticos para su diagnóstico.
Los OS yuxtacorticales se originan en la superficie interna del hueso, distinguiéndose tres subgrupos: paraostal, periostal y de alto grado. El paraostal es el más frecuente, con estroma fibroblástico y focos de cartílago. El periostal crece en la superficie de la diáfisis, generalmente la tibia o el fémur. El superficial de alto grado aparece generalmente en adultos y precisa de tratamiento agresivo como los intramedulares.
Los estudios de imagen nos localizan la lesión, la biopsia le pone nombre y con estos datos se define el tumor para, posteriormente, aplicar el tratamiento más adecuado. Siguiendo la ya conocida clasificación de Enneking7, los OS se dividen en 5 estadios. La aplicación del tratamiento diferenciará los de alto grado, los de bajo grado y los metastásicos, ofreciendo diferente agresividad terapéutica para cada uno.
Biopsia en el osteosarcomaPreviamente a plantearse una biopsia debe disponerse de todo el estudio iconográfico de la lesión que se va a biopsiar, para orientar la localización de la biopsia y evitar alteraciones locales secundarias y orientar la sesión con los especialistas en diagnóstico por imagen en caso de duda.
La técnica de biopsia ideal en el OS es la punción con trefina ósea bajo control radioscópico. Teniendo en cuenta las localizaciones habituales de esta neoplasia, metáfisis del fémur distal o de la tibia proximal y metáfisis proximal del húmero, esta técnica se puede efectuar en la mayoría de los casos, siendo excepcional la necesidad de practicar una biopsia abierta. Cuando exista una masa de partes blandas, será suficiente una biopsia tipo trucut, aunque lo ideal es que la biopsia incluya una muestra de dicha masa junto al hueso.
Los condicionantes que una biopsia abierta provoca para la cirugía ulterior son muy importantes al tener que escindir la cicatriz de esta junto con la resección completa del tumor. En caso de que fuera necesaria, la biopsia abierta debe ser practicada por el mismo equipo quirúrgico que tratará el OS. Por otra parte, hay que evitar las biopsias agresivas para prevenir fracturas patológicas secundarias.
La mala praxis de una biopsia abierta con una ventana amplia con osteotomo y provocando una fractura patológica puede terminar en una amputación o diseminación local que imposibilite la cirugía de salvamento de la extremidad. La biopsia debe ser considerada como un acto quirúrgico en estrictas condiciones de esterilidad y la infección del trayecto de biopsia puede condicionar todo el curso ulterior.
Aunque se ha comentado que la incisión de una biopsia ha de ser practicada por el equipo especializado, deben recordarse los principios para practicar las incisiones, siguiendo el trayecto de la cirugía que se va a programar, que serán longitudinales respecto al eje de la extremidad, evitando las incisiones transversas. Asimismo, se debe evitar la disección por planos, asegurar la hemostasia para evitar la diseminación local del hematoma con células tumorales y evitar la colocación de drenajes tipo Penrose que al abocar al exterior a través de la herida de biopsia ocasionarán una vía de crecimiento exofítico de la tumoración. En caso de necesidad, el drenaje será aspirativo y abocará junto con uno de los polos de la incisión. Por último, el cierre será estricto por planos y suturado con material no reabsorbible.
La obsesión y precisión por «coger mucha muestra» es consecuencia de una mala relación con los equipos de radiodiagnóstico y de anatomía patológica. Esta actitud puede asegurar el diagnóstico pero al precio de condicionar gravemente el tratamiento y el pronóstico8.
Tratamiento quimioterapéuticoEl OS clásico es el paradigma oncológico de la enfermedad micrometastásica, aquella que debemos considerar diseminada en cualquiera de sus estadios y que, en consecuencia, necesita siempre un tratamiento sistémico. La hipótesis de la micrometástasis guió la incorporación de la quimioterapia al tratamiento multidisciplinario del OS.
Muchos años después de que el empleo de quimioterapia fuese práctica cotidiana, las técnicas de detección inmunomagnética demostraron que la existencia de micrometástasis en la sangre y la médula ósea era un hecho que determinaba el destino de los pacientes9. Hasta el advenimiento de la quimioterapia eficaz se usaron multitud de estrategias quirúrgicas, pero nunca se consiguió obtener una mortalidad inferior al 80%. Los tratamientos poliquimioterapéuticos óptimos pueden convertir en supervivientes a las dos terceras partes de los pacientes.
El tratamiento de quimioterapia es capaz de curar el OS diseminado cuando el volumen tumoral es todavía microscópico10,11. Si bien el empleo de quimioterapia complementaria a la cirugía en todos los pacientes diagnosticados de OS, pediátricos o adultos, es un hecho universalmente aceptado desde hace muchos años, se sigue debatiendo la composición ideal del tratamiento y el mejor momento para aplicarlo. La controversia es mayor en el ámbito de los adultos.
Los mejores resultados en niños se obtuvieron al añadir dosis altas de metotrexato a regímenes basados en cisplatino y adriamicina. Pronto se empezó a aplicar esta clase de regímenes antes de la cirugía, en lugar de en el postoperatorio. Al principio, esta estrategia era práctica, dictada por la necesidad de controlar el crecimiento del tumor mientras se fabricaba la endoprótesis metálica12 pero pronto se vio que la reducción en el volumen tumoral era útil para realizar cirugías conservadoras menos mutilantes. Persistía la duda de si el retraso en el tratamiento local comprometía la probabilidad de curación, y los ensayos clínicos multicéntricos han demostrado que las probabilidades de sobrevivir son semejantes, independientemente de si la quimioterapia se emplea antes o después de la cirugía.
Además de permitir la supervivencia y mejorar el control local, la quimioterapia preoperatoria permite conocer la sensibilidad al tratamiento en cada paciente, merced al grado de necrosis observado en la pieza. Una de las direcciones más sugerentes ha sido la de intentar ajustar el tratamiento de cada paciente sobre la base de su respuesta al tratamiento neoadyuvante13.
El grado de necrosis es un factor pronóstico de primer orden. Se pudo comprobar cómo aquellos pacientes con una respuesta patológica completa o casi completa, aunque pobremente correlacionada con la respuesta clínica o radiográfica, mostraban una supervivencia a los 5 años superior al 80%, mientras que aquellos sin cambios histológicos o, incluso, con grados de necrosis notable pero inferiores al 90% fallecían a lo largo de ese período en una proporción superior al 60 o al 70%. Se pensó que los pacientes que no respondían al tratamiento podrían mejorar su pronóstico si eran tratados tras la cirugía mediante agentes activos con un mecanismo de acción tan distinto que evitara las resistencias cruzadas. Así fue al menos en principio, y el cruce del tratamiento de los sujetos resistentes mejoró su pronóstico hasta llegar a aproximar sus resultados al grupo de los que respondían14. Esto se basa en el esquema T10 de Rosen, que ha sido la brújula con la que se ha guiado el tratamiento oncológico de los sarcomas durante muchos años. No obstante, con el paso de los años, el efecto ha ido desapareciendo, y la curva de supervivencia de los que no responden se ha separado progresivamente de la de aquellos que obtenían excelentes grados de necrosis tras el tratamiento inicial15.
Por otro lado, otros grupos cooperativos no han podido reproducir, al menos con el mismo grado de eficacia, los resultados iniciales obtenidos en el Memorial Sloan-Kettering Cancer Center de Nueva York. Parece, pues, que la estrategia de cruzar quimioterapias sin resistencia cruzada sobre la base de la necrosis, si bien permite alargar el período libre de enfermedad y estratificar mucho mejor el pronóstico de los pacientes, no es capaz de salvar más vidas a largo plazo.
La alta tasa de respuestas observada en pacientes metastásicos mediante el empleo de un nuevo régimen basado en ifosfamida y etopósido (I/E)16 ha abierto la esperanza de mejorar el pronóstico de los pacientes que no responden mediante la modulación del tratamiento. Un gran ensayo cooperativo internacional, pendiente de resultados definitivos, explora la adición de I/E a la fase postoperatoria de los pacientes con bajo grado de necrosis.
Un problema acuciante en el tratamiento de los adultos con OS consiste en que la práctica totalidad de los estudios seminales mencionados se realizó mayoritaria o únicamente en niños y adolescentes, dejando un margen de duda muy amplio respecto a la aplicación de sus conclusiones a pacientes por encima de la treintena. Así, el esquema T10 de Rosen se ensayó en sujetos por debajo de los 21 años; la dosis alta de metotrexato excluyó a los mayores de 15 años y no ha demostrado aumento de la supervivencia en los escasos y pequeños ensayos dedicados a adultos; la comparación de la quimioterapia neoadyuvante con la adyuvante se limitó en su ensayo inicial a menores de 30 años y el ensayo clínico en marcha respecto al esquema I/E llega hasta los 31 años.
Es necesario conocer el SO en el adulto, determinar su biología, sus factores pronósticos y el mejor tratamiento adyuvante. Los ensayos clínicos no debieran excluir a los adultos, sino estratificarlos para permitir analizar sus datos, por escasos que sean, sin contaminar los de los niños y adolescentes. Entre tanto, los adultos jóvenes (menores de 50 o 60 años) no deberían ser privados de los beneficios reservados a los pacientes más jóvenes.
Tratamiento quirúrgico del osteosarcomaSin tratamiento quirúrgico no existe posibilidad de curación del OS. Aunque la enfermedad diseminada metastásica es la causa del fallecimiento y la quimioterapia ha conseguido un cambio radical en las supervivencias, el tratamiento quimioterapéutico aislado no puede mantenerse por sí solo pues es incapaz de erradicar el tumor primario. Por lo tanto, el tratamiento quirúrgico del OS convencional queda intercalado entre la quimioterapia preoperatoria y la quimioterapia postoperatoria.
La finalidad de la secuencia terapéutica «quimioterapia preoperatoria y cirugía-quimioterapia postoperatoria» pretende controlar la enfermedad microscópica no detectable inicialmente, reducir el volumen, necrosar el tumor primario y posibilitar la guía del tratamiento quimioterapéutico postoperatorio a tenor de la tasa de necrosis evaluada en las piezas de resección o amputación.
La cirugía, siguiendo protocolos similares en niños y adultos, se realiza sobre la semana 15 de inicio de la quimioterapia. Ello representa una ventaja importante para el cirujano oncológico con tal de planificar adecuadamente el tipo de intervención y reconstrucción que se va a realizar. En cambio, no hemos observado disminuciones importantes de volumen tumoral, como inicialmente se aducía, con la quimioterapia preoperatoria.
Un inconveniente de la quimioterapia preoperatoria es el riesgo de que se produzca una fractura patológica en los OS líticos, como ocurre con el OS telangiectásico, que debe ser prevenida con la descarga en los tumores de la extremidad inferior.
El principal inconveniente de la quimioterapia postoperatoria es el riesgo de infección de las reconstrucciones, especialmente en la tibia, lo que condiciona que frecuentemente se demore su inicio hasta las 3 o 4 semanas después de la intervención, si el estado local de la herida quirúrgica lo aconseja.
La situación clínica y los estudios por imagen en pacientes no diseminados es la base para decidir si se realiza una cirugía de salvamento de la extremidad o una amputación. En esta decisión es imprescindible la coordinación con los servicios de anatomía patológica y radiodiagnóstico.
El salvamento de la extremidad es posible cuando se puede hacer la resección con un margen de 5cm, a nivel medular, si la resección del tumor extraóseo-partes blandas permite una funcionalidad aceptable y cuando el paquete vasculonervioso de la extremidad, después de resecar el tumor, asegura la viabilidad posterior de esta. En la porción articular, el margen puede ajustarse más por el efecto barrera del cartílago articular17. En casos seleccionados se resecan segmentos vasculares con by pass reparativo aunque han de ser valorados individualmente, tanto antes como durante la cirugía.
Las reconstrucciones en cirugía ortopédica oncológica son posibles con los homoinjertos estructurales masivos, las megaprótesis «a medida» y las megaprótesis tumorales modulares. La utilización de sistemas compuestos de megaprótesis y homoinjerto tiene la preferencia de los autores en pacientes jóvenes, en tanto que reservamos las artroplastias modulares en pacientes de edad media y avanzada o cuando no se pueden precisar los límites de la resección permitiendo a un sistema modular adaptarse a las circunstancias y hallazgos intraoperatorios18,19.
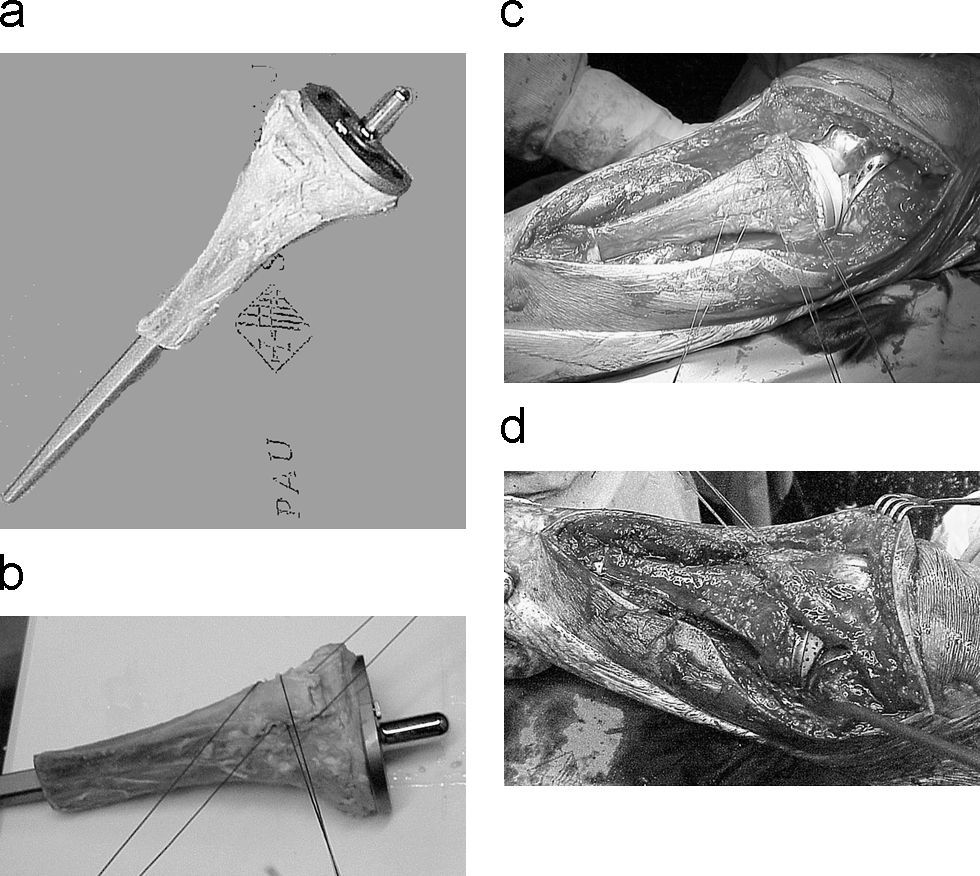
Los homoinjertos osteoarticulares en el área de la rodilla y en las articulaciones de carga se abandonaron por sus complicaciones, y también los utilizados en la reconstrucción del húmero proximal por la elevada tasa de fracturas del injerto. Preferimos, en pacientes jóvenes, la utilización de sistemas compuestos, y, en los pacientes de edad media, las megaprótesis modulares. Por localizaciones, las modalidades de reconstrucción en OS son en el fémur distal la artroplastia «a medida» compuesta con homoinjerto estructural en pacientes jóvenes y artroplastias modulares en pacientes de edad media o de difícil evaluación preoperatoria de los niveles de resección (fig. 1). En el fémur proximal indicamos las artroplastias de anclaje diafisario con homoinjerto para insertar la musculatura pelvitrocantérea en los pacientes jóvenes y las artroplastias modulares en edades medias.
En la tibia proximal están indicadas las megaprótesis «a medida» con homoinjerto masivo estructural para la reparación y reinserción ósea del aparato extensor (fig. 2) y en el húmero proximal aconsejamos la artroplastia «a medida» con homoinjerto estructural que incluya la cápsula y el manguito rotador del donante (fig. 3). El resto de localizaciones no es protocolizable por su menor incidencia y se planifican para cada tumor. Las reconstrucciones completas de fémur y húmero son excepcionales en OS.
La proporción de salvamento de la extremidad frente a la amputación primaria en los OS de las extremidades, entre 1983–1999, fue de 3:1 y las tasas de recidiva local tras salvamento de la extremidad del mismo equipo, en este período de tiempo, fueron del 15,3% en las resecciones de la tibia, del 10,3% en las resecciones del fémur y del 5% en las resecciones del húmero.
Las complicaciones inmediatas posquirúrgicas del salvamento de la extremidad en el OS se centran en la tibia y son las infecciones, los síndromes compartimentales, las roturas y las desinserciones del aparato extensor; pero en la mayoría de las series se obvian complicaciones a largo-medio plazo. En nuestra experiencia, la tasa de complicaciones fue del 11%, entre 2–5 años después de la cirugía de salvamento. Estas complicaciones en 161 reconstrucciones fueron roturas de material, fracturas de los homoinjertos, seudoartrosis con traducción clinicomecánica, luxaciones e infecciones hematógenas. No deben olvidarse las complicaciones locales a largo plazo (más de 5 años) que, en nuestra experiencia, llegan al 2,4%. Tampoco hay que olvidar las complicaciones mecánicas con reintervenciones por aflojamientos mecánicos que sucederán inevitablemente en una población superviviente tan joven y demandante de actividad. Por eso debe prevenirse a estos pacientes contra las causas de deterioro de los montajes reconstructivos, evitando triunfalismos demasiado frecuentes y potenciando que estas cirugías sean realizadas por equipos muy especializados.
Experiencia y resultados de la Sociedad Española de Oncología Pediátrica
Para la Sociedad Española de Oncología Pediátrica (SEOP), el OS es la neoplasia de hueso más frecuente, de localización preferente en huesos de extremidades inferiores de pacientes jóvenes. El pronóstico histórico ha cambiado en las últimas tres décadas como respuesta a la utilización de tratamientos quimioterapéuticos más efectivos, que han disminuido la incidencia de metástasis y de mortalidad. La literatura médica internacional ha aportado supervivencia a los 5 años para los pacientes diagnosticados en el período de 1974–1994 del 63%, y en la actualidad se intenta superar esas cifras al tiempo que se disminuyen las cirugías de amputación y las secuelas a corto y largo plazo. Revisiones muy recientes de grandes grupos cooperativos han evaluado la importancia de diversos factores pronóstico, separando grupos según esos criterios y, si bien se han superado ligeramente las expectativas de supervivencia para los OS localizados, las posibilidades para los que debutan con metástasis en el momento del diagnóstico se sitúan en un 9%.
Protocolo de la Sociedad Española de Oncología Pediátrica 1995 para el tratamiento de los osteosarcomasLa SEOP elaboró un primer protocolo de tratamiento que se activó en 1995 y se cerró en 2001, cuyos resultados se exponen a continuación.
El esquema terapéutico consistió en la utilización de cuatro drogas básicas:
Ifosfamida (1.800mg/m2 intravenosa [IV], en 1 h, 5 días) (semana 0, 5).
Adriamicina (25mg/m2 IV, en 18h, 3 días) (semana 0, 5 y 10).
Metotrexato (12g/m2 IV, en 4h, 1 día) (semana 3, 4, 8, 9, 13, 14).
Cisplatino (120mg/m2, en 4h, 1 día) (semana 10).
En la semana 15 se procedió a cirugía y la quimioterapia postoperatoria consistió en:
Ifosfamida (1.800mg/m2 IV, en 1h, 5 días) (semana 17, 22, 23, 37).
Adriamicina (25mg/m2 IV, en 18h, 3 días) (semana 17, 22, 27).
Metotrexato (12g/m2 IV, en 4h, 1 día) (semana 20, 21, 25, 26, 30, 31, 35, 36, 40, 41).
Cisplatino (120mg/m2, en 4h, 1 día) (semana 27, 42).
En este protocolo se registraron un total de 136 pacientes de 22 hospitales, de los cuales se analizaron 116, dado que 20 fueron excluidos por violaciones del protocolo. Se trataba de 100 casos de OS localizado y 16 casos metastásicos o multicéntricos (13,8%) (tabla 1).
Casos de la Sociedad Española de Oncología Pediátrica 1995
| Hospital | Pacientes |
| Sant Pau | 17 |
| Ramón y Cajal | 17 |
| Virgen del Rocío | 15 |
| La Paz | 10 |
| Valle Hebrón | 9 |
| Niño Jesús | 8 |
| S. Joan de Deu | 8 |
| Central de Asturias | 7 |
| 12 de Octubre | 4 |
| Virgen del Camino | 3 |
| La Fe | 2 |
| Cruces | 2 |
| Carlos Haya | 2 |
| Clínico de Valencia | 2 |
| Juan Canalejo | 2 |
| Basurto | 2 |
| Miguel Servet | 2 |
| Sabadell | 1 |
| Virgen de Arrixaca | 1 |
| Virgen de Aránzazu | 1 |
| Trias i Pujol | 1 |
| S. Juan de Alicante | 1 |
Respecto a la cirugía, en dos casos se efectuó de inicio, dado que se mostraron fracturas patológicas como primer síntoma. Del resto de los pacientes, 16 (15%) precisaron amputación y 94 precisaron cirugía conservadora. Respecto a la respuesta histológica efectuada valorando el grado de necrosis, se obtuvo una buena respuesta en el 67% (>90% de necrosis) y en el 33% restante la respuesta fue pobre. De los 100 pacientes localizados, 9 presentaron recidiva local (tabla 2).
La supervivencia libre de enfermedad, según criterios de respuesta histológica, fue del 62% para los que respondieron bien y del 44% cuando la respuesta era pobre.
Protocolo de la Sociedad Española de Oncología Pediátrica-Osteosarcoma-2001Basados en estos resultados, en el 2001 se elaboró un nuevo protocolo para continuar un registro español completo y actualizado de todos los pacientes pediátricos con OS, tratar de forma diferente el OS localizado y el metastásico y acortar la duración del tratamiento reduciendo el número total de dosis de metotrexato, en vista de los resultados (similares a los de la SEOP 95) publicados por otros grupos terapéuticos que emplean menos número de dosis de metotrexato y, así, adecuar la dosis de metotrexato sobre la base de la farmacocinética individual, para conseguir niveles terapéuticos óptimos. Además, se iniciaron los estudios de biología molecular para evaluar su correlación pronóstica.
El esquema de quimioterapia para los casos con enfermedad localizada consistió en:
Ifosfamida (1.800mg/m2 IV, en 1h, 5 días) (semana 0 y 5).
Adriamicina (25mg/m2 IV, en 18h, 3 días) (semana 0, 5 y 10).
Metotrexato (12g/m2 IV, en 4h, 1 día) (semana 3, 4, 8, 9, 13, 14).
Cisplatino (120mg/m2, en 4h, 1 día) (semana 10).
En la semana 15 se procedió a cirugía y la quimioterapia postoperatoria:
Ifosfamida (1.800mg/m2 IV, en 1h, 5 días) (semana 17, 21, 29, 33).
Adriamicina (25mg/m2 IV, en 18h, 3 días) (semana 17, 21, 25).
Metotrexato (12g/m2 IV, en 4h, 1 día) (semana 20, 24, 28, 32, 36).
Cisplatino (120mg/m2, en 4h, 1 día) (semana 25, 37).
En los pacientes con metástasis en el momento del diagnóstico se indicó cirugía en la semana 11, tras haber recibido dos ciclos de ifosfamida y adriamicina, tres ciclos de metotrexato y un ciclo de cisplatino y adriamicina. Tras la cirugía siguió el tratamiento quimioterapéutico de mantenimiento hasta la semana 32, cuando se procedió a la intensificación quimioterapéutica con carboplatino, tiotepa y etopósido, seguida de TASPE. Los pacientes incluidos hasta marzo de 2008 en el protocolo SEOP-OS-2001 se presentan en las tablas 3 y 4.
Sociedad Española de Oncología Pediátrica-Osteosarcoma-2001-Localizados
| Hospital | Pacientes |
| Niño Jesús | 15 |
| Virgen del Rocío | 12 |
| Sant Pau | 13 |
| Sant Joan de Deu | 6 |
| La Paz | 6 |
| 12 de Octubre | 4 |
| Carlos haya | 4 |
| La Fe | 3 |
| Miguel Servet | 3 |
| Ramón y Cajal | 2 |
| Valle Hebrón | 2 |
| Cruces | 2 |
| Gregorio Marañón | 2 |
| Trias i Pujol | 2 |
| Virgen del Camino | 2 |
| Central de Asturias | 2 |
| Universitario de Canarias | 1 |
| Ntra. Sra. de la Candelaria | 1 |
| Sabadell | 1 |
| Juan Canalejo | 1 |
| Virgen de Arrixaca | 1 |
| Xeral de Galicia | 1 |
| Torre Cárdenas | 1 |
| Total | 97 |
La supervivencia global fue del 73%; en los pacientes con grado de necrosis superior al 90% fue del 77%, y en los pacientes con necrosis inferior al 90% fue del 72%, aunque el protocolo sigue abierto y se evalúa la toxicidad y plantean cambios en la forma de administrar las drogas para disminuir los efectos secundarios a corto y largo plazo (fig. 4).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.