El tratamiento de los tumores primitivos de la columna vertebral toracolumbar requiere el conocimiento de las características biológicas, de las diversas formas clínicas, de sus manifestaciones radiológicas y el conocimiento de la sensibilidad al tratamiento coadyuvante. Además, es necesario el conocimiento de la vía anatómica y de la técnica quirúrgica que permita practicar una resección en bloque, cuando está indicada. La elección terapéutica debe ser planificada sobre la base del diagnóstico y del estadiaje oncológico del tumor, evitando que sea una cirugía demasiado tímida, limitada a un curetaje, cualquiera que sea el diagnóstico, o bien demasiado agresiva, siguiendo el ejemplo de una resección en bloque en lesiones curables con una escisión intralesional asociada a tratamiento adyuvante. La clave está en el conocimiento de las características biológicas del tumor y su encuadramiento en un estadiaje oncológico.
La elección de la instrumentación depende de la necesidad reconstructiva y del pronóstico. La inestabilidad residual en la escisión de una neoplasia primitiva no está sólo ligada al defecto óseo provocado por el tumor, sino también a un desequilibrio del sistema musculotendinoso interrumpido por la resección intra o extralesional, y del consiguiente defecto mecánico-funcional ocasionado en el raquis. El desarrollo de la terapia médica, radioterápica y quirúrgica, permite una supervivencia larga, incluso en los tumores malignos, y una reconstrucción para obtener no sólo la inmediata recuperación funcional del paciente sino sobre todo una estabilidad a largo plazo del raquis.
La cirugía de las neoplasias del aparato locomotor comporta la creación de un defecto óseo que puede ser reconstruido con diferentes procedimientos y materiales de osteosíntesis. Los criterios de reconstrucción son diferentes para cada caso y tipo de resección1.
La resección completa del arco posterior requiere siempre de una instrumentación, preferiblemente en titanio, que provoca menos artefactos en la tomografía axial computarizada (TAC) y la resonancia magnética nuclear (RMN), asociada a un injerto óseo para la artrodesis. La corporectomía completa implica la sustitución del cuerpo vertebral y de un sistema de estabilización anterior o posterior2-5.
La vertebrectomía requiere un sistema de estabilización posterior y otro anterior asociado a una sustitución del cuerpo vertebral6-8. Algunos tipos de reconstrucción del cuerpo vertebral evitan el uso de implantes de estabilización anterior. El material más frecuentemente utilizado para la instrumentación es de acero o titanio. En la reconstrucción anterior se puede usar autoinjerto, aloinjerto o prótesis con aleación de acero, titanio, cerámica o carbono. Para la reconstrucción posterior se utilizan barras conectadas a tornillos pediculares o ganchos que ofrecen gran estabilidad y versatilidad.
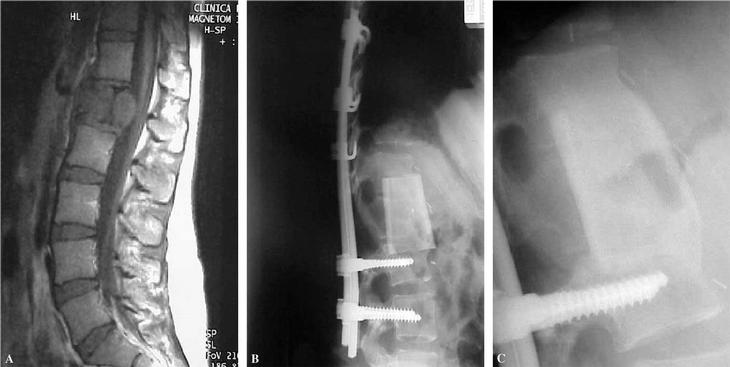
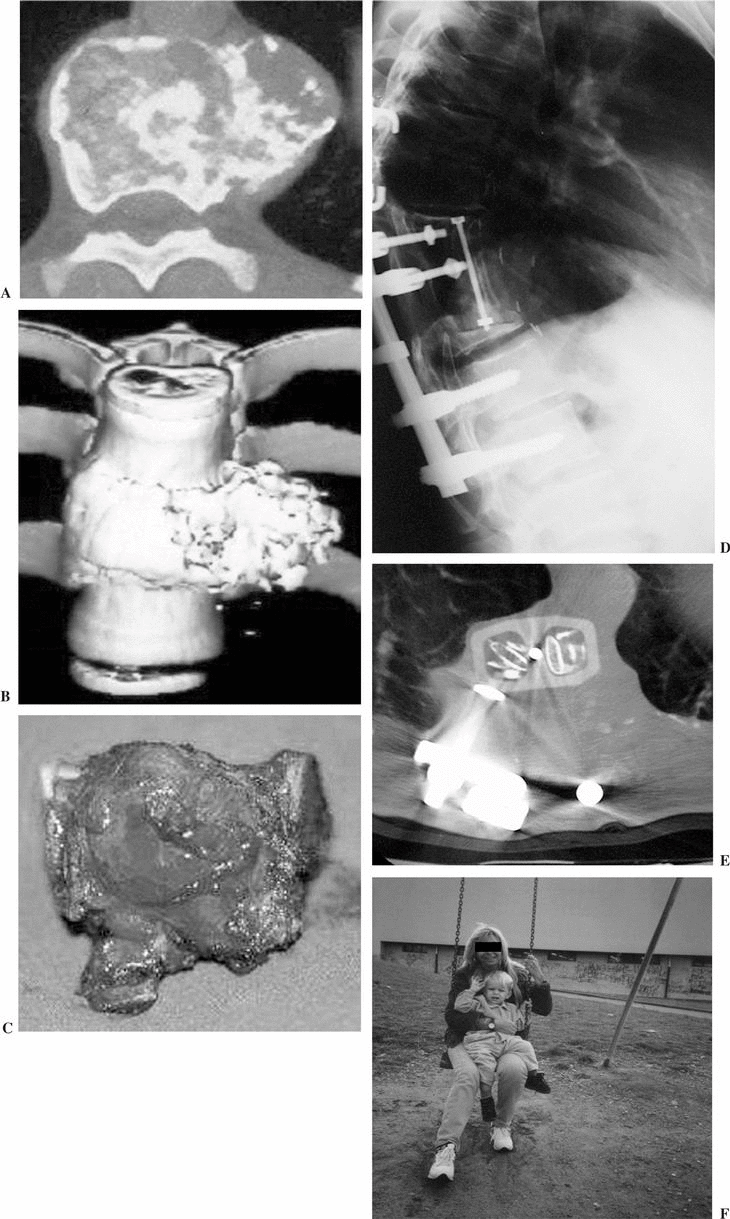
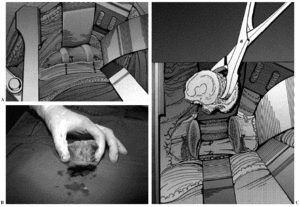
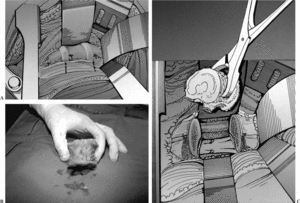
El cemento profusamente utilizado en el pasado se recomienda tan sólo en la actualidad para reconstruir la columna anterior de pacientes con breve expectativa de vida, condicionada por su limitada fiabilidad en el tiempo9. Los injertos óseos representan el más antiguo y clásico espaciador utilizado en la cirugía oncológica. Todos los injertos pueden ser indicados para conseguir una artrodesis intersomática o para sustituir un cuerpo vertebral extirpado. El injerto autólogo garantiza una fusión más rápida, mientras que el injerto homólogo precisa de un tiempo de protección más prolongado, para evitar el riesgo de pseudoartrosis o fracaso del montaje. Sin embargo, su comportamiento es muy superior al de otras localizaciones anatómicas (fig. 1A-C). La experiencia más reciente es el uso de prótesis de fibra de carbono (fig. 2).
Figura 1. Sustitución del cuerpo vertebral con un aloinjerto. (A) Resonancia magnética nuclear (RMN) en T1 de una tumoración de L1 en una paciente de 26 años afecta de condrosarcoma de la primera vértebra lumbar con afectación del cuerpo vertebral. (B) Resección en bloque del tumor; colocación anterior de un aloinjerto de diáfisis femoral congelado de banco, con sobredimensión del mismo. (C) La misma paciente a los tres años con integración completa del aloinjerto y adaptación a la forma vertebral.
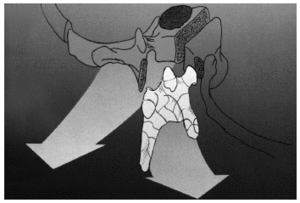
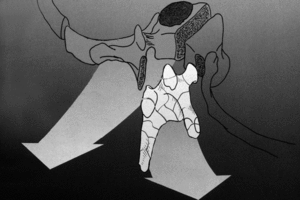
Figura 2. Reconstrucción del cuerpo vertebral resecado con un sistema original que comprende módulos combinables (Stakable Cages®) de fibra de carbono que pueden conectarse con las barras posteriores y rellenarse de autoinjerto.
INTERVENCIONES ONCOLÓGICAS EN EL RAQUIS TORACOLUMBAR
Además del estudio clínico y radiológico utilizaremos el estadiaje siguiendo la clasificación de Ennekin10,11.
Escisión intralesional intracapsular
Tratándose de una escisión simple de la neoplasia en el interior de la pseudocápsula, requiere una sola vía de acceso. En el plano operatorio la vía de acceso se escogerá según la localización de la neoplasia. La indicación oncológica incluye pequeñas lesiones benignas estadio 2, o lesiones pseudotumorales, de las que son ejemplos el osteoma osteoide o el quiste óseo aneurismático, respectivamente.
Escisión intralesional extracapsular
Como suele ser indispensable resecar estos tumores con su pseudocápsula, es frecuentemente necesario un doble acceso. Es la técnica de elección en las lesiones benignas estadio 2, y va asociado a radioterapia complementaria en las lesiones benignas estadio 3 (fig. 3).
Figura 3. Imagen de un quiste óseo aneurismático que afecta el arco posterior de una vértebra torácica. Grupo 2 de la clasificación de Enneking1,2.
Papel de la embolización arterial
La embolización arterial selectiva es una técnica radiológica invasiva que requiere experiencia manual, y es de ayuda para el cirujano que prepara una resección intralesional. También puede tener un valor terapéutico en algún caso de quiste óseo aneurismático12. En el estudio vertebral el neurorradiólogo debe averiguar si los ramos arteriales a embolizar nutren la médula para evitar que la maniobra comporte isquemia medular (fig. 4).
Figura 4. La embolización arterial selectiva permite estudiar la vascularización de los tumores vertebrales, y si es posible su embolización.
Resección en bloque
Es la intervención quirúrgica que procura la exéresis de la neoplasia en una sola pieza, circundada de un estrato continuo de tejido sano, de espesor más o menos amplio. Está indicada en las lesiones benignas estadio 3 y en las lesiones malignas de bajo grado (estadio 1). Suele ser insuficiente en las lesiones malignas estadio 2, si no se asocia a protocolo oncológico combinado.
VÍA DE ACCESO
Vía posterior
Es la vía de acceso mediana normal. La primera regla quirúrgica, incluso en la cirugía intralesional, es la de rodear el tumor siempre que sea posible, dejándolo cubierto de tejido sano, y ejecutar la hemostasia de la manera más cuidadosa posible. Se efectúa la exéresis del tumor después de proteger con gasas el tejido circundante en condiciones de perfecto control hemodinámico, para reducir al mínimo el sangrado, evitar la difusión del tumor y para visualizar mejor la masa a resecar.
La vía posterior consigue una resección completa extracapsular del arco posterior incluyendo la apófisis transversa. La escisión extracapsular de un pedículo comporta el sacrificio del istmo y de gran parte de la apófisis articular. La escisión intralesional del cuerpo vertebral por vía posterior13 es extracapsular si el tumor está contenido en el interior del cuerpo vertebral, ya que si se expande anteriormente, no podemos obtener una escisión extracapsular, faltando el necesario control visual sobre las estructuras contiguas.
Via anterior
El cuerpo de T1 y de T2 pueden ser abordados por vía preesternocleidomastoidea, alargada inferiormente mediante resección del manubrio esternal. El acceso a esta zona se ve dificultado por el nervio laríngeo recurrente y por el tronco venoso homónimo, la cúpula pleural y el ganglio estrellado.
El cuerpo de T2-T3 a T10-T11 puede ser abordado por toracotomía izquierda o derecha, según la extensión del tumor a resecar. En particular los cuerpos de T2 a T5-T6 pueden ser alcanzados mediante una incisión longitudinal axilar que no comporta sección muscular.
El segmento toracolumbar requiere una toracofrenolumbotomía. La vía de acceso descrita por Mirbaha14 tiene la ventaja de evitar la sección de la pleura, consiguiendo un postoperatorio menos doloroso y menos complicado. El cuerpo vertebral L2-L3-L4, y parcialmente L5, se alcanza mediante una lumbotomía anterolateral, con el paciente en decúbito lateral, consiguiendo una visualización lateral de todo el cuerpo vertebral. Los grandes vasos y el contenido abdominal se desplazan por vía extraperitoneal gracias a las valvas maleables que quedan dispuestas en torno al cuerpo vertebral, después de la sección de al menos tres pedículos vasculares segmentarios.
El acceso sobre L5 y sobre la fascia anterior del sacro requiere una laparotomía media, con la disección y el desplazamiento de la bifurcación aórtica y de los vasos venosos, consiguiéndose una luz reducida y profunda, que hace muy difícil la resección de neoplasias muy vascularizadas.
LA TÉCNICA DE RESECCIÓN
Una resección en bloque, con la excepción de los pequeños tumores posteriores, es una intervención de larga duración que requiere una estrecha colaboración y experiencia anestesiológica15. La edad avanzada y las condiciones generales precarias son contraindicaciones relativas. Además, la quimioterapia después de una intervención de esta entidad, con una pérdida del 100%-120% de la masa hemática, la reducción de la defensa inmunitaria o la menor de las complicaciones quirúrgicas, pueden impedir su ejecución. En diagnósticos como el osteosarcoma pueden condicionar un grave perjuicio para el pronóstico, aun después de una intervención quirúrgica bien ejecutada16,17.
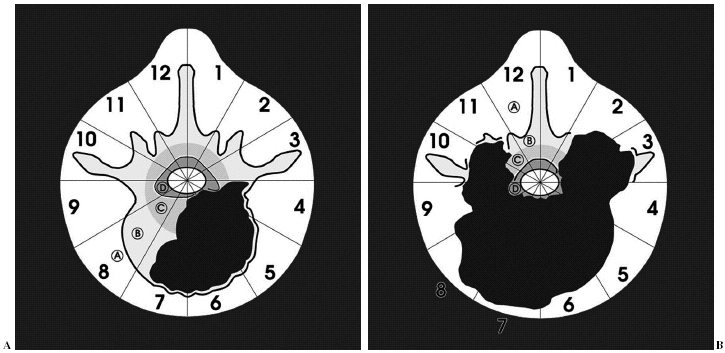
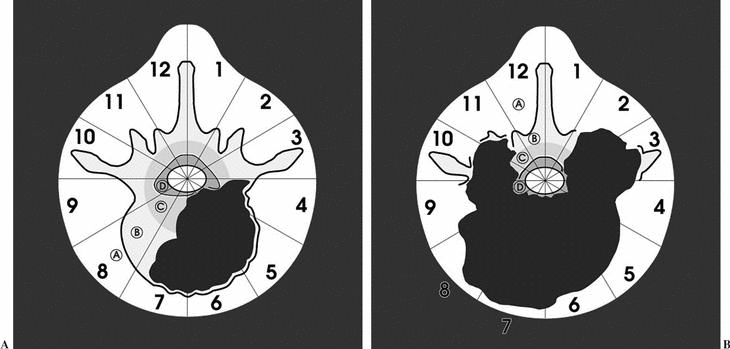
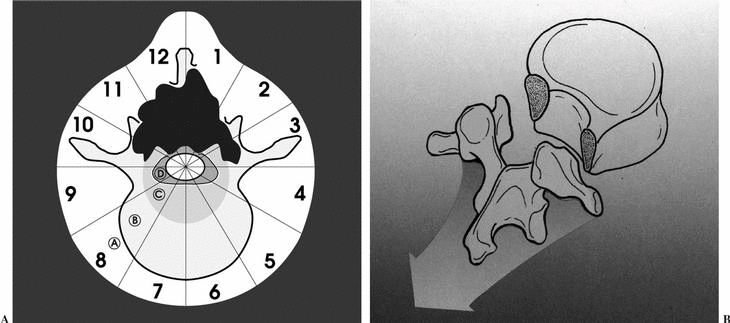
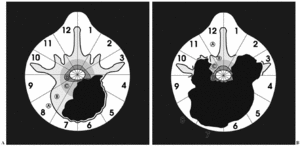
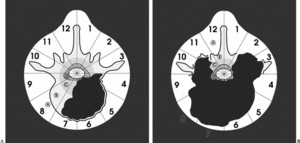
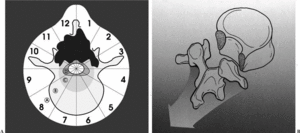
Durante la descripción de la técnica quirúrgica haremos referencia al sistema de estadiaje WBB18,19 (fig. 5), basado en el estudio preoperatorio. La RMN permite identificar la posible invasión del espacio epidural, elemento crítico para la adecuación del margen quirúrgico.
Figura 5. Wenstein, Boriani y Biagini9,10 (WBB) diseñaron una clasificación para localizar las áreas de afectación vertebral de los tumores raquídeos y diseñar una resección quirúrgica. La vértebra se divide en 12 áreas (1-12) y en 5 sectores (A-E), donde A corresponde a la afectación más periférica en las partes blandas y E a la más profunda en la duramadre. Entre ellas se situarían en el gráfico, como se puede observar, las áreas B, C y D.
Otro elemento de contaminación del espacio epidural y en consecuencia de la inadecuación oncológica es la biopsia, realizada mediante laminectomía sobre una neoplasia del cuerpo vertebral. El riesgo de contaminación aumenta con una intervención previa de resección parcial, que incrementa la morbilidad a causa de la cicatriz quirúrgica, que puede englobar vasos, uréter, tejido dural, conducto torácico, la pleura, el peritoneo y los órganos que contiene, que hacen posible la lesión de estas estructuras durante la cirugía de revisión. Problemas análogos pueden encontrarse en la fibrosis postquirúrgica.
La resección en bloque del cuerpo vertebral
Tuvo su origen en las publicaciones de Stener y Jensen20-22 y Roy Camille23, en los años setenta; se trata de un procedimiento de resección en bloque del cuerpo vertebral realizado con mentalidad «oncológica», con técnica de acceso prevalentemente posterior, modificada más tarde por K.Tomita et al24.
Indicaciones de resección en bloque del cuerpo vertebral
Deben considerarse tres criterios oncológicos:
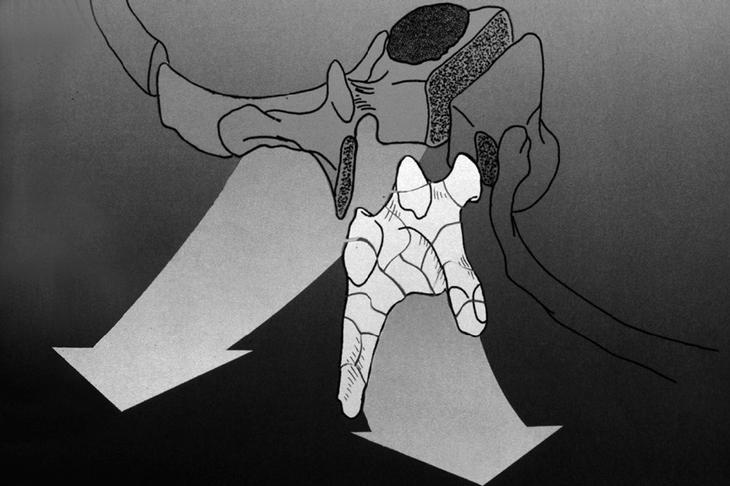
1) Un abordaje posterior simple puede ser adecuado si la neoplasia no se extiende por delante. La disección manual de la superficie anterior del cuerpo vertebral y de las estructuras vasculares supone inevitablemente un margen intralesional (fig. 6A). Es mejor dejar un plano de tejido sano (psoas, pleura) que cubra el tumor, pues la rotura de un vaso segmentario, por vía posterior, puede significar un evento dramático, mientras que es una complicación controlable por vía anterior.
Figura 6. Según la invasión corresponderá un tipo de resección u otro. (A) Afectación del área 4-9 en los sectores B, C y D; sin afectación en el sector A puede abordase tan sólo por una vía anterior. (B) Afectación amplia uni o bilateral del pedículo vertebral que supone la utilización de un doble abordaje anterior y posterior para poder realizar una resección en bloque.
2) Sea cual sea la técnica empleada, uno de los dos pedículos debe ser liberado del tumor. El gesto final de exéresis del cuerpo vertebral requiere una maniobra de rotación que no es posible sin retirar al menos un pedículo (por el riesgo de dañar la dura o comprimir su contenido), que debe ser liberado del tumor; de otro modo, la resección debe ser definida como intralesional (fig. 6B).
3) La invasión del espacio epidural comporta, casi constantemente, una contaminación del margen de resección, pues el ligamento longitudinal posterior no cubre toda la pared posterior del cuerpo vertebral, y no impide que el tumor pueda difundirse por el canal medular, sin la posibilidad de formación de una pseudocápsula.
En la preparación del plano operatorio debe considerarse: a) la extensión longitudinal del tumor, y en consecuencia el nivel por el que seguiremos la sección a través del cuerpo vertebral o del disco; b) saber qué raíz debe sacrificarse en el caso de que el tumor la circunde (invasión foraminal) o para conseguir que la dura se desplace sin tracción medular. Debe de ser evaluado el significado funcional de la raíz sacrificada y discutir con el paciente informando del coste-beneficio del daño funcional y su adecuación quirúrgica según el diagnóstico inicial; c) si se propone seccionar una raíz y tenemos documentado que en su interior se encuentra una arteria eferente de la arteria espinal anterior, deberá valorarse el problema con el paciente, con la posibilidad de que en el sujeto joven puedan desarrollarse otras aferencias; d) la eventual invasión de un pedículo condiciona su abordaje, y en la vía anterior se hará a través del lado afecto; e) el área de invasión del espacio epidural para poder programar la disección de la dura o su resección con el tumor, y f) el área de invasión del plano superficial anterior para escoger la vía de acceso debe ser cuidadosamente realizada por vía posterior.
Abordaje posterior
Debe realizarse en decúbito prono, con la cadera y las rodillas flexionadas. Se controlarán cuidadosamente los soportes torácicos y de la cresta ilíaca para evitar los decúbitos y el estiramiento de los troncos nerviosos (este proceso puede durar hasta 6 horas) o bien la compresión sobre la pared abdominal. Tras una incisión longitudinal media se diseca el plano muscular, dejando un plano de tejido sobre la eventual expansión neoplásica extraósea posterior. Se implantan tornillos pediculares sobre al menos dos segmentos por encima y por debajo de la resección. El montaje debe sobrepasar las zonas de transición y adaptarse a la curva sagital.
En el raquis torácico alto (T1-T3) debe considerarse el anclaje proximal en el raquis cervical mediante placas que permiten la dirección en los tres planos del espacio o bien con barras de varios calibres.
En la columna torácica (T4-T10) se puede escoger entre sistemas de barras con ganchos y tornillos o placas con tornillos pediculares. En cirugía oncológica, el tornillo pedicular tiene ventajas (amarra mejor incluso en caso de osteoporosis) y se puede desconectar, reconectar o ampliar en caso de revisión.
En la charnela toracolumbar (T11-L2) las ventajas mecánicas de los tornillos pediculares son todavía mayores. En la columna lumbar, donde contamos con un amarre mayor del tornillo pedicular, puede considerarse el montaje breve a tres espacios para las lesiones de L3 a L5, aunque un montaje más largo da siempre más garantías de estabilidad a largo plazo después de una vertebrectomía.
Es necesaria una escisión muy amplia de las estructuras posteriores para tener espacio suficiente y visualizar las estructuras anteriores donde se realizará la resección del cuerpo vertebral o del disco. Si un pedículo está invadido por el tumor el abordaje anterior se realizará por el mismo lado, aunque no permite obtener un margen de seguridad adecuado.
En esta fase puede realizarse una biopsia extemporánea para la eventual confirmación del diagnóstico. El trazo biópsico en el pedículo o el cuerpo vertebral deberá cubrirse con cemento acrílico. Todo esfuerzo es poco para conseguir reducir al mínimo la contaminación del tejido sano a causa de la dispersión de las células neoplásicas. En el raquis torácico la invasión costal exigirá la resección de la costilla afecta. La pared lateral del cuerpo vertebral puede ser disecada por vía extrapleural y se pueden ligar los vasos segmentarios. Si el tumor se expande fuera de la vértebra debe respetarse la cobertura pleural representando un exiguo pero suficiente margen.
El saco dural debe ser cuidadosamente disecado y liberado de toda adherencia con el cuerpo vertebral. La raíz que retiene al saco dural, con el peligro de que sufra un desgarro, será incluida en la resección tumoral. Separando el saco dural se decide el nivel de resección, iniciando ésta por el ligamento longitudinal común posterior a través del disco o del muro superior. Es particularmente útil seguir una sección completa hasta el lado opuesto decidido por el abordaje anterior.
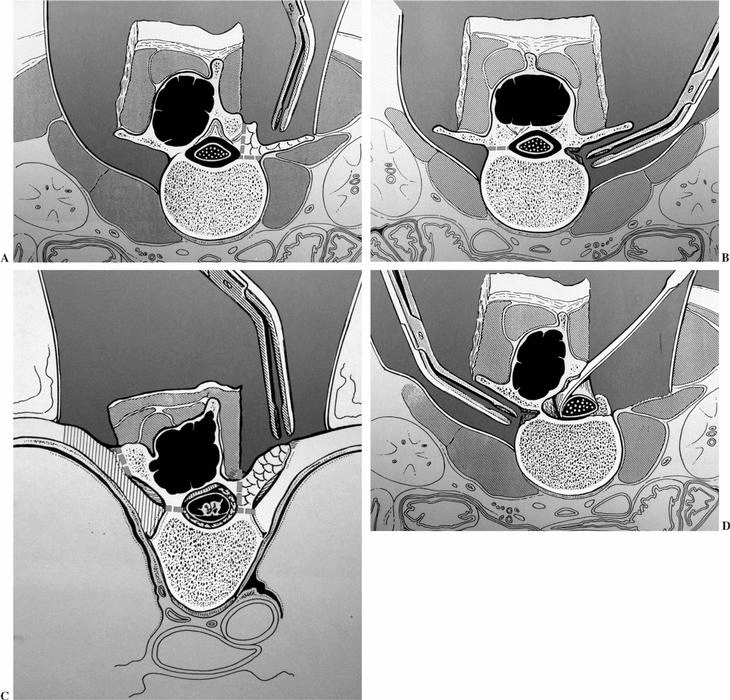
Si el tumor está totalmente incluido en el cuerpo vertebral (fig. 6A) puede realizarse toda la vertebrectomía por vía posterior, después de haber rodeado la cara anterior y lateral del cuerpo vertebral, con la precaución de liberar los grandes vasos. Se introduce una valva maleable a modo de protección de las estructuras anteriores para concluir con sierra de Gigli, de Tomita, escoplo o bisturí la sección transversal de la columna anterior. Posteriormente, a diferencia de la técnica que prevé un doble acceso, la fase final del abordaje anterior incluye la interposición de material para mantener un espacio no virtual entre la dura y los márgenes tumorales, y el margen tumoral y los tejidos circundantes del lado contrapuesto al previsto abordaje anterior, completando la instrumentación y la sutura temporal de la herida.
Abordaje anterior
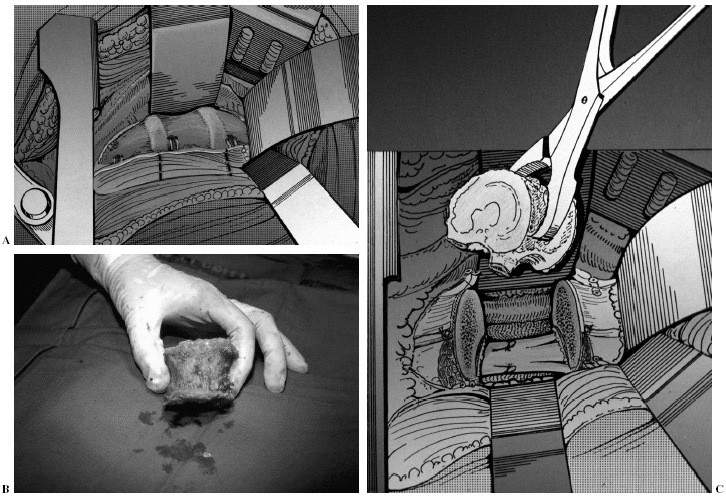
El paciente se coloca en decúbito lateral (90°) con 4 puntos sólidos de apoyo. Según el nivel de la vertebrectomía seguiremos una vía de acceso para conseguir una exposición suficiente (toracotomía, toracofrenolombotomía, lobotomía posterolateral). Expuesta la masa neoplásica, se reemprende la escisión manteniendo la distancia al tumor, dejándolo cubierto por la pleura o el psoas (fig. 7A). Es necesario ligar los vasos segmentarios lo más lejos posible de la aorta (y de la cava en caso de acceso derecho lumbar).
Figura 7. Abordaje exterior torácico. (A) Expuesta la masa neoplásica se abordan los vasos segmentarios por encima y por debajo de la lesión. (B) Resección en bloque del cuerpo vertebral. (C) Esquema peroperatorio.
Se introduce delicadamente una valva maleable, modificando progresivamente la forma, para desplazar las estructuras mediastínicas en el área torácica, y el contenido abdominal especialmente los vasos, en área lumbar. En este momento, el cirujano tiene una visualización completa de los dos tercios del cuerpo vertebral, y a continuación aborda de nuevo la incisión posterior y la valva maleable se desliza hasta la base del pedículo contralateral, donde se identifica por palpación, garantizando una protección completa. En este punto con toda seguridad y bajo el control visual, podemos realizar la resección en bloque del cuerpo vertebral usando el escoplo, el bisturí, o una fresa de alta velocidad según el tejido a cortar, la experiencia o preferencia del cirujano (figs. 7B y C). La reconstrucción de la columna anterior puede ser obtenida con un sistema original que comprende módulos combinables de carbono (Stakable Cages®, Depuy, Raynham, EE.UU.) que pueden conectarse con las barras posteriores rellenas de fragmentos óseos autólogos de la cresta ilíaca. El uso de aloinjerto estructural es otra posibilidad. No es necesaria una instrumentación anterior, obteniéndose la estabilidad al comprimir la instrumentación posterior.
La resección del cuerpo de L5 requiere un acceso triple a causa de la estrecha correlación anatómica en la bifurcación de los grandes vasos, con liberación a derecha e izquierda de los mismos.
Tratamiento postoperatorio
Después del ingreso en la Unidad de Cuidados Intensivos, el reequilibrio de las condiciones cardiovasculares y la retirada del drenaje pleural, el paciente puede iniciar ejercicios de movilización activa, y lo antes posible la sedestación y la marcha con una ortesis raquídea. El primer control radiográfico y la TAC a los tres meses permiten en muchas ocasiones distinguir la presencia de hueso neoformado en el interior de la prótesis radiotransparente, y aconsejar el abandono progresivo de la ortesis.
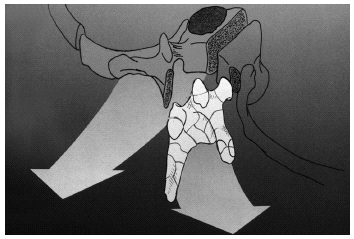
Resección sagital
Es la resección en bloque de las neoplasias que se desarrollan de forma excéntrica, a partir del pedículo o del área limítrofe25 (fig. 8).
Figura 8. Resección sagital de parte del arco posterior y de parte del cuerpo vertebral.
Indicaciones de la resección en bloque del cuerpo vertebral
El criterio para obtener un margen oncológicamente adecuado (fig. 8) exige la no invasión del espacio D del sistema WBB18, o bien explorar el plano de clivaje entre la cápsula del tumor y la duramadre. La correcta planificación de la intervención debe considerar la extensión del tumor en el plano longitudinal, el nivel de resección a través del disco o del cuerpo vertebral, y las raíces que deberán sacrificarse, englobadas en la masa tumoral para permitir una liberación de la dura sin riesgo. Una exéresis del foramen es imprescindible con este procedimiento. La porción de tumor que se extienda en el espacio epidural deberá ser liberado con exquisita atención, y será necesario el uso del microscopio o de lupas de al menos 2,5 aumentos.
Abordaje posterior
La posición del enfermo, la incisión cutánea, la vía de acceso y la colocación de los tornillos pediculares son los mismos que los indicados para la vertebrectomía. La diferencia más importante es que la disección del plano muscular no será bilateral, y si la neoplasia crece hacia el dorsal deberá dejarse un plano muscular con el tumor, cortando las fibras musculares por encima y por debajo de éste a una distancia adecuada. Puede ser útil una incisión en T (fig. 9). En este caso, si el tumor invade también la apófisis transversa o la costilla, deben dejarse intactas.
Figura 9. Incisión en «T» que al unirse con el abordaje anterior permite un campo quirúrgico suficiente.
A continuación se inciden las estructuras posteriores sanas, quedando siempre lejos del tumor. La dura debe ser aislada por encima y debajo del tumor. En la región lumbar el tumor debe ser separado de los músculos de la pared abdominal. En el raquis torácico, a fin de seguir la incisión, deben prepararse las costillas por encima y debajo del tumor.
En este punto se implantan los tornillos pediculares o los ganchos. Generalmente, durante la planificación preoperatoria, la reconstrucción debe prever una estabilización de dos niveles por encima y por debajo del nivel de la lesión.
Se debe después disecar con mucha atención la duramadre para separarla del tumor. Una o dos raíces suelen ser sacrificadas para poder preservar con relativa seguridad el saco dural de manera que podamos completar la exposición posterior del plano de resección sagital (fig. 10).
Figura 10. Disección de la duramadre del tumor, sacrificando una o dos raíces nerviosas para exponer el saco dural y completar la exposición posterior del plano de resección sagital.
La resección sagital del pedículo contralateral resultará muy útil a fin de evitar comprimir el contenido dural contra una estructura ósea durante la retirada del tumor. Puede resultar difícil conseguir la hemostasia de los vasos epidurales, en particular en el punto donde el tumor invade el canal, para lo cual se recomienda la pinza de coagulación bipolar y asociar compresión o productos hemostáticos.
La instrumentación posterior se fija temporalmente y viene seguida de un cierre cutáneo.
Abordaje anterior
La posición del paciente será en decúbito lateral (90°) mediante 4 apoyos fijos. Se abre de nuevo la incisión posterior y se amplía mediante una incisión transversa a 90° por encima del nivel de la lesión, con una incisión en T.
En el raquis torácico la costilla debe ser resecada a distancia adecuada de la masa tumoral, abriendo la cavidad pleural. Después del colapso del pulmón se separa la pleura de alrededor del tumor; se ligan y seccionan los vasos segmentarios, alejándose lo más posible de la aorta y el mediastino, colocando una valva maleable alrededor del cuerpo vertebral.
En el raquis lumbar se realiza un acceso anterior al espacio retroperitoneal, para desplazar el saco peritoneal hacia delante. La incisión debe realizarse alrededor del tumor incluyendo, si es necesario, la inserción diafragmática. Los vasos segmentarios serán ligados y seccionados lo más lejos posible de la vena cava y la arteria aorta, introduciendo una valva maleable alrededor del cuerpo vertebral. Así, el tumor queda aislado circunferencialmente y podemos llevar a cabo la última fase de la resección.
El saco dural se despega con precaución. Se coloca un escoplo en el muro posterior y se hace avanzar hasta la superficie anterior del cuerpo vertebral, donde la valva maleable protege a los vasos y vísceras. Cuando se ha completado la osteotomía sobre el plano sagital se realizan dos osteotomías sobre el plano transverso, permitiendo la resección en bloque del tumor. Es posible que durante la osteotomía se afronte un sangrado profuso.
Se reconstruye el defecto vertebral mediante aloinjerto o prótesis de carbono e injerto autólogo, que finalmente se completa con una instrumentación posterior.
Tratamiento postoperatorio
Después del ingreso en la Unidad de Cuidados Intensivos y la retirada del eventual drenaje torácico, el paciente puede iniciar los ejercicios de bipedestación con un simple soporte externo de tres puntos que llevará durante tres meses.
Resección posterior
Es la resección en bloque de la neoplasia que se desarrolla en el arco posterior, respetando el pedículo, que es el criterio de adecuación oncológica25,26 (figs. 11A y B).
Figura 11. Las neoplasias que afectan el arco posterior (sectores 10-12 y 1-3) y que respetan el pedículo vertebral (A) pueden ser abordadas tan sólo por una vía posterior para conseguir una resección en bloque. (B) Imagen tridimensional de la exéresis completa del arco posterior.
Indicación de la resección posterior
Sobre la base del sistema WBB18,19, los criterios necesarios para poder obtener un margen oncológicamente apropiado son: los sectores 4 y 9 deben estar libres de tumor, no debe estar invadido el nivel epidural D y se dispone de un claro plano de clivaje entre la pseudocápsula tumoral y el saco medular. La escisión en bloque del tumor localizado posteriormente es relativamente simple; se consigue mediante un solo abordaje posterior y requiere que el pedículo no esté invadido por la neoplasia para obtener un margen oncológico adecuado (fig. 11B).
Abordaje posterior
Se procede a una incisión longitudinal posterior en la línea media que incluye la posible cicatriz de la biopsia. Se deja un amplio plano de tejido sano alrededor del tumor, mientras que por encima y por debajo de la lesión realizamos un abordaje clásico, esqueletizando la musculatura del arco posterior, la vía de acceso debe ser amplia: en el raquis lumbar hasta las apófisis transversas y hasta los arcos costales en la región torácica.
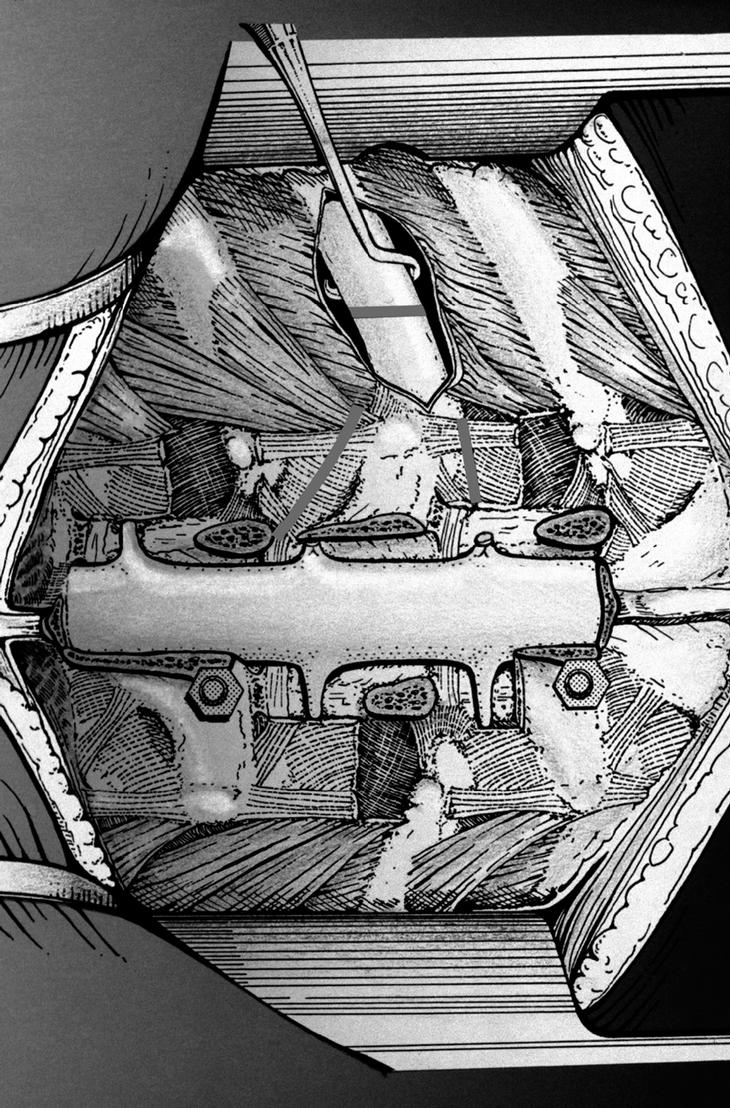
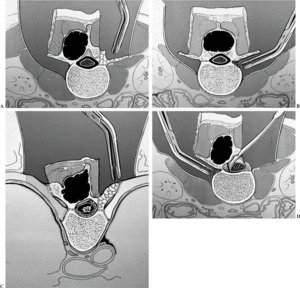
La laminectomía se realiza por debajo y por encima del tumor, exponiendo el saco dural y realizando una meticulosa hemostasia. Para la resección del pedículo vertebral no existe una técnica particular, pudiéndose utilizar una sierra de Gigli, asociada a la instrumentación diseñada por Tomita, una fresa de alta velocidad, o bien un escoplo curvo (fig. 12A-D). Una vez seccionado el pedículo se despega el tumor con extrema prudencia para liberar las posibles adherencias a la dura (fig. 12D). Posteriormente se realiza la instrumentación y artrodesis posterolateral, generalmente con el uso de tornillos pediculares, dos niveles por encima y dos niveles por debajo de la resección.
Figura 12. Exéresis de una tumoración del arco posterior con resección del pedículo vertebral bilateral. (A) Abordaje de uno de los lados de la lesión respetando las partes blandas e identificando la apófisis transversa. (B) Disección de la parte más anterior de la apófisis transversa hasta la unión con el cuerpo vertebral. (C) En localizaciones torácicas abordaje entre la costilla y la apófisis transversa sin penetrar en el espacio pleural. (D) Preparado bilateralmente el canal medular, se podrá realizar la exéresis en bloque del tumor.
Tratamiento postoperatorio
Para el paciente expuesto a este procedimiento no siempre es necesario el ingreso en la Unidad de Cuidados Intensivos. El paciente puede comenzar inmediatamente los ejercicios de deambulación con un corsé de tres puntos de apoyo que podrá abandonar a los tres meses.
Resultados oncológicos de la resección en bloque
La revisión más reciente de nuestra experiencia conjunta del Hospital Maggiore de Bolonia y del Hospital IMAS de Barcelona se basa en 94 resecciones en bloque con control clínico y radiográfico entre 6 y 359 meses (promedio de 30 meses), de las que 60 casos presentan un seguimiento superior a los dos años. Se han realizado 49 vertebrectomías, 11 resecciones sagitales y 34 resecciones posteriores.
El 71% de los pacientes (67/94) se muestran libres de enfermedad a los 58 meses. Hay 4 muertos por causa no relacionada con el tumor y 14 han fallecido a causa del mismo (después de un intervalo de 10 a 28 meses de la intervención con un promedio de 4 meses). El análisis de las 11 recidivas locales (12%) han revelado ser:1/15 tumores benignos estadio 3 (tratamiento de la recidiva); 6/33 tumores malignos estadio 1 A/B (márgenes intralesionales en 4 casos, tratamiento de recidiva en 3 casos); 3/17 tumores malignos estadio 2B (márgenes intralesionales en tres casos y tratamiento de recidiva en un caso); 1/17 metastasis.
Es de particular interés que el porcentaje de recidivas locales, independientemente del tumor tratado, sea del 8% (6/77) para los tratados primitivamente y del 30% (5/17) de las lesiones tratadas previamente y visitados en nuestros centros por recidiva o progresión de la enfermedad.
Implante modular en fibra de carbono
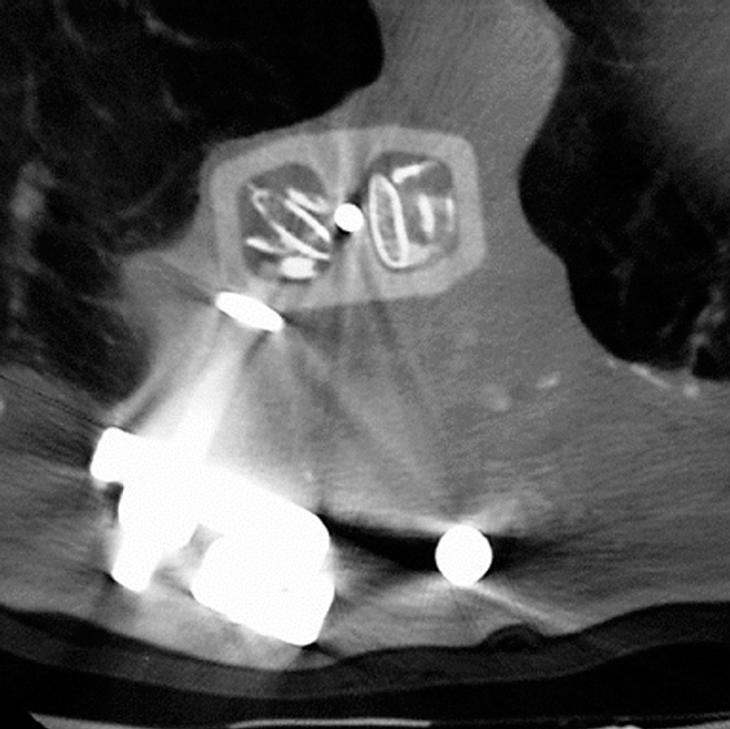
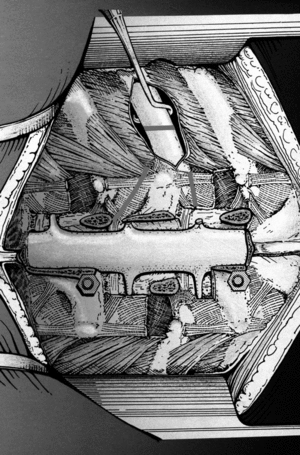
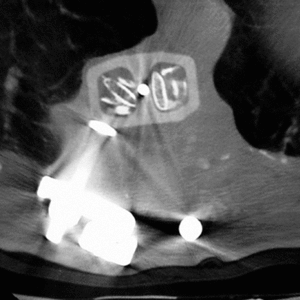
Se trata de una prótesis constituida por una o más cajas conectables entre sí, constituidas por fibras de polímero de carbono envueltas en una matriz de Ultrapeck® de forma octogonal (fig. 2). El componente de base está disponible en tres alturas (10, 15 y 22 mm), cada una con diferentes secciones transversales posibles (torácico [20 x 30 mm] y lumbar [30 x 40 mm]). Todos estos componentes están agujereados, permitiendo su relleno con injerto óseo (fig. 13); y además la posibilidad de conectarse con placas anteriores (UNIVERSITY® Depuy, Raynham, EE.UU.) en el caso de corporectomía mediante acceso anterior o de vertebrectomía intralesional (fig. 1), o intrumentación posterior ISOLA® (Depuy, Raynham, EE.UU.), tornillos pediculares conectados a barras o placas. La matriz polímera reforzada de fibra de carbono presenta fundamentalmente propiedades mecánicas y biológicas: es notablemente resistente a las fuerzas de carga y a las solicitaciones en otras direcciones, biológicamente inerte y no cancerígena27-30. Su módulo de elasticidad es muy parecido al del hueso cortical28, con lo que transmite las fuerzas de carga al injerto permitiendo el crecimiento en su interior por debajo y por encima de la resección. Una última característica es la de ser transparente a la radiología convencional y a la TAC, además de no crear artefactos.
Figura 13. Tomografía axial computarizada (TAC) del relleno del implante con injerto proveniente de la costilla resecada en el abordaje anterior.
Estudio clínico
Hemos evaluado 42 pacientes, 33 afectos de tumor primitivo, 6 de metástasis y 3 de plasmocitoma, de los que 18 eran mujeres y 24 varones. Su edad media fue de 45 años con un mínimo de 7 y un máximo de 69. De 42 casos, 10 pacientes (23,8%) fueron expuestos a quimioterapia preoperatoria, 14 (31%) a radioterapia y 13 (35%) a terapia adyuvante combinada. De ellos 20 pacientes (47,6%) fueron sometidos a terapia adyuvante postoperatoria. En el momento del diagnóstico el dolor estaba presente en todos los pacientes y sólo dos (4,9%) de ellos realizaban las actividades cotidianas normales. El cuadro clínico neurológico se ha evaluado según la escala de Frankel modificada31: el 85,4% de los pacientes no presentaba alteración neurológica (grado E), mientras que en un caso se presentó una paraplejía con afectación del área genitosexual. El 30% de los casos estaban localizados en el área torácica y el 70% restante era de localización lumbar. En 36 pacientes la lesión afectaba una sola vértebra, en 5 de ellos en dos segmentos vertebrales y en uno en tres vértebras. En tres cuartas partes de los casos (32 sujetos) en que se ha realizado una resección en bloque del cuerpo vertebral (vertebrectomía) se ha llevado a cabo un abordaje posterior/anterior32 en 29 (69%) pacientes, mediante un solo acceso posterior24 en tres casos (7,1%). Se han realizado 10 corporectomías intralesionales, 8 por vía anterior y dos mediante un abordaje posterior13. La resección de una vértebra entera ha supuesto un promedio de 12,4 horas de media, con una pérdida hemática de cerca de 5,201 cc, mientras que la corporectomía ha sido conseguida en 5,6 horas de media con una pérdida hemática de 2,561 cc15,16. Veintitrés casos (54%) han sido sometidos a la resección de un solo segmento vertebral.
Se ha utilizado para la reconstrucción de la resección un implante modular de carbono, con una altura mínima de 10 mm y máxima de 94 mm (altura promedio 48,8 mm). En el 79% de los pacientes se han utilizado dos, tres o 4 componentes protésicos. La prótesis ha sido rellenada con injerto autólogo proveniente de costilla o cresta ilíaca en todos los casos (fig. 13) excepto tres, uno de ellos afecto de osteosarcoma con radioterapia postoperatoria de gran entidad, y los otros dos afectos de plasmocitoma y metástasis, en los que fue imposible colocar la prótesis en posición horizontal y se realizó en posición vertical, consiguiéndose la conexión con los elementos anteriores. En los casos de vertebrectomía (73,8%) se conectó a la instrumentación posterior y en los de corporectomía por vía anterior a una placa anterior.
RESULTADOS
Complicaciones
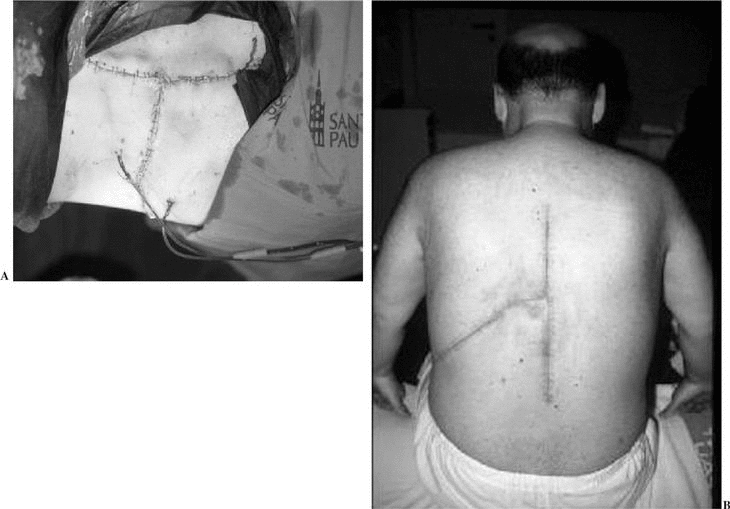
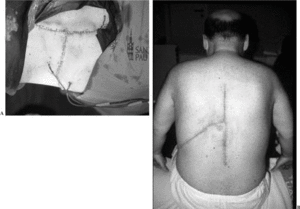
En 5 pacientes se presentaron complicaciones peroperatorias (11,9%) y complicaciones en los primeros 30 días en 12 de ellos (28,6%). Posteriormente no han aparecido más complicaciones. Ninguna de éstas se ha asociado al implante protésico, pero sí fueron secundarias al procedimiento quirúrgico empleado, o al estado clínico debido a la enfermedad del paciente. Constantemente la cicatrización ha sido excelente a pesar de la agresividad de la intervención (figs. 14A y B).
Figura 14. Las incisiones en "T" cicatrizan sin problemas. (A) Abordaje en "T" para la resección en bloque de un tumor vertebral. (B) Cicatrización completa.
Reintervenciones
No se ha realizado ninguna revisión de las prótesis, mientras que en dos casos ha sido necesaria la sustitución de la instrumentación posterior; en un caso por rotura del tornillo pedicular a los 8 meses de la intervención, y en otro por la sustitución de un tornillo y un gancho a los 4 meses.
Control a distancia
El seguimiento fue comprendido entre un mínimo de 6 meses y un máximo de 60, con un período promedio de 26 meses. Todos los pacientes han estado controlados ambulatoriamente. En el último control clínico y radiológico 29 pacientes estaban vivos y libres de enfermedad con un seguimiento medio de 28,1 meses (mínimo 7 y máximo 60), y 6 pacientes estaban vivos con enfermedad con un seguimiento promedio de 27,8 meses (mínimo 4 meses y máximo 51 meses); 7 pacientes murieron con un período mínimo de 6 meses y máximo de 33 meses (media de 15,8 meses).
Evolución de la enfermedad neoplásica
En el seguimiento del procedimiento quirúrgico 4 pacientes (9,5%) han desarrollado una recidiva local, mientras que en otros 9 (21,4%) se han diagnosticado localizaciones metastásicas pulmonares, óseas y en otras localizaciones.
Dolor
A partir de los últimos controles ambulatorios 32 pacientes (78%) han referido la presencia de un dolor de media intensidad o ninguno, es decir, han manifestado una notable mejoría, 5 pacientes (12,2%) presentan un cuadro clínico invariable y 4 (9,8%) han empeorado. La mejoría del dolor ha sido progresiva en el tiempo.
Capacidad funcional
En el momento del último control clínico el 75,6% de los pacientes había recuperado plenamente la capacidad para realizar sus actividades físicas habituales (figs. 15A-F). En el preoperatorio el 26,9% no presentaba limitación funcional, y postoperatoriamente 27 pacientes (64,3%) habían obtenido una neta mejoría de la capacidad funcional y dos pacientes (4,9%) un neto empeoramiento, debido a la progresión de la enfermedad.
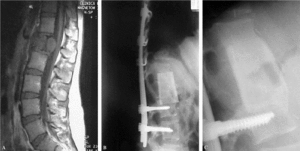
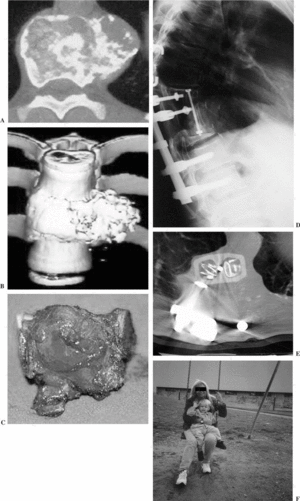
Figura 15. Condrosarcoma en T10, en un paciente de 32 años. (A) Tomografía axial computarizada (TAC) que muestra el pedículo libre de tumor. (B) Reconstrucción tridimensional. (C) Imagen macroscópica de la pieza resecada en bloque. (D) Control radiográfico a los 48 meses de la resección mediante reconstrucción somática anterior con prótesis de carbono e injerto autólogo. (E) TAC sin signos de recidiva local, a los 48 meses, con una buena incorporación del injerto situado en su interior. (F) Función óptima, sin ninguna lumbalgia ni siquiera durante el embarazo.
Cuadro neurológico
En el momento del diagnóstico, según la clasificación de Frankel modificada31, el 85,4% presentaba un Frankel E, y al final del seguimiento el 87,8% de los pacientres mostraba una exploración neurológica normal. En efecto 4 pacientes (9,8%) han mostrado una clara mejoría del cuadro neurológico después del tratamiento, mientras que otros 4 casos (9,8%) presentaron empeoramiento neurológico en la escala de Frankel; de estos 4 casos dos murieron y los otros dos conviven con la enfermedad: uno de ellos presentaba paraplejía preoperatoria que se resolvió parcialmente después de la intervención, manteniendo incontinencia de esfínteres.
Fusión ósea
Todos los pacientes han sido seguidos mediante controles radiológicos y TAC, periódicamente, permitiéndonos la valoración de la integración ósea del injerto, según las siguientes sugerencias:
1) Pseudoartrosis evidente: movilidad del implante y reabsorción del injerto.
2) Probable pseudoartrosis: presencia de un área de radiolucencia de grosor mayor de 2 mm en torno al injerto.
3) Retardo de consolidación o dudosa consolidación: presencia de un área de radiolucencia de grosor inferior a 2 mm alrededor de una parte del injerto.
4) Probable fusión ósea: presencia de un puente de fusión ósea.
5) Fusión ósea: aumento de densidad ósea con presencia de trabéculas óseas continuas por dentro del puente de fusión (fig. 16A-B).
Figura 16. Tomografía axial computarizada (TAC) de la fusión ósea completa en el interior del implante de fibra de carbono. (A) Reconstrucción frontal. (B) Reconstrucción sagital .
Desde los 13 a los 24 meses de la intervención la mayor parte de los pacientes (80%) presenta una fusión obvia, y un 20% probable. Después de los tres meses de la intervención sólo en dos pacientes era evidente la fusión ósea; a los 6 meses eran 11 pacientes, a los 12 meses 18 y a los 24, 37 (80%).
COMPLICACIONES
El porcentaje de morbilidad de la cirugía de los tumores vertebrales es muy elevada. La vertebrectomía y la resección sagital presentan todos los riesgos e inconvenientes de la vía anterior33, añadidos a los problemas ligados a un largo y difícil postoperatorio. El riesgo de ocasionar una lesión en los grandes vasos va asociado directamente con la necesidad de dejar un plano de tejido sano en torno al tumor. Es obvio que en el paciente que se ha sometido previamente a cirugía con adherencias y fibrosis, éstas suponen un aumento del riesgo de complicaciones (adherencias al uréter, los vasos, vejiga, vasos segmentarios y raíces nerviosas). Entre las complicaciones tardías, la infección, debida a la amplia vía de acceso y a la inmunodeficiencia relativa de estos pacientes, es la más frecuente y la de tratamiento más exigente.
La reconstrucción debe ser sobredimensionada a causa de la liberación muscular y ligamentosa en el nivel de la resección. El uso de una prótesis de carbono rellena de injerto óseo autólogo, y conectada con una barra rígida, es eficaz como se comprueba en nuestra experiencia, permitiendo identificar una posible recidiva local de forma fácil. En la serie IMAS se ha utilizado aloinjerto con resultados superponibles. La resección posterior es una intervención relativamente corta y las complicaciones asociadas son secundarias a la disección entre la dura y el tumor, o alguna posible lesión vascular, o visceral durante la disección posterior de la neoplasia.
En conclusión, el desarrollo de la técnica operatoria en relación con la resección en bloque de los tumores óseos del raquis de la columna requiere conocer las características biológicas de los diferentes tipos histológicos de neoplasias, con el fin de poder decidir cuál es el margen quirúrgico más adecuado en cada tipo de tumor. Un estadiaje quirúrgico del tumor es necesario para planificar la técnica quirúrgica que permitirá obtener márgenes correctos. La combinación del estadiaje de Enneking10,11 y el estadiaje WBB18 permite: evitar una cirugía con alta morbilidad si no es necesaria (por ejemplo, un caso de tumor benigno estadio 2 o de metástasis); obtener márgenes adecuados mediante una escisión en bloque correctamente realizada en casos estrictamente seleccionados, y progresar en el conocimiento de estos tumores comprando los resultados obtenidos mediante estudios con otras series también homogéneas. Finalmente, recordar que el primer tratamiento decide el pronóstico del tumor, ya que en la columna es excepcional la reintervención con éxito de una recidiva de un tumor maligno o benigno agresivo, a diferencia de las extremidades, en donde una amputación puede casi siempre resolver el control local de la enfermedad después de la recidiva.
Conflicto de intereses. Los autores no hemos recibido ayuda económica alguna para la realización de este trabajo. Tampoco hemos firmado ningún acuerdo por el que vayamos a recibir beneficios u honorarios por parte de alguna entidad comercial. Por otra parte, ninguna entidad comercial ha pagado ni pagará a fundaciones, instituciones educativas u otras organizaciones sin ánimo de lucro a las que estemos afiliados.