La incidencia de infección articular periprotésica (IAP) en cirugías de cadera ha disminuido significativamente gracias a la profilaxis antibiótica intravenosa (IV). Sin embargo, en pacientes colonizados con Staphylococcus aureus resistente a meticilina (SARM), o en aquellos con riesgo de colonización, es necesario incluir vancomicina en la profilaxis. La administración intraósea de vancomicina podría mejorar su eficacia en la artroplastia total de cadera (ATC).
Material y métodosSe realizó un estudio retrospectivo entre marzo y diciembre de 2023 con la participación de 53 pacientes programados para ATC primaria con factores de riesgo de colonización. La mediana de edad de los pacientes fue de 67 años (rango de 61 a 75), y todos recibieron tratamiento con vancomicina intraósea (500mg). Se llevaron a cabo registros detallados y documentación de las complicaciones que se presentaron tanto durante la hospitalización como en los 3 primeros meses posteriores a la cirugía. Como medida de resultado secundaria, se exploró la incidencia de IAP.
ResultadosAdministramos 500mg de vancomicina intraósea, inyectada en trocánter mayor, junto a profilaxis IV habitual. La incidencia de complicaciones fue del 1,64%. La tasa de IAP a 90 días fue del 0%.
ConclusionesLa administración intraósea de dosis bajas de vancomicina en ATC en pacientes con factores de riesgo de colonización por SAMR, combinada con profilaxis IV estándar, se mostró segura y no presentó efectos adversos significativos. Además, esta estrategia elimina los desafíos logísticos asociados con la administración oportuna de vancomicina.
Nivel de evidencia IV: Serie de casos.
The incidence of periprosthetic joint infection (PJI) in hip surgeries has significantly decreased thanks to intravenous (IV) antibiotic prophylaxis. However, in patients colonized with methicillin-resistant Staphylococcus aureus (MRSA) or those at risk of colonization, it is necessary to include vancomycin in the prophylaxis. Intraosseous administration of vancomycin could enhance its effectiveness in total hip arthroplasty (THA).
Materials and methodsA retrospective study was conducted between March and December 2023 involving 53 patients scheduled for primary THA with colonization risk factors. The median age of the patients was 67 years (range 61 to 75), and all received treatment with intraosseous vancomycin (500mg). Detailed records and documentation of complications during hospitalization and the first three months post-surgery were maintained. As a secondary outcome measure, the incidence of PJI was explored.
ResultsWe administered 500mg of intraosseous vancomycin, injected into the greater trochanter, along with standard IV prophylaxis. The incidence of complications was 1.64%. The PJI rate at 90 days was 0%.
ConclusionsIntraosseous administration of low-dose vancomycin in THA for patients at risk of MRSA colonization, combined with standard IV prophylaxis, was shown to be safe and did not present significant adverse effects. Furthermore, this strategy eliminates the logistical challenges associated with timely vancomycin administration.
Level of evidence IV: Case Series.
La artroplastia total de cadera es probablemente uno de los procedimientos quirúrgicos más exitosos de la ortopedia, aunque puede verse afectada por la infección periprotésica, una complicación temida que presenta desafíos terapéuticos y una sustancial carga socioeconómica. La variabilidad geográfica en los agentes causales destaca la complejidad del problema. Aproximadamente dos tercios de las infecciones articulares periprotésicas son causadas por Staphylococcus1,2. Aunque las cefalosporinas son comúnmente usadas como profilaxis, su eficacia ha sido cuestionada debido a concentraciones tisulares a menudo insuficientes3.
El aumento en la resistencia de Staphylococcus aureus y coagulasa negativos a los antibióticos impulsa a los profesionales médicos a reevaluar su enfoque4,5. En este contexto, la vancomicina emerge como el antibiótico profiláctico recomendado para hacer frente a estas circunstancias.
Sin embargo, el empleo de vancomicina por vía intravenosa ha sido vinculado con diversos efectos adversos, y su correcta administración se ha convertido en un auténtico desafío logístico6,7. Por esta razón, en los últimos años, la administración de dosis bajas de vancomicina intraósea en la artroplastia de rodilla mediante el uso de un manguito hemostático ha ganado popularidad. Esta técnica ha demostrado alcanzar concentraciones tisulares elevadas, presentando tasas reducidas de complicaciones y superando las dificultades técnicas asociadas con la administración intravenosa8.
No obstante, su aplicación en la artroplastia de cadera ha sido recientemente abordada en una publicación, donde se evidencian aumentos significativos de las concentraciones tisulares de vancomicina en comparación con la administración intravenosa, con mínimos efectos adversos registrados9.
El propósito de este estudio es evaluar las complicaciones asociadas con la administración intraósea de una única dosis de vancomicina en el trocánter mayor durante la artroplastia total de cadera primaria, utilizada como medida profiláctica adicional a la cefazolina estándar en pacientes con factores de riesgo de colonización por Staphylococcus aureus resistente a la meticilina (SAMR) durante el periodo de hospitalización y los 3 primeros meses postoperatorios.
Material y métodosRealizamos un estudio retrospectivo entre abril y diciembre de 2023 con la participación de 53 pacientes. Se incluyeron todos los pacientes que se sometieron a una artroplastia primaria y programada de cadera con diagnóstico de coxartrosis o necrosis ósea avascular en nuestras instituciones y que presentaban uno o más factores de riesgo de colonización por SARM. Estos factores incluían un índice de masa corporal (IMC) ≥35, diabetes insulinodependiente, adicción intravenosa, hemodiálisis, enfermedad renal crónica (ERC), enfermedades crónicas de la piel/forunculosis, hospitalización prolongada y/o transferencia desde otra institución (incluyendo comunidades cerradas), hospitalización por más de 24h en los 3 meses previos a la evaluación, cirugías articulares previas, uso de antibióticos durante más de un mes en los 6 meses previos (cefalosporinas, quinolonas, múltiples antibióticos previos), antecedentes de infección o colonización previa por S. aureus, presencia de catéteres intravasculares e inmunodepresión. Los criterios de exclusión comprendieron a pacientes sometidos a artroplastias de cadera por fracturas, revisiones protésicas e hipersensibilidad comprobada a la vancomicina.
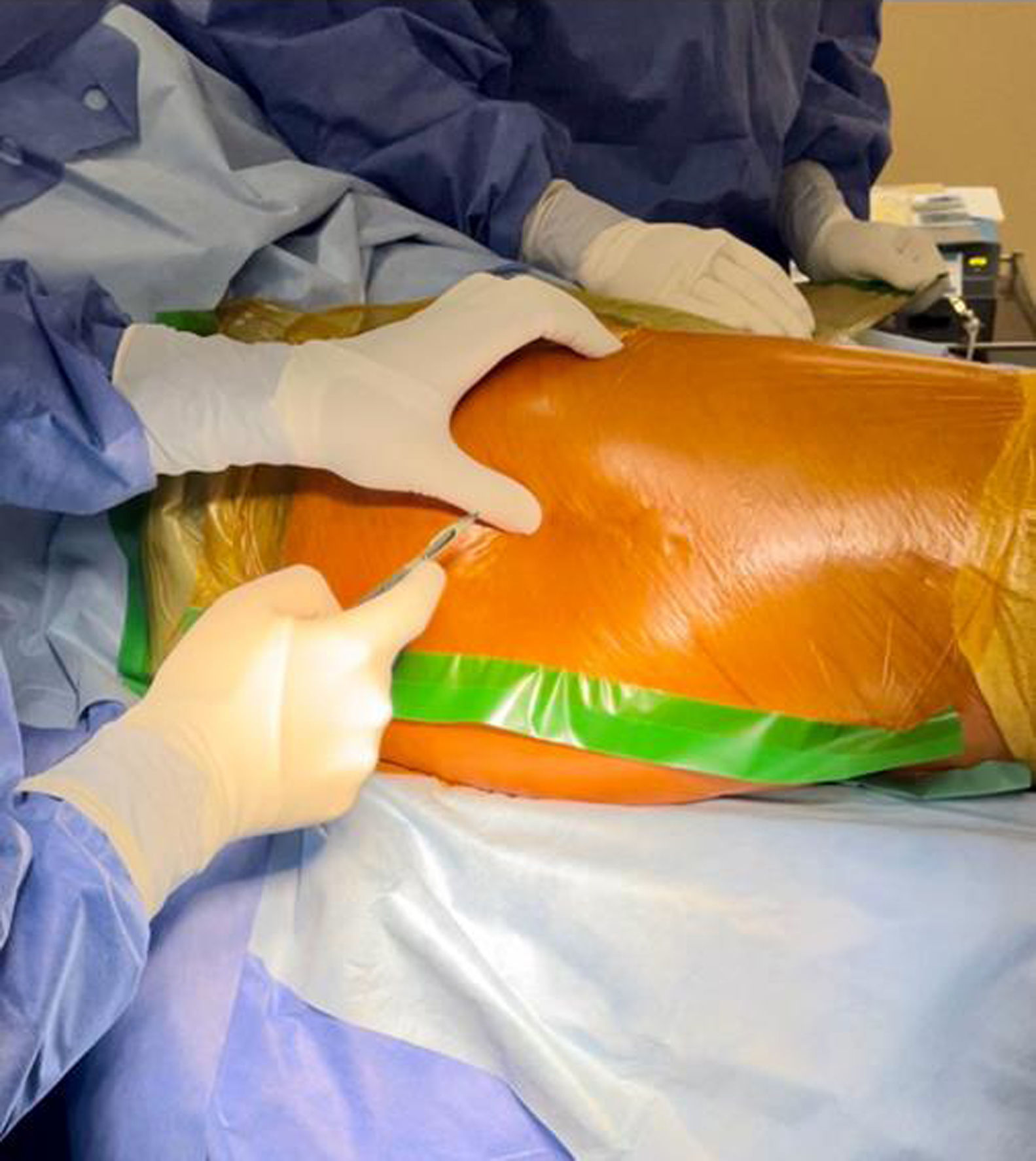
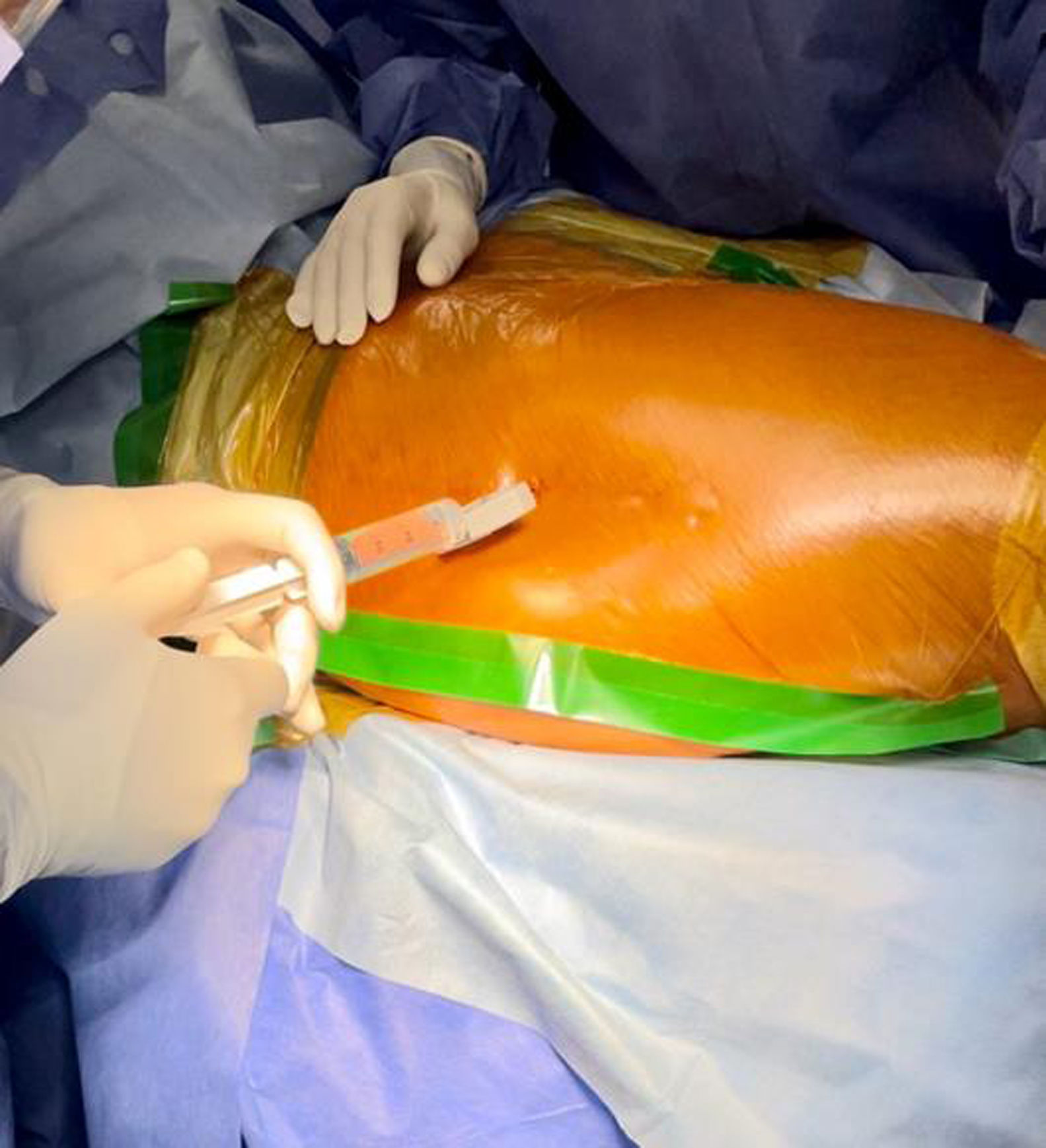
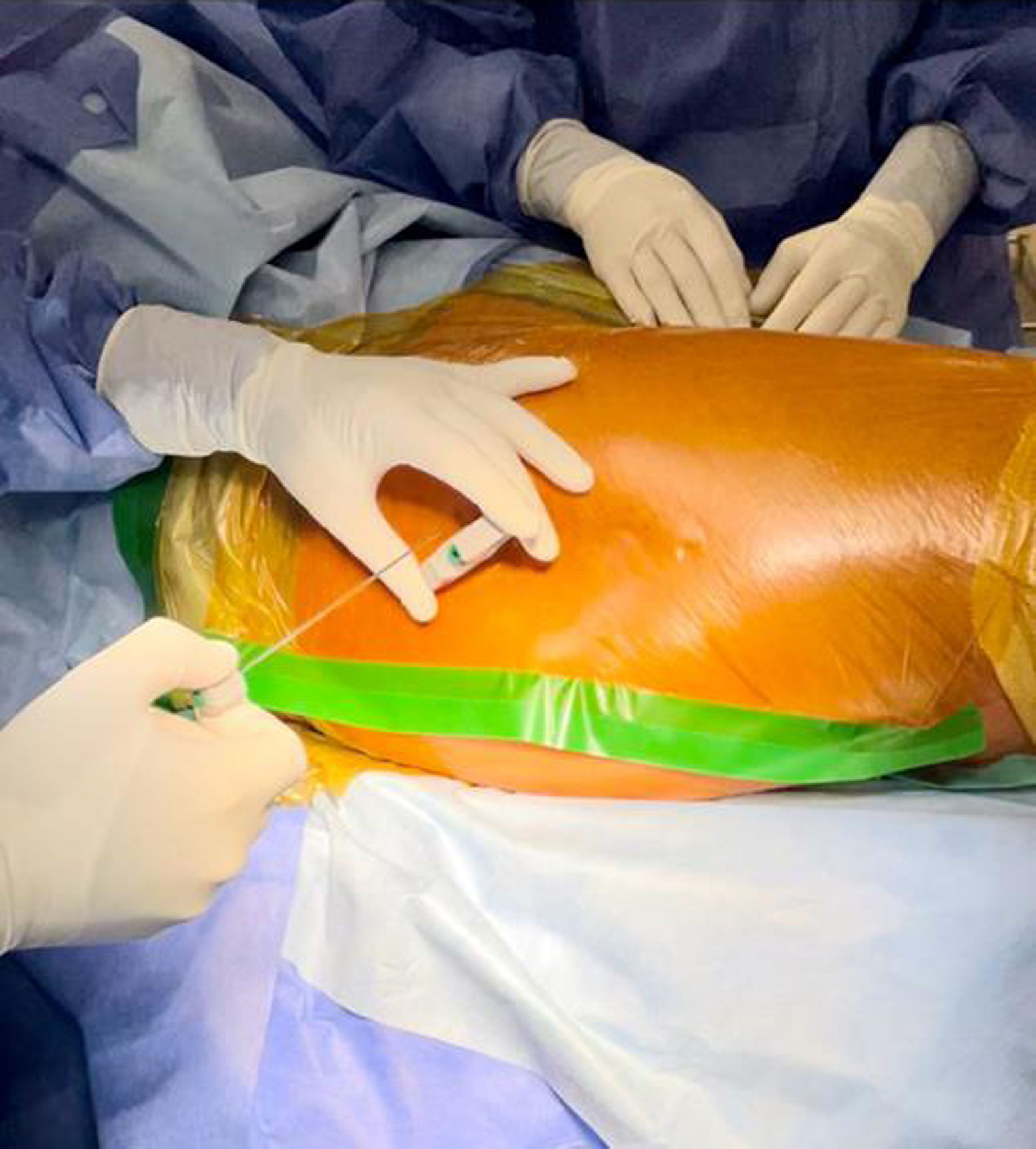
En 46 pacientes se utilizaron implantes no cementados de fijación metafisaria; para copas acetabulares de 52mm o mayores usamos polietileno de alto entrecruzamiento y cabezas en su mayoría de 36mm y en copas acetabulares de 50mm o más pequeñas se colocaron cabezas de 32mm. En 7 pacientes se utilizó una fijación híbrida utilizando cabezas del mismo diámetro y tallos pulidos cónicos. Se realizó anestesia raquídea y todos los pacientes recibieron profilaxis antibiótica intravenosa rutinaria con 1g de cefazolina (2g si el peso del paciente superaba los 70kg o 3g si el peso era superior a 120kg), administrada en 3 dosis cada 8h. La vancomicina intraósea diluida se administró siguiendo el protocolo publicado por Harper et al.9. Se disolvieron 500mg de vancomicina en 10ml de solución salina fisiológica; luego, la mezcla se diluyó en 90ml de solución salina. Se realizó una incisión en el campo adhesivo y en la piel (fig. 1), se accedió al hueso esponjoso de la cara lateral del trocánter mayor con una aguja de Jamshidi (fig. 2) y se inyectaron los 100ml de la preparación (fig. 3). La administración de antibióticos intraóseos se llevó a cabo justo antes de realizar la incisión en la piel para el procedimiento, y la dosificación no se ajustó en pacientes con obesidad. En pacientes obesos y con un gran panículo adiposo, incidimos la piel hasta la fascia y allí colocamos la aguja de punción ósea.
La seguridad clínica se evaluó mediante la investigación de la incidencia de las reacciones adversas asociadas a la vancomicina, incluyendo hipotensión arterial posterior a la infusión, disnea, prurito y síndrome del hombre rojo, relacionados con una liberación masiva de histamina debido a la rápida administración del antibiótico; lesión renal aguda y neutropenia. Se llevaron a cabo registros detallados y documentación de las complicaciones que se presentaron tanto durante la hospitalización como durante el primer mes posterior a la cirugía. Como medida de resultado secundaria, se investigó la incidencia de infección periprotésica en los 3 primeros meses posquirúrgicos.
Evaluamos la presión arterial inmediatamente después de la infusión de vancomicina, durante toda la cirugía (a los 15, 30 y 60min posteriores a la administración) y la hospitalización de los pacientes, definiendo hipotensión como la disminución de la presión arterial sistólica en más de 20mmHg y de la diastólica en más de 10mmHg. Los registros fueron tomados con un tensiómetro manual.
Realizamos evaluaciones posoperatorias en todos los pacientes en busca de enrojecimiento de la parte superior del cuerpo, prurito, sensación de ardor, dolor en el pecho, sibilancias, disnea y espasmos musculares, todos signos asociados al síndrome de hombre rojo.
Determinamos el diagnóstico de lesión renal aguda siguiendo las pautas de la Kidney Disease Improving Global Outcomes, las cuales se basan en cambios en los niveles de creatinina sérica y la producción de orina10. Consideramos que existía lesión renal aguda cuando la creatinina sérica aumentaba 1,5 veces o más en comparación con el valor basal, o cuando el aumento era igual o superior a 0,3mg/dl respecto al valor basal del paciente. Además, se utilizó el flujo urinario como criterio, considerando una cifra inferior a 0,5ml/kg/h durante un período de 6 a 12h.
Definimos neutropenia en nuestro estudio como un recuento absoluto de neutrófilos inferior a 1000/μl11.
Comprobamos el flujo urinario en todos los pacientes, y efectuamos análisis de laboratorio antes y después de la intervención quirúrgica para valorar la incidencia de lesión renal aguda y neutropenia. Los controles comprendieron niveles séricos de urea, creatinina y recuento de glóbulos blancos. Los registros de laboratorio posteriores a la cirugía se realizaron a las 48h y al mes para un seguimiento exhaustivo.
Por último, registramos la incidencia de infección articular periprotésica hasta los 3 meses de evolución posquirúrgica, considerando los criterios de diagnóstico de infección periprotésica definidos por la Musculoskeletal Infection Society (MSIS)12.
ResultadosLa edad media de los pacientes fue de 67 años (rango de 61 a 75); 18 pacientes eran hombres y 35 fueron mujeres. Todos los pacientes tenían factores de riesgo de colonización por SAMR; 18 presentaban 2 o más comorbilidades que predisponían a colonización (tabla 1).
Factores de riesgo de colonización por SARM de los pacientes sometidos a técnica de infusión intraósea de vancomicina
| IMC ≥35 | 12 |
| Diabetes | 13 |
| Adicción IV | 2 |
| ERC/hemodiálisis | 6 |
| Enf. cutáneas crónicas | 4 |
| Hospitalización por más de 24h en los 3 meses previos | 17 |
| Hospitalización prolongada/transferencia desde otra institución | 9 |
| Cirugías articulares previas | 6 |
| Antibióticos 6 meses previos | 1 |
| Antecedentes de infección o colonización previa por S. aureus | 1 |
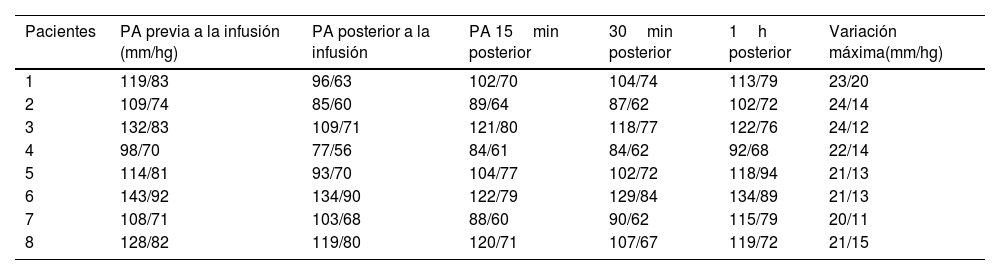
Ocho pacientes de nuestro estudio presentaron hipotensión; 5 de ellos en la toma de PA posterior a la infusión intraósea de vancomicina, 2 en la toma realizada a los 15min de la aplicación intraósea y un paciente presentó hipotensión a la media hora de la administración. En todos los casos la hipotensión fue leve y todos los pacientes corrigieron parcial o totalmente los valores previos sin necesidad de utilizar fármacos vasoactivos (tabla 2).
Registro de presión arterial posterior a la infusión de vancomicina intraósea
| Pacientes | PA previa a la infusión (mm/hg) | PA posterior a la infusión | PA 15min posterior | 30min posterior | 1h posterior | Variación máxima(mm/hg) |
|---|---|---|---|---|---|---|
| 1 | 119/83 | 96/63 | 102/70 | 104/74 | 113/79 | 23/20 |
| 2 | 109/74 | 85/60 | 89/64 | 87/62 | 102/72 | 24/14 |
| 3 | 132/83 | 109/71 | 121/80 | 118/77 | 122/76 | 24/12 |
| 4 | 98/70 | 77/56 | 84/61 | 84/62 | 92/68 | 22/14 |
| 5 | 114/81 | 93/70 | 104/77 | 102/72 | 118/94 | 21/13 |
| 6 | 143/92 | 134/90 | 122/79 | 129/84 | 134/89 | 21/13 |
| 7 | 108/71 | 103/68 | 88/60 | 90/62 | 115/79 | 20/11 |
| 8 | 128/82 | 119/80 | 120/71 | 107/67 | 119/72 | 21/15 |
No se registraron casos de «síndrome de hombre rojo»; sin embargo, 2 pacientes reportaron síntomas leves de prurito, los cuales remitieron espontáneamente. El primer paciente experimentó estos síntomas 28min después de la infusión, mientras que el otro los manifestó a las 22h de la misma. Además, un paciente mencionó apreciar disnea leve 40min después de la aplicación, la cual mejoró con la administración de oxigenoterapia.
Se identificó un solo paciente que presentó lesión renal aguda según los criterios establecidos por la guía clínica de la Kidney Disease Improving Global Outcomes. Este paciente era diabético insulinodependiente y, tras la corrección de la hiperglucemia postoperatoria y los desequilibrios electrolíticos observados, logró recuperar sus valores de función renal a niveles similares a los previos a la cirugía.
No tuvimos casos de neutropenia en nuestra serie de casos.
Un paciente presentó secreción persistente de la herida definida como un área de drenaje superior a 2×2cm en la gasa incisional que persistió más de 72h después de la operación. Se implementaron medidas no quirúrgicas incluyendo la modificación de la profilaxis del tromboembolismo venoso (se suspendieron las heparinas de bajo peso molecular y se indicó aspirina), se prescribió suplementación nutricional, y se restringió el rango de movimiento. No fue necesario realizar ningún gesto quirúrgico en este paciente.
La tasa de infección periprotésica en los 90 días posteriores a la cirugía fue del 0% en nuestra serie.
La incidencia total de complicaciones fue del 15% (tabla 3), aunque todas fueron leves y de escasa repercusión en los pacientes.
Complicaciones asociadas a la dosificación intraósea de vancomicina en nuestra serie
| Complicaciones asociadas al uso de vancomicina intraósea | Número de pacientes | Tiempo de aparición de los síntomas |
|---|---|---|
| Hipotensión arterial | 8 | 0-30min |
| Prurito | 2 | 28min y 22h |
| Lesión renal aguda | 1 | 24h |
| Secreción persistente por herida | 1 | 0-72h postadministración |
En el contexto de la artroplastia total de cadera, la prevención de la infección articular periprotésica es crucial, y la profilaxis antibiótica desempeña un papel fundamental. Sin embargo, el aumento de infecciones por SARM y del sitio quirúrgico ha generado incertidumbres sobre el régimen óptimo de profilaxis quirúrgica. Nuestra investigación sugiere que la aplicación de dosis bajas de vancomicina en el trocánter mayor, junto con cefalosporinas intravenosas, en pacientes con riesgo de colonización, representa una estrategia eficaz y segura para prevenir la. Además, esta aproximación conlleva menos efectos adversos que la administración intravenosa de vancomicina y evita los desafíos logísticos asociados con esta última.
La profilaxis antibiótica debe abarcar las cepas bacterianas comúnmente asociadas con la infección articular periprotésica. Las cefalosporinas son una elección destacada para prevenir infecciones por S. aureus y coagulasa negativos, que representan hasta el 70% de los casos de infección articular periprotésica13.
A pesar de su eficacia, se observa un aumento en la resistencia a los betalactámicos en estos agentes. Estudios, como el de Stevoska et al., indican que los Staphylococcus coagulasa negativos, con una alta incidencia de resistencia a oxacilina (50,0 a 100,0%)14, son los microorganismos más frecuentes en las infecciones periprotésicas de cadera y rodilla. Además, se ha observado un incremento en los casos de infecciones por SARM, llegando a aproximadamente el 50% de los pacientes infectados, según datos de EE. UU. y el Reino Unido15–17.
Afortunadamente, tanto los Staphylococcus coagulasa negativos resistentes a la oxacilina como los SARM siguen siendo susceptibles a la vancomicina. Sin embargo, la administración intravenosa de este antibiótico ha sido asociada con múltiples efectos adversos. Entre las complicaciones vinculadas a su uso, se incluyen la nefrotoxicidad. Courtney et al. informaron una mayor incidencia de lesión renal aguda en pacientes que recibieron cefazolina y vancomicina intravenosa juntas como profilaxis dual para el reemplazo total articular18. No obstante, un estudio realizado por Harper et al. destacó que el uso de vancomicina intraósea en el reemplazo total de rodilla no aumentó la incidencia de lesión renal aguda en comparación con la administración intravenosa de vancomicina19.
Sin embargo, la complicación más temida de la administración intravenosa rápida de vancomicina es la respuesta de liberación histaminérgica, que puede manifestarse desde enrojecimiento generalizado hasta hipotensión severa, dificultad respiratoria, e incluso shock y paro cardiorrespiratorio20. Esta reacción anafiláctica se atribuye a la liberación de histamina después de la desgranulación de los mastocitos.
En los últimos años, ha ganado popularidad una técnica segura y eficaz para administrar la vancomicina como profilaxis antibiótica en la artroplastia de rodilla: la aplicación intraósea en la metáfisis tibial proximal21. Esta técnica presenta varias ventajas destacadas. En primer lugar, la dosis utilizada (500mg) es la mitad de la que se emplea en la administración intravenosa (1g o 15mg/kg). En segundo lugar, se ha observado que las concentraciones de vancomicina en el hueso y la grasa subcutánea son mucho más altas, llegando a ser de 10 a 15 veces superiores a las concentraciones logradas con la administración intravenosa22. Por último, esta técnica elimina los inconvenientes logísticos asociados con la aplicación sistémica de vancomicina, como el momento oportuno de la infusión, la dosis adecuada según el peso y la lentitud de la dosificación de este antibiótico en la profilaxis antibiótica en reemplazos articulares8.
Recientemente, un estudio realizado por Harper et al. demostró que, mediante la infusión intraósea de este antibiótico en el trocánter mayor en la artroplastia total de cadera justo antes de la incisión quirúrgica, se lograban concentraciones de antibióticos estadísticamente más altas en las muestras óseas y en todas las muestras de tejido en comparación con la vía intravenosa. Esto se logró incluso sin la capacidad de restringir el flujo sanguíneo en el área, ya que no fue posible utilizar un manguito hemostático. Además, los niveles sistémicos de vancomicina fueron significativamente más bajos cuando se administró por vía intraósea, y no se evidenciaron efectos adversos con su uso9.
Las limitaciones de nuestro estudio abarcan el carácter retrospectivo del estudio, el tamaño reducido de la muestra, las características particulares de los pacientes y las medidas de resultado. En última instancia, los resultados no permiten concluir si el método de administración de antibióticos utilizado se traduce en una disminución de las infecciones periprotésicas a largo plazo. Sin embargo, una fortaleza significativa radica en que todas las cirugías fueron realizadas siguiendo un protocolo y una técnica uniforme.
ConclusiónLa administración intraósea sin restricción del flujo sanguíneo minimiza las complicaciones sistémicas relacionadas comúnmente con el uso de vancomicina y elimina los desafíos logísticos relacionados con su administración marcando un paso prometedor hacia la mejora de los resultados de la artroplastia total de cadera. Las investigaciones futuras se centrarán en determinar si esta técnica se traduce en reducciones clínicas de infección, como se ha demostrado previamente en la artroplastia total de rodilla.
Nivel de evidenciaNivel de evidencia IV.
FinanciaciónNo tuvimos financiación de ninguna institución pública o privada para realizar este estudio.
Consideraciones éticasObtuvimos la aprobación del Comité de Ética en investigación de nuestra institución (Comité de Ética en Investigación de CPHA, con fecha 9/02/23, n° referencia 0000098657). Se respetaron los principios del Código de Ética de la Asociación Médica Mundial (Declaración de Helsinki). Todos los datos sensibles de los pacientes fueron protegidos. Obtuvimos los respectivos consentimientos informados de los pacientes incluidos en este trabajo.
Conflicto de interesesNinguno.