Las roturas del manguito rotador afectan aproximadamente al 30% de la población mayor de 60 años. El tratamiento quirúrgico por vía artroscópica de estas lesiones es el tratamiento de elección, sin embargo, a pesar de las mejoras técnicas de reparación el índice de rerroturas oscila entre el 11 y el 94%. Por ello, los investigadores buscan mejorar el proceso de curación biológica mediante el uso de diferentes alternativas como las células madre mesenquimales (MSC). Nuestro objetivo es evaluar la eficacia de un medicamento de terapia celular elaborado a partir de células madre alogénicas derivadas del tejido adiposo en un modelo de lesión crónica del manguito rotador en ratas.
Material y métodoSe creó la lesión del supraespinoso en 48 ratas para su posterior sutura a las 4 semanas. A 24 animales se les añadió las MSC en suspensión tras la sutura, y a 24 animales HypoThermosol-FRS® (HTS) como grupo control. En ambos grupos se analizó la histología (escala Åström y Rausing) y la carga máxima, desplazamiento y constante elástica del tendón supraespinoso a los 4 meses de la reparación.
ResultadosNo se encontraron diferencias estadísticamente significativas en la puntuación histológica comparando los tendones tratados con MSC con respecto a los tendones tratados con HTS (p=0,811) ni tampoco en los resultados de carga máxima (p=0,770), desplazamiento (p=0,852) ni constante elástica (p=0,669) del tendón en ambos grupos.
ConclusionesLa adición en suspensión de células derivadas de tejido adiposo a la reparación de una lesión crónica de manguito no mejora las características histológicas ni biomecánicas del tendón suturado.
Rotator cuff tears emerge in approximately 30% of the population over 60 years of age. Arthroscopic surgical treatment of these lesions is the treatment of choice, however, despite the improved repair techniques, the rate of re-tears ranges between 11 and 94%. Therefore, researchers seek to improve the biological healing process through the use of different alternatives such as mesenchymal stem cells (MSCs). Our objective is to evaluate the efficacy of a Cellular Therapy Drug made from allogeneic stem cells derived from adipose tissue in a rat model of chronic rotator cuff injury.
Material and methodsThe supraspinatus lesion was created in 48 rats for subsequent suturing at 4 weeks. MSCs in suspension were added to 24 animals after suturing, and HypoThermosol-FRS® (HTS) to 24 animals as a control group. Histology (Åström and Rausing scale) and the maximum load, displacement and elastic constant of the supraspinatus tendon were analyzed in both groups 4 months after the repair.
ResultsNo statistically significant differences were found in the histological score comparing the tendons treated with MSCs with respect to the tendons treated with HTS (P=.811) nor in the results of maximum load (P=.770), displacement (P=.852) or elastic constant (P=.669) of the tendon in both groups.
ConclusionsThe addition of adipose-derived cells in suspension to the repair of a chronic cuff injury does not improve the histology or biomechanics of the sutured tendon.
Las roturas del manguito rotador afectan aproximadamente al 30% de la población mayor de 60 años, siendo sintomáticas en la mayoría de los casos1. El tendón del supraespinoso es el más lesionado, dada su vulnerable localización bajo el arco coracoaromial y a su pobre vascularización2–5.
Además, la entesis o «footprint» del tendón supraespinoso, es una estructura compleja formada por 4 zonas de transición en su inserción humeral: tendón, fibrocartílago no-mineralizado, fibrocartílago minieralizado y hueso, que dificulta su reproducibilidad tras su reparación6,7.
El tratamiento quirúrgico por vía artroscópica de estas lesiones es el tratamiento de elección8, sin embargo, a pesar de las mejoras técnicas de reparación, todos los factores anteriormente expuestos contribuyen a que el índice de rerroturas actual oscile entre el 11 y el 94%9,10.
Por todo ello, los investigadores buscan mejorar el proceso de curación biológica mediante el uso de diferentes alternativas como puede ser el uso de plasma rico en plaquetas (PRP), factores de crecimiento, uso de trasportadores, o las terapias celulares con células madre mesenquimales (MSC).
Las MSC, a parte de su capacidad de diferenciación hacia otros linajes celulares, parece que presentan un efecto inmunomodulador que podría ayudar a estimular la reparación endógena del propio tejido mediante su efecto paracrino, de esta forma, modularían la reacción inflamatoria y proporcionarían un microambiente favorable para la formación del tejido de regeneración8. Su empleo en suspension evitaría adicionalmente los problemas derivados del empleo de determinados transportadores.
Nuestro objetivo es evaluar la eficacia de un medicamento de terapia celular elaborado a partir de células madre alogénicas derivadas del tejido adiposo en un modelo de lesión crónica del manguito rotador en ratas, mediante su empleo en suspensión.
Material y métodosEste proyecto fue evaluado favorablemente por el Comité de Ética de Experimentación Animal en su reunión con acta 6.1/2018 (Código Interno: 18/002-II), a su vez se remitió una comunicación del procedimiento a la Sección de Protección Animal de la Consejería de Medio Ambiente de la Comunidad. Todos los procedimientos quirúrgicos se realizaron íntegramente en el Animalario de la Unidad de Cirugía Experimental del Hospital Clínico San Carlos, siguiendo las recomendaciones descritas por la Directiva UE 2010/63/UE para experimentos con animales y su posterior reglamento UE 2019/1010.
El cálculo del tamaño muestral se realizó siguiendo el principio de las 3R en la investigación animal: Reemplazar, Reducir y Refinar. Para ello nos basamos en los datos de un estudio previo con el mismo modelo de lesión y reparación donde la media de carga máxima antes de la rotura fue 20,8N (DE: 4,4) a las 4 semanas11,12. Hemos considerado clínicamente significativo un incremento de la fuerza del 25% entre los 2 grupos, una potencia de 0,8 y un nivel de significación del 0,05. Con estas especificaciones, el tamaño muestral calculado es de 24 hombros intervenidos para estudio biomecánico (12 añadiendo MSC+12 añadiendo HTS) y otros 24 hombros intervenidos para estudio histológico (12 añadiendo MSC+12 añadiendo HTS), lo que hacen un total de 48 hombros intervenidos o 48 ratas. Se ha utilizado para ello el paquete estadístico «TrialSize» para igualdad de medias del software estadístico R. Se calculan un 10% de pérdidas, por lo que la n total estimada fue de 48+5, es decir 53 animales.
Se han empleado un total de 49 ratas (48 + una pérdida) tipo Sprague-Dawley de 8 meses de edad con pesos comprendidos entre 500 y 950g, con una media de 678g. Todos ellos machos y procedentes del mismo laboratorio (Laboratorio Janvier). Todos los animales fueron sometidos a una sección unilateral del tendón supraespinoso procediéndose a la reparación posterior del mismo a las 4 semanas de la lesión, momento en el que se considera que la lesión es crónica13–17.
Al grupo I (n=24) se le administró el producto de terapia celular (células madre mesenquimales derivadas de tejido adiposo [ADSC]) en suspensión sobre la reparación tendinosa, buscando el efecto paracrino local directo de las MSC. Al grupo II (n=24) se le administro HypoThermosol-FRS® (HTS) como grupo control. La eutanasia se llevó a cabo a los 4 meses tras la reparación tendinosa para enviar la mitad de las muestras de cada grupo a estudio histológico (n=24, 12 del grupo I+12 del grupo II) y biomecánico (n=24, 12 del grupo I+12 del grupo II).
El principio activo del medicamento de terapia celular consiste en células madre mesenquimales para uso alogénico obtenidas a partir de lipoaspirados de donante (ADSC), obtenidas y tratadas en la Sala Blanca del Hospital Clínico San Carlos, según la regulación vigente. El excipiente que nos asegura una correcta viabilidad de las células a una concentración de 20×106 células es el HypoThermosol-FRS®.
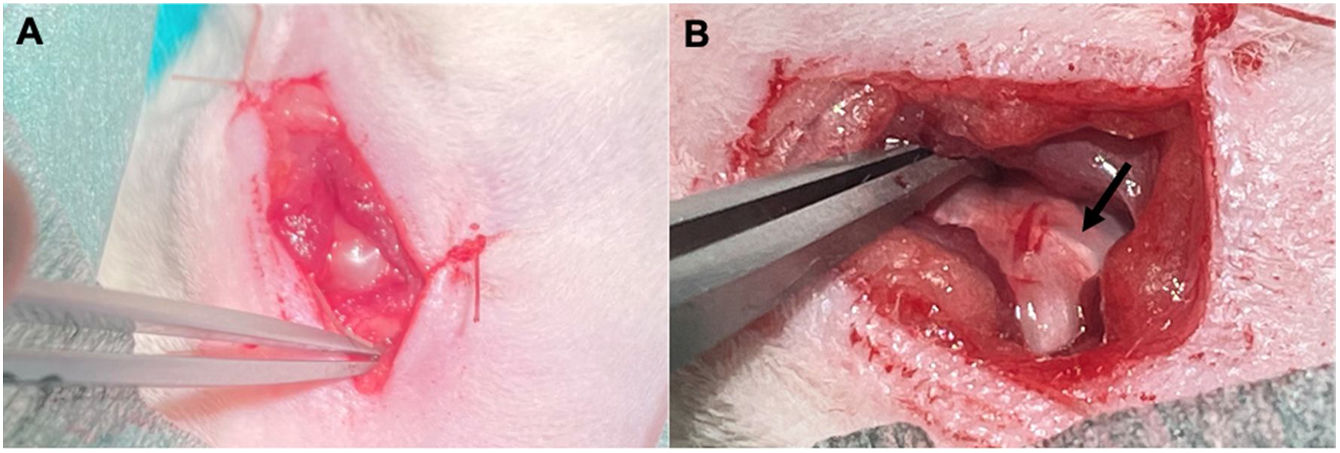
Técnica quirúrgicaBajo sedación con isoflurano y anestesia local con mepivacaina al 2% en piel y tejido celular subcutáneo, se realiza una incisión en piel de unos 2cm sobre el hombro izquierdo con bisturí sobre la parte superolateral de la articulación escapulohumeral. Se realiza una incisión en T invertida en el músculo deltoides que nos permite visualizar el tendón supraespinoso (fig. 1), que tras su delimitación es marcado con Prolene® 6.0, para realizar su sección lo más perpendicular posible a su eje mayor en la zona crítica del tendón, situada a unos 4mm de su inserción. Finalmente se suturará músculo, subcutáneo y piel con Vicryl Rapide® 4.0.
Una vez finalizada la intervención, se retira el gas y se deja al animal solo con oxígeno, hasta que él mismo va eliminando el gas inhalado.
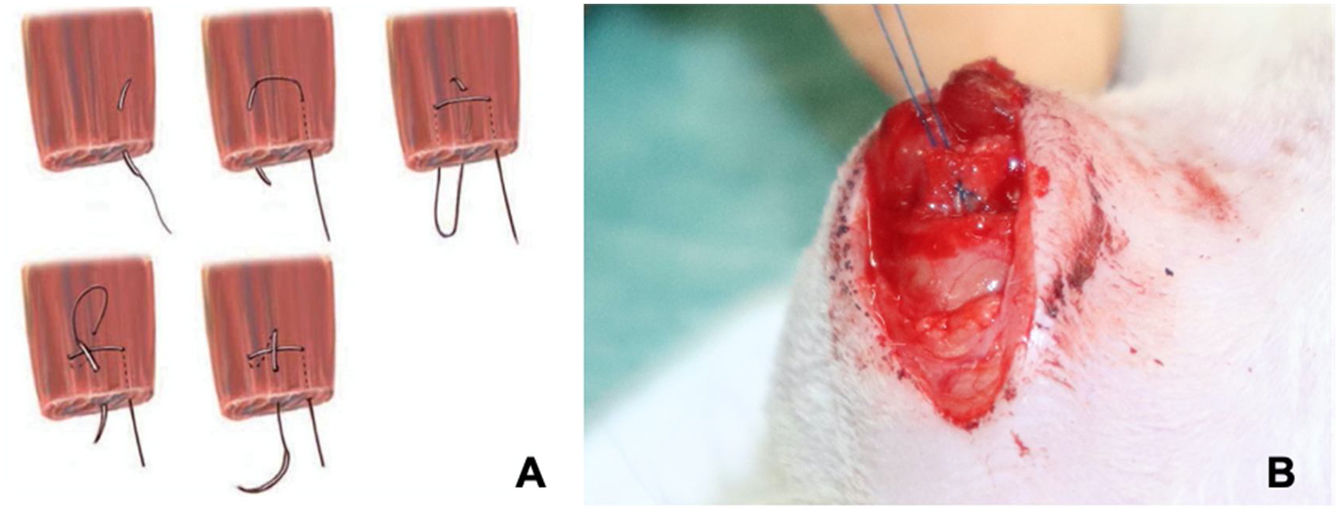
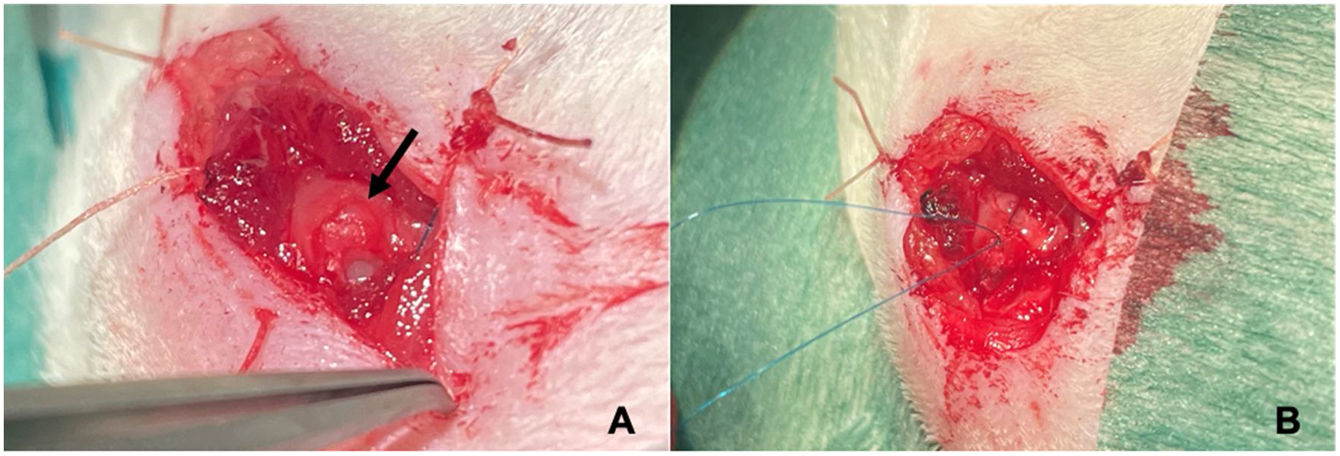
En una segunda intervención realizada a las 4 semanas de la primera bajo anestesia general se realiza tras la localización del cabo tendinoso, la reparación del tendón mediante una sutura tipo Mason-Allen modificada18 con Prolene® 6.0. (fig. 2). Para su fijación en el húmero, realizaremos un túnel transóseo a través del cual pasaremos uno de los cabos de la sutura para así aproximar el cabo proximal del tendón supraespinoso a la región limpia del troquíter (fig. 3). Una vez suturado el tendón, realizamos el cierre del deltoides, de forma que la articulación glenohumeral quede lo más estanca posible.
A) Ilustración de la sutura tipo Mason-Allen modificada18. B) Imagen de la cirugía, sutura tipo Mason-Allen modificada sobre el tendón supraespinoso de la rata.
El siguiente paso será inyectar la solución de MSC o HTS sobre el tendón reparado en suspensión, según el grupo de estudio al que pertenezca el animal. Finalmente se suturará el tejido celular subcutáneo y piel con Vicryl Rapide® 4.0.
Durante el postoperatorio de ambas cirugías se inyectarán enrofloxacino y meloxicam subcutáneo durante 3 días, para el mayor bienestar del animal.
A los 4 meses tras la reparación tendinosa se procede a la eutanasia. Según el protocolo de bienestar animal (RD 53/2013) para evitar el sufrimiento animal, se le suministra mediante una máscara de anestesia isoflurano al 4% hasta que el animal queda sedado. Posteriormente, se deposita al animal en una cabina cerrada herméticamente con una atmósfera de CO2.
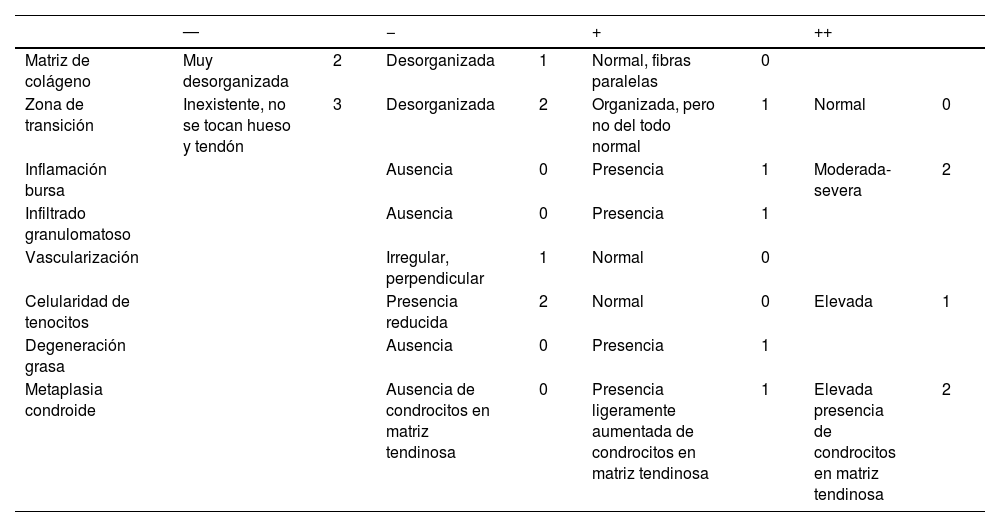
Estudio histológicoTodas las muestras (n=24; 12 grupo I+12 grupo II) fueron evaluadas por 2 investigadores, a doble ciego. Con hematoxilina-eosina se trató de determinar la presencia de lesiones histológicas en los tejidos estudiados. Utilizamos la escala de valoración semicuantitativa que se muestra en la tabla 1, basada en la escala de Åström y Rausing19. Posteriormente se pusieron en común las valoraciones de ambos investigadores.
Escala y puntuación utilizada en las muestras histológicas
| — | − | + | ++ | |||||
|---|---|---|---|---|---|---|---|---|
| Matriz de colágeno | Muy desorganizada | 2 | Desorganizada | 1 | Normal, fibras paralelas | 0 | ||
| Zona de transición | Inexistente, no se tocan hueso y tendón | 3 | Desorganizada | 2 | Organizada, pero no del todo normal | 1 | Normal | 0 |
| Inflamación bursa | Ausencia | 0 | Presencia | 1 | Moderada-severa | 2 | ||
| Infiltrado granulomatoso | Ausencia | 0 | Presencia | 1 | ||||
| Vascularización | Irregular, perpendicular | 1 | Normal | 0 | ||||
| Celularidad de tenocitos | Presencia reducida | 2 | Normal | 0 | Elevada | 1 | ||
| Degeneración grasa | Ausencia | 0 | Presencia | 1 | ||||
| Metaplasia condroide | Ausencia de condrocitos en matriz tendinosa | 0 | Presencia ligeramente aumentada de condrocitos en matriz tendinosa | 1 | Elevada presencia de condrocitos en matriz tendinosa | 2 |
El estudio biomecánico se llevó a cabo por el Departamento de Ciencia de Materiales de la Escuela Técnica Superior de Ingenieros de Caminos, Canales y Puertos, por la Universidad Politécnica de Madrid.
Utilizamos la máquina de tracción Instron® modelo 4411 con una célula de carga de 1000N con software de control PCD 2K. Se analizaron los valores de carga máxima (N), el grado de desplazamiento del tendón (mm) y la pendiente o constante elástica de cada muestra (N/mm).
Analizamos tanto el hombro sano como el intervenido en un total de 24 animales, 12 pertenecientes al grupo I y 12 al grupo II. Por lo tanto, se analizaron un total de 48 hombros. Esto se realizó así dada la variabilidad en tamaño y peso que puede haber entre un animal y otro, de tal forma que eliminamos ese sesgo comparando un hombro intervenido con su contralateral.
Estudio estadísticoLas variables continuas se presentan como medias y desviaciones estándar, y se han analizado mediante la prueba de la t de Student. Si los datos no eran normales (confirmado con la prueba de Shapiro-Wilk), se presentan como medianas, utilizándose el test Mann-Whitney y la prueba de Chi-cuadrado para realizar el análisis. Se consideró significativo un valor de p<0,05. El análisis estadístico se realizó con el software IBM® SPSS.
ResultadosTan solo obtuvimos una pérdida durante el seguimiento. El animal pertenecía al grupo I. Falleció durante la inducción anestésica en la segunda intervención sin llegar, por tanto, a ser intervenido.
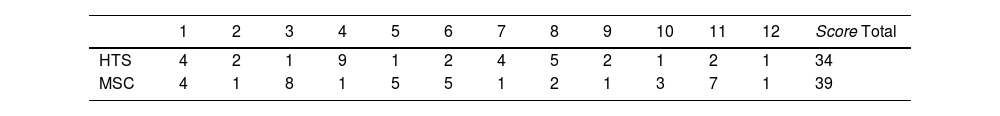
A nivel histológico, un tendón sano obtendrá una puntación de 0, mientras que el tendón más patológico puntuará 14. El score total de ambos grupos fue de 39 para el grupo MSC y de 34 para HTS (p=0,811), sin diferencias estadísticamente significativas. La mediana del grupo HTS es de 1 y 2, empatados a 4 muestras, mientras que la del grupo MSC es de 1 (tabla 2). Analizando cada variable por separado obtenemos los datos que se muestran en la tabla 3.
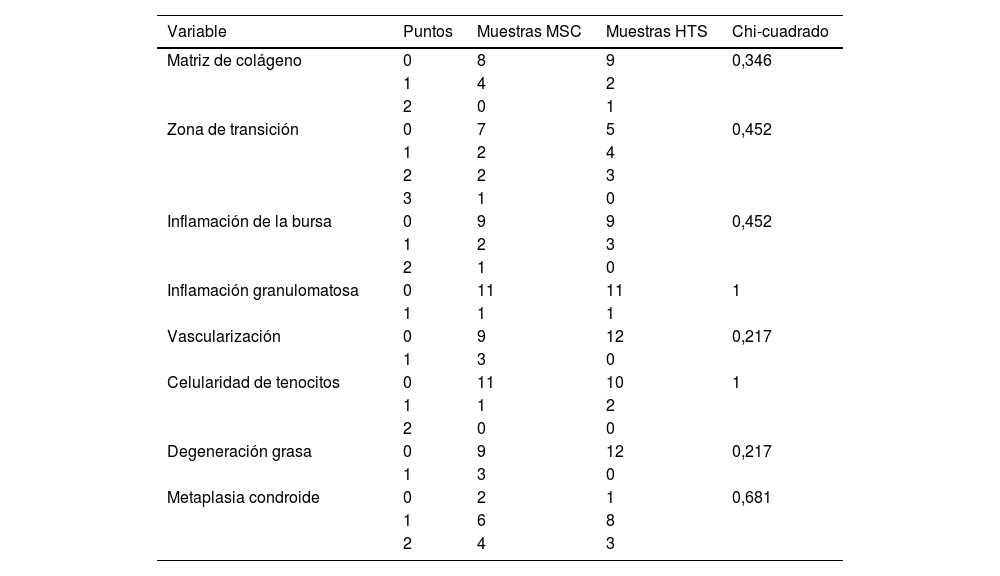
Resultados histológicos por variables independientes, comparando el grupo MSC frente al HTS
| Variable | Puntos | Muestras MSC | Muestras HTS | Chi-cuadrado |
|---|---|---|---|---|
| Matriz de colágeno | 0 | 8 | 9 | 0,346 |
| 1 | 4 | 2 | ||
| 2 | 0 | 1 | ||
| Zona de transición | 0 | 7 | 5 | 0,452 |
| 1 | 2 | 4 | ||
| 2 | 2 | 3 | ||
| 3 | 1 | 0 | ||
| Inflamación de la bursa | 0 | 9 | 9 | 0,452 |
| 1 | 2 | 3 | ||
| 2 | 1 | 0 | ||
| Inflamación granulomatosa | 0 | 11 | 11 | 1 |
| 1 | 1 | 1 | ||
| Vascularización | 0 | 9 | 12 | 0,217 |
| 1 | 3 | 0 | ||
| Celularidad de tenocitos | 0 | 11 | 10 | 1 |
| 1 | 1 | 2 | ||
| 2 | 0 | 0 | ||
| Degeneración grasa | 0 | 9 | 12 | 0,217 |
| 1 | 3 | 0 | ||
| Metaplasia condroide | 0 | 2 | 1 | 0,681 |
| 1 | 6 | 8 | ||
| 2 | 4 | 3 |
HTS: HypoThermosol; MSC: células madre mesenquimales.
En ninguna de las variables obtenemos difierencias estadísticamente significativas. La variable metaplasia condroide destaca como la que más puntúa en ambos grupos como variable patológica (fig. 4).
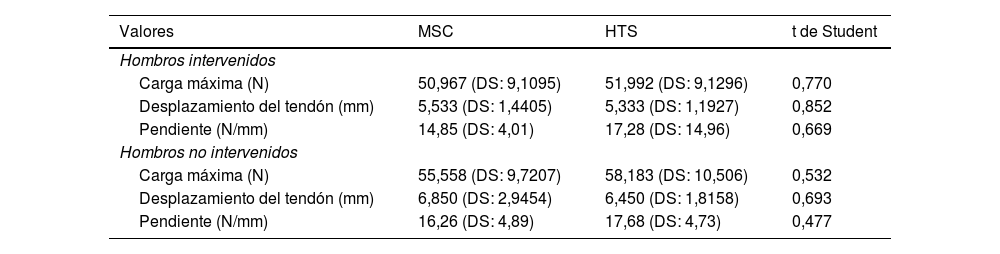
A nivel biomecánico, los resultados obtenidos se resumen en la tabla 4.
Media de las variables del estudio biomecánico en los hombros intervenidos y no intervenidos, comparado por grupos de estudio
| Valores | MSC | HTS | t de Student |
|---|---|---|---|
| Hombros intervenidos | |||
| Carga máxima (N) | 50,967 (DS: 9,1095) | 51,992 (DS: 9,1296) | 0,770 |
| Desplazamiento del tendón (mm) | 5,533 (DS: 1,4405) | 5,333 (DS: 1,1927) | 0,852 |
| Pendiente (N/mm) | 14,85 (DS: 4,01) | 17,28 (DS: 14,96) | 0,669 |
| Hombros no intervenidos | |||
| Carga máxima (N) | 55,558 (DS: 9,7207) | 58,183 (DS: 10,506) | 0,532 |
| Desplazamiento del tendón (mm) | 6,850 (DS: 2,9454) | 6,450 (DS: 1,8158) | 0,693 |
| Pendiente (N/mm) | 16,26 (DS: 4,89) | 17,68 (DS: 4,73) | 0,477 |
DS: desviación estándar; HTS: HypoThermosol; MSC: células madre mesenquimales.
Como vemos, todos los valores son muy similares en ambas muestras. La carga máxima media de grupo MSC es de 50,967N, mientras que el del grupo HTS es de 51,992N, tan solo 1 newton de diferencia. Lo mismo ocurre con el valor desplazamiento del tendón, donde la diferencia de la media entre ambos grupos es menor a 1mm (5,533mm en el grupo MSC frente a 5,333mm en el grupo HTS). La pendiente presenta mayor diferencia entre grupos (14,85N/mm MSC frente a 17,28N/mm HTS), pero aun así no lo suficiente para alcanzar la significación estadística.
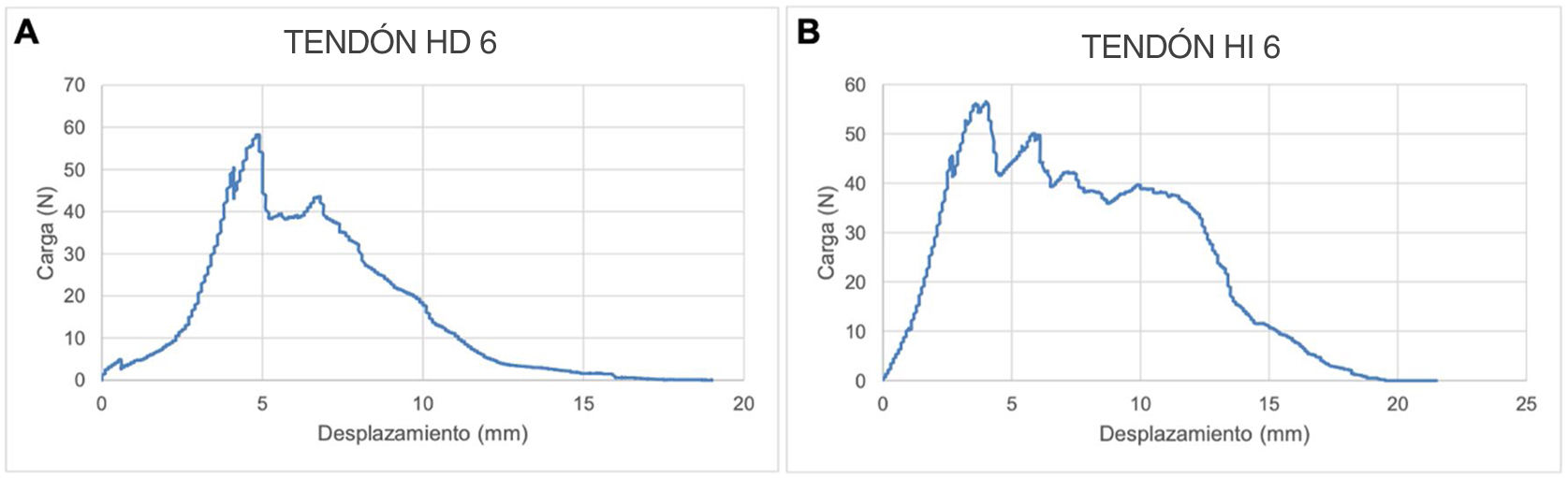
En la figura 5 se representa la curva fuerza-desplazamiento del tendón sano e intervenido de un animal del grupo MSC. Como vemos en este ejemplo, el tendón intervenido de desplaza menos milímetros antes de llegar al valor de carga máxima de la curva (alcanza el punto de rotura o carga máxima – 56,5N antes de llegar a los 5mm de desplazamiento del tendón), con respecto al tendón sano (alcanza el punto de rotura o carga máxima – 58,2N cuando el tendón se desplaza 5mm). El valor de carga máxima es mayor en el tendón sano (58,2N) con respecto al intervenido en este caso (56,5N), lo que significa que el tendón sano necesita una fuerza mayor para causar su rotura.
DiscusiónLa optimización de una terapia utilizando MSC va a ser complicada hasta que los mecanismos primarios de acción ejercidos por las células tras su administración sean dilucidados por completo. Durante mucho tiempo se pensó que la actividad terapéutica ejercida tras la administración de MSC dependía exclusivamente de la capacidad de las células de injertarse en los tejidos y de su capacidad de diferenciación. Sin embargo, posteriormente numerosos estudios empezaron a demostrar la efectividad de la terapia celular a pesar de una escasa capacidad de injerto de las células, principalmente cuando se administraban de forma sistémica20. En la actualidad se cree que el mecanismo de acción de las MSC está asociado no solo con su capacidad de injertarse y de diferenciación sino también al de su capacidad para liberar señales paracrinas, aunque la contribución de cada una de estas propiedades sigue sin estar clara21. Se sabe sin embargo, que factores asociados a las MSC como son el tamaño celular, la edad del donante, la inmunogenicidad relacionada con la fuente del donante (autólogo o alogénico), el pase de cultivo, así como el número de pases son factores asociados con la distribución de las células tras su administración, son importantes para la obtención de unas células de calidad, de ahí la importancia de tener un producto de terapia celular que nos aporte esa información y, por lo tanto, esa seguridad a la hora de utilizarlas como una opción más de tratamiento.
Las MSC que más se han utilizado son aquellas derivadas de la médula ósea (BMSC) y las derivadas de tejido adiposo (ADSC). En nuestro estudio elegimos las MSC derivadas del tejido adiposo, porque su principal ventaja es la gran accesibilidad a ellas en la práctica diaria habitual, ya que se pueden conseguir a través de procedimientos como las liposucciones o lipoaspirados, obteniendo un rendimiento considerablemente superior al de otras localizaciones. Pueden controlarse además, factores como la edad del donante, enfermedades de base o la forma de cultivo y tratado posterior antes de su administración. Como principal desventaja es que la mayoría se utilizan de forma alogénica en el receptor.
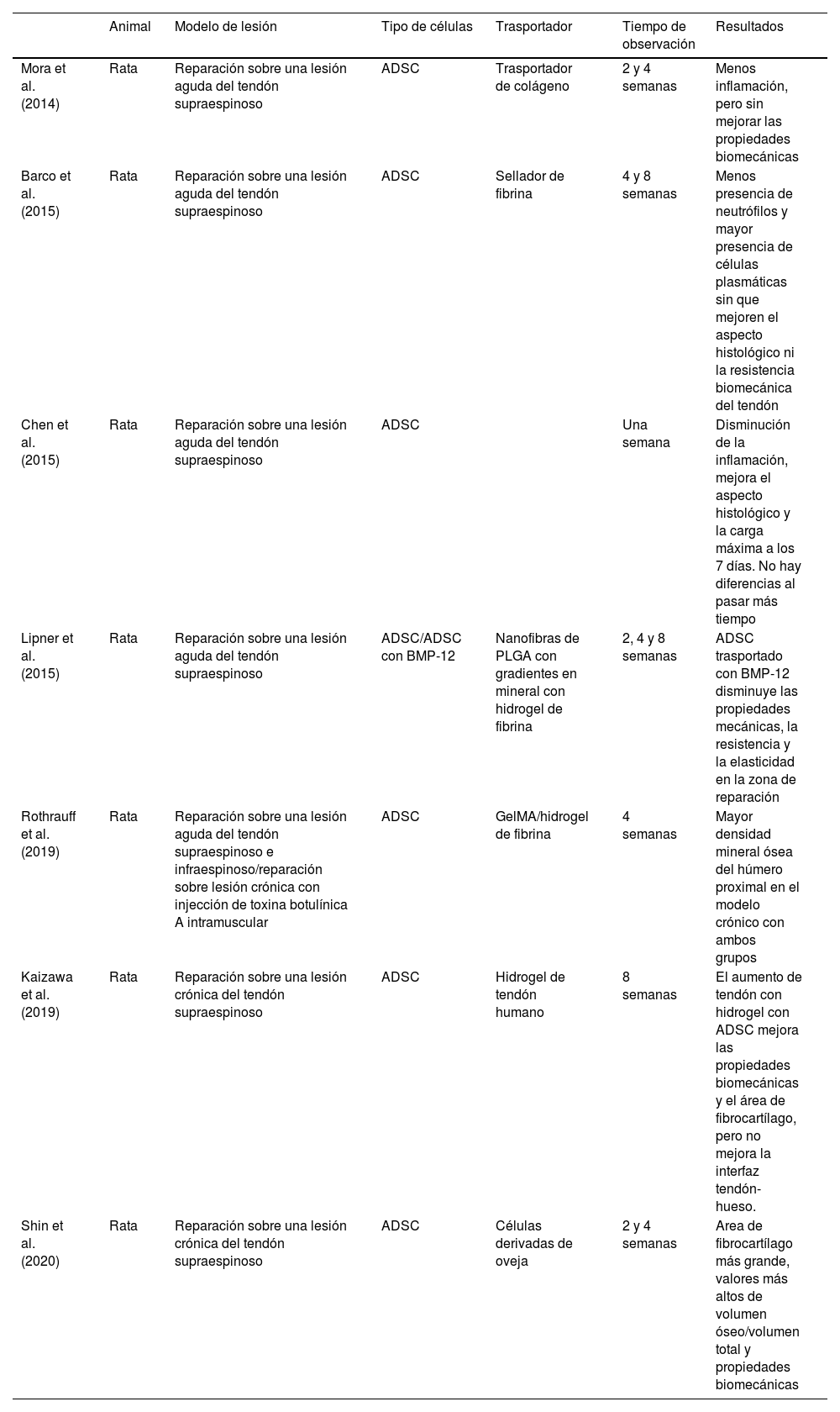
Los efectos terapéuticos de las ADSC para las lesiones del manguito rotador en modelos experimentales se resumen en la tabla 5. Como vemos, la rata es un animal ampliamente utilizado en la literatura para el estudio de la enfermedad del manguito rotador. Su fácil manejo, sus similitudes en a la anatomía y movilidad del hombro al humano, sumado a la experiencia previa de nuestro grupo de investigación con este animal ha hecho que nos decantemos por él para la realización de este trabajo13,22.
- Efectos terapéuticos de las ADSC en las lesiones del manguito rotador en modelos experimentales en ratas
| Animal | Modelo de lesión | Tipo de células | Trasportador | Tiempo de observación | Resultados | |
|---|---|---|---|---|---|---|
| Mora et al. (2014) | Rata | Reparación sobre una lesión aguda del tendón supraespinoso | ADSC | Trasportador de colágeno | 2 y 4 semanas | Menos inflamación, pero sin mejorar las propiedades biomecánicas |
| Barco et al. (2015) | Rata | Reparación sobre una lesión aguda del tendón supraespinoso | ADSC | Sellador de fibrina | 4 y 8 semanas | Menos presencia de neutrófilos y mayor presencia de células plasmáticas sin que mejoren el aspecto histológico ni la resistencia biomecánica del tendón |
| Chen et al. (2015) | Rata | Reparación sobre una lesión aguda del tendón supraespinoso | ADSC | Una semana | Disminución de la inflamación, mejora el aspecto histológico y la carga máxima a los 7 días. No hay diferencias al pasar más tiempo | |
| Lipner et al. (2015) | Rata | Reparación sobre una lesión aguda del tendón supraespinoso | ADSC/ADSC con BMP-12 | Nanofibras de PLGA con gradientes en mineral con hidrogel de fibrina | 2, 4 y 8 semanas | ADSC trasportado con BMP-12 disminuye las propiedades mecánicas, la resistencia y la elasticidad en la zona de reparación |
| Rothrauff et al. (2019) | Rata | Reparación sobre una lesión aguda del tendón supraespinoso e infraespinoso/reparación sobre lesión crónica con injección de toxina botulínica A intramuscular | ADSC | GelMA/hidrogel de fibrina | 4 semanas | Mayor densidad mineral ósea del húmero proximal en el modelo crónico con ambos grupos |
| Kaizawa et al. (2019) | Rata | Reparación sobre una lesión crónica del tendón supraespinoso | ADSC | Hidrogel de tendón humano | 8 semanas | El aumento de tendón con hidrogel con ADSC mejora las propiedades biomecánicas y el área de fibrocartílago, pero no mejora la interfaz tendón-hueso. |
| Shin et al. (2020) | Rata | Reparación sobre una lesión crónica del tendón supraespinoso | ADSC | Células derivadas de oveja | 2 y 4 semanas | Area de fibrocartílago más grande, valores más altos de volumen óseo/volumen total y propiedades biomecánicas |
ADSC: células madre mesenquimales derivadas de tejido adiposo.
En cuanto a nuestros resultados histológicos, ninguna de las variables analizadas en nuestro estudio ha obtenido una significación estadística, por lo tanto, no se ha podido demostrar que el tratamiento con las células madre en este modelo de lesión crónica tenga una acción suficiente como para mejorar la histología del tendón. Revisando la literatura, nos encontramos con 2 problemas: uno es que la mayoría de los estudios que utilizan MSC lo hacen sobre modelos de lesión aguda y, por lo tanto, no podemos compararnos con esos estudios y con la capacidad de regeneración celular que describen, ya que no tiene los mismos mecanismos de cicatrización si se trata de una lesión aguda o de una lesión crónica23–27; y otro es que no hay ningún estudio que se centre al completo y valore el efecto paracrino de las células dejándolas en suspensión en la articulación glenohumeral, sino que la mayoría de ellos utilizan transportadores o aportan factores de crecimiento a las muestras23,26–29.
Shin et al. utilizan MSC derivadas de adipocitos en su modelo crónico de lesión del manguito rotador en ratas colocándolas sobre una lamina a modo de transportador. Observaron a las 2 y 4 semanas tras la reparación que a nivel histológico el grupo tratado con células tenía un área de fibrocartílago mayor, de forma estadísticamente significativa29.
En cuanto a los resutlados biomecánicos, no hemos encontrado diferencias estadísticamente significativas que nos sugieran que el tratamiento con células aporta una mejoría clara de las propiedades biomecánicas del tendón.
La carga máxima, supone la fuerza máxima necesaria que hay que aplicar sobre el tendón para que se rompa, por lo tanto, a mayor carga máxima, más resistente será el tendón. Analizando nuestros resultados, vemos que la carga máxima media de los tendones no intervenidos (56,871N – DS: 9,9889) es mayor que la carga máxima media de los tendones intervenidos (51,479N – DS: 8,9344), o lo que es lo mismo: los tendones intervenidos se rompen antes. Igualmente, al añadir MSC (50,967N – DS: 9,1095) o HTS (51,479N – DS: 9,1298) sobre la sutura, no somos capaces de aportar esa resistencia que necesita el tendón para aumentar la carga máxima, y así evitar el riesgo de rerrotura de una forma más eficaz.
El desplazamiento del tendón en milímetros evalúa lo que el tendón es capaz de ceder antes de que se rompa al aplicar la carga máxima. Analizando nuestros resultados, los tendones de los hombros intervenidos soportan un menor desplazamiento del tendon antes de romperse (5,433mm – DS: 1,2974) con respecto a los tendones sanos (6,650mm – DS: 2,4016), por lo tanto, son más rígidos. Además, al aportar MSC (5,533mm – DS: 1,4405) o HTS (5,333mm – DS: 1,1927), no somos capaces de mejorar esta característica biomecánica del tendón.
Por último, la variable «pendiente» o también conocida como ‘constante elástica’ evalúa la elasticidad del mismo de una forma estimada, de tal forma que a mayor pendiente, menor será la elasticidad del tendón evaluado. Analizando nuestros resultados, la pendiente de los tendones sanos (16,97N/mm – DS: 4,76) es muy similar a la pendiente de los tendones intervenidos (16,06N/mm – DS: 4,56).
Analizando la bibliografía, vemos que Shin et al. observaron que a 4 las semanas la biomecánica tendinosa del grupo tratado con células obtuvo puntuaciones más altas, siendo este resultado estadísticamente significativo29. Kaizawa et al. quienes ya tenían un estudio previo en el que implantaban un hidrogel rico en colágeno tipo I (tHG) en un modelo de lesion crónica, y concluían con resultados estadísticamente significativos la mejoría de las propiedades biomecánicas del tendón, quisieron seguir en esa misma línea, pero esta vez añadiendo ASC sobre el hidrogel, para comprobar si mejoraba aún más las propiedades cicatriciales del tendón28. Para su estudio analizaron 2 variables, la carga hasta el fallo en newton, y la elasticidad medida en N/mm. Realizaron el estudio a las 8 semanas tras la reparación, objetivando que la carga máxima hasta la rotura era significativamente mayor en el grupo tHGASC y el tHG con respecto al control. Con respecto a la rigidez ocurre lo mismo, obteniendo diferencias estadísticamente significativas en los grupos tHGASC y tHG con respecto al grupo control. Las ASC solo mejoraron de forma estadísticamente significativa la morfometría ósea del lugar de insercción, pero no mejoró la cicatrización biomecánica ni histológica del tendón supraespinoso.
En un estudio realizado previamente por nuestro grupo, Tornero-Esteban et al. analizaron el impacto biomecánico que podía tener el aporte de MSC sobre un transportador de colágeno tipo I (OrthADAPT) en un modelo de lesión crónica del manguito en ratas. Al igual que en nuestro trabajo, analizaron la carga máxima, el grado de desplazamiento del tendón y la constante elástica del mismo. Sus resultados concluyen que la carga máxima del tendón aumenta según va avanzado el tiempo, y con ella la resistencia tendinosa (en el grupo OrthAADAPT+MSC). Con respecto a la rigidez y la deformidad, no se encontraron diferencias estadísticamente significativas14. Sin embargo, en el estudio publicado posteriormente por Lamas et al. en humanos, observamos que el uso de un trasportador podía ocasionar efectos adversos en el paciente, motivo por el cual en este trabajo decidimos prescindir del uso de un trasportador y aprovechar las características paracrinas que nos ofrecen las MSC30.
Las limitaciones que nos podemos encontrar, como en la mayor parte de los estudios experimentales, es el reducido tamaño muestral para cada grupo. Inicialmente, el cálculo del tamaño muestral se realizó en base a la resistencia tendinosa, y no en base a la escala histológica del tendón, por lo tanto, no podemos estar seguros de que la falta de resultados en este punto se deba a que efectivamente no existen diferencias estadísticamente significativas entre ambos tratamientos, o a que, el tamaño muestral sea insuficiente. Además, la incapacidad de controlar el grado de retracción tendinosa tras la generación de la lesión crónica podría condicionar la tasa de rerroturas o la curación biológica del mismo. La evaluación histológica, a pesar de haberla realizado de forma ciega y por dos investigadores, cuenta con la desventaja de que ciertos parámetros se puedan ver alterados por la varianza histológica en el lugar del tendón del corte realizado.
ConclusionesA pesar de que la capacidad reguladora y mediadora de las MSC a través de su efecto paracrino es cada vez más evidente, la adición de células derivadas de tejido adiposo como medicamento de terapia celular en suspensión sobre la sutura no mejora las características histológicas ni biomecánicas del tendón lesionado de nuestro modelo de lesión crónica en ratas.
Nivel de evidenciaNivel de evidencia I.
FinanciaciónEste trabajo ha sido realizado gracias al proyecto de Investigación financiado por el Instituto Carlos III, Madrid (FIS) CIF: G83727115 Expediente PI16/00549.
Conflicto de interesesLa co-autora Yaiza Lópiz forma parte del comité editorial de la revista, pero no ha participado en el proceso de revisión ciega ni de toma de decisión del artículo.
Los autores declaran que no existe conflicto de interés respecto a la obtención del medicamento de terapia Celular ni con el uso del excipiente de la marca HypoThermosol-FRS®.