Conocer la influencia del momento de la retirada del manguito de isquemia en la necesidad de transfusiones sanguíneas en las artroplastias primarias de rodilla y su influencia en las complicaciones postoperatorias.
Material y métodoFueron analizadas 201 artroplastias primarias de rodilla retrospectivamente. Se dividieron en 2 grupos: el grupo A (101 pacientes), en el que se retiró el manguito antes del cierre quirúrgico, y el grupo B (100 pacientes), en el que se retiró tras el cierre. Se compararon las transfusiones sanguíneas (medidas en concentrados de hematíes) llevadas a cabo por ambos grupos, contrastándolas con el tiempo quirúrgico, así como las complicaciones posquirúrgicas.
ResultadosLa media de concentrados de hematíes transfundidos en el grupo A fue de 0,62, mientras que en el grupo B fue de 0,61 (p=0,831). El tiempo medio quirúrgico en el grupo A fue de 111min, y en el grupo B, de 98min (p<0,05), no existiendo relación entre el tiempo quirúrgico y los concentrados de hematíes transfundidos (p=0,055). Las complicaciones posquirúrgicas en el grupo A fueron 8, y en el B, 10 (p=0,69).
DiscusiónNo hubo diferencias entre retirar el manguito de isquemia antes o después del cierre quirúrgico, ni en las necesidades transfusionales ni en las complicaciones posquirúrgicas. Tradicionalmente las mayores pérdidas sanguíneas al retirar el manguito antes del cierre han sido explicadas por el mayor tiempo quirúrgico que se requiere; sin embargo, este hecho no se relacionó con mayores necesidades transfusionales en nuestro estudio, ni con mayores complicaciones posquirúrgicas.
To determine the influence of the timing of the removal of the ischaemia tourniquet on the transfusion needs in primary knee arthroplasty and its influence on post-operative complications.
Material and methodA retrospective analysis was performed on 201 primary knee arthroplasties. The patients were divided into 2 groups: group A (101 patients), where the tourniquet was removed before surgical closure, and group B (100 patients), where the tourniquet was removed after the surgical closure. A comparison was made of the blood transfusions (pools of red corpuscles) received by both groups, along with the surgical time, and the post-operative complications.
ResultsThe mean number of packed red cells transfused in group A was 0.62, while in the group B it was 0.61 (P=.831). The mean time in the surgery in group A was 111min, and in group B it was 98min (P<.05), with no significant difference between the surgical time and the number of packed cells transfused (P=.055). The post-operative complications in the group A were 8, and in the B were 10 (P=.79).
DiscussionThere were no differences between removing the tourniquet before or after surgical closure or in the transfusion needs or in the post-operative complications. Traditionally, the greater blood loss due to the removal of the tourniquet before surgical closure has been explained as due to the longer surgery time required. However, in the present study, this fact was not associated with greater transfusion needs, or with more post-operative complications.
La pérdida sanguínea derivada de la cirugía ortopédica no puede ser infravalorada, estimándose entre 1.000 y 1.500ml la hemorragia perioperatoria en las cirugías artroplásticas de cadera y rodilla. Se estima que un descenso de 1.000ml supone la pérdida de 3gr/dl de hemoglobina (Hb)1. En nuestro medio, un acusado descenso de Hb posquirúrgica se trata con transfusiones de concentrados de hematíes (CH), sin embargo, esta medida se acompaña de un aumento de la morbimortalidad2, en forma de infecciones, coagulopatías, inmunosupresión, lesiones pulmonares, transmisión de enfermedades, etc. Los criterios para realizar una transfusión no siempre están bien definidos, dejándose en manos del facultativo la decisión con base en la clínica del paciente, junto con los niveles de Hb en sangre venosa. Pero estos niveles no son del todo fiables en el postoperatorio inmediato, por lo que, en esta situación, los datos clínicos son fundamentales (hipotensión, taquicardia, palidez, escasa reactividad, etc.).
Para minimizar la pérdida de sangre perioperatoria se utiliza tradicionalmente un manguito de presión colocado en el muslo, que provoca isquemia a nivel distal del manguito, lo que reduce el sangrado intraoperatorio, que, además de suponer un descenso en la morbimortalidad del paciente, mejora la visión del campo operatorio y favorece la técnica de cementación. Sin embargo, es controvertida su utilidad con este fin, pues parece demostrado que en los 5min inmediatos a la liberación del manguito se produce un aumento del sangrado reactivo3. Además, el uso de isquemia parece ser un factor de riesgo para la producción de trombosis venosas profundas y de mayor dolor postoperatorio debido a la compresión neurovascular4–7. Por otra parte, hay datos que demuestran un mayor tracking lateral de la patela con el uso del manguito, por la acción del vasto lateral8,9.
En nuestro medio se implantó el uso del manguito de isquemia parejo a la propia cirugía protésica de rodilla, y actualmente el 100% de las artroplastias de rodilla se llevan a cabo con manguito de isquemia. Pero está aún en discusión cuál es la manera ideal de retirar dicho manguito, pues existen 2 tendencias: una opta por retirar la isquemia tras la cementación, previamente al cierre quirúrgico, realizando hemostasia en el acto, mientras que la otra defiende la retirada tras el cierre, una vez aplicado un vendaje compresivo sobre la articulación. Los partidarios del primer método defienden la conveniencia de realizar hemostasia mediante coagulación diatérmica, pues existe una red arterial periarticular (las arterias geniculadas, principalmente, derivadas de la arteria poplítea) que, de ser afectada, provocaría una hemorragia a tener en cuenta. Los que optan por retirar el manguito de isquemia después del cierre quirúrgico aseguran que con un abordaje adecuado se evitan las arterias geniculadas, y que si no se realiza hemostasia el tiempo quirúrgico se reduce, con el beneficio que esto conlleva para la reducción hemorrágica e infecciosa.
La mayoría de los estudios realizados muestran una mayor pérdida de sangre retirando el manguito antes del cierre quirúrgico10–15, cuando la sangre perdida es medida mediante el cálculo estimado en función del descenso de Hb en relación con el índice de masa corporal16, mientras que solo un estudio ha encontrado una mayor pérdida sanguínea con la retirada posterior al cierre17. Lo que parece corroborarse es el aumento de la necesidad de transfusiones cuando se retira el manguito previamente al cierre, como muestra el metaanálisis de Rama et al.18, 28,6 frente a 21,1%. Mientras que si la sangre perdida es medida directamente (Hb, Hcto, drenaje, etc.) no existen diferencias en la mayoría de los estudios10–12,18–25; solo Yildiz et al.26 encontraron diferencias en la pérdida de sangre media directamente (Hb). Se da, por lo tanto, un importante error en las mediciones poco exactas que se realizan postoperatoriamente, pues su variabilidad se muestra muy elevada18.
Por el contrario, existe una mayor ratio de complicaciones locales cuando el manguito es retirado tras el cierre18, como son las complicaciones de la herida, las trombosis venosas profundas o la necesidad postoperatoria de manipulación articular. También son mayores las reintervenciones en la liberación posterior al cierre, 3,1 frente a 0,3%.
Por otra parte, el uso de recuperador sanguíneo no se ha relacionado con la mayor necesidad de transfusiones en función de si se quita antes el manguito o después27.
Así pues, dada esta diferencia de resultados, y ya que en nuestro hospital existe disparidad a la hora de llevar a cabo la retirada del manguito, nos propusimos revisar nuestra serie y comprobar la diferencia en cuanto al sangrado posquirúrgico y su repercusión clínica, que se manifiesta con una anemia normocítica y normocrómica, con el consiguiente aumento de transfusiones sanguíneas y las posibles complicaciones derivadas de ello.
Material y métodosPacientesHan sido analizadas, de manera retrospectiva, 201 intervenciones quirúrgicas de artroplastias totales primarias de rodilla. Fueron incluidos pacientes entre 55 y 85 años de edad. Se excluyeron aquellos pacientes sometidos a terapia anticoagulante o antiagregante (no se tuvo en consideración el ácido acetil salicílico 100mg o heparinas de bajo peso molecular) debido a la variabilidad en la retirada y reintroducción de estos fármacos en función del cirujano, lo que podría crear un sesgo entre estos pacientes. Tampoco se incluyeron pacientes con coagulopatías, trombopatías u otras enfermedades hematológicas que influyeran en la hemostasia. Los pacientes presentaron unos niveles mínimos de 10gr/dl de Hb prequirúrgica. Recibieron una dosis de heparina de bajo peso molecular 12h antes de la cirugía y otra 6h después, siendo administrada durante 10 días cada 24h.
DatosLos pacientes fueron operados entre el 30 de junio de 2010 y el 31 de diciembre de 2013. Los datos de los pacientes fueron obtenidos de sus historias clínicas, pertenecientes al archivo del propio hospital. Se ha obtenido la aprobación del comité regional de ética e investigaciones científicas.
Un total de 8 cirujanos especialistas en Cirugía Ortopédica y Traumatología llevaron a cabo las intervenciones como responsables.
CirugíaLos pacientes fueron divididos en 2 grupos: a los que se les retiró el manguito de isquemia previamente al cierre quirúrgico (grupo A) y a los que se les retiró tras el mismo (grupo B). El manguito fue colocado en el extremo proximal del muslo, siendo inflado previamente a la cirugía a una presión de entre 270 y 350mmHg. El abordaje utilizado fue parapatelar medial clásico en todas ellas. Todas las artroplastias de rodilla fueron posteroestabilizadas. En aquellas cirugías en que el manguito fue retirado antes del cierre quirúrgico se esperó a completar la cementación para soltar la presión, y tras realizar compresión mediante gasas del lecho quirúrgico se realizó hemostasia con el bisturí diatérmico hasta objetivar que ningún vaso continuase sangrando de modo activo. Luego se realizó el cierre quirúrgico, colocando un redón de drenaje o bien un redón recuperador desde el interior de la articulación al exterior. Tras ello, se aplicó un vendaje sobre todo el miembro inferior. La otra alternativa es retirar el manguito tras el cierre quirúrgico (también se deja drenaje redón o recuperador) realizando un vendaje compresivo posterior al cierre sobre el miembro inferior. Los datos sobre el modo de retirar el manguito fueron extraídos del protocolo quirúrgico de la intervención, corroborándose en el protocolo de enfermería y en el de anestesia. La elección del método de retirada fue responsabilidad de cada cirujano principal, siendo el mismo método para un mismo cirujano en todas sus intervenciones (excepto un cirujano, que llevó a cabo 2 cirugías con un método y el resto con el otro). Todas las artroplastias fueron cementadas, tanto el componente femoral como en el tibial, así como la patela, si fuese esta sustituida.
Los pacientes fueron llevados a Reanimación tras la intervención, y de allí a la planta de Traumatología pasadas 3-4h. La contabilización de la sangre transfundida fue llevada a cabo recogiendo los datos de la historia de enfermería en la sala de Reanimación y en la planta de Traumatología. Se tuvieron en cuenta el número de CH transfundidos. Se consideró la autotransfusión con la sangre derivada del redón recuperador, contabilizando cada 250ml de sangre recuperada como un CH. Los criterios de transfusión fueron analíticos, con una Hb inferior a 8gr/dl sin comorbilidades, o a 10gr/dl con comorbilidades asociadas o clínica franca de anemia. La clínica fue la que motivó la decisión de transfusión durante la estancia en Reanimación (en función de la hipotensión sistólica<80mmHg, la taquicardia>120lpm o el estado poco reactivo del paciente, con palidez cutánea y de mucosas). Se tuvieron en cuenta los CH transfundidos durante el ingreso hospitalario en el Servicio de Traumatología en las 72h posteriores a la intervención. La elección de redón o recuperador dependió de la decisión de cada cirujano intraoperatoriamente.
El seguimiento de las complicaciones fue realizado siguiendo la historia clínica del paciente, desde la intervención hasta el momento actual. Se tuvieron en cuenta las complicaciones agudas (en el primer mes), las subagudas (en los 6 primeros meses) y las crónicas (tras 6 meses). Fueron diferenciadas las complicaciones infecciosas y las mecánicas que requirieron reingreso. Además, las infecciones fueron diferenciadas entre superficiales y profundas.
Análisis estadísticoEn el análisis descriptivo las variables gaussianas se expresaron como media±desviación estándar y las no gaussianas como mediana y primer-tercer cuartil. Para conocer la normalidad de las variables se realizó el test de Kolmogorov-Smirnov. Las variables cualitativas se expresaron como frecuencia y porcentaje.
Se realizaron pruebas no paramétricas (Chi-cuadrado y U de Mann-Whitney) para determinar la asociación entre la retirada del manguito de isquemia (antes, después) y las variables del estudio.
Para comprobar si hay diferencias en el tiempo de cirugía entre los no transfundidos y los que sí, se realizó el test U de Mann-Whitney.
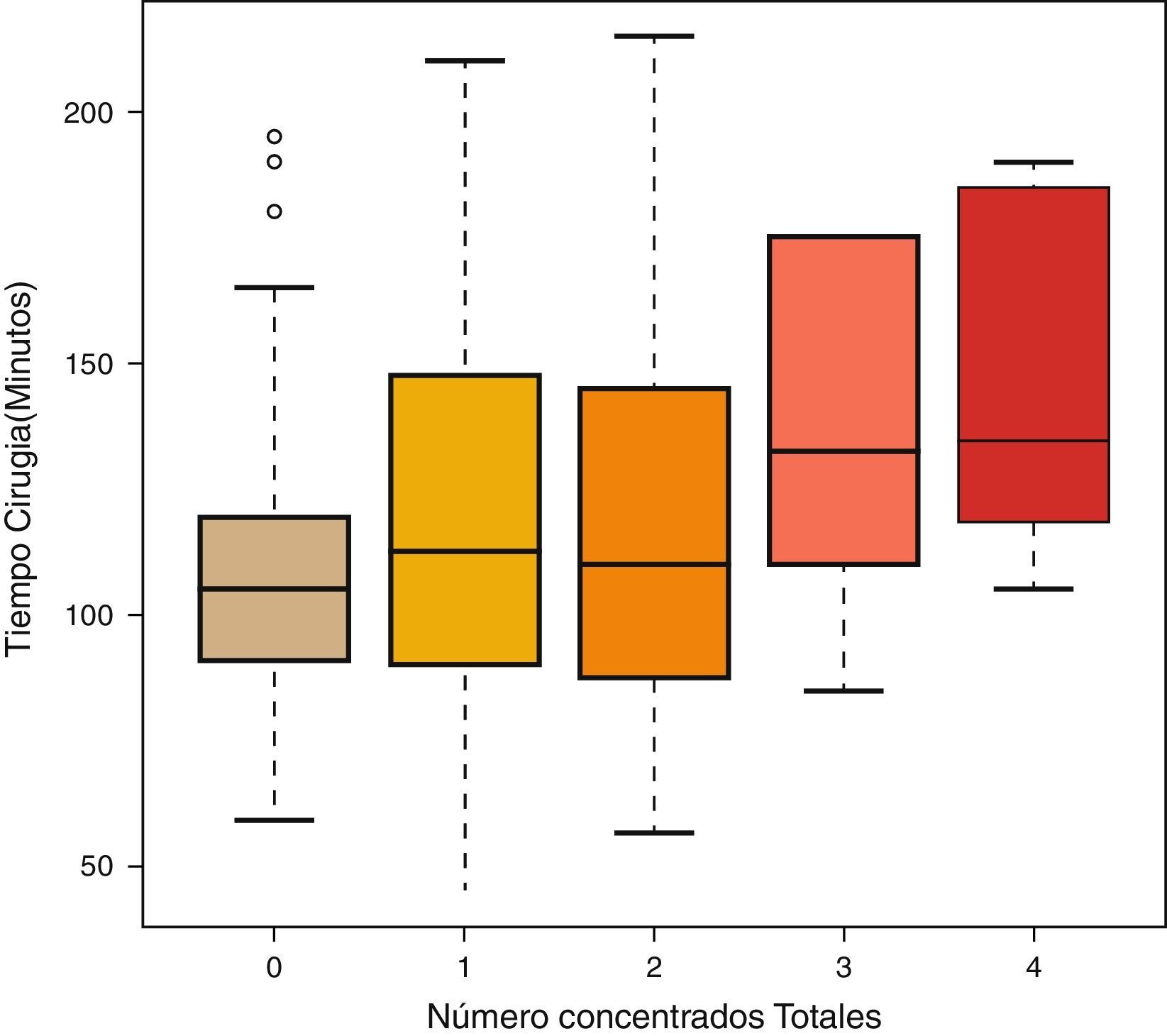
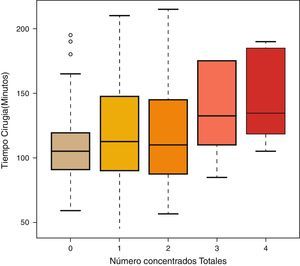
Por último, para ver si hay diferencias en el tiempo de cirugía entre los diferentes números de concentrados totales, se utilizó el test de Kruskal-Wallis. También se realizaron comparaciones múltiples 2 a 2 utilizando el test U de Mann-Whitney usando la corrección de Bonferroni.
En todos los análisis se consideraron estadísticamente significativas las diferencias con p<0,05. Los análisis se realizaron utilizando el software libre R (http://www.r-project.org).
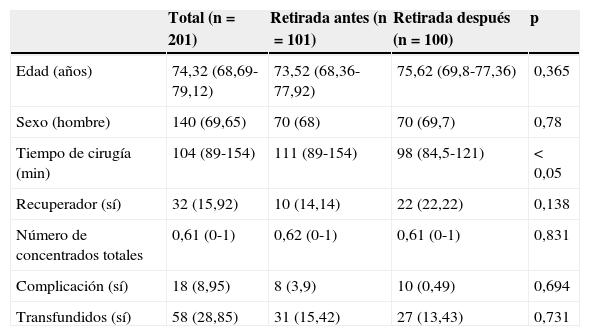
ResultadosLas mujeres operadas fueron 140 (72 años de edad media), y los hombres, 61 (71 años de edad media). Ciento un pacientes recibieron el método de retirada A (previo al cierre), y 100, el B (posterior al cierre). No hubo diferencias entre los grupos en función de la edad o el sexo. Cada cirujano llevó a cabo una media de 25 artroplastias (rango: 18-31). A 32 pacientes se les aplicó redón recuperador, y al resto (169), redón drenaje simple, sin que hubiese diferencias tampoco entre ambos grupos por el hecho de usar recuperador (tabla 1). El tiempo medio de intervención fue de 111min para el grupo A y de 98min para el B, siendo la diferencia estadísticamente significativa (p<0,05) (tabla 1). La media de CH transfundidos fue de 0,62 para el grupo A y de 0,61 para el B, no existiendo diferencias estadísticamente significativas entre ambos grupos. Tampoco se estableció una correlación entre el tiempo quirúrgico y los CH transfundidos (p=0,055), aunque sí existió una tendencia a ser sometidos a más transfusiones cuanto mayor fue el tiempo quirúrgico (tabla 2; fig. 1). Hubo 18 complicaciones en total, 8 en el grupo A y 10 en el B, sin que hubiese diferencias entre ellos. Hubo 12 infecciones (8 superficiales y 4 profundas). De las 8 superficiales, 7 fueron agudas o subagudas y una crónica, mientras que las 4 profundas fueron crónicas y requirieron recambio protésico en 2 tiempos. Según el grupo quedaron así: 5 en el grupo A, 3 superficiales y 2 profundas, y 7 en el B, 5 superficiales y 2 profundas; no habiendo diferencias significativas entre ambos grupos (p=0,69) (tabla 1).
Datos de los pacientes en función del momento de retirada del manguito
| Total (n=201) | Retirada antes (n=101) | Retirada después (n=100) | p | |
|---|---|---|---|---|
| Edad (años) | 74,32 (68,69-79,12) | 73,52 (68,36-77,92) | 75,62 (69,8-77,36) | 0,365 |
| Sexo (hombre) | 140 (69,65) | 70 (68) | 70 (69,7) | 0,78 |
| Tiempo de cirugía (min) | 104 (89-154) | 111 (89-154) | 98 (84,5-121) | <0,05 |
| Recuperador (sí) | 32 (15,92) | 10 (14,14) | 22 (22,22) | 0,138 |
| Número de concentrados totales | 0,61 (0-1) | 0,62 (0-1) | 0,61 (0-1) | 0,831 |
| Complicación (sí) | 18 (8,95) | 8 (3,9) | 10 (0,49) | 0,694 |
| Transfundidos (sí) | 58 (28,85) | 31 (15,42) | 27 (13,43) | 0,731 |
Las variables cuantitativas se representan con la mediana (primer-tercer cuartil), y las variables cualitativas, con las frecuencias absolutas (porcentajes).
Nuestro estudio no ha encontrado diferencias entre retirar el manguito antes o después del cierre quirúrgico. Tampoco en cuanto a la necesidad de transfusiones ni en relación con las complicaciones posquirúrgicas. Rama et al.18 concluyeron, en el primero de los 2 metaanálisis sobre el tema, que retirar el manguito antes del cierre quirúrgico aumenta el sangrado posquirúrgico estimado, algo que Zan et al.28, en el último realizado, corroboró, añadiendo también a ese aumento de pérdida sanguínea el de la sangre perdida de modo directo y a la perdida intraoperativamente. Esta pérdida se podría explicar por 2 motivos: por un lado, el tiempo quirúrgico se ve aumentado, lo que produciría un mayor sangrado, y por otro, se daría una hemorragia reactiva tras la retirada del manguito, que aumentaría el sangrado fisiológico3. Este resultado se ha visto refrendado por la mayor necesidad de transfusiones en estos pacientes. En los nuestros, la media de transfusiones ha sido muy inferior a la de otros estudios, apenas de 0,6 CH (tabla 1) por paciente en ambos grupos, lo que contrasta con los 1,3 en la retirada previa al cierre y los 1,4 en la retirada posterior al mismo en el estudio de Harvey et al.4, del mismo modo que Page et al.17 obtuvieron 2,6 CH de media en ambos grupos. Esto puede ser explicado por varios motivos; en primer lugar, la selección de pacientes en nuestro estudio fue muy estricta, pues el número de sujetos descartados por terapias o enfermedades fue de 90, casi un 30% del total de artroplastias realizadas, lo que ha seleccionado nuestra población, dándole menos posibilidades de complicaciones intra y postoperatorias, a diferencia de la mayoría de los estudios, en los que no se especifican los tratamientos previos de los pacientes y los protocolos de retirada de anticoagulación o antiagregación. Además, en muchos estudios no se especifica el tiempo quirúrgico ni si hay diferencias entre ambos grupos, motivo que parece influir en la mayor pérdida sanguínea postoperatoria18. Sin embargo, nosotros no hemos encontrado una relación directa entre el tiempo quirúrgico y la necesidad de transfusiones sanguíneas, aunque sí una tendencia que no fue estadísticamente significativa (p=0,055) (fig. 1). Urbano Manero y Miguelena Bobadilla24 tampoco encontraron diferencias en el número de transfusiones (con unas medias parecidas a las nuestras de 0,3 y 0,4 CH) entre ambos grupos, pero sí las encontraron en cuanto a la sangre perdida intraoperatoriamente y a la sangre total perdida, lo que no sería congruente con esa idéntica necesidad transfusional ante Hb previas semejantes. Por el contrario, Abbas et al.25 sí obtuvieron un descenso en el número de CH transfundidos en el grupo de retirada intraoperatoria respecto de la retirada postoperatoria, aunque curiosamente ellos no encontraron diferencia en la pérdida de sangre medida directamente. Nosotros sí hemos encontrado diferencias significativas en el tiempo quirúrgico entre ambos grupos (111min en el A y 98min en el B) (tabla 2), al igual que Hersekli et al.20, que obtuvieron un tiempo medio quirúrgico inferior al nuestro, pero igualmente superior para la retirada previa al cierre (87min para la retirada previa y 80min para la posterior), así como Yavarikia et al. (104 frente a 96min)23. Por otro lado, Steffin et al.29, Barwell et al.30, Burkhart et al.19 o Newman et al.13 no establecieron diferencias entre ambos grupos.
De esta manera, la reducción en las transfusiones ha podido influir en la posibilidad de encontrar diferencias entre ambos grupos. De todos modos, en nuestro estudio solo hemos podido medir la sangre perdida mediante la necesidad de transfusiones, lo que confiere un carácter subjetivo a la decisión de transfundir a un paciente. Así mismo, parece que la técnica quirúrgica juega un papel fundamental en el sangrado posquirúrgico, pues un abordaje cuidadoso, reconociendo la anatomía vascular, evitaría dañar las arterias geniculadas, principales responsables del sangrado derivado de esta intervención. No se ha recogido, en los estudios publicados que comparan la técnica quirúrgica con ambos tipos de retirada del manguito, ningún caso de sección de la arteria poplítea, algo que tampoco hemos recogido en nuestra serie, lo que resta importancia a la retirada previa al cierre para constatar que esta arteria no se ha visto afectada.
Los metaanálisis de Rama et al.18 y Zan et al.28 también han comparado las complicaciones en función del momento de la retirada del manguito, siendo el resultado diferente al nuestro, puesto que en este caso la retirada previa al cierre redujo las complicaciones y la necesidad de reintervenciones. Esto ha sido explicado por la mayor presencia de hematomas subcutáneos, que se producen tras el cierre quirúrgico al no realizar hemostasia, lo que provocaría un aumento de la isquemia a nivel local en la fase de recuperación de los tejidos, con la consiguiente predisposición para las infecciones y las dehiscencias de la herida. Además, Zan et al.28, a diferencia de Rama et al.18, concluyen que las complicaciones también aumentan en el grupo de retirada posterior al cierre en cuanto a la rehabilitación y la movilidad. En nuestra serie no hemos identificado más complicaciones con la retirada posterior al cierre. El número de complicaciones graves también fue bajo, y nuevamente debemos explicarlo por las características de nuestros pacientes, con menos comorbilidades y, por lo tanto, menos predispuestos a complicaciones, aunque el número de complicaciones locales, sobre todo las infecciones superficiales, fuese alto. Esta reducción de las complicaciones ha disminuido la posibilidad de constatar diferencias entre ambos grupos.
A la vista de nuestros resultados no parece determinante el momento en el cual se decide retirar el manguito de isquemia para reducir las transfusiones sanguíneas. En todo caso, se hace necesario un profundo conocimiento de la anatomía vascular de la rodilla a la hora de realizar el abordaje. Así mismo, las complicaciones posquirúrgicas parecen estar más relacionadas con las características del paciente, en relación con sus comorbilidades, que con la técnica quirúrgica llevada a cabo. Más estudios prospectivos son necesarios para poder determinar la influencia de la isquemia en la pérdida sanguínea, así como la repercusión en las complicaciones que se derivan de la isquemia y de las transfusiones sanguíneas.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.