La pérdida de masa ósea, como consecuencia del remodelado óseo, en el tercio proximal del fémur, es un factor que contribuye al fracaso de las prótesis de cadera a medio-largo plazo. Este remodelado periprotésico se desarrolla sobre todo durante los 12 primeros meses tras la intervención.
Se pretende evaluar el comportamiento a un año de un nuevo vástago anatómico, el vástago ANATO® (2015-Stryker®), el cual es un rediseño de su predecesor (vástago ABG-ii®--Stryker) mediante densitometría ósea.
Material y métodoEstudio prospectivo, controlado, en el que se analizan densitométricamente los cambios en la densidad mineral ósea (DMO), observados en torno a las siete áreas de Gruen, en un grupo de 61 pacientes, afectos de coxartrosis primaria, en quienes se implantó un vástago ANATO®. La cadera sana fue tomada como grupo control. Se comparó la existencia de diferencias en el patrón de remodelado según sexo, edad e índice de masa corporal (IMC). El seguimiento fue durante el primer año tras la intervención.
ResultadosAl año de seguimiento se aprecian descensos de la densidad mineral ósea en la zona siete, de -5,9%, siendo este descenso estadísticamente significativo. No se encontraron diferencias en el patrón de remodelado según edad, sexo e índice de masa corporal.
ConclusiónEl vástago ANATO®, permite una transmisión eficiente de cargas desde el vástago al fémur próximal. Únicamente en la zona siete se aprecia atrofia ósea significativa. Las diferencias de edad, IMC y sexo parecen no influir en la remodelación ósea en torno a este nuevo vástago.
The loss of bone mass, as a consequence of bone remodelling, in the proximal third of the femur, is a factor that contributes to the failure of hip prostheses in the medium to long term. This periprosthetic remodelling occurs mainly during the first 12 months after the operation.
The aim is to evaluate the behaviour at one year of a new anatomical stem, the ANATO® stem (2015-Stryker®), which is a redesign of its predecessor (ABG-ii®-Stryker stem) by means of bone densitometry.
MethodProspective, controlled study in which the changes in bone mineral density (BMD) observed around the seven areas of Gruen in a group of 61 patients affected by primary coxarthrosis, in whom an ANATO® stem was implanted, are analysed densitometrically. The healthy hip was taken as the control group. The existence of differences in the remodelling pattern according to sex, age and body mass index (BMI) was compared. The follow-up was during the first year after the intervention.
ResultsAfter one year of follow-up, decreases of bone mineral density in zone seven of -5.9% were observed, being this decrease statistically significant. No differences were found in the remodelling pattern according to age, sex and body mass index.
ConclusionThe ANATO® stem allows an efficient transmission of loads from the stem to the proximal femur. Only in zone seven significant bone atrophy is observed. Differences in age, BMI and sex do not seem to influence the bone remodelling around this new stem.
La pérdida de masa ósea en el tercio proximal del fémur es un factor que contribuye al fracaso de las prótesis de cadera a medio-largo plazo. Se asocia con aflojamiento, hundimiento, rotura de la prótesis o fractura femoral1.
Se considera que la masa ósea inicial del paciente es el factor más importante, con capacidad predictiva de los cambios de remodelación2. Además, otros factores dependientes del paciente, como la edad, peso, actividad o el sexo pueden influir en los cambios remodelativos.
La resorción ósea se produce tanto en prótesis cementadas como en no cementadas. Este hecho se atribuye al puenteo de fuerzas (stress-shielding), a la existencia de micromovimiento y a las lesiones osteolíticas debidas a la reacción biológica que causan las partículas de desgaste de polietileno3,4.
Actualmente se acepta que la remodelación ósea periprotésica es un proceso multifactorial5 que depende del diseño, tamaño, material empleado en su fabricación, morfología y extensión del recubrimiento poroso del vástago6. Este remodelado periprotésico se desarrolla sobre todo durante los 12 primeros meses tras la intervención2.
Para determinar la densidad mineral ósea se han utilizado diferentes métodos, siendo la absorciometría dual con rayos x superior a otros métodos absorciométricos en cuanto a coste, tiempo de rastreo, dosis de radiación y precisión7. También se ha concluido que la precisión de esta técnica no se ve modificada por el diseño y tipo de implante5. Por esto es un método bien aceptado para el seguimiento de la remodelación ósea adaptativa periprotésica8.
A lo largo de los últimos 15 años, se han publicado algunos estudios valorando el comportamiento de vástagos anatómicos no cementados a corto, medio y largo plazo, mostrando buenos resultados clínicos y radiológicos, tanto al año de su implantación, como a los 10 años de la misma9-12.
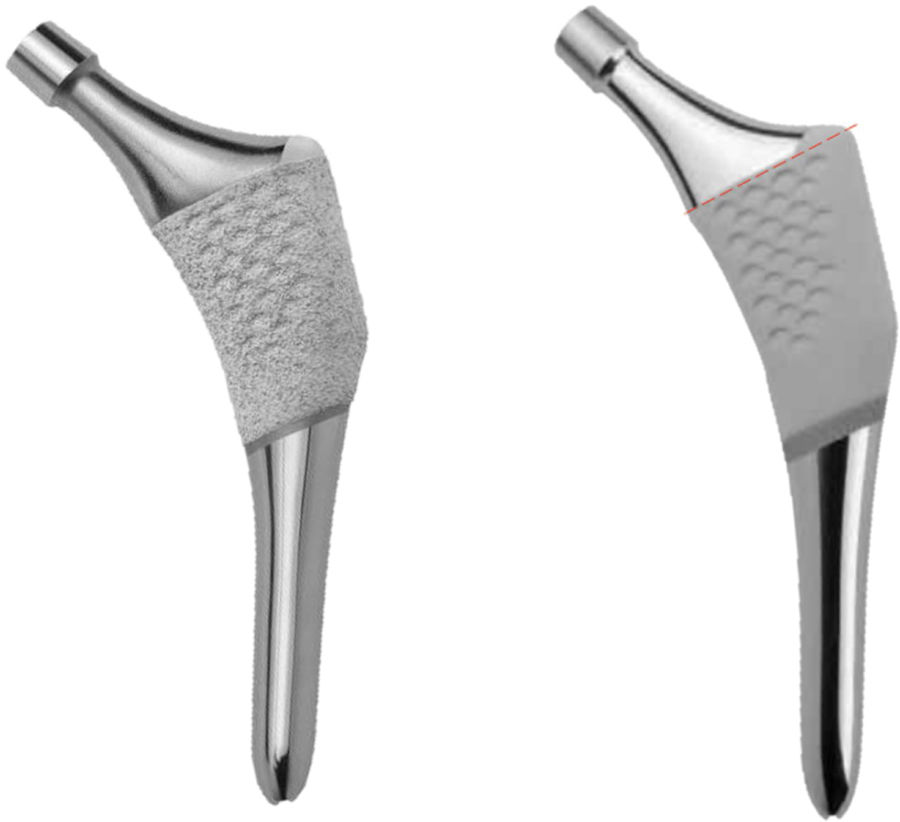
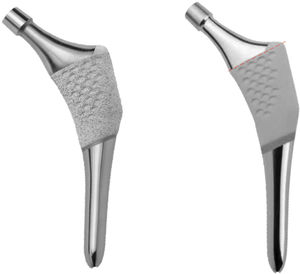
Con este objetivo se ha diseñado un estudio prospectivo, para evaluar el comportamiento a un año de un nuevo vástago anatómico, el vástago ANATO® (2015-Stryker®, E.E.U.U) (fig. 1), el cual es un rediseño de su predecesor (vástago ABG-ii®). Mediante densitometría ósea se pretenden determinar los cambios en la densidad mineral ósea periprotésica que tienen lugar en distintos momentos de seguimiento, durante el primer año postcirugía, como consecuencia de los cambios en la biomecánica de la cadera que se producen tras la implantación de este vástago anatómico.
Material y métodosPara este trabajo se ha diseñado un estudio prospectivo, controlado con la cadera sana contralateral, con inclusión de pacientes desde junio de 2017 a enero de 2018. Se pretende detectar y cuantificar la remodelación ósea periprotésica en pacientes a quienes se implantó una prótesis total de cadera no cementada modelo ANATO® a un año tras la intervención quirúrgica.
El estudio fue aprobado por el Comité de Ética del hospital y cada paciente fue notificado y aceptó previamente su inclusión mediante un documento de consentimiento informado.
Población de estudioLa muestra incluye 61 pacientes (41 hombres y 20 mujeres) afectos de coxartrosis primaria unilateral, sin signos de osteoporosis radiográfica y con morfología femoral tipo A de Dorr. La media de índice de masa corporal fue de 29,6 kg/m2 (18-34 kg/m2). La mediana de edad de 57 años (37-70 años). Todos los pacientes completaron el seguimiento a un año (tabla 1).
Características demográficas de los pacientes incluidos en el estudio
| ANATO (n = 61) | |
|---|---|
| Hombre/mujer | 41 H/20 M |
| IMC | 29,6 kg/m2 (18-34) |
| Edad | 57 años (37-70) |
| Diagnóstico | 100% coxartrosis primaria |
| Morfología ósea | 100% Dorr A |
| Tamaño de vástago(100% con 7° de anteversión) | 3:9 pacientes4:28 pacientes5:14 pacientes6:8 paciente7:2 pacientes |
Este implante es un vástago anatómico no cementado, de anclaje metafisario por ajuste a presión, fabricado a partir de una aleación Ti-6Al-4V, con recubrimiento circunferencial de hidroxiapatita (Plasma-Spray, 200 microns) en el tercio proximal del vástago (fig. 1).
Su predecesor, el vástago ABG-ii®, es un vástago anatómico no cementado, de anclaje metafisario por ajuste a presión, fabricado a partir de una aleación titanio-molibdeno-zirconio-hierro (TMZF). El recubrimiento de hidroxiapatita (Plasma-Spray, 70 microns) queda limitado a la parte metafisaria (fig. 1). Este implante no será objeto de estudio.
A todos los pacientes se les implantó un cotilo no cementado (TRIDENT®-Stryker®, EE.UU.) y par de fricción cerámica-polietileno, los cuales no serán objetos de estudio.
Técnica quirúrgicaTodos los pacientes fueron intervenidos utilizando la misma vía de abordaje (posterolateral de Kocher Langenbeck) y grupo de cirujanos.
La preparación del fémur, ya iniciada con la osteotomía, sigue con el tallado de la metáfisis proximal con un escoplo hueco. Posteriormente, se inicia el fresado diafisario progresivo para conseguir un sobrefresado de 1 mm por encima del diámetro de la cola del implante planificado. La preparación metafisaria se completa con raspas progresivas hasta el tamaño calculado en la planificación preoperatoria y se confirma al observar un óptimo ajuste metafisario y una adecuada estabilidad rotatoria.
Durante el postoperatorio inmediato, los pacientes mantienen el apoyo parcial con dos bastones durante seis semanas, momento en que se retira el bastón homolateral y se autoriza la carga completa. A los dos o tres meses se retira el bastón contralateral y se autorizaba el movimiento libre.
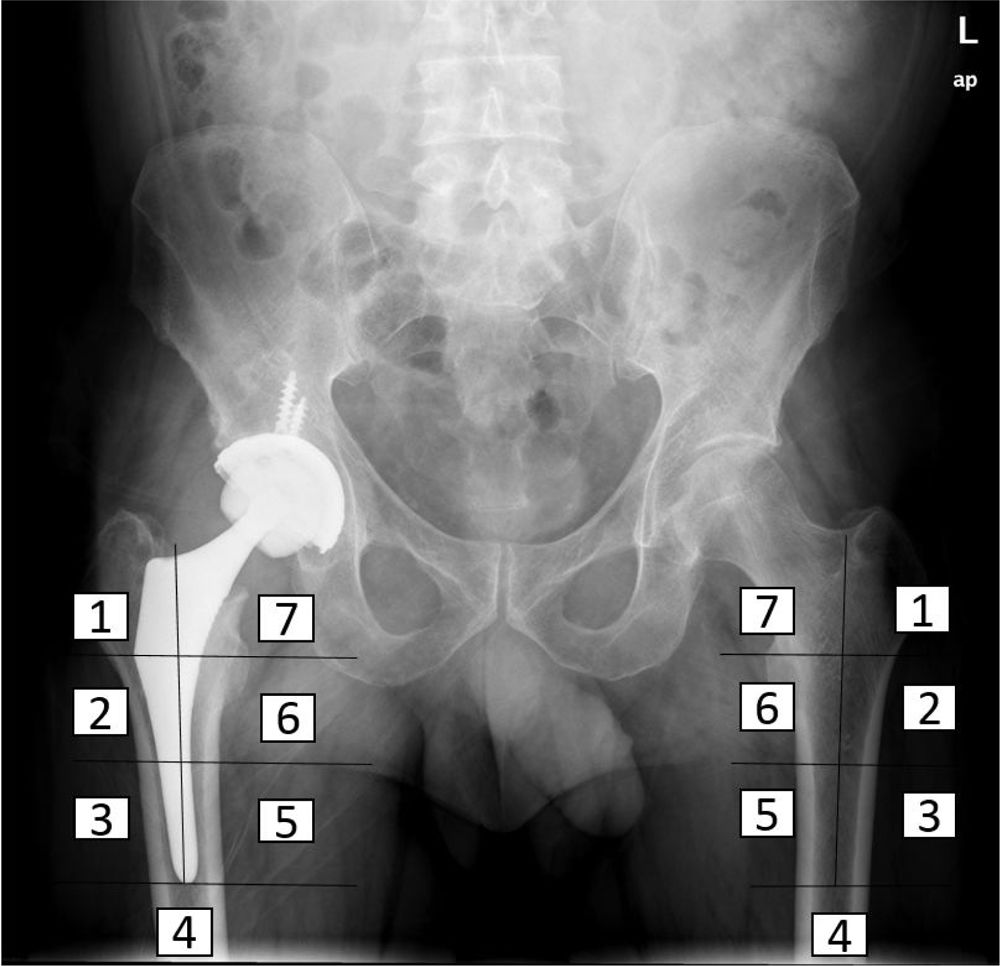
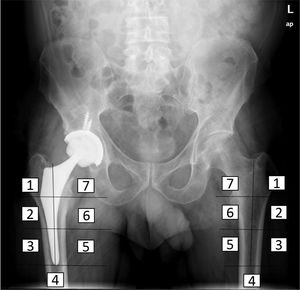
Estudio densitométricoSe determinó la densidad mineral ósea de los pacientes intervenidos en el preoperatorio, postoperatorio inmediato, y a los tres, seis y 12 meses tras la intervención, por el método DEXA (LUNAR DPX enCORE, General Electrics Healthcare®, Madison), cuyo análisis se realizó por separado en las siete regiones de interés en que Gruen y Johnston13 (recuadros de 30 por 30 píxeles cada uno) divide el fémur proximal (fig. 2). Se utilizó un software con exclusión de metales, incluido por el propio fabricante en el densitómetro para el análisis. Además, se valoraron la influencia de otras variables en el remodelado óseo en el postoperatorio inmediato, a los seis meses y al año, como la edad, el sexo y el índice de masa corporal (IMC). Para ello se tomó como punto de corte la mediana de la edad, la media de IMC de la muestra, para dividirla en dos grupos respectivamente. Los datos de masa ósea obtenidos se expresan en mg de calcio/cm2, informando de la densidad mineral ósea de cada zona alrededor del implante.
Análisis estadísticoEl estudio estadístico se realizó con el programa SPSS® versión 20.0. Para la comparación de porcentajes se utilizó la prueba χ2, para las medias con parámetros homogéneos se utilizó la «t» de Student, y para las medias con parámetros no homogéneos se utilizó el test de Kruskall-Wallis. El nivel de significación estadística se fijó en p igual o menor a 0,05.
ResultadosLa evolución de la masa ósea en nuestra muestra a lo largo de los tres, seis y 12 primeros meses de la intervención se recoge en la tabla 2. Los valores postoperatorios se tomaron como referencia para el seguimiento de la densidad mineral ósea en la cadera operada.
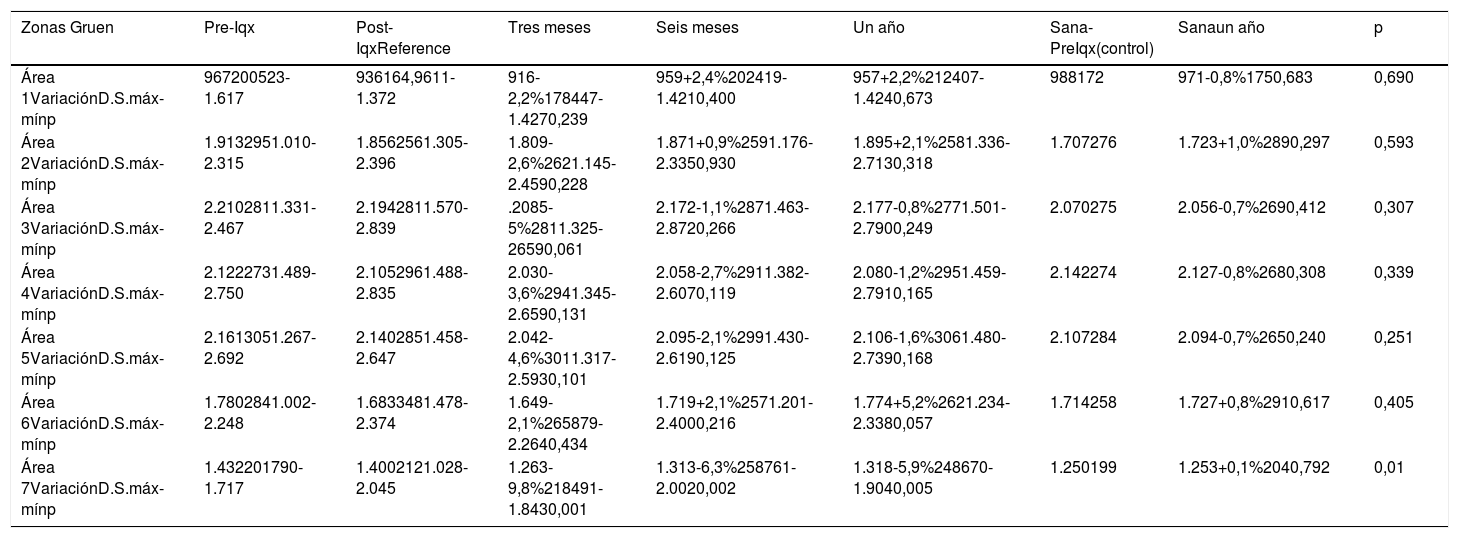
Cambios en la densidad ósea en la cadera operada y sana para el vástago ANATO durante el primer año de seguimiento. La densidad mineral ósea se expresa en mg de calcio/cm2. El porcentaje de variación se calcula con respecto a la exploración postoperatoria, considerada como el valor de referencia
| Zonas Gruen | Pre-Iqx | Post-IqxReference | Tres meses | Seis meses | Un año | Sana-PreIqx(control) | Sanaun año | p |
|---|---|---|---|---|---|---|---|---|
| Área 1VariaciónD.S.máx-mínp | 967200523-1.617 | 936164,9611-1.372 | 916-2,2%178447-1.4270,239 | 959+2,4%202419-1.4210,400 | 957+2,2%212407-1.4240,673 | 988172 | 971-0,8%1750,683 | 0,690 |
| Área 2VariaciónD.S.máx-mínp | 1.9132951.010-2.315 | 1.8562561.305-2.396 | 1.809-2,6%2621.145-2.4590,228 | 1.871+0,9%2591.176-2.3350,930 | 1.895+2,1%2581.336-2.7130,318 | 1.707276 | 1.723+1,0%2890,297 | 0,593 |
| Área 3VariaciónD.S.máx-mínp | 2.2102811.331-2.467 | 2.1942811.570-2.839 | .2085-5%2811.325-26590,061 | 2.172-1,1%2871.463-2.8720,266 | 2.177-0,8%2771.501-2.7900,249 | 2.070275 | 2.056-0,7%2690,412 | 0,307 |
| Área 4VariaciónD.S.máx-mínp | 2.1222731.489-2.750 | 2.1052961.488-2.835 | 2.030-3,6%2941.345-2.6590,131 | 2.058-2,7%2911.382-2.6070,119 | 2.080-1,2%2951.459-2.7910,165 | 2.142274 | 2.127-0,8%2680,308 | 0,339 |
| Área 5VariaciónD.S.máx-mínp | 2.1613051.267-2.692 | 2.1402851.458-2.647 | 2.042-4,6%3011.317-2.5930,101 | 2.095-2,1%2991.430-2.6190,125 | 2.106-1,6%3061.480-2.7390,168 | 2.107284 | 2.094-0,7%2650,240 | 0,251 |
| Área 6VariaciónD.S.máx-mínp | 1.7802841.002-2.248 | 1.6833481.478-2.374 | 1.649-2,1%265879-2.2640,434 | 1.719+2,1%2571.201-2.4000,216 | 1.774+5,2%2621.234-2.3380,057 | 1.714258 | 1.727+0,8%2910,617 | 0,405 |
| Área 7VariaciónD.S.máx-mínp | 1.432201790-1.717 | 1.4002121.028-2.045 | 1.263-9,8%218491-1.8430,001 | 1.313-6,3%258761-2.0020,002 | 1.318-5,9%248670-1.9040,005 | 1.250199 | 1.253+0,1%2040,792 | 0,01 |
A los tres meses de la intervención, se apreció una pérdida ósea generalizada en todas las zonas estudiadas de -9,8% a -2,1%, siendo estadísticamente significativa en el área siete.
A los seis meses de la intervención, se apreció una recuperación de la densidad mineral ósea en todas las zonas estudiadas.
Al año de la intervención, persisten pérdidas de -5,9%, estadísticamente significativas, en la zona siete, aunque en menor cuantía con respecto a las mediciones realizadas a los tres y seis meses.
En las zonas una, dos y seis se verificó una recuperación de masa ósea que varía desde +2,1% a +5,2%. En las zonas tres, cuatro y cinco se producen pequeñas pérdidas de -1,2% a -0,3%. En ninguna de estas zonas estudiadas se encontraron diferencias estadísticamente significativas.
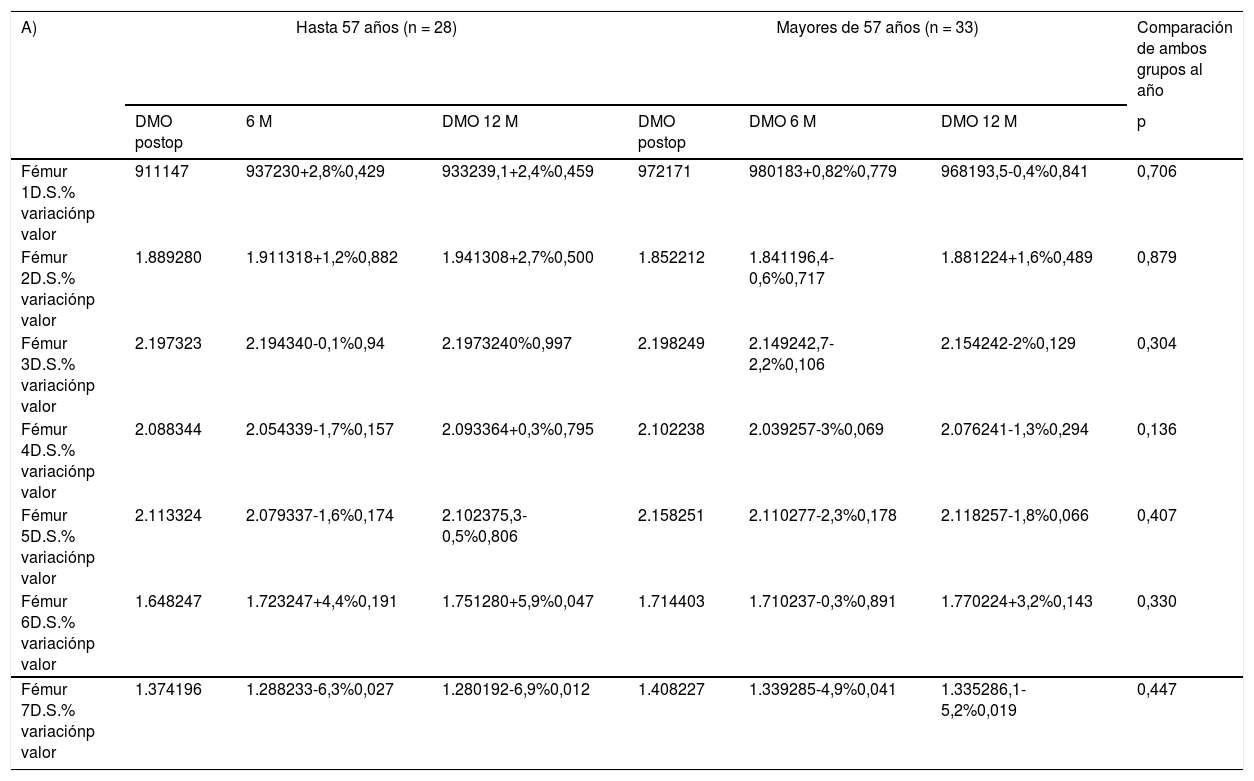
Cuando se compararon diferencias de densidad mineral ósea (DMO) (tabla 3A) al final del seguimiento entre grupos de edad, se tomó como punto de corte la mediana de edad de la muestra (57 años). Así, se observó una variación de -6,9% a +5,9% de DMO en el grupo menor o igual a 57 años, y de -5,2% a +3,2% en el grupo mayor de 57 años, sin apreciarse diferencias estadísticamente significativas entre los dos grupos en ninguna de las zonas estudiadas.
A) Comparación entre la remodelación ósea inducida por cada vástago según edad. B) La misma comparación según IMC. C) Comparación de acuerdo al género. La densidad mineral ósea se expresa en mg de calcio/cm2. El porcentaje de variación se calcula con respecto a la exploración postoperatoria, considerada como el valor de referencia
| A) | Hasta 57 años (n = 28) | Mayores de 57 años (n = 33) | Comparación de ambos grupos al año | ||||
|---|---|---|---|---|---|---|---|
| DMO postop | 6 M | DMO 12 M | DMO postop | DMO 6 M | DMO 12 M | p | |
| Fémur 1D.S.% variaciónp valor | 911147 | 937230+2,8%0,429 | 933239,1+2,4%0,459 | 972171 | 980183+0,82%0,779 | 968193,5-0,4%0,841 | 0,706 |
| Fémur 2D.S.% variaciónp valor | 1.889280 | 1.911318+1,2%0,882 | 1.941308+2,7%0,500 | 1.852212 | 1.841196,4-0,6%0,717 | 1.881224+1,6%0,489 | 0,879 |
| Fémur 3D.S.% variaciónp valor | 2.197323 | 2.194340-0,1%0,94 | 2.1973240%0,997 | 2.198249 | 2.149242,7-2,2%0,106 | 2.154242-2%0,129 | 0,304 |
| Fémur 4D.S.% variaciónp valor | 2.088344 | 2.054339-1,7%0,157 | 2.093364+0,3%0,795 | 2.102238 | 2.039257-3%0,069 | 2.076241-1,3%0,294 | 0,136 |
| Fémur 5D.S.% variaciónp valor | 2.113324 | 2.079337-1,6%0,174 | 2.102375,3-0,5%0,806 | 2.158251 | 2.110277-2,3%0,178 | 2.118257-1,8%0,066 | 0,407 |
| Fémur 6D.S.% variaciónp valor | 1.648247 | 1.723247+4,4%0,191 | 1.751280+5,9%0,047 | 1.714403 | 1.710237-0,3%0,891 | 1.770224+3,2%0,143 | 0,330 |
| Fémur 7D.S.% variaciónp valor | 1.374196 | 1.288233-6,3%0,027 | 1.280192-6,9%0,012 | 1.408227 | 1.339285-4,9%0,041 | 1.335286,1-5,2%0,019 | 0,447 |
| IMC < 30 (n = 37) | IMC > 30 (n = 24) | ||||||
|---|---|---|---|---|---|---|---|
| B) | DMO postop | DMO 6 M | DMO 12 M | DMO postop | DMO 6 M | DMO 12 M | p |
| Fémur 1D.S.% variaciónp valor | 951157 | 953221-0,2%0,959 | 945235-0,7%0,847 | 906155 | 930190+2,6%0,279 | 937176+3,4%0,105 | 0,252 |
| Fémur 2D.S.% variaciónp valor | 1.874216 | 1.843250-1,7%0,462 | 1.868226-0,4%0,788 | 1.810261 | 1.833269+1,3%0,344 | 1.852270+2,3%0,252 | 0,314 |
| Fémur 3D.S.% variaciónp valor | 2.189264 | 2.108282-3,8%0,133 | 2.160252-1,4%0,213 | 2.127282 | 2.205292+3,6%0,112 | 2.226282+4,5%0,06 | 0,061 |
| Fémur 4D.S.% variaciónp valor | 2.087266 | 2.026286-3%0,107 | 2.058282-1,4%0,162 | 2.057311 | 2.055314-0,1%0,949 | 2.086320+1,4%0,789 | 0,631 |
| Fémur 5D.S.% variaciónp valor | 2.128284 | 2.082329-2,2%0,022 | 2.090318-1,8%0,295 | 2.126315 | 2.095296-1,5%0,387 | 2.150329,+1,2%0,253 | 0,215 |
| Fémur 6D.S.% variaciónp valor | 1.651391 | 1.692274+1,9%0,466 | 1.731255+4,7%0,085 | 1.667222 | 1.715195+2,8%0,174 | 1.768267+5,8%0,030 | 0,991 |
| Fémur 7D.S.% variaciónp valor | 1.384215 | 1.266262-8,6%0,01 | 1.279236-7,6%0,01 | 1.383182 | 1.382241-0,1%0,989 | 1.359265-1,8%0,582 | 0,064 |
| Hombres (n = 41) | Mujeres (n = 20) | ||||||
|---|---|---|---|---|---|---|---|
| C) | DMO postop | DMO 6 M | DMO 12 M | DMO postop | DMO 6 M | DMO 12 M | p |
| Fémur 1D.S.% variaciónp valor | 964160,4 | 989198+2,6%0,281 | 993210+3%0,249 | 831122 | 838220+0,8%0,428 | 845206+1,7%0,762 | 0,875 |
| Fémur 2D.S.% variaciónP valor | 1.898244 | 1.916261+1%0,710 | 1.947267+2,6%0,466 | 1.722171 | 1.758206+2,1%0,576 | 1.770197+2,7%0,457 | 0,641 |
| Fémur 3D.S.% variaciónp valor | 2.234281 | 2.220273-0,7%0,446 | 2.228262-0,3%0,510 | 2.016193 | 1.957278-2,9%0,304 | 1.941,256-3,8%0,141 | 0,353 |
| Fémur 4D.S.% variaciónp valor | 2.142294 | 2.098283-2,1%0,146 | 2.116295-0,8%0,191 | 1.912270 | 1.859277-2,8%0,247 | 1.878262,4-1,8%0,662 | 0,789 |
| Fémur 5D.S.% variaciónp valor | 2.175280 | 2.136292-1,8%0,272 | 2.150307-1,2%0,301 | 1.966266 | 1.903284-2,8%0,187 | 1.927324,85-2%0,236 | 0,275 |
| Fémur 6D.S.% variaciónp valor | 1.704359 | 1.744264+2,3%0,316 | 1.794263,2+5,3%0,109 | 1.597135 | 1.647157+1,3%0,463 | 1.674222+4,6%0,176 | 0,786 |
| Fémur 7D.S.% variaciónp valor | 1.406217 | 1.320271-6,1%0,001 | 1.330266-5,5%0,03 | 1.338160 | 1.247231-6,9%0,01 | 1.253197-6,4%0,01 | 0,174 |
Para valorar las diferencias de DMO al final del seguimiento según IMC (tabla 3B) subdividimos la muestra en dos grupos (Grupo 1: IMC < 30 y Grupo 2: IMC > 30). Se escogió el punto de corte en 30, ya que al ser la media poblacional del estudio dividía la muestra en dos grupos homogéneos. Vemos que en el grupo IMC < 30 existieron oscilaciones de DMO que fueron desde -7,6% a +4,7% y que en el grupo IMC > 30, osciló entre -1,8% a +5,8%. Esta diferencia no resultó estadísticamente significativa entre ambos subgrupos en ninguna área estudiada.
Para completar la investigación se estudiaron los cambios de masa ósea en torno a estos implantes en hombres y mujeres (tabla 3C). Para la población masculina la variación de masa ósea a lo largo del seguimiento mostró variaciones que fueron desde -5,5% a +5,3% y en mujeres de -6,4% a +4,6%, sin apreciarse diferencias estadísticamente significativas entre ambos géneros.
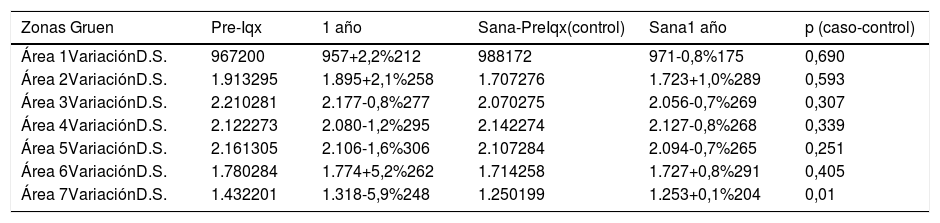
Respecto a la evolución de la masa ósea de la cadera sana (tabla 4), tomada como control, se observó una variación de masa ósea del -0,8% al +1,0%. Se encontraron diferencias estadísticamente significativas (p = 0,01) en zona siete al comparar la variación de DMO entre la cadera sana y el fémur protetizado, al año de la intervención.
Comparación entre la remodelación ósea entre la cadera protetizada (caso) y la cadera sana (control). La densidad mineral ósea se expresa en mg de calcio/cm2
| Zonas Gruen | Pre-Iqx | 1 año | Sana-PreIqx(control) | Sana1 año | p (caso-control) |
|---|---|---|---|---|---|
| Área 1VariaciónD.S. | 967200 | 957+2,2%212 | 988172 | 971-0,8%175 | 0,690 |
| Área 2VariaciónD.S. | 1.913295 | 1.895+2,1%258 | 1.707276 | 1.723+1,0%289 | 0,593 |
| Área 3VariaciónD.S. | 2.210281 | 2.177-0,8%277 | 2.070275 | 2.056-0,7%269 | 0,307 |
| Área 4VariaciónD.S. | 2.122273 | 2.080-1,2%295 | 2.142274 | 2.127-0,8%268 | 0,339 |
| Área 5VariaciónD.S. | 2.161305 | 2.106-1,6%306 | 2.107284 | 2.094-0,7%265 | 0,251 |
| Área 6VariaciónD.S. | 1.780284 | 1.774+5,2%262 | 1.714258 | 1.727+0,8%291 | 0,405 |
| Área 7VariaciónD.S. | 1.432201 | 1.318-5,9%248 | 1.250199 | 1.253+0,1%204 | 0,01 |
La pérdida ósea en el fémur proximal, como consecuencia del stress-shielding se ha descrito en prácticamente todos los implantes femorales3,4,14.
Los vástagos anatómicos no cementados han demostrado ser, a lo largo de las décadas, unos implantes fiables6,9-12,15. Se han desarrollado varios estudios con seguimiento a largo plazo, revelando resultados excelentes y consistentes para algunos modelos, como para el vástago ABG-ii9-11, modelo predecesor del vástago ANATO®.
En un primer momento, esta pérdida ósea también está influenciada por otros factores, como la agresión quirúrgica, el reposo en el postoperatorio inmediato y la carga parcial de peso10,16. De hecho, el fresado quirúrgico y la preparación del fémur proximal, causan un descenso inmediato del stock óseo17, que se calcula entre el 2-10%. En nuestra muestra podemos observar que la densidad mineral ósea disminuyó en la primera determinación a los tres meses de forma generalizada, debido probablemente a los factores mencionados anteriormente.
En la determinación a los seis meses, se aprecia una recuperación progresiva en todas las áreas, probablemente asociado al aumento de la actividad física habitual, que fomenta la remodelación ósea. Además, esta recuperación de la DMO refleja la respuesta biomecánica del hueso, de acuerdo a la ley de Wolff, como consecuencia de la osteointegración del implante, lográndose la estabilidad secundaria. La mayor recuperación se observa en las áreas dos y seis con respecto a la determinación de DMO postoperatoria, y las mayores pérdidas en el área siete, como consecuencia de la redistribución de cargas tras la implantación del vástago. Así, las zonas metafisarias reciben cargas que favorecen la conservación y el aumento de la DMO, mientras que en las zonas proximales, las cargas transmitidas a ese nivel no son suficientes para favorecer la conservación ósea, produciéndose atrofia por desuso.
Al año de seguimiento, las cifras de masa ósea en el área siete sugieren que se mantiene parcialmente desfuncionalizada y no recibe suficiente estímulo de cargas que favorezcan la recuperación ósea. Las áreas dos y seis, donde se transmiten más cargas, muestran un remodelado positivo, con un aumento de masa ósea en coincidencia con la ley de Wolff. En las zonas tres y cinco se aprecian pérdidas poco relevantes.
Valorando los resultados obtenidos por el vástago ANATO® en nuestro estudio en relación con los resultados publicados en los últimos años por su predecesor (ABG-ii®)9-11, observamos un patrón biomecánico más eficiente para preservar el hueso femoral proximal en el vástago ANATO®.
Creemos que la principal causa de esta mejor preservación ósea puede encontrarse en las características del recubrimiento biológico a nivel metafisario del vástago ANATO®, que con un recubrimiento proximal de 200 micras de hidroxiapatita, se comporta como un factor mecánico en sí mismo. A ese nivel, el mayor grosor del recubrimiento poroso incrementa la estabilidad intraoperatoria del implante y favorece una mayor y más extensa aposición ósea, minimizando la atrofia proximal y promoviendo la conservación ósea, y cierto remodelado positivo en las zonas metafisarias. Este factor ya había sido sugerido previamente en otros estudios18. Sin embargo, hemos de señalar, que sería necesario realizar un estudio prospectivo aleatorizado comparativo entre ambos vástagos, para poder demostrar este mejor comportamiento.
Por otro lado, hay desacuerdo sobre el papel que juegan la edad, el índice de masa corporal y el sexo en la remodelación ósea periprotésica alrededor de las siete áreas de Gruen.
Autores como Korovessis et al.19 y Sköldenberg et al.20 no encontraron correlación entre la edad y los cambios periprotésicos en la DMO. Otros autores consideran que la edad podría afectar al remodelado óseo femoral, sobre todo, en el área del trocánter mayor y en el área cuatro21.
También se ha señalado, que las zonas de Gruen dos y seis podrían estar afectadas por el género22 y que el índice de masa corporal podría influir en la DMO en el área tres21.
En nuestro estudio, al valorar la influencia de la edad en la variación de DMO, nuestros resultados muestran que en los pacientes jóvenes, en principio con mejor calidad ósea y fémures más rígidos, el remodelado es más uniforme, con variaciones de DMO que, en varias zonas son algo menores que en pacientes de mayor edad, pero sin significación estadística. Además, al ser pacientes con mayor nivel de actividad física, muestran cambios remodelativos con mayor antelación con respecto a los pacientes más añosos, con tendencia a ser más sedentarios.
Al realizar el análisis estadístico comparativo, no se han encontrado diferencias entre ambos grupos de edad, probablemente debido a la relativa baja edad media de la población estudiada.
Al fijarnos en el efecto del IMC en el remodelado óseo, vemos que en los pacientes más delgados se observó una ligera tendencia a perder hueso de forma homogénea en las áreas estudiadas, excepto en la seis. Estas pérdidas observadas en un primer momento, probablemente sean fruto de la agresión quirúrgica, produciéndose una recuperación progresiva de la DMO en a lo largo del seguimiento como consecuencia del remodelado adaptativo alrededor de la prótesis.
En el grupo de los pacientes más obesos, al año de seguimiento, la DMO se refuerza en las zonas de carga dos y seis y en las zonas tres y cinco. Además, en el área siete se aprecia una pequeña pérdida. Este refuerzo de DMO en estas áreas es debido fundamentalmente a la mayor transmisión de cargas por parte de los pacientes con mayor IMC. Maloney et al.23 ya afirmó en su estudio que los pacientes con mayor peso tendían a conservar más hueso en las áreas distales con respecto a los de menor peso. Además, esta mayor transmisión de cargas en fémur proximal podría explicar la menor desfuncionalización observada en el área siete en el grupo de los obesos con respecto al grupo de los delgados.
En cuanto al sexo, en conjunto, podemos apreciar que en los hombres, con fémures grandes y densos, con mayor DMO inicial, los cambios en el remodelado se producen de forma gradual. En cambio, en las mujeres, con fémures más pequeños y menos densos, aparentemente, se aprecian mayores cambios resortivos a nivel proximal y distal en comparación con los varones. Tanto en hombres como en mujeres, el área siete queda desfuncionalizada. Sin embargo, no se han encontrado diferencias estadísticamente significativas entre ambos grupos, pudiendo concluir que el sexo no afecta a la remodelación ósea del fémur tras la implantación de una prótesis de cadera ANATO®. Nuestros resultados coinciden con los hallados en otros estudios21,24 en los que no se considera al sexo un factor predictor del patrón remodelativo.
Finalmente, en la variación del DMO con respecto a la cadera sana, podemos observar variaciones en la zona siete estadísticamente significativas al año de la intervención. Esta zona sufre una doble agresión durante el acto quirúrgico. Por un lado, durante la exposición del cuello y calcar femoral para identificar el punto de osteotomía, se produce una lesión del aporte vascular perióstico. Por otro, el trabajo de las fresas y las raspas para preparar el lecho para el vástago protésico, daña la circulación endostal. De este modo, la zona siete queda inicialmente devascularizada, y después parcialmente desfuncionalizada, explicando las pérdidas óseas observadas a ese nivel.
Diversos estudios demuestran la importancia de que se tenga en cuenta en el estudio los valores de la cadera sana contralateral, con el fin de describir el patrón de densidad de masa ósea considerado como control, y cómo varía éste a lo largo de un año, en función de las variables clínicas consideradas, excepto la intervención2,9-11,25.
Este estudio presenta algunas limitaciones:
- •
El seguimiento de nuestro estudio es relativamente corto, pudiendo esperar cambios atribuibles a la remodelación tardía a largo plazo. Sin embargo, la mayoría de estudios semejantes concluyen que la mayor parte del remodelado óseo ocurre en el primer año tras la implantación.
- •
Además, la muestra incluye un número más elevado de varones que de mujeres, por lo que los resultados pueden estar influenciados por esta proporción. Cabría considerar en los varones, con fémures más grandes, que las tallas utilizadas son más grandes y, por tanto, más rígidas, influyendo en los resultados obtenidos.
- •
Finalmente, la población estudiada es relativamente joven, por lo que en pacientes más añosos este patrón de remodelado podría ser diferente.
En conclusión, el vástago ANATO® permite una transmisión eficiente de cargas desde el vástago al fémur próximal. Únicamente en la zona siete se aprecia atrofia ósea significativa, atribuible inicialmente a la denervación y devascularización que sufre la zona durante la técnica quirúrgica9-11. Las diferencias de edad, IMC y sexo parecen no influir en la remodelación ósea en torno a este nuevo vástago.
Nivel de evidenciaNivel de evidencia ii.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesTodos los autores declaran no tener ningún conflicto de intereses, ni haber recibido financiación para realizar el estudio.