Recientemente se ha descrito una nueva modalidad de la técnica de implante de condrocitos autólogos sobre membrana de colágeno i/iii llamada HD-ACI (High Density Autologous Chondrocyte Implantation) que está basada en el aumento de la densidad celular. El objetivo de este trabajo fue estudiar la evolución clínica y la incidencia de la aparición de edema óseo en pacientes con lesiones de cartílago en la rodilla tratados con HD-ACI al año y a los 2 años de la intervención.
MétodosSe trata de un estudio retrospectivo en 40 pacientes con lesiones condrales grado iii-iv. Todos los pacientes fueron tratados con HD-ACI con una dosis celular de 5×106 condrocitos/cm2 de lesión. La percepción subjetiva de la mejora de los síntomas/funcionalidad se valoró mediante la escala del Comité Internacional de Documentación de la Rodilla (IKDC, International Knee Documentation Committee). La presencia de edema óseo se evaluó a los 6, 12 y 24 meses de seguimiento por resonancia magnética. Comité Internacional de Documentación de la Rodilla (IKDC)
ResultadosLos valores de IKDC mostraron una mejoría significativa a los 12 y 24 meses (p<0,001). La diferencia media de IKDC entre la visita basal y los 12 meses fue de 26,3 puntos y de 31,6 puntos a los 24 meses. El 27,5% de los pacientes presentaron edema óseo subcondral a los 2 años de seguimiento.
ConclusionesHD-ACI es un tratamiento efectivo y seguro que mejora el dolor, la percepción clínica y la funcionalidad de la articulación. No se ha encontrado correlación entre la presencia de edema óseo y la evolución clínica de los pacientes.
Recently, a new approach of autologous chondrocyte implantation technique (using as biomaterial a collagen type i/iii membrane) based on increasing cell density called HD-ACI (High Density Autologous Chondrocyte Implantation) has been described. The objective of this paper was to study the clinical outcome and incidence of subchondral bone oedema in patients with cartilage lesions in the knee treated with HD-ACI at 1-2 years of follow-up.
MethodsThis is a retrospective study performed with forty patients with chondral injuries grade iii-iv. All patients were treated with HD-ACI with a cellular dose of 5×106 chondrocytes /cm2 of lesion. The subjective perception of improvement of symptoms and functionality was measured with the IKDC score (International Knee Documentation Committee). The presence of bone oedema was assessed at 6, 12 and 24 months of follow-up by magnetic resonance imaging.
ResultsIKDC values showed a significant improvement at 12 and 24 months (P<.001). The mean difference of IKDC between the baseline visit and 12 months was 26.3 points, and 31.6 points at 24 months. Twenty-seven point five percent of the patients presented subchondral bone oedema at 2 years of follow-up.
ConclusionsHD-ACI is an effective and safe treatment that improves pain, clinical perception and functionality of the joint. No correlation was found between the presence of bone oedema and the patients’ clinical outcome.
En el año 2018 se han cumplido 24 años de la aplicación de técnicas de Medicina Regenerativa, concretamente de Terapia Celular para el tratamiento de lesiones de cartílago articular. Desde que en el año 1743 Hunter1 afirmara que el cartílago, una vez dañado, es imposible repararlo, la visión predominante de la traumatología ante este problema ha sido bastante pesimista. En los últimos años han ido surgiendo técnicas encaminadas a reparar las lesiones focales del cartílago articular2 como son las de sustitución (mosaicoplastia)3 o las de estimulación (microfracturas y perforaciones)4 basadas estas últimas en la estimulación de las células mesenquimales de la médula ósea subyacente. Mediante la técnica de mosaicoplastia se puede llegar a resolver el problema cuando el defecto condral es pequeño (menor de 1cm de diámetro) y se requiere un solo cilindro para la reparación. Cuando el defecto es mayor es preciso utilizar más de un cilindro y se puede llegar a formar un tejido fibrocartilaginoso entre los cilindros, incapaz de conferir al cartílago reparado sus características biomécanicas. Por otro lado, los métodos de estimulación no resuelven el problema a largo plazo ya que conducen a la formación de un tejido de reparación fibrocartilaginoso, rico en colágeno tipo i que no puede restaurar las funciones de un tejido altamente especializado como el cartílago articular (cartílago hialino con alto contenido en colágeno de tipo ii)2.
No fue hasta finales del siglo pasado, concretamente en 1994, cuando Brittberg et al.5 describieron la utilización del condrocito como agente terapéutico y abrieron de manera clara las puertas de la Medicina Regenerativa al tratamiento efectivo de estas lesiones. La Medicina Regenerativa trata de restablecer la función propia del órgano, sustituyendo las células dañadas por células sanas, de modo que la causa subyacente desaparezca y se restituya la función original del órgano indefinidamente. Hoy en día, el implante de condrocitos autólogos (ACI) es la única terapia celular capaz de generar cartílago hialino6. Se han publicado muchos datos sobre los beneficios clínicos a largo plazo de este tratamiento7–9. La técnica ACI está basada en el aislamiento de condrocitos sanos a partir de una biopsia de cartílago tomada del paciente de una zona de no carga, que posteriormente se cultivan e implantan en la región de cartílago dañada, donde contribuyen a su regeneración. En la técnica original de ACI se empleaba una suspensión de 20 millones de condrocitos cultivados in vitro que se implantaban en la lesión de cartílago (independientemente de su tamaño) bajo un parche de periostio. A pesar de sus buenos resultados, en algunos casos la técnica presenta algunos problemas ya que al encontrarse las células en medio líquido hacen que su manejo sea complicado y el procedimiento quirúrgico sea dificultoso. Además el empleo de periostio a veces conlleva una cirugía de rescate ya que al ser un tejido vivo puede dar lugar a un crecimiento hipertrófico e incluso delaminación del tejido neoformado10. Ante la dificultad de la técnica ACI y la morbilidad asociada, se comenzó a desarrollar una segunda generación del procedimiento, utilizando una membrana de colágeno que actúa como un soporte biológico sobre la cual están integrados los condrocitos, naciendo de esta manera el MACI (del inglés Membrane-based Autologous Chondrocyte Implantation)11. Una de las ventajas de la incorporación de la membrana es que la técnica se puede realizar por vía artroscópica y en un alto porcentaje de los casos se alcanza una regeneración total de la superficie articular, mediante la formación de cartílago hialino, rico en colágeno tipo ii12. En la técnica MACI la densidad celular empleada es de un millón de condrocitos cultivados por cm2 de lesión. Por tanto, según el tamaño de la lesión el número de células implantadas es distinto y menor que el que se implantaba con ACI. Recientemente se ha descrito un nuevo método de ACI, HD-ACI (del inglés; high density autologous chondrocyte implantation)13,14 que utiliza también una membrana de colágeno como transportador pero a una densidad celular 5 veces mayor. En HD-ACI, durante la segunda cirugía se mide la lesión y se recorta la membrana de acuerdo al tamaño y forma de la misma. Los condrocitos cultivados se siembran en la membrana a una densidad de 5 millones de células por cm2 de lesión y la membrana con los condrocitos se fija al defecto. En este sentido, Guillen-García et al.13 compararon las características histológicas y moleculares del tejido reparado después del tratamiento de lesiones de cartílago con MACI o HD-ACI en el modelo animal de la oveja. Los resultados histológicos mostraron que el tejido neoformado después de HD-ACI fue más similar en cuanto a su estructura, celularidad y organización al tejido control (cartílago normal) que el tejido sintetizado después del tratamiento con MACI. Además, los niveles de expresión de colágeno tipo ii y agrecano tras HD-ACI fueron más cercanos a los niveles de expresión del cartílago control que los encontrados tras MACI13. Resultados observados en pacientes tratados con HD-ACI en lesiones en el cartílago articular de la rodilla mostraron que la técnica es eficaz y segura, con buena evolución en cuanto al dolor y la movilidad14. Además, en cuanto a la percepción subjetiva de la funcionalidad de la rodilla, medida por el índice del Comité Internacional de Documentación de la Rodilla (IKDC, International Knee Documentation Committee) se encontró una mejora estadísticamente significativa al año y a los 2 años de seguimiento por lo que el aumento de la densidad celular parece indicar una mejora en los pacientes14.
Una de las complicaciones más comunes después del ACI es la presencia de edema óseo15. El edema óseo es un proceso inflamatorio que se produce cuando tras una sobrecarga o un traumatismo se produce una lesión en el hueso. Como respuesta del hueso se genera un infiltrado inflamatorio en la zona medular procedente de los vasos sanguíneos presentes en el hueso esponjoso. Dicho infiltrado presiona contra las terminaciones nerviosas irritándolas y produciendo dolor. A menudo es causado por una respuesta a una lesión, una fractura ósea o una contusión. Aunque el edema óseo puede estar presente en diferentes articulaciones, ocurre más comúnmente en las rodillas y, en este caso, es la causa principal del dolor localizado de rodilla y articulación y solo se puede diagnosticar mediante la prueba de imagen de resonancia magnética (RM).
El porcentaje de pacientes con edema óseo tras el implante de condrocitos (según lo publicado tras ACI en medio líquido o MACI) es muy dispar según los diferentes autores15,16 y oscila entre el 50% y el 79%. Se ha publicado que el edema óseo está presente durante las primeras fases de la maduración del cartílago hasta los 2 años de seguimiento, luego tiende a desaparecer y, en algunos casos, vuelve a aparecer después de algunos años15,17. En este trabajo estudiamos la incidencia en la aparición de edema óseo en 40 pacientes con lesiones de cartílago articular en la rodilla tratados con la técnica HD-ACI y su correlación con el resultado funcional de la rodilla al año y a los 2 años del tratamiento.
Pacientes y métodosEn este estudio retrospectivo se han incluido una serie de 40 pacientes que presentaban lesiones en el cartílago en la rodilla y que fueron tratados con HD-ACI en nuestro hospital. Todos los pacientes firmaron un consentimiento informado, el estudio se llevó a cabo siguiendo los principios dictados en la Declaración de Helsinki para la investigación médica en seres humanos y fue aprobado por el Comité de Docencia e Investigación del Hospital. Los criterios de inclusión/exclusión del estudio se recogen en la tabla 1. A todos los pacientes se les tomó una biopsia de cartílago de una zona de no-carga. Las muestras extraídas se introdujeron en medio de cultivo DMEM (Lonza Group Ltd., Basilea, Suiza) y se procesaron antes de 24h en un laboratorio con acreditación GMP (Good Manufacturing Practices) aprobado y certificado por la Agencia Española del Medicamento y Productos Sanitarios. Para el aislamiento de los condrocitos, las biopsias de cartílago fueron digeridas a 37°C con agitación durante 16h en una solución 1mg/ml de colagenasa A (Roche Diagnostics GmbH, Mannheim, Alemania). Una vez aisladas, las células se cultivaron en monocapa en DMEM completo (10% de suero autólogo, L-glutamina y penicilina-estreptomicina) y se incubaron a 37°C, con un 5% de CO2 y un 95% de humedad relativa. Una vez que el cultivo alcanzó el 80% de confluencia, las células se separaron de la base del recipiente de cultivo con tripsina-EDTA (Hyclone Utah, EE. UU.). Las células se contaron en cámara Neubauer mediante el método de exclusión Azul-Tripan. Se congeló una alícuota de células (muestra de retención) en este punto y se almacenó en N2 líquido como una muestra de seguridad del cultivo. Las células restantes se subcultivaron un máximo de 3 pases hasta que se obtuvieron 40-50 millones de células.
Criterios de inclusión/exclusión del estudio
| Criterios de inclusión | Criterios de exclusión |
|---|---|
| • Edad entre 18 y 55 años• De 1 a 4 lesiones condrales en rodilla diagnosticadas mediante pruebas de imagen (RX, RM, artro-RM)• Lesiones grado iii-iv Outerbridge• Tamaños entre 1cm2 y 4cm2 de superficie | • Presencia de artrosis• Desalineación de la extremidad (más de 10° de varo o valgo)• Lesiones de menisco• Alergia a penicilina y/o estreptomicina• Hipersensibilidad a derivados bovinos• Infección activa• Patología tumoral, patología sistémica o autoinmune• Presencia de edema óseo objetivado en la RM basal |
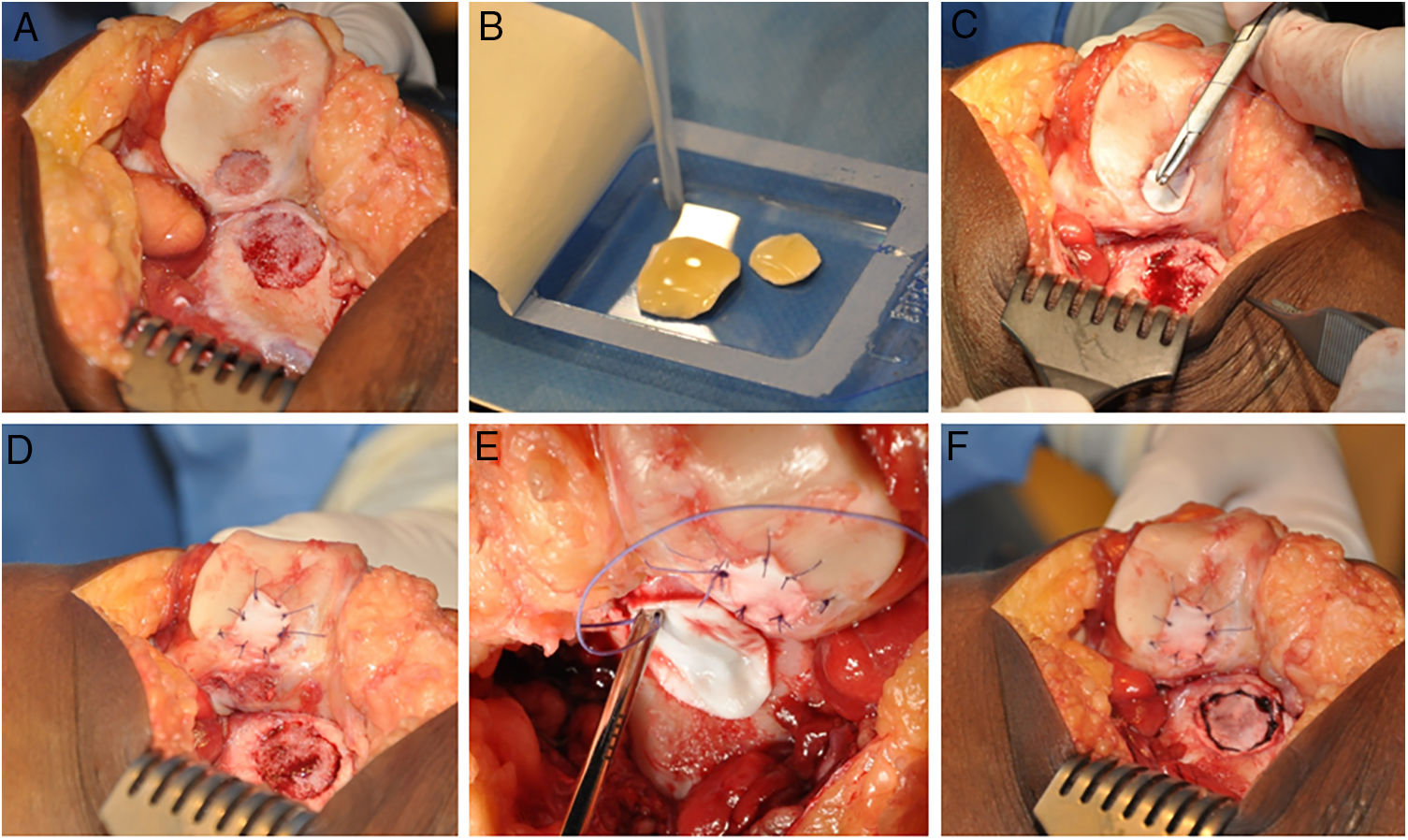
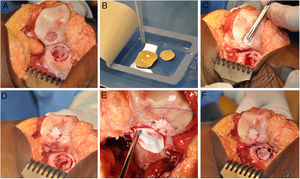
La técnica de HD-ACI utiliza como transportador de las células una membrana reabsorbible de colágeno i/iii de origen porcino (Chondro-Gide, Geistlich Biomaterials, Wolhusen, Suiza). En una segunda cirugía (la correspondiente al implante celular), cada defecto condral se desbrida con una cureta eliminando las áreas de cartílago inestable y dejando el cartílago estable, llegando hasta el hueso subcondral pero evitando dañar la superficie del mismo. Posteriormente se recorta la membrana según el tamaño y forma de la lesión. Los condrocitos cultivados se siembran en la membrana a una densidad de 5 millones de células/cm2 de superficie de lesión (fig. 1). Tras un periodo de espera de 10min13,14 (tiempo en el que las células son embebidas en la membrana) esta se coloca sobre el defecto y se sutura al cartílago adyacente y se sellan los extremos con Tissucol (Baxter, Madrid, España). Todas las intervenciones se realizaron por el mismo equipo de cirujanos.
Procedimiento quirúrgico HD-ACI (condrocitos autólogos de alta densidad) en un paciente que presenta 2 lesiones en la rodilla: rótula y cóndilo femoral externo (tróclea). Una vez que las lesiones de cartílago han sido desbridadas (A), los condrocitos cultivados se siembran en las membranas previamente recortadas según el tamaño y forma de las lesiones y se espera 10min a que las células sean absorbidas (B). Se coloca una de las membranas en la primera lesión y se sutura a cartílago adyacente (C y D). A continuación se procede a la colocación y sutura de la otra membrana en la segunda lesión (E y F).
La percepción subjetiva del paciente de la mejora de los síntomas y funcionalidad de la rodilla se midió con el cuestionario IKDC en la visita basal, al año y a los 2 años de seguimiento. La presencia de edema óseo se evaluó a los 6, 12 y 24 meses de seguimiento por RM. Todos los pacientes tenían una RM basal. Asimismo, el dolor se evaluó con la escala visual analógica a nivel basal y en los mismos periodos de seguimiento que la presencia de edema óseo.
El análisis estadístico se realizó utilizando el programa IBM SPSS, versión 22.0.0 (Nueva York, EE. UU.). Las variables cuantitativas se expresaron como la media o la mediana como medida de tendencia central. La dispersión de estas variables se expresó como la desviación estándar o los valores mínimo y máximo. La normalidad de las variables cuantitativas se verificó con el test Kolmogorov-Smirnov. La comparación de los valores de las variables cuantitativas en los distintos momentos del seguimiento se llevó a cabo utilizando el test no paramétrico de Friedman para muestras relacionadas. Las comparaciones por pares se realizaron utilizando la prueba de rango con signo de Wilcoxon para muestras relacionadas. La distribución de variables continuas entre los pacientes con o sin edema óseo se comparó utilizando la prueba de la U de Mann Whitney. Las variables categóricas se expresaron con la frecuencia absoluta y el porcentaje. La evolución de estas variables a lo largo del periodo de seguimiento se estudió mediante tablas cruzadas, cuya significación estadística se determinó mediante la prueba de la χ2 de Pearson. Todos los contrastes de hipótesis fueron bilaterales y se consideró estadísticamente significativo un valor de p<0,05.
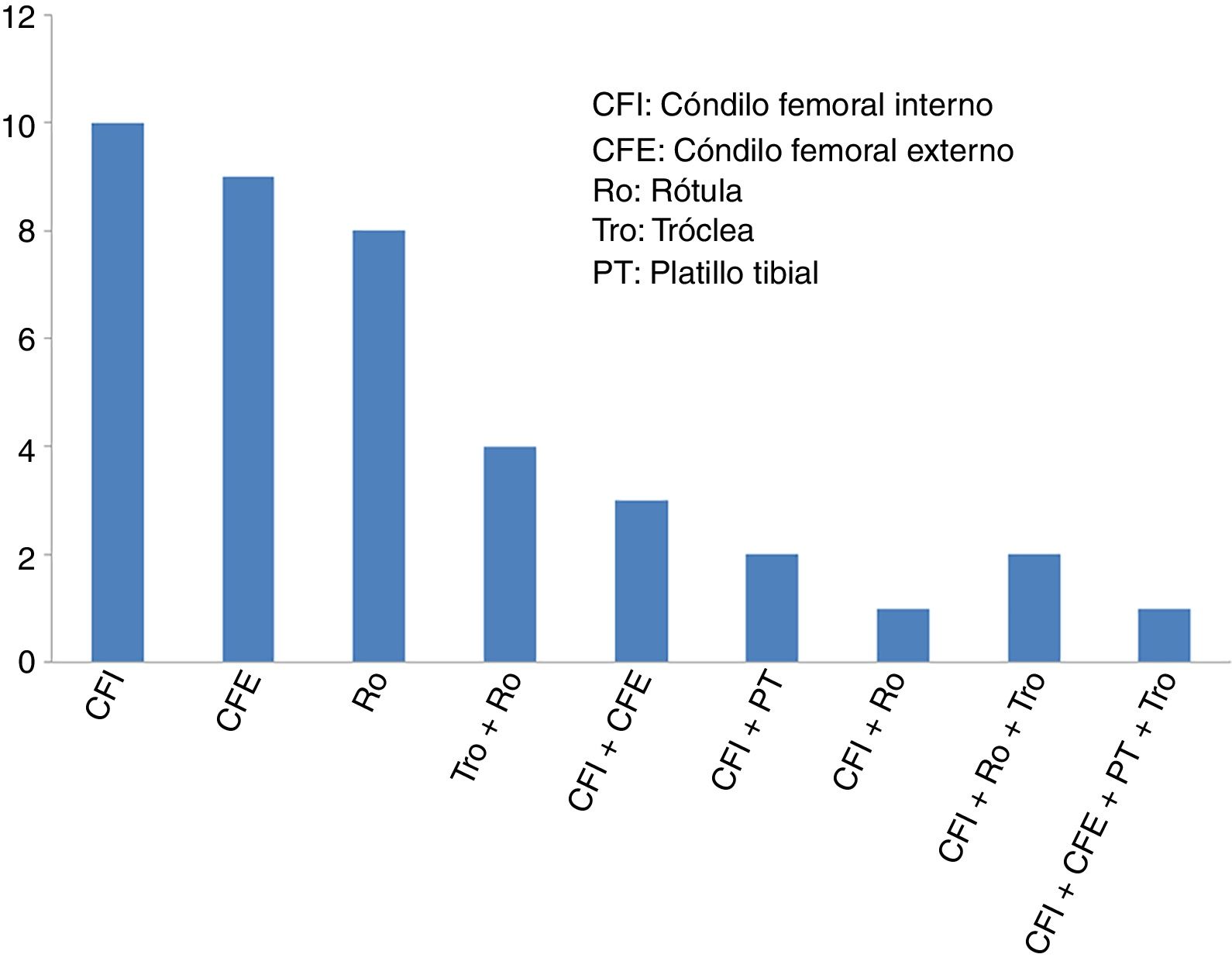
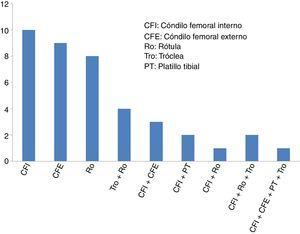
ResultadosLa edad media de los 40 pacientes incluidos (27 hombres y 13 mujeres) fue de 34,2±9,6 años (media±desviación estándar) y el diagnóstico más frecuente fue lesión condral. La mayoría de los pacientes (29 de 40 casos: 72,5%) presentaban cirugías previas en la rodilla, antes de someterse a la cirugía de implante de condrocitos de alta densidad HD-ACI. En algo más de la mitad de estos pacientes con cirugías de rodilla previas (17 de 29 casos: 58,6%), estas se debieron a problemas de cartílago. Las cirugías de cartílago de rodilla que presentaban estos pacientes antes de someterse al implante HD-ACI correspondían a técnicas de estimulación de la médula ósea (perforaciones/microfracturas). La mediana del tamaño de las lesiones de cartílago que presentaban los pacientes era 5cm2 (mínimo: 1,4 – máximo: 10,5). Veintisiete pacientes tenían solo una lesión (68%), 10 pacientes 2 lesiones (25%), 2 pacientes presentaban 3 lesiones (5%) y solo uno tenía 4 lesiones (2%). La localización de las lesiones dentro de la articulación se muestra en la figura 2. En la mayoría de los casos (27 pacientes) la intervención para el implante celular se realizó mediante cirugía abierta. El tiempo transcurrido entre la obtención de la biopsia y el implante de condrocitos osciló entre 8 y 24 semanas.
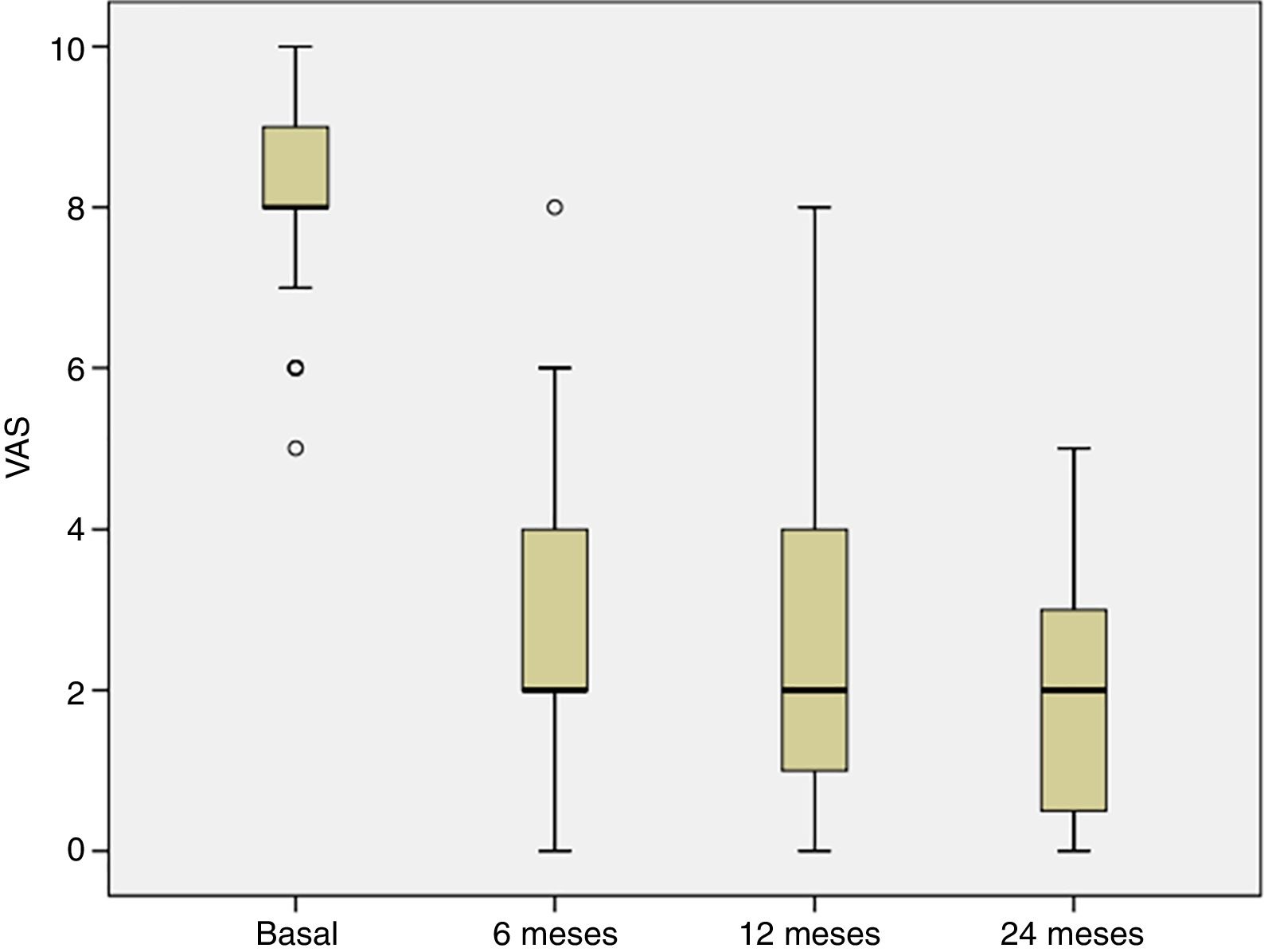
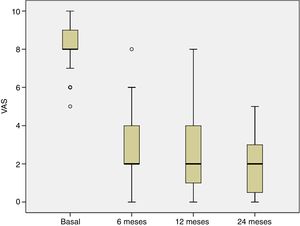
La evolución del dolor se estudió desde la visita basal hasta los 6, 12 y 24 meses postratamiento. En la visita basal, todos los pacientes sufrieron dolor y el porcentaje de pacientes con dolor disminuyó significativamente a los 6 meses del tratamiento y esta mejoría se mantuvo en las siguientes visitas del seguimiento (p<0,001) (fig. 3),
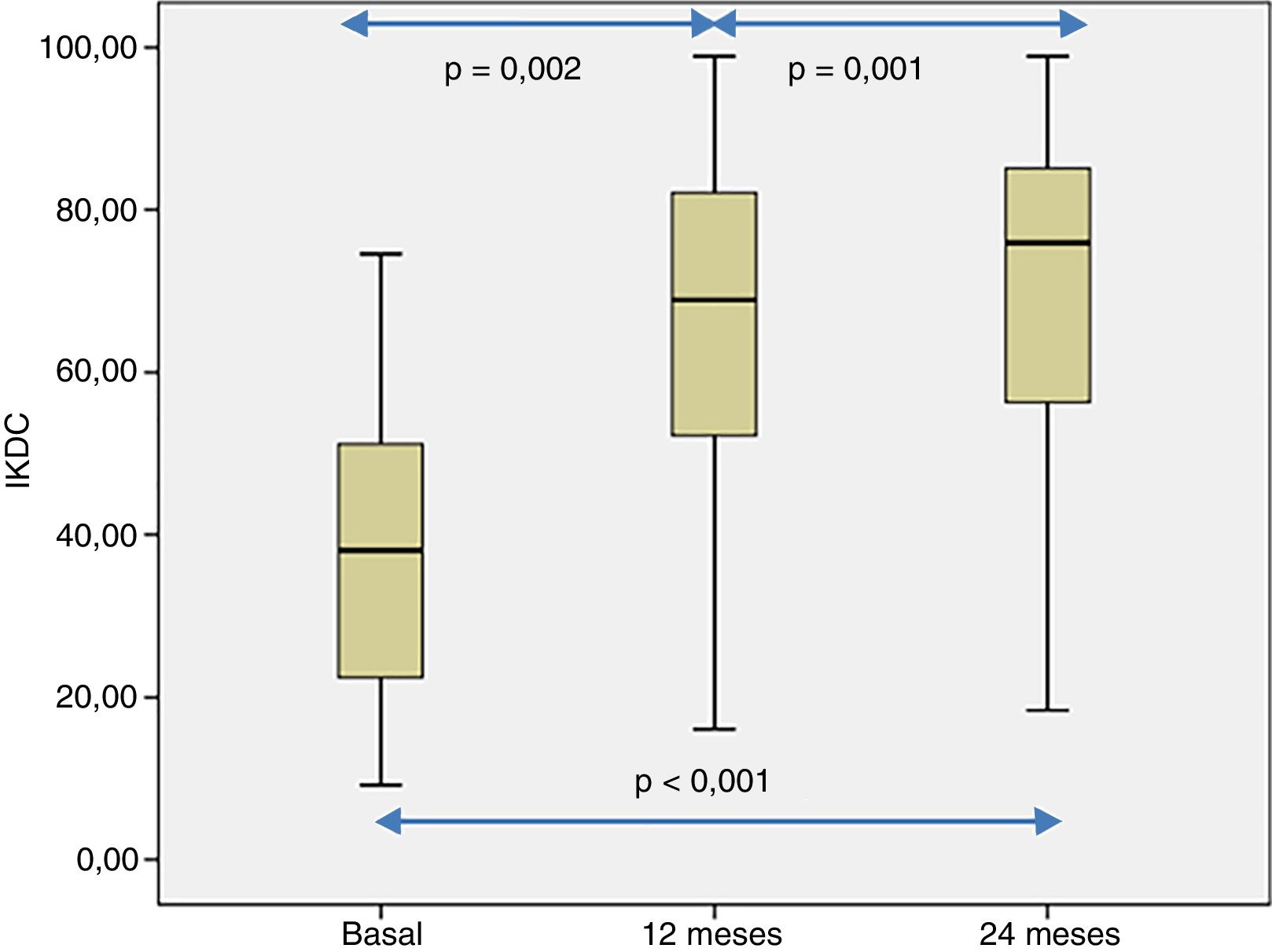
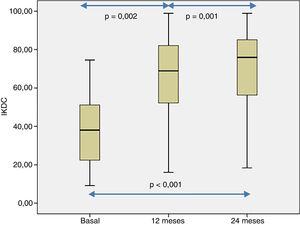
La percepción subjetiva del paciente de la funcionalidad de la rodilla, medida con el cuestionario IKDC, mostró una mejoría significativa cuando se compararon las visitas basales, 12 y 24 de seguimiento (p<0,001) (fig. 4). Las puntuaciones de IKDC mejoraron progresivamente desde la visita basal hasta el seguimiento de 24 meses (p<0,002) (fig. 4). En todos los casos se estimó la diferencia media en la puntuación IKDC entre la visita basal y los periodos de seguimiento (12 y 24 meses) que el paciente percibe como clínicamente relevante. Así, la diferencia media de la puntuación de IKDC entre la visita basal y los 12 meses de seguimiento fue de 26,3 puntos (IC del 95%: 17,6-35 puntos) y de 31,6 puntos (IC del 95%: 22,8-40,3 puntos) con respecto a los 24 meses del tratamiento con HD-ACI.
Valores de la escala IKDC a nivel basal, a los 12 y 24 meses de seguimiento de los 40 pacientes incluidos en este estudio. La distribución de los valores de IKDC fue estadísticamente diferente en los 3 puntos analizados (p<0,001). Las comparaciones por pares también fueron estadísticamente significativas.
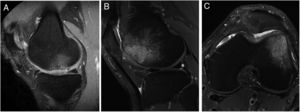
La presencia de edema óseo se evaluó por RM en los 40 pacientes incluidos en el estudio (fig. 5). De acuerdo con los criterios de inclusión/exclusión del estudio, ninguno de los pacientes presentaba edema óseo en la RM basal. Los resultados de RM mostraron muy poca variación en el número de pacientes que mostraban edema óseo a los 6 meses (9 pacientes), 12 meses (10 pacientes) y a los 24 meses (11 pacientes) del implante celular de alta densidad HD-ACI. Asimismo, no se encontraron diferencias estadísticas cuando se compararon los 3 periodos de tiempo (p=0,223). No se hallaron diferencias estadísticamente significativas en el número de cirugías previas entre los pacientes con o sin edema a los 6 (p=0,406), 12 (p=0,701) y 24 meses (p=0,455) (mediana [mínimo-máximo]: una cirugía previa [0-5 cirugías] en los pacientes con edema frente a una cirugía previa [0-4 cirugías] en los pacientes sin edema a los 6, 12 y 24 meses). Tampoco hubo diferencias significativas en el número de lesiones entre los pacientes con o sin edema a los 6 (p=0,371), 12 (p=0,233) y 24 meses (p=0,139) (una lesión [1-3 lesiones]) en los pacientes con edema frente a una lesión [1-3 lesiones] en los pacientes sin edema en los 3 momentos del seguimiento). Por último, tampoco se encontraron diferencias significativas en el tamaño de lesiones entre los pacientes con o sin edema a los 6 (p=0,503), 12 (p=0,939) y 24 meses (p=0,720) (4cm2 [1,2-10,5cm2] en los pacientes con edema frente a 4,6cm2 [1,5-8cm2] en los pacientes sin edema a los 6, 12 y 24 meses).
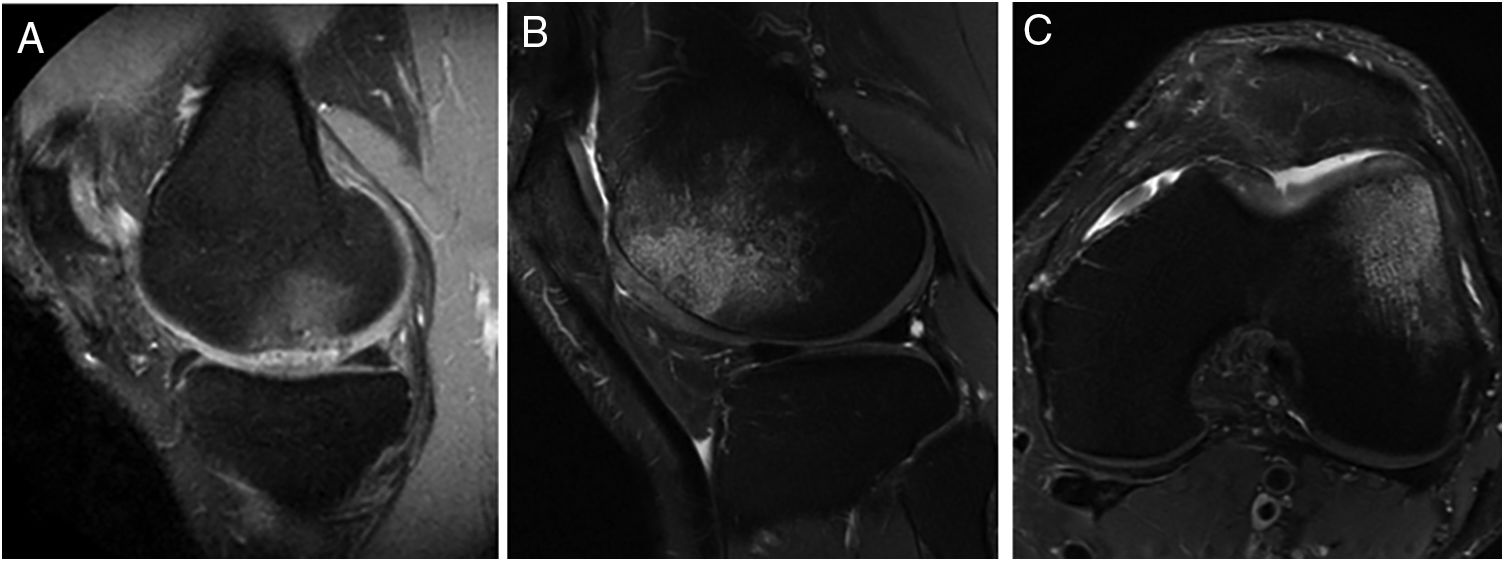
Imágenes representativas de RM que muestran la aparición de edema óseo subcondral en 2 pacientes después de 12 meses (A) y 24 meses (B y C) del tratamiento con implante de condrocitos autólogos de alta densidad (HD-ACI). A) Edema subcondral en zona de carga de cóndilo femoral interno, con menisco integro e irregularidad en hueso subcondral (corte sagital). Corte sagital (B) y corte axial (C) de imágenes de RM de un paciente con edema óseo en el cóndilo femoral externo (tróclea) en las que se observa una buena integración del implante de condrocitos con el hueso subcondral.
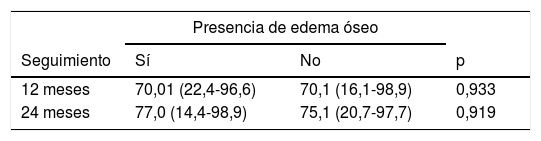
Para estudiar si existía relación entre la presencia de edema óseo y la evolución clínica de los pacientes, se compararon los valores de la escala IKDC entre los pacientes que presentan edema óseo frente a los que no, a los 12 y 24 meses del tratamiento con HD-ACI (tabla 2). No se encontraron diferencias significativas entre los 2 grupos en ninguno de los periodos de seguimiento (p=0,933 a los 12 meses; p=0,919 a los 20 meses). Asimismo, no existía correlación con la presencia de edema óseo y la diferencia media en los valores IKDC a los 12 meses (p=0,959; coeficiente de correlación de Spearman=−0,009) y a los 24 meses (p=0,867; coeficiente de correlación de Spearman=−0,029) con respecto a la visita basal. En todos los pacientes incluidos se observó que la zona del implante en las RM de seguimiento mostraron una señal homogénea y continua, compatible con una correcta integración del implante en todos los casos.
Comparación de los valores de IKDC expresados como la mediana (mínimo-máximo) entre los pacientes que presentan o no edema óseo a los 12 y 24 meses del tratamiento con HD-ACI
| Presencia de edema óseo | |||
|---|---|---|---|
| Seguimiento | Sí | No | p |
| 12 meses | 70,01 (22,4-96,6) | 70,1 (16,1-98,9) | 0,933 |
| 24 meses | 77,0 (14,4-98,9) | 75,1 (20,7-97,7) | 0,919 |
En este trabajo describimos el resultado clínico de 40 pacientes con lesión de cartílago articular en la rodilla tratados con implante de condrocitos de alta densidad, HD-ACI, y su relación con la incidencia de la aparición de edema óseo subcondral. El dolor mostró una mejoría significativa a los 6 meses (media: 2,8±1,8) después de la intervención con respecto a la visita basal (8,2±1,1), que se mantuvo a los 12 (2,3±2,1) y 24 meses (2,1±1,8) del seguimiento. En el mismo sentido, el índice IKDC aumentó progresivamente desde la visita basal (mediana: 39,9 [9,8-77,3]) hasta los 12 (70,1 [19,3-97,8]) y los 24 meses (76,1 [17,6-98,3]), indicando que la percepción subjetiva del paciente sobre la funcionalidad de sus rodillas mejoró con el tratamiento. Se ha publicado la relación entre la mejora clínica que percibe el paciente y la diferencia media en la puntuación IKDC entre la visita basal y los 12 meses de seguimiento, cuyo valor se ha estimado en 16,7 puntos18. Este valor, denominado diferencia mínima clínicamente relevante, significa que por encima del mismo los pacientes perciben una mejoría clínica real 12 meses después del tratamiento con condrocitos autólogos. En nuestros pacientes se observa una mejora media en los valores de IKDC de 26,3 puntos a los 12 meses y de 31,6 puntos a los 24 meses, lo que significa que en nuestro caso los pacientes perciben esa diferencia como una mejoría real a los 12 y 24 meses, con respecto a la situación basal. Estos resultados están en consonancia con los encontrados por otros autores en pacientes tratados con ACI en suspensión o con MACI19,20.
El edema de hueso subcondral es un hallazgo común después del tratamiento del cartílago, pero su interpretación todavía se debate. En el presente trabajo, en el que se incluyeron pacientes sin edema óseo en la visita basal, el porcentaje que presentaron edema óseo tras el tratamiento con HD-ACI fue muy similar a los 6 (22,5%), a los 12 (25%) y a los 24 meses (27,5%). Diversos autores refieren una elevada y a la vez heterogénea incidencia de edema óseo tras la intervención de implante de condrocitos. La incidencia de edema óseo al año de tratamiento con ACI en suspensión oscila entre un 47-56%15,21 mientras que con MACI se eleva hasta un 78%16 aunque en ningún caso los autores encontraron una correlación con una peor evolución clínica. En otros estudios de tratamiento con MACI con periodos de seguimiento mayores se han encontrado unos valores de incidencia de edema óseo subcondral muy similares que van desde el 47% a los 5 años22 de seguimiento al 65,2% a los 10 años23 de la intervención.
Para valorar este aspecto Filardo et al.17 realizaron un estudio sobre 116 pacientes afectados por lesiones de cartílago en la rodilla. El seguimiento por RM se realizó desde los 6 meses hasta los 9 años postratamiento por MACI. La puntuación subjetiva IKDC se recogió en el momento de cada RM. Los autores concluyeron que el edema después del tratamiento se presentó durante las primeras fases de la maduración del cartílago hasta 2 años de seguimiento, luego se redujo notablemente a los 2 y 3 años. Posteriormente, el nivel de edema aumentó nuevamente y permaneció constante en el seguimiento a medio/largo plazo. Al igual que ocurría en periodos de seguimiento más cortos15,16,21, la presencia de edema no se correlacionó con un peor resultado clínico. En nuestro estudio encontramos un llamativo menor porcentaje de edema óseo tras el tratamiento con HD-ACI (25% al año; 27,5% a los 2 años) del publicado por otros autores15–17,21–23. Esto podría ser debido al incremento en la densidad celular en la técnica HD-ACI, lo cual podría dar lugar a un aumento de la densidad de la matriz extracelular, y por lo tanto, a la formación de un tejido neoformado con mayor similitud al cartílago hialino que restablezca las propiedades biomecánicas de este, protegiendo al hueso subcondral del edema gracias a su mayor dureza. Respecto a la relación entre la incidencia del edema subcondral y la mejora de los síntomas y funciones de la rodilla percibida por nuestros pacientes, se observa que a los 12 meses postimplante los pacientes que presentan edema tienen el mismo valor de IKDC (70,1) que los que no. Valores muy similares (75,1 frente 77) son observados a los 2 años de seguimiento. Asimismo, no hay correlación con la presencia de edema óseo y la diferencia media en los valores IKDC a los 12 y a los 24 meses. Al igual que el resto de autores15–17,21 en nuestros pacientes tampoco encontramos una correlación entre la presencia de edema óseo y la evolución clínica de los mismos.
Aunque nuestros resultados indican que no parece haber ninguna relación entre la aparición de edema óseo y una peor evolución clínica, diversas publicaciones indican que esto podría no ser así para otras patologías. En especial, existen algunas patologías en las cuales la presencia de edema óseo predispone para una peor evolución de la patología subyacente24–27 e incluso podría condicionar la progresión hacía artrosis24, especialmente en mujeres con lesiones condrales de espesor completo28. Los pacientes incluidos en este estudio tienen una edad media (34,2±9,6) similar a la que presentan pacientes de otros estudios14,29. Este periodo de edad coincide con uno de los periodos más activos de la vida, en el que el daño del cartílago de la articulación de la rodilla debido al ejercicio físico o a lesiones traumáticas es altamente frecuente2,14. En más de la mitad de nuestros pacientes, HD-ACI no fue la primera opción de tratamiento para tratar sus defectos del cartílago, ya que fueron tratados con técnicas de estimulación de la médula ósea como perforaciones o microfracturas. Estas técnicas, junto con otras como la mosaicoplastia, se recomiendan principalmente para tratar los defectos del cartílago menores de 1cm2, y en la práctica habitual el implante de condrocitos (en cualquiera de sus modalidades) se considera como una técnica de rescate cuando las técnicas anteriores fallan. De hecho, los defectos de los pacientes incluidos en este estudio son lesiones focales con un tamaño medio superior a 1cm2 por lo que se convirtieron en candidatos para recibir un implante de condrocitos siguiendo nuestros propios criterios y los publicados por otros autores14,30. Más de la mitad de nuestros pacientes (27 de 40) se sometieron a una cirugía abierta. Este número relativamente alto de pacientes se relaciona con el número de pacientes que tienen más de una lesión o con la ubicación de los defectos del cartílago, lo que para nosotros constituye una indicación para la realización de cirugía abierta.
En nuestra Unidad, llevamos 22 años utilizando técnicas de Terapia Celular para el tratamiento de estas lesiones en rodilla y en tobillo bien con ACI líquido (152 pacientes)9 o el MACI (174 pacientes)12 habiendo realizado nuestro primer implante en el año 199631. Recientemente, López-Alcorocho et al.14 han publicado resultados a 2 años de seguimiento en 50 pacientes tratados con la técnica de HD-ACI sobre membrana de colágeno en lesiones en el cartílago articular de la rodilla. Los resultados de este trabajo indican que la percepción subjetiva de la funcionalidad de la rodilla, medida mediante la escala IKDC, la presencia de dolor así como el rango de movilidad (grados de flexión y de extensión) mejoraron significativamente a los 12 y a los 24 meses de seguimiento. Estos resultados junto con la ausencia de eventos adversos demuestran que el HD-ACI es una técnica es eficaz y segura.
La principal limitación del presente estudio es su carácter retrospectivo y la ausencia de grupo control. En este sentido, un estudio prospectivo en el que se estudiara la evolución del edema óseo en pacientes con o sin esta patología en su visita basal podría revelar de manera más clara el papel de esta patología. Sin embargo, el objetivo de nuestro estudio era determinar la incidencia de la aparición edema tras el tratamiento que en nuestro hospital se considera como estándar para este tipo de lesiones y su relación con la evolución clínica. El diseño del presente estudio permite contestar esta pregunta, aunque no se descarta el diseño comparativo para un futuro.
Tomando en conjunto todos nuestros resultados, podemos concluir que la incidencia del edema óseo es del 22,5-27,5% en nuestros pacientes tratados con la técnica HD-ACI para las lesiones de cartílago articular de más de 1cm2. No se observa correlación entre la presencia de edema óseo y la evolución de los parámetros clínicos como el dolor, la funcionalidad subjetiva de la rodilla y la movilidad.
Nivel de evidenciaIII.
FinanciaciónEste trabajo ha sido financiado por la Fundación Dr. Pedro Guillén.
Conflicto de interesesNinguno de los autores tiene conflicto de intereses.