Describir la mortalidad y las complicaciones de pacientes atendidos en urgencias, con diagnóstico de infección necrosante de partes blandas (INPB) y su correlación con la escala Laboratory Risk Indicator for Necrotizing Fasciitis (LRINEC).
MétodoEstudio observacional retrospectivo con inclusión de pacientes con diagnóstico de INPB en urgencias de un hospital terciario durante 7 años. Los resultados se muestran como mediana, rango intercuartílico y rango absoluto para las variables cuantitativas. En el caso de las variables cualitativas, como frecuencias absoluta y relativa. La comparación se ha llevado a cabo mediante comparación post-hoc a partir de un análisis ANOVA con aproximación no paramétrica. Las comparaciones entre grupos de LRINEC en las variables cualitativas se han realizado con la prueba exacta de Fisher.
ResultadosSe identificaron 24 pacientes con edad media de 51,9 años. La escala LRINEC se determinó en 21 pacientes: en 10 indicó bajo riesgo (<6), en 4 riesgo intermedio (6 o 7) y en 7 alto riesgo (≥8). La tasa de amputación en riesgos bajo, intermedio y alto fue del 10, 25 y 66%, respectivamente, con una mortalidad del 4,2%. Se observa un aumento en la estancia hospitalaria entre los niveles bajo y alto de la escala (p=0,007).
ConclusionesEn general no se ha podido constatar un cambio en el pronóstico entre los niveles medio y alto de la escala LRINEC. Pero sí entre la estancia hospitalaria entre el nivel bajo y el alto, triplicando prácticamente la mediana de días de estancia hospitalaria.
To describe mortality and complications of patients seen in the emergency room, diagnosed with necrotizing soft tissue infection (NSTI) and the correlation of such complications with the Laboratory Risk Indicator for Necrotizing fasciitis scale (LRINEC).
MethodsRetrospective observational study including patients with a diagnosis of NSTI in the emergency room of a tertiary hospital over 7 years. The results are shown as median, interquartile range and absolute range for quantitative variables. In the case of qualitative variables, the results are shown as absolute and relative frequency. The comparison between the categories of the LRINEC scale was performed through a post-hoc comparison from a non-parametric ANOVA analysis. Comparisons between LRINEC groups in the qualitative variables were performed using Fisher's Exact test.
Results24 patients with a mean age of 51.9 years were identified. The LRINEC scale was used on 21 patients: in 10, the value indicated low risk (<6), in 4 it indicated intermediate risk (6 or 7) and in 7 it indicated high risk (≥8). The amputation rate in patients with low, intermediate and high risk was 10%, 25% and 66% respectively with a mortality of 4.2%. There was an increase in hospital stay between the low and high level of the scale (p=0,007).
ConclusionsIn general, a change in the prognosis between the medium and high levels of the LRINEC scale could not be recorded, but was recorded in hospital stay between the low and the high level, practically tripling the median of days of hospital stay.
La infección necrosante de piel y partes blandas (INPB) es una entidad que se caracteriza por la necrosis de la piel, tejido celular subcutáneo, fascia, músculo o varias de las estructuras citadas al mismo tiempo, que progresa muy rápidamente, comprometiendo la viabilidad de la extremidad, e incluso la vida del paciente1-3. Se trata de una infección poco frecuente, pero tiene aún hoy día una elevada morbimortalidad que se podría reducir mediante el diagnóstico y tratamiento precoz4,5. Sin embargo, en fases iniciales es muy difícil de distinguir entre una INPB y una celulitis. La escala Laboratory Risk Indicator for Necrotizing Fasciitis (LRINEC) ha sido validada en un intento de diagnosticar precozmente una INPB y se basa en el valor de la hemoglobina, glucosa, proteína C reactiva (PCR), creatinina, natremia y cifra de leucocitos6,7. El objetivo del presente trabajo es describir la mortalidad y las complicaciones de los pacientes atendidos en urgencias, con diagnóstico de INPB y su correlación con la escala LRINEC.
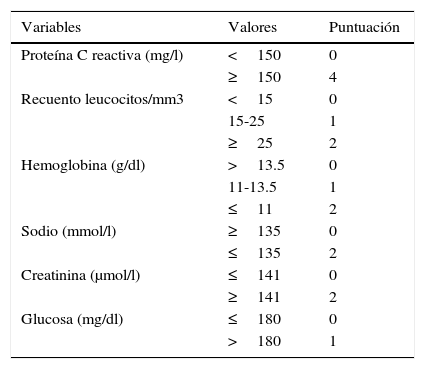
Material y métodosSe revisaron de manera retrospectiva las historias clínicas de todos los pacientes con el diagnóstico confirmado de INPB en una extremidad entre enero de 2001 y febrero del 2008 en nuestro centro. Se incluyeron en el estudio aquellos pacientes que, tras el diagnóstico clínico de sospecha de INPB en el servicio de urgencias, presentaron durante el desbridamiento hallazgos quirúrgicos característicos de infección necrosante: fascia desvitalizada de fácil disección digital entre planos o finger test, presencia de exudado purulento o en «agua de lavar platos» (dish-water pus), ausencia de sangrado y trombosis vascular regional y tuvieron un diagnóstico histopatológico de fascitis necrosante. Se recogieron los siguientes datos: edad, sexo, comorbilidad, localización de la infección, posible puerta de entrada de la infección, síntomas principales, analítica al ingreso, presencia de shock séptico, y el diagnóstico de sospecha al ingreso. Además, se determinó el tratamiento antibiótico al ingreso, el tiempo transcurrido entre la llegada del paciente a urgencias y el desbridamiento quirúrgico, la histología del tejido resecado, el número de intervenciones, el microorganismo aislado, la amputación o no de la extremidad, la estancia hospitalaria y la mortalidad. En todos los casos en los que se pudo disponer de los datos necesarios, se procedió al cálculo del valor de la escala LRINEC (tabla 1).
Escala Laboratory Risk Indicator for Necrotizing Fasciitis (LRINEC)
| Variables | Valores | Puntuación |
|---|---|---|
| Proteína C reactiva (mg/l) | <150 | 0 |
| ≥150 | 4 | |
| Recuento leucocitos/mm3 | <15 | 0 |
| 15-25 | 1 | |
| ≥25 | 2 | |
| Hemoglobina (g/dl) | >13.5 | 0 |
| 11-13.5 | 1 | |
| ≤11 | 2 | |
| Sodio (mmol/l) | ≥135 | 0 |
| ≤135 | 2 | |
| Creatinina (μmol/l) | ≤141 | 0 |
| ≥141 | 2 | |
| Glucosa (mg/dl) | ≤180 | 0 |
| >180 | 1 |
LRINEC: Bajo riesgo: menor de 6. Moderado riesgo: 6-7. Alto riesgo: mayor de 7.
Fuente: Wong et al.5.
Los resultados se muestran como mediana, rango intercuartílico y rango absoluto para las variables cuantitativas. En el caso de las variables cualitativas, los resultados se muestran como frecuencias absoluta y relativa. La comparación entre las categorías de la escala LRINEC se ha realizado mediante comparación post-hoc a partir de un análisis ANOVA con aproximación no paramétrica por transformación a rangos de las variables independientes. Las comparaciones entre grupos de LRINEC en las variables cualitativas se han llevado a cabo mediante la prueba exacta de Fisher. Todos los análisis se han realizado con el programa SPSS v. 20 y se ha empleado un error de tipo I bilateral del 5% en todas las pruebas estadísticas.
ResultadosSe identificaron un total de 24 pacientes. La edad media fue de 51,9 años, de los cuales 13 eran hombres. Siete pacientes (29,1%) estaban infectados por el virus de la hepatitis C, 6 (25%) eran adictos a drogas por vía parenteral, 4 (16,6%) eran portadores del VIH, 3 (12,2%) eran alcohólicos activos, 2 (8,3%) eran diabéticos insulinodependientes y 2 (8,3%) seguían tratamiento crónico con corticoides por artritis reumatoide. Trece pacientes (54,1%) tenían 2 o más antecedentes patológicos. Seis pacientes (25%) no presentaban ningún antecedente patológico de interés. La localización fue en la extremidad superior en 6 casos (25%) y en la inferior en 19 (79,1%). Las principales características clínicas y evolutivas de los pacientes estudiados se resumen en las tablas 2 y 3.
Características clínicas y valor de la escala LRINEC en los pacientes estudiados
| N.o | Edad | sexo | Morbilidad | Extremidad | Puerta de entrada | Síntoma principal | Leucos × 1.000 cel/mm3 | PCR mg/dl | Shock | Diagnóstico inicial | LRINEC |
|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 51 | M | No | Inf | Erosión | Dolor | 9,2 | 7,8 | No | INPB | 0 |
| 2 | 36 | M | VHC, VIH, ADVP | Inf | Venopunción | Dolor | 9,2 | 29,2 | No | Celulitis | 7 |
| 3 | 21 | V | VHC, VIH, ADVP | Sup | Venopunción | Signos inflamatorios | 14,2 | 16,9 | No | INPB | 7 |
| 4 | 51 | M | VHC, ADVP | Inf | Venopunción | Drenaje purulento | 20 | 16,8 | No | INPB | 11 |
| 5 | 16 | V | No | Sup | Herida incisa | Dolor-edema | 9,1 | 14,4 | No | INPB | nd |
| 6 | 73 | M | DMID, Linfoma | Inf | No | Dolor | 8 | 5,5 | Sí | Celulitis | 3 |
| 7 | 83 | M | Ca mama | Sup | Quemadura mano | Fiebre- eritema | 6,8 | 33,5 | No | Celulitis | 6 |
| 8 | 80 | M | Obesidad | Inf | No | Dolor- eritema | 6,1 | 22,1 | Sí | Celulitis | 4 |
| 9 | 40 | M | VHC, ADVP | Inf | Herida incisa | Dolor | 9,9 | 8,5 | No | INPB | 2 |
| 10 | 72 | V | VHC | Sup/Inf | Erosión | Dolor | 2,7 | 43,2 | Sí | INPB | 9 |
| 11 | 67 | V | Enolismo | Inf | No | Dolor | 6,5 | 28,1 | No | Celulitis | 5 |
| 12 | 71 | V | EPOC | Inf | Herida contusa | Dolor | 12 | 28,3 | No | INPB | 9 |
| 13 | 86 | M | No | Inf | Herida quirúrgica | Dolor | 15,1 | 42,5 | No | TVP | 11 |
| 14 | 65 | V | AR | Inf | No | Dolor-edema | 8,1 | 34,6 | No | Celulitis | 10 |
| 15 | 36 | V | DMID | Inf | No | Dolor | 30,9 | 31,5 | No | INPB | 13 |
| 16 | 23 | M | No | Sup | Picadura insecto | Dolor | 12,6 | 12 | No | Celulitis | 1 |
| 17 | 38 | M | VHC, VIH,A DVP | Inf | Venopunción | Dolor | 21,2 | 26,6 | No | Celulitis | 8 |
| 18 | 30 | V | VIH, ADVP | Inf | IM | Dolor | 14,4 | 9,2 | No | Absceso | 2 |
| 19 | 29 | V | Enolismo, esplenectomía | Inf | Erosión | Dolor | 6,4 | 6,6 | Sí | INPB | 3 |
| 20 | 50 | V | AR | Inf | No | Dolor | 1,9 | 44,6 | Sí | Artritis sépt. | 7 |
| 21 | 90 | V | VHC | Inf | No | Dolor | 1,1 | 12,1 | No | Celulitis | 4 |
| 22 | 36 | M | Enolismo | Inf | Herida quirúrgica | Supuración | 17 | 13,4 | No | INPB | 5 |
| 23 | 32 | V | No | Sup | Herida incisa | Dolor | 15,7 | 15,3 | No | Sd. compart | nd |
| 24 | 72 | V | No | Inf | No | Dolor | 11,5 | – | No | Celulitis | nd |
ADVP: adicto drogas vía parenteral; AR: artritis reumatoide; Ca: cáncer; DMID: diabetes mellitus insulinodependiente; EPOC: enfermedad pulmonar obstructiva crónica; Inf: inferior; INPB: infección necrosante partes blandas; LRINEC: Laboratory Risk Indicator for Necrotizing Fasciitis; M: mujer; nd: no disponible; PCR: proteína C reactiva; Sup: superior; TVP: trombosis venosa profunda; V: varón; VHC: virus hepatitis C; VIH: virus inmunodeficiencia humana.
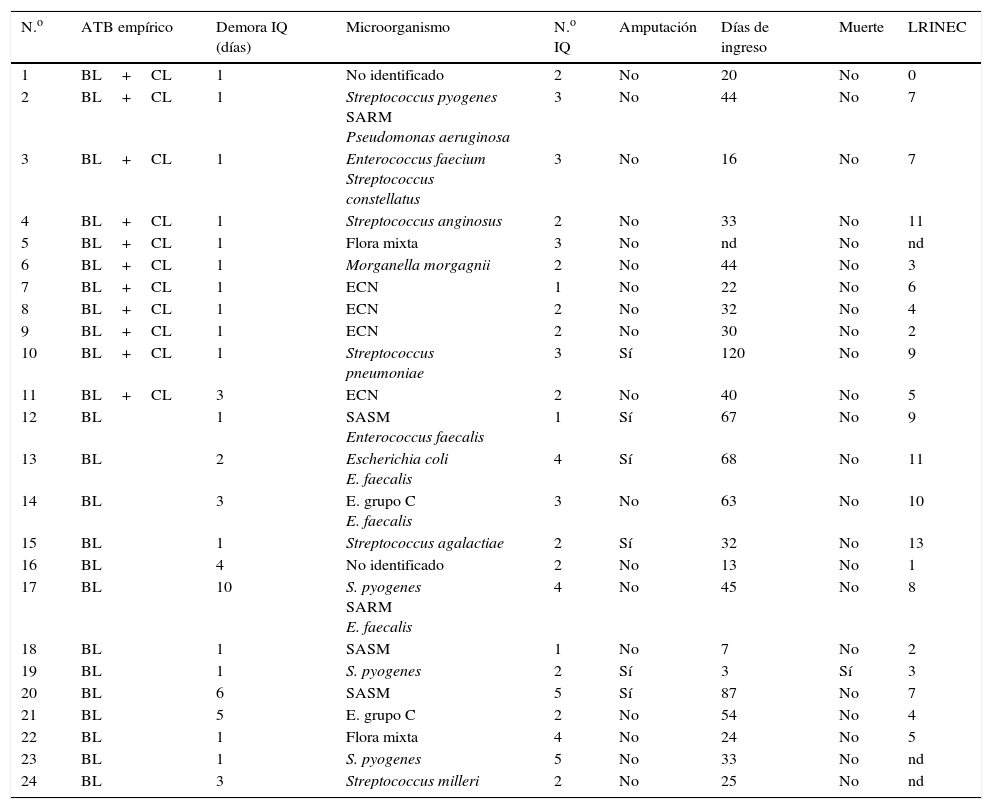
Diagnóstico, tratamiento y evolución de los pacientes estudiados
| N.o | ATB empírico | Demora IQ (días) | Microorganismo | N.o IQ | Amputación | Días de ingreso | Muerte | LRINEC |
|---|---|---|---|---|---|---|---|---|
| 1 | BL+CL | 1 | No identificado | 2 | No | 20 | No | 0 |
| 2 | BL+CL | 1 | Streptococcus pyogenes SARM Pseudomonas aeruginosa | 3 | No | 44 | No | 7 |
| 3 | BL+CL | 1 | Enterococcus faecium Streptococcus constellatus | 3 | No | 16 | No | 7 |
| 4 | BL+CL | 1 | Streptococcus anginosus | 2 | No | 33 | No | 11 |
| 5 | BL+CL | 1 | Flora mixta | 3 | No | nd | No | nd |
| 6 | BL+CL | 1 | Morganella morgagnii | 2 | No | 44 | No | 3 |
| 7 | BL+CL | 1 | ECN | 1 | No | 22 | No | 6 |
| 8 | BL+CL | 1 | ECN | 2 | No | 32 | No | 4 |
| 9 | BL+CL | 1 | ECN | 2 | No | 30 | No | 2 |
| 10 | BL+CL | 1 | Streptococcus pneumoniae | 3 | Sí | 120 | No | 9 |
| 11 | BL+CL | 3 | ECN | 2 | No | 40 | No | 5 |
| 12 | BL | 1 | SASM Enterococcus faecalis | 1 | Sí | 67 | No | 9 |
| 13 | BL | 2 | Escherichia coli E. faecalis | 4 | Sí | 68 | No | 11 |
| 14 | BL | 3 | E. grupo C E. faecalis | 3 | No | 63 | No | 10 |
| 15 | BL | 1 | Streptococcus agalactiae | 2 | Sí | 32 | No | 13 |
| 16 | BL | 4 | No identificado | 2 | No | 13 | No | 1 |
| 17 | BL | 10 | S. pyogenes SARM E. faecalis | 4 | No | 45 | No | 8 |
| 18 | BL | 1 | SASM | 1 | No | 7 | No | 2 |
| 19 | BL | 1 | S. pyogenes | 2 | Sí | 3 | Sí | 3 |
| 20 | BL | 6 | SASM | 5 | Sí | 87 | No | 7 |
| 21 | BL | 5 | E. grupo C | 2 | No | 54 | No | 4 |
| 22 | BL | 1 | Flora mixta | 4 | No | 24 | No | 5 |
| 23 | BL | 1 | S. pyogenes | 5 | No | 33 | No | nd |
| 24 | BL | 3 | Streptococcus milleri | 2 | No | 25 | No | nd |
ATB: antibiótico; BL: betalactámico; CL: clindamicina; ECN: estafilococo coagulasa negativa; IQ: intervención quirúrgica; LRINEC: Laboratory Risk Indicator for Necrotizing Fasciitis; nd: no disponible; SARM: Staphylococcus aureus resistente a meticilina; SASM: S. aureus sensible a meticilina.
La radiología simple se realizó en el momento del ingreso y mostró gas en tejidos blandos solo en 4 casos. Todos los pacientes fueron intervenidos y la media de la demora desde la llegada a urgencias fue de un día (rango 1-10), siendo el número medio de intervenciones por paciente de 2,6 (rango 1-5). En 16 casos la infección fue monomicrobiana y los microorganismos más frecuentes fueron los estreptococos betahemolíticos (2 Streptococcus pyogenes, un Streptococcus agalactiae y un estreptococo del grupo C). En 8 casos la infección fue polimicrobiana, en 4 con participación de diferentes especies de cocos grampositivos y 3 con bacilos gramnegativos (asociando bacilos grampositivos en 2 de los casos). A 6 pacientes (25%) se les practicó una amputación como parte del tratamiento, en un caso se amputó tanto un miembro superior como uno inferior. Once pacientes (45,8%) recibieron como tratamiento antibiótico empírico inicial un betalactámico (BL) asociado a clindamicina (CL) y 13 (54,1%) un BL en monoterapia. En el primer grupo se practicó una amputación (del miembro inferior) y no hubo ninguna defunción. En el segundo grupo se practicaron 5 amputaciones (20,8%) y un paciente falleció (4,2%). La estancia hospitalaria media fue de 39,9 (rango 7-120) días y la mortalidad global de la serie fue del 4,2% (1 caso).
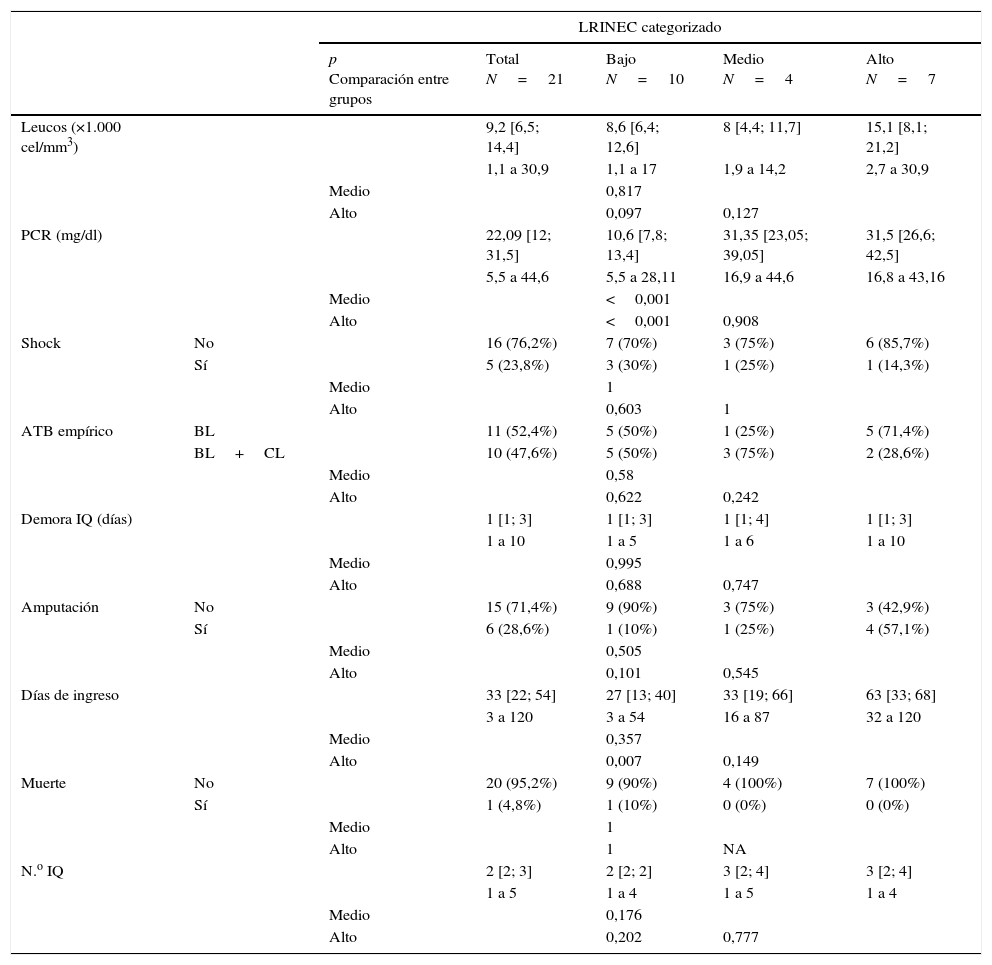
La escala LRINEC se determinó en 21 pacientes en el momento de la admisión en urgencias (tabla 1). En 10 pacientes el valor fue <6 (bajo riesgo), en 4 pacientes fue de 6 o 7 (riesgo intermedio) y en 7 pacientes fue ≥8 (alto riesgo). La evolución de los pacientes según el grupo de riesgo en el que entraban tras la clasificación con la escala LRINEC fue: en el grupo de bajo riesgo, el 10% precisó una amputación, con una media de cirugías de 2,1 (rango 1-4) a lo largo de 26,7 días de media de ingreso (rango 3-54); en el grupo de riesgo intermedio, la amputación aumentó al 25% con una media de 3 cirugías (rango 1-5), durante una estancia media de 42,2 días (rango 16-87), sin que existiera ninguna defunción; por último, en el grupo de riesgo alto, la necesidad de amputación a lo largo de 65,8 días de ingreso (rango 32-120) ascendió al 66,6%, con una media de 2,8 cirugías (rango 1-4), sin que existiera ninguna defunción. Se observa una muy leve tendencia al aumento en el recuento leucocitario entre los grados bajo y alto de la escala (p=0,097). En cuanto a los resultados de PCR, se observa un aumento claro de los grupos medio o alto respecto al nivel bajo de la escala (p<0,001 en ambas comparaciones). Se observa un aumento en la estancia hospitalaria entre los niveles bajo y alto de la escala (p=0,007) (tabla 4).
Tabla de resultados
| LRINEC categorizado | ||||||
|---|---|---|---|---|---|---|
| p Comparación entre grupos | Total N=21 | Bajo N=10 | Medio N=4 | Alto N=7 | ||
| Leucos (×1.000 cel/mm3) | 9,2 [6,5; 14,4] | 8,6 [6,4; 12,6] | 8 [4,4; 11,7] | 15,1 [8,1; 21,2] | ||
| 1,1 a 30,9 | 1,1 a 17 | 1,9 a 14,2 | 2,7 a 30,9 | |||
| Medio | 0,817 | |||||
| Alto | 0,097 | 0,127 | ||||
| PCR (mg/dl) | 22,09 [12; 31,5] | 10,6 [7,8; 13,4] | 31,35 [23,05; 39,05] | 31,5 [26,6; 42,5] | ||
| 5,5 a 44,6 | 5,5 a 28,11 | 16,9 a 44,6 | 16,8 a 43,16 | |||
| Medio | <0,001 | |||||
| Alto | <0,001 | 0,908 | ||||
| Shock | No | 16 (76,2%) | 7 (70%) | 3 (75%) | 6 (85,7%) | |
| Sí | 5 (23,8%) | 3 (30%) | 1 (25%) | 1 (14,3%) | ||
| Medio | 1 | |||||
| Alto | 0,603 | 1 | ||||
| ATB empírico | BL | 11 (52,4%) | 5 (50%) | 1 (25%) | 5 (71,4%) | |
| BL+CL | 10 (47,6%) | 5 (50%) | 3 (75%) | 2 (28,6%) | ||
| Medio | 0,58 | |||||
| Alto | 0,622 | 0,242 | ||||
| Demora IQ (días) | 1 [1; 3] | 1 [1; 3] | 1 [1; 4] | 1 [1; 3] | ||
| 1 a 10 | 1 a 5 | 1 a 6 | 1 a 10 | |||
| Medio | 0,995 | |||||
| Alto | 0,688 | 0,747 | ||||
| Amputación | No | 15 (71,4%) | 9 (90%) | 3 (75%) | 3 (42,9%) | |
| Sí | 6 (28,6%) | 1 (10%) | 1 (25%) | 4 (57,1%) | ||
| Medio | 0,505 | |||||
| Alto | 0,101 | 0,545 | ||||
| Días de ingreso | 33 [22; 54] | 27 [13; 40] | 33 [19; 66] | 63 [33; 68] | ||
| 3 a 120 | 3 a 54 | 16 a 87 | 32 a 120 | |||
| Medio | 0,357 | |||||
| Alto | 0,007 | 0,149 | ||||
| Muerte | No | 20 (95,2%) | 9 (90%) | 4 (100%) | 7 (100%) | |
| Sí | 1 (4,8%) | 1 (10%) | 0 (0%) | 0 (0%) | ||
| Medio | 1 | |||||
| Alto | 1 | NA | ||||
| N.o IQ | 2 [2; 3] | 2 [2; 2] | 3 [2; 4] | 3 [2; 4] | ||
| 1 a 5 | 1 a 4 | 1 a 5 | 1 a 4 | |||
| Medio | 0,176 | |||||
| Alto | 0,202 | 0,777 | ||||
Datos representados como mediana, rango intercuartílico [percentiles 25 y 75] y rango absoluto en las variables cuantitativas. En las variables cualitativas, como n (%).
ATB: antibiótico; BL: betalactámico; CL: clindamicina; IQ: intervención quirúrgica; LRINEC: Laboratory Risk Indicator for Necrotizing Fasciitis; NA: no aplicable; PCR: proteína C reactiva.
En nuestra serie de 24 pacientes con diagnóstico de INPB de extremidades, la mortalidad fue del 4,2%, 6 pacientes (25%) fueron amputados y la media de estancia hospitalaria fue de 39,9 días (rango 7-120). Majeski y Alexander6-8 compararon la mortalidad de 2 grupos con INPB, uno de 20 pacientes (grupo A) tratados entre 1965-1980, y otro de 10 (grupo B) tratados entre 1980 y 2000. Las características clínicas y epidemiológicas fueron similares. Sin embargo, la mortalidad del grupo A fue del 50%, mientras que en el grupo B fue del 0%. La mejora de supervivencia se atribuyó a un diagnóstico precoz y un inmediato y extenso desbridamiento del tejido necrótico. En el año 1998, Bilton et al.6,7,9 revisaron su experiencia en 68 pacientes. En 21 pacientes el tratamiento quirúrgico correcto se realizó después de 24h del ingreso, mientras que el segundo grupo de 47 pacientes fue sometido a desbridamiento precoz y extenso. La media de procedimientos quirúrgicos en ambos grupos fue similar en 3,4 y 3,3; sin embargo, la estancia hospitalaria en el primer grupo fue de 46 días de media (rango 11-104), y en el segundo grupo fue de 28 (rango 4-45). La mortalidad en el primer grupo fue del 38%, mientras que en el segundo fue del 4,2%. En el estudio de Wong et al.5,9, en una serie de 89 pacientes consecutivos entre 1997-2002, observaron que retrasar más de 24h el tratamiento quirúrgico fue el único factor independiente asociado a mayor mortalidad. En el estudio de Wong et al. la mortalidad fue del 21% y la tasa de amputación del 22%. La reducida mortalidad observada en nuestra serie (4,2%) no puede atribuirse a ningún factor de los estudiados con los datos de los que disponemos. El único paciente que falleció en nuestra serie, a pesar de tener una puntuación de LRINEC de bajo riesgo, fue diagnosticado inicialmente de INPB y desbridado en las primeras 24h, sin que podamos dar una explicación más allá de suponer que la esplenectomía haya sido el agravante fundamental en su evolución fatal. No encontramos diferencias estadísticamente significativas en cuanto al número de amputaciones en función del riesgo en la escala LRINEC.
Solo en 10 de los 24 (41,7%) casos revisados el diagnóstico inicial fue de INPB, siendo la celulitis el diagnóstico alternativo más frecuente10-21. La búsqueda de parámetros objetivos que ayuden a identificar precozmente la INPB es de gran importancia8,20,22-25. La escala LRINEC utiliza parámetros de laboratorio para identificar el riesgo de que un paciente con una infección aparente de piel y partes blandas tenga realmente una infección necrosante2,6,7,25. En nuestra serie, 11 de los 21 pacientes a los que se determinó el LRINEC presentaban una puntuación ≥6 (riesgo intermedio-alto de INPB) y 10 pacientes no fueron adecuadamente identificados. Una potencial explicación es que en nuestro medio el acceso al servicio de urgencias es fácil y los pacientes llegan en fases tempranas de la infección, presentando pocas alteraciones biológicas. Por ello pensamos que es preciso que el clínico mantenga un alto índice de sospecha inicial ante posibles INPB especialmente cuando i) el dolor sea muy importante, ii) la infección progrese rápidamente a pesar de haber iniciado tratamiento antibiótico correcto o iii) el paciente tenga una afectación importante del estado general o esté en estado de shock, todo ello con independencia de la aparente gravedad de la lesión o del valor de la escala LRINEC. En todos aquellos casos en los que se sospeche una INPB es necesario realizar controles evolutivos cada 3-4h de la lesión y de las constantes vitales.
La escala tuvo una correlación con la evolución del paciente y así el grupo de riesgo alto requirió amputación en el 66% de los casos frente al 10% en el grupo de bajo riesgo; la estancia hospitalaria fue de 65,8 días frente a 26 días, y el número de intervenciones quirúrgicas necesarias para controlar la infección aumentó un 30% en el grupo de riesgo intermedio-alto respecto al grupo de bajo riesgo. En general, no se ha podido constatar un cambio en el pronóstico entre los niveles medio y alto de la escala LRINEC, pero sí entre la estancia hospitalaria entre el nivel bajo y el alto, triplicando prácticamente la mediana de días de estancia hospitalaria. Respecto a los parámetros que se emplean para la elaboración de la escala, el más relacionado es el resultado de la PCR, siendo el triple entre el grupo bajo y los grupos medio o alto, sin existir cambios significativos entre el medio y el alto (tabla 4). El limitado número de la serie presentada, aun pudiéndose considerar representativa dada la ventana temporal de recogida de datos, hace que cambios clínicamente relevantes, como el caso de las diferencias en el recuento leucocitario entre el bajo o medio y alto riesgo o la alta tasa de amputaciones (más de la mitad) en el grupo de alto riesgo, no hayan resultado estadísticamente significativos.
Diversos modelos experimentales de INPB producidas por S. pyogenes han puesto de manifiesto que la asociación de un BL con CL o linezolid frente a un BL en monoterapia reduce la mortalidad del animal en más del 50%24-31. Nuestra serie apoya el uso combinado de antibióticos, y aunque la administración del mismo no se realizó bajo criterios de aleatorización, hemos observado que en el grupo de pacientes tratados con BC+CL (54,1%) se realizó una amputación y no hubo ningún fallecimiento. En el grupo tratado solo con BL (45,8% de los pacientes) se practicaron 5 amputaciones y un paciente falleció.
En la mayoría de las series el microorganismo más frecuentemente aislado suele ser un estreptococo betahemolítico, sin embargo, en la serie que presentamos 3 casos están producidos por bacilos gramnegativos. El paciente en el que se aisló una Pseudomonas aeruginosa tenía como antecedentes una infección por VIH, por VHC y era adicto a drogas por vía parenteral; el segundo caso, en el que se aisló una Morganella morgagnii, era una paciente que padecía un linfoma, siendo ambas situaciones casos con mayor predisposición a una infección por gérmenes gramnegativos, dada la alteración de la inmunidad. Sin embargo, el tercer caso de los relacionados con bacilos gramnegativos, producido por una Escherichia coli y que asociaba un Enterococcus faecalis, no tenía antecedentes médicos relevantes.
Es destacable que presentemos 3 casos causados por bacilos gramnegativos, ya que en infecciones en extremidades son poco frecuentes, si bien es cierto que algún autor ya ha mencionado una tendencia en el cambio de los microorganismos causantes de las INPB32, hecho que debería tenerse en cuenta en un futuro.
En conclusión, en nuestro estudio la escala LRINEC identificó adecuadamente solo el 52% de las INPB, por lo que deberemos recordar que la puntuación baja en la escala no descarta la presencia de esta entidad; sin embargo, se correlacionó con el pronóstico de la infección. Reconocemos las limitaciones de nuestro estudio: en primer lugar, el bajo número de pacientes, aunque al ser esta entidad poco prevalente es difícil tener un tamaño muestral suficiente; en segundo lugar, y a consecuencia del tamaño muestral limitado, no hemos podido realizar un estudio inferencial que permita sacar todas las conclusiones estadísticamente significativas que necesitaríamos, y en tercer lugar, el ser un estudio observacional de cohorte retrospectiva. No obstante, pensamos que en la situación actual, en la que no disponemos de una herramienta que facilite de manera extraordinaria la identificación de una INPB, ante una infección de piel y partes blandas debemos monitorizar su evolución, y ante la sospecha de INPB o progresión hacia ella, indicar un desbridamiento precoz y agresivo, e instaurar un tratamiento antibiótico combinado intravenoso adecuado, siguen siendo las medidas más importantes para modificar el pronóstico de esta entidad.
Nivel de evidencia1- Centre for Evidence-Based Medicine (CEBM) Nivel de evidencia: 2C.
2-Agency for Healthcare Research and Quality (www.ahrq.gov/clinic/uspstfix.htm). Nivel de Evidencia: II 2.
3- Scottish Intercollegiate Guidelines Network (SIGN). Nivel de Evidencia: 2++.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores no hemos recibido ayuda económica alguna para la realización de este trabajo. Tampoco hemos firmado ningún acuerdo por el que vayamos a recibir beneficios u honorarios por parte de alguna entidad comercial. Ninguna entidad comercial ha pagado, ni pagará, a fundaciones, instituciones educativas u otras organizaciones sin ánimo de lucro a las que estamos afiliados.