La creciente resistencia a antimicrobianos está impulsando la adición de antibióticos con elevada actividad antiestafilocócica al polimetilmetacrilato (PMMA), para su uso en los espaciadores de cemento en la infección periprotésica. El linezolid o el levofloxacino ya han sido utilizados en estudios in vitro; sin embargo, la rifampicina ha demostrado un efecto deletéreo sobre las propiedades mecánicas del PMMA, inhibiendo su polimerización. El objetivo de nuestro estudio fue aislar la rifampicina durante el proceso de polimerización mediante técnicas de microencapsulación, con el fin de obtener un PMMA apto para la fabricación de espaciadores articulares.
Material y métodoSe sintetizaron microcápsulas de rifampicina con alginato y PHBV, utilizando Rifaldin®. Se estudió la concentración de rifampicina mediante espectrofotometría UV-visible. Se realizaron ensayos de compresión, dureza y tiempo de fraguado con probetas de cemento CMW®1 solo, con rifampicina y microcápsulas de PHBV y alginato.
ResultadosEl rendimiento de producción, la eficiencia y el rendimiento de microencapsulación fueron mayores con alginato (p=0,0001). El cemento con microcápsulas mostró mayor resistencia a la compresión que el cemento con rifampicina (91,26±5,13, 91,35±6,29 y 74,04±3,57MPa en alginato, PHBV y rifampicina, respectivamente) (p=0,0001). El tiempo de fraguado disminuyó, siendo la curva de dureza del cemento con microcápsulas de alginato similar a la de control.
Discusión y conclusionesLa microencapsulación con alginato es una técnica adecuada para introducir rifampicina en el PMMA preservando las propiedades de compresión y el tiempo de fraguado. Su obtención permitiría fabricar espaciadores que liberasen localmente rifampicina para el tratamiento de la infección periprotésica.
The increasing antimicrobial resistance is promoting the addition of antibiotics with high antistaphylococcal activity to polymethylmethacrylate (PMMA), for use in cement spacers in periprosthetic joint infection. Linezolid and levofloxacin have already been used in in-vitro studies, however, rifampicin has been shown to have a deleterious effect on the mechanical properties of PMMA, because it inhibits PMMA polymerization. The objective of our study was to isolate the rifampicin during the polymerization process using microencapsulation techniques, in order to obtain a PMMA suitable for manufacturing bone cement spacers.
Material and methodMicrocapsules of rifampicin were synthesized with alginate and PHBV, using Rifaldin®. The concentration levels of rifampicin were studied by UV-visible spectrophotometry. Compression, hardness and setting time tests were performed with CMW®1 cement samples alone, with non-encapsulated rifampicin and with alginate or PHBV microcapsules.
ResultsThe production yield, efficiency and microencapsulation yield were greater with alginate (P = .0001). The cement with microcapsules demonstrated greater resistance to compression than the cement with rifampicin (91.26±5.13, 91.35±6.29 and 74.04±3.57 MPa in alginate, PHBV and rifampicin, respectively) (P = .0001). The setting time reduced, and the hardness curve of the cement with alginate microcapsules was similar to that of the control.
Discussion and conclusionsMicroencapsulation with alginate is an appropriate technique for introducing rifampicin into PMMA, preserving compression properties and setting time. This could allow intraoperative manufacturing of bone cement spacers that release rifampicin for the treatment of periprosthetic joint infection.
La infección periprotésica es una complicación grave cuya prevalencia ha aumentado en las últimas décadas. Se estima que será la causa más frecuente de revisión protésica en las próximas 2 o 3 décadas1,2. La aparición de gérmenes multirresistentes y la complejidad médica de los pacientes obliga a modificar los protocolos de actuación existentes, insuficientes para el óptimo manejo de un problema tan complejo, y a investigar nuevas formas de tratamiento.
La mayoría de los microorganismos que causan la infección periprotésica son productores de biofilm. Las bacterias que están dentro del biofilm modifican su fenotipo radicalmente llevando a un crecimiento bacteriano con baja actividad metabólica y permitiendo la supervivencia bacteriana durante la infección crónica3. Esto implica que, en condiciones de biofilm maduro, las dosis activas in vitro de antibiótico sean de 200 a 1.000 veces superiores a la dosis habitual4, haciendo imposible el tratamiento de las infecciones periprotésicas únicamente con antibióticos administrados por vía sistémica. La obtención de concentraciones elevadas de antibiótico en el sitio de la infección aumenta la probabilidad de éxito en el tratamiento, y esto se puede conseguir mediante la utilización de espaciadores de cemento cargados de antibiótico.
El recambio en 2 tiempos es considerado el patrón oro del tratamiento de la infección periprotésica crónica. Tras la retirada de la prótesis articular y el desbridamiento amplio de los tejidos infectados, se implanta temporalmente un espaciador de cemento óseo con altas dosis de antibióticos, con el fin de conservar el espacio articular y alcanzar concentraciones locales elevadas de antibióticos. Los aminoglucósidos y la vancomicina son los antibióticos más frecuentemente añadidos al cemento óseo, pero la aparición de cepas de bacterias multirresistentes está amenazando su eficacia en el tratamiento local5.
El papel de la rifampicina frente a las infecciones estafilocócicas asociadas a implantes ha sido demostrado6. La rifampicina, en combinación con otros antibióticos, es considerado el de elección para el tratamiento de la infección estafilocócica de prótesis articulares por su actividad bactericida frente a las bacterias en fase estacionaria, su actividad intracelular y su capacidad de difusión en el biofilm7. Teóricamente, su uso de forma tópica en los tejidos periprotésicos aportaría ventajas, sin embargo, la adición de rifampicina al polimetilmetacrilato (PMMA) retrasa la polimerización del cemento, impidiendo su uso para la fabricación de espaciadores. El mecanismo propuesto es que la rifampicina reacciona con el peróxido de benzoilo (iniciador) y/o con la N,N-Dimetil-p-toluidina (activador), impidiendo que se formen radicales de benzoilo y que estos formen enlaces covalentes en el metilmetacrilato8.
El objetivo de este trabajo experimental fue el aislamiento de la rifampicina durante el proceso de polimerización del PMMA mediante técnicas de microencapsulación, con el fin de preservar las propiedades mecánicas y el tiempo de fraguado del cemento óseo.
Material y métodosProceso de síntesis de microcápsulasSe sintetizaron microcápsulas de rifampicina con alginato y polihidroxibutirato (PHBV) por los métodos de gelificación iónica y evaporación del disolvente, respectivamente, utilizando rifampicina comercial Rifaldin® (Sanofi, Barcelona, España).
La gelificación iónica se fundamentó en la capacidad del alginato para reticular y formar hidrogeles en presencia de contraiones (CaCl2 y quitosano). Se adicionó la mezcla de alginato y la rifampicina por goteo, bajo condiciones constantes de agitación, a una disolución con los contraiones, formándose complejos entre las especies de carga opuesta y dando lugar a las microcápsulas, que fueron recogidas por filtración.
El método de evaporación del disolvente consistió en la formación de una emulsión cuya fase interna fue el PHBV disuelto en un disolvente orgánico con la rifampicina. Posteriormente, la fase orgánica se dispersó en una solución acuosa que contenía el tensioactivo. Una vez formada la emulsión, se homogeneizó y se evaporó el disolvente para conseguir la precipitación gradual del PHBV con rifampicina.
Las micropartículas obtenidas fueron analizadas con microscopia electrónica de barrido. La morfología de las micropartículas fue esférica en las muestras de PHBV e irregular en las de alginato. Se sintetizaron 8 muestras de microcápsulas de PHBV y 4 de alginato.
Caracterización de las microcápsulasPara determinar el contenido de rifampicina de las microcápsulas de PHBV se disolvieron 5mg de cada muestra en 5ml de una disolución de diclorometano y metanol (10/90%). En el caso del alginato, se utilizó una disolución de ácido etilendiaminotetraacético 0,25M ya que el alginato no se disuelve en diclorometano y etanol. Para favorecer la disolución total de las microcápsulas, se centrifugaron a 4.000rpm durante 5min. El sobrenadante se analizó mediante espectrofotometría ultravioleta-visible (Agilent Technologies, Santa Clara, CA, EE. UU.), previa construcción de la curva de calibrado de la rifampicina a una longitud de onda de 334nm. Cada muestra se analizó por triplicado.
El proceso de microencapsulación se caracterizó mediante 3 parámetros: eficiencia de encapsulación de rifampicina o contenido de rifampicina (% Rifampicina), rendimiento de producción de microcápsulas (ηMIC) y rendimiento de microencapsulación de rifampicina (ηRIF). El contenido de rifampicina se definió como el cociente entre la masa de rifampicina microencapsulada y la masa de microcápsulas obtenida. El rendimiento de producción de microcápsulas se determinó como el cociente entre la masa de microcápsulas obtenida y la masa de los reactivos de partida. El rendimiento de microencapsulación de rifampicina se calculó como el cociente entre la masa de rifampicina microencapsulada y la masa de rifampicina utilizada.
Preparación de las muestras de cemento y ensayos mecánicosEl cemento se preparó manualmente siguiendo los estándares internacionales ASTM F451:99 (Standard Specification for Acrylic Bone Cement)9 e ISO 5833:2002 (Implants for surgery-Acrylic resin cements)10. Se empleó cemento comercial CMW®1 (DePuy International Ltd., Blackpool, Reino Unido). Se prepararon muestras con rifampicina (1,25% P/P) y microcápsulas (5% P/P) siguiendo las recomendaciones de Frommelt para conseguir la distribución homogénea del antibiótico. También se prepararon muestras control de cemento sin antibiótico.
Se fabricaron probetas cilíndricas de 12,0±0,1mm de altura y 6,0±0,1mm de diámetro para los ensayos de compresión (fig. 1), siguiendo la norma ISO 5833:2002. Se obtuvieron entre 4 y 6 probetas de cada muestra. Se ensayaron con la máquina de ensayos universales ELIB 20W® (Ibertest, Madrid, España) una semana después de su fabricación, a una velocidad de compresión de 20mm/min y con una célula de carga de 20kN.
Para estudiar la dureza, se fabricaron probetas rectangulares de 80,0±0,1mm de longitud, 10,0±0,1mm de anchura y 4,0±0,1mm de altura (fig. 2), según el estándar internacional UNE-ISO 7619-1:2011 (Caucho vulcanizado o termoplástico. Determinación de la dureza de indentación)11. Se utilizó el durómetro shore Bareiss® (Neurtek, Eibar, España) para la determinación de la dureza a los 15, 30, 45 y 60min, y a las 2, 3, 4 y 24h, en 3 probetas de cada muestra.
Los datos se presentan como media±desviación estándar. El análisis estadístico se realizó con SPSS® versión 22,0 (SPSS Inc., Chicago, IL, EE. UU.), utilizando el test de ANOVA para medidas repetidas y el análisis post hoc de Bonferroni. Se definió como estadísticamente significativa una p<0,05.
ResultadosEl porcentaje de rifampicina, el rendimiento de producción de microcápsulas y el rendimiento de microencapsulación de rifampicina fueron mayores con alginato que con PHBV, como se muestra en la tabla 1, siendo las diferencias estadísticamente significativas (p=0,0001).
Valores medios y desviación estándar del porcentaje de rifampicina encapsulada, rendimiento de producción y de microencapsulación de las 8 muestras de microcápsulas de PHBV y las 4 de alginato
| Polímero | Reactivos de partida | % Rifampicina encapsulada | Rendimiento producción (%) | Rendimiento microencapsulación (%) |
|---|---|---|---|---|
| PHBV | PHBV: 0,92g Rif: 0,11g Masa obtenida: 0,73g | 1,75±0,24 | 70,51±6,51 | 11,13±2,19 |
| Alginato | Alginato: 1,50g Rif: 0,20g Masa obtenida: 2,32g | 5,33±1,47 | 135,6±16,31 | 60,03±12,19 |
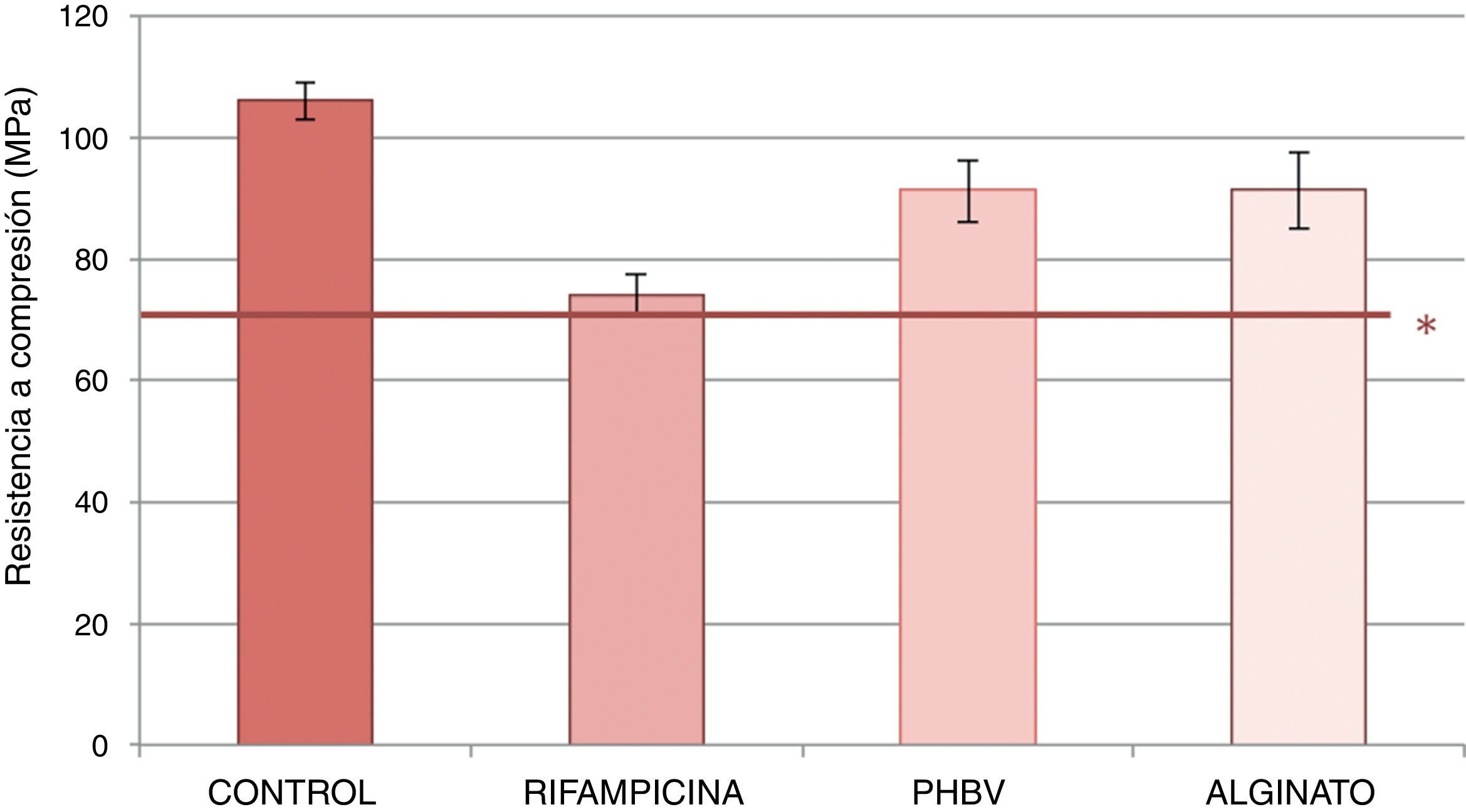
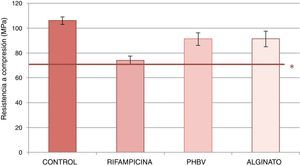
La figura 3 expone la resistencia a compresión de las muestras estudiadas. Las probetas de cemento con microcápsulas de PHBV y alginato mostraron una menor reducción en la resistencia a compresión (reducción del 14% respecto al cemento control) que el cemento con rifampicina no encapsulada (disminución del 30% comparado con el cemento control). Los datos obtenidos en el ensayo se muestran en la tabla 2. Se detectaron diferencias estadísticamente significativas al comparar los valores medios de la resistencia a compresión entre cemento control-rifampicina, control-alginato, PHBV-control, PHBV-rifampicina y alginato-rifampicina (p=0,0001 en todas las comparaciones). No se alcanzó la significación estadística al comparar PHBV y alginato (p=1).
Valores medios y desviación estándar de la resistencia a compresión de los cementos control, con rifampicina sin encapsular, con microcápsulas de PHBV y con microcápsulas de alginato
| Resistencia a compresión (MPa) | Desviación estándar | |
|---|---|---|
| Control | 106,2 | 2,97 |
| Rifampicina | 74,04 | 3,57 |
| PHBV | 91,26 | 5,13 |
| Alginato | 91,35 | 6,29 |
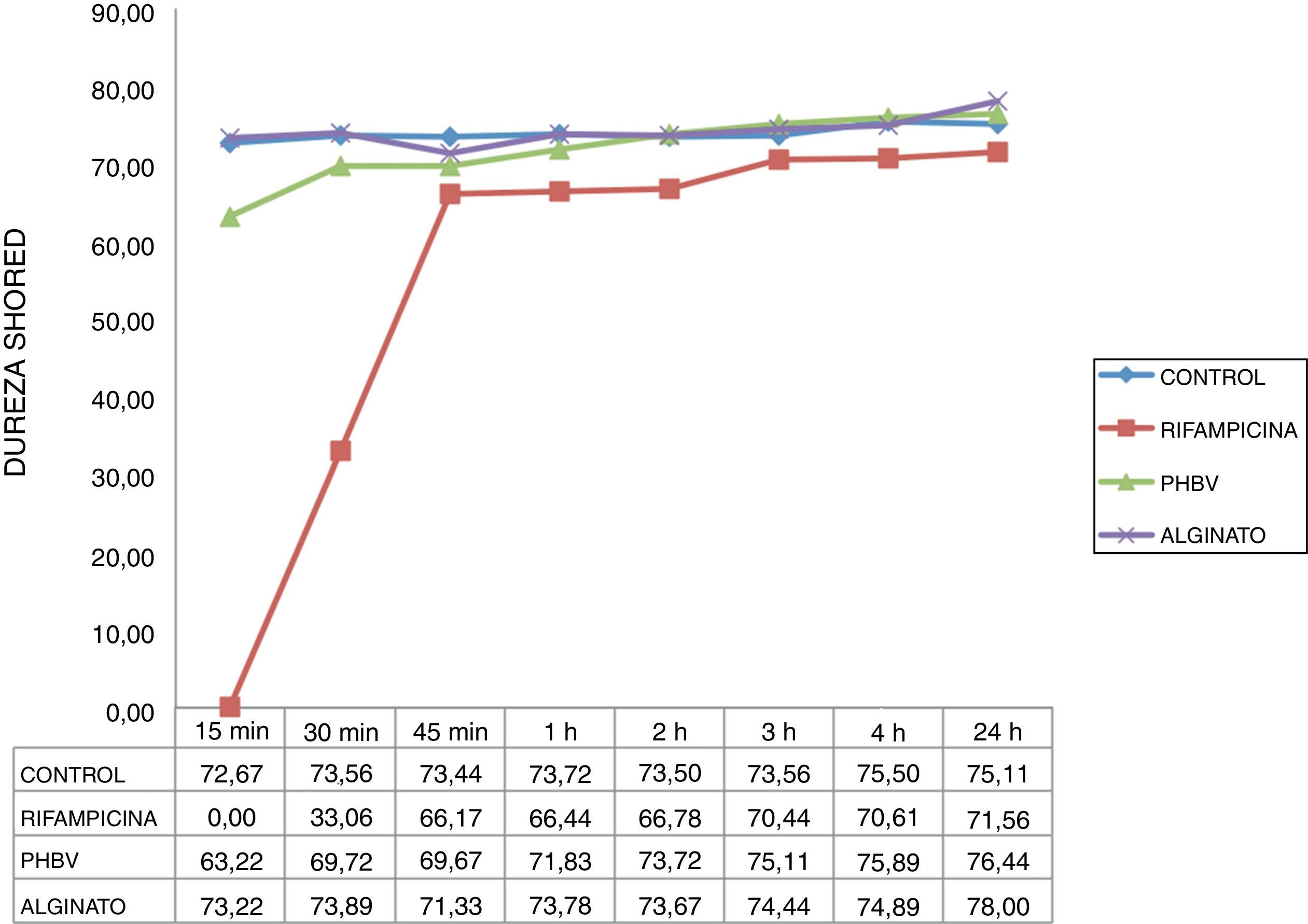
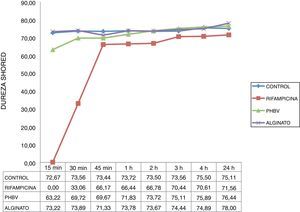
La curva de dureza obtenida con el cemento con microcápsulas de alginato fue similar a la del cemento control en todos los momentos estudiados (fig. 4), alcanzado la dureza máxima a los 15min (73 HD). El tiempo de fraguado del cemento con rifampicina no encapsulada fue mayor que el del cemento con rifampicina microencapsulada y el cemento control. El cemento con rifampicina no encapsulada no pudo ensayarse a los 15min porque estaba demasiado líquido. Comenzó a adquirir dureza a los 30min (33 HD) y no consiguió una dureza similar a la del cemento control hasta los 45min (67 HD).
DiscusiónExiste un creciente interés por añadir al cemento óseo antibióticos con elevada actividad antiestafilocócica debido a la preocupación por el aumento de la resistencia bacteriana a los antibióticos habituales. El linezolid y algunas quinolonas como el levofloxacino ya han sido utilizados en estudios in vitro12,13. Sin embargo, la adición de rifampicina al PMMA evita su completa polimerización, produciendo un material pastoso negro inadecuado para su uso en la práctica clínica, a pesar de haber demostrado una buena elución in vitro y actividad frente a S. aureus5,8,14.
Los primeros en microencapsular un antibiótico para añadirlo al PMMA fueron Shi et al.15, que describieron la fabricación de microesferas de colistina con ácido poliláctico para controlar la liberación del antibiótico del PMMA usado en los defectos óseos craneofaciales. Desde entonces, no hay referencias en la bibliografía sobre la microencapsulación de antibióticos en el PMMA.
La rifampicina ya había sido previamente encapsulada para su uso en el tratamiento de la tuberculosis pulmonar. Los polímeros empleados fueron PHBV, alginato, colistina con ácido poliláctico, y también liposomas y lípidos16–20. Sin embargo, no se ha estudiado la utilización de rifampicina microencapsulada en el cemento óseo con el fin de preservar las propiedades mecánicas y las características de fraguado.
Son necesarios entre un 5-10% P/P de antibiótico para obtener buenos niveles de elución de antibiótico del cemento óseo y así conseguir niveles locales terapéuticos. Sin embargo, la adición de dosis elevadas de antibióticos al cemento óseo deteriora sus propiedades mecánicas. He et al.21 estudiaron las modificaciones mecánicas tras añadir 1g (2,4% P/P), 2g (4,8% P/P), 4g (9,1% P/P) y 6g (13% P/P) de gentamicina al cemento Palacos®, recomendando un máximo de 6,5% P/P de antibiótico para mantener las propiedades de compresión del cemento. Lautenschlager et al.22 estimaron que la adición de 4,5g de gentamicina por 40g (10,1% P/P) disminuía la fuerza de compresión por debajo de 70MPa. La rifampicina, incluso en concentraciones inferiores a las recomendadas para la fabricación de espaciadores de cemento, deteriora de forma importante las propiedades del PMMA. De Palma et al., en 1982, fueron los primeros en hacer referencia a la inhibición de la polimerización completa del cemento óseo CMW® cuando se añadía rifampicina23. Anguita-Alonso et al.5 y Gálvez-López et al.24 reconocieron recientemente los beneficios que supondría la obtención de un cemento que liberase rifampicina en el tratamiento de la infección periprotésica, pero señalaron la misma problemática en cuanto al retraso del fraguado. En nuestros ensayos mecánicos, la resistencia a compresión del cemento con 1,25% P/P de rifampicina (0,5g de rifampicina por 40g) fue de 74,04MPa, y la del cemento con 5% P/P de microcápsulas (0,035 o 0,10g de rifampicina por 40g) fue de 91,26 y 91,35MPa en las microcápsulas de PHBV o alginato, respectivamente. No hay datos en la bibliografía sobre la resistencia a compresión de PMMA con rifampicina.
Nuestro estudio es el primero en aportar una solución al problema del retraso del tiempo de fraguado del PMMA al añadir rifampicina. La polimerización del cemento con rifampicina no encapsulada se retrasó 45min, excediendo el tiempo habitualmente disponible en quirófano para la fabricación de espaciadores de cemento. Sin embargo, la microencapsulación con alginato permitió obtener tiempos de fraguado equivalentes a los del cemento control. Tiempos mayores de fraguado, 122,5±31,1min, han sido publicados tras añadir 1, 2 y 4g de rifampicina o una combinación de 1g de rifampicina+1g de isoniazida, o 2g de rifampicina+2g de isoniazida al cemento CMW®314. Los resultados obtenidos indican que la microencapsulación podría ser una técnica adecuada para aislar la rifampicina durante el proceso de polimerización del PMMA, permitiendo su completo fraguado en un tiempo razonable.
La principal limitación de nuestro estudio es su naturaleza in vitro, que puede no reflejar con exactitud las condiciones in vivo. Se necesitarían ensayos en animales para conocer mejor los efectos del cemento con rifampicina en la infección protésica. Otra limitación es que todos los ensayos se realizan en monoterapia. Es bien conocido que el uso de rifampicina en monoterapia no se recomienda por el riesgo elevado de desarrollar resistencias. El estudio de la sinergia de la rifampicina con otros antibióticos habitualmente utilizados en el cemento óseo, como la gentamicina o la vancomicina, forma parte de nuestras futuras investigaciones. Tampoco se determinó la cinética de liberación de la rifampicina desde el cemento con microcápsulas, ya que esto no formaba parte del objetivo de la fase inicial del estudio, que era conseguir la adición de rifampicina al PMMA.
La aplicación clínica primordial que se deriva de este estudio experimental es la posibilidad de obtener un cemento óseo que contenga rifampicina, preservando unas propiedades mecánicas válidas para la fabricación de espaciadores de cemento. Los beneficios de conseguir concentraciones locales elevadas de rifampicina en el lugar de la infección periprotésica son indudables. La gelificación iónica con alginato sería la técnica de microencapsulación de rifampicina que más ventajas aportaría en cuanto a tiempo de fraguado y propiedades de compresión del PMMA.
Los ensayos realizados en este trabajo pueden ser el punto de partida para estudiar si la microencapsulación aportaría ventajas en el caso de antibióticos de uso común en el cemento óseo, permitiendo conservar las propiedades mecánicas a pesar de aumentar su concentración. Siguiendo la misma línea, la encapsulación podría suponer una ventaja en otros antibióticos cuya adición al cementó óseo plantea inconvenientes, como la anfotericina25, y en la vehiculización de agentes tumorales en metástasis óseas26.
En conclusión, la microencapsulación con alginato es la mejor técnica para introducir rifampicina en el PMMA, ya que preserva las propiedades de compresión y tiempo de fraguado.
Nivel de evidenciaNivel de evidencia i.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónEste proyecto ha sido financiado gracias a la Ayuda a Proyecto de Inicio a la Investigación en Cirugía Ortopédica y Traumatología, concedida por la Sociedad Española de Cirugía Ortopédica y Traumatología (SECOT), 2015. Título del proyecto: «Estudio experimental de la elución de rifampicina del cemento óseo (polimetilmetracrilato)». Autor principal: Esther Carbó Laso. Colaboradores: Pablo Sanz Ruiz; Francisco Javier Vaquero Martín. Centro de trabajo: Hospital Universitario Gregorio Marañón, Madrid.
Conflicto de interesesNegamos la existencia de conflictos de intereses.
A Carmen de Pablos, estudiante del Máster de Ingeniería Mecánica de ICAI, que colaboró en la ejecución de los ensayos mecánicos. Al Departamento de Microbiología del Hospital General Universitario Gregorio Marañón, por facilitarnos los medios para llevar a cabo los ensayos microbiológicos.