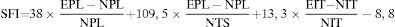El objetivo del proyecto es estudiar la regeneración de las lesiones no reparables del nervio periférico, mediante un injerto muscular enriquecido con factores de crecimiento.
Material y métodoLa experimentación se desarrolla en 2 fases: primero, comparamos la sutura directa del defecto crítico en el nervio ciático de 10 ratas, con la interposición de un injerto de músculo autólogo desnaturalizado por calor en otras 10. En la segunda, se comparan 10 ratas con reparación mediante injerto muscular acelular, con la inyección de 2cc de IGF-1 (10mg/ml de mecasermina, en solución inyectable) dentro del injerto acelular de otras 10.
Realizamos el seguimiento clínico y el control funcional de la marcha, medición de la huella plantar y «Grasping Test». Fueron sacrificadas a los 90-100 días, obteniendo muestras para macro y microscopía, con tinciones de azul de toluidina, hematoxilina-eosina y tricrómico de Masson.
ResultadosLa primera experimentación demostró el hallazgo de tejido de características nerviosas en las secciones del injerto muscular. La segunda supuso una potenciación de los resultados: mejoría clínica posquirúrgica, precoz deambulación, descenso en la tasa de úlceras por presión en partes acras, recuperación de la huella plantar, e incremento del porcentaje de terminaciones nerviosas en regeneración del cabo distal (47-62%).
ConclusionesExponemos en este trabajo las posibilidades experimentales y clínicas de la reparación del defecto nervioso mediante músculo desnaturalizado, confirmando la adecuación de la técnica. Además, confirmamos nuestra hipótesis con clínica y determinaciones celulares enriquecidas por la adicción de factores de crecimiento que impulsan la regeneración nerviosa.
This project aims to study the regeneration of non-repairable lesions of peripheral nerve by muscle grafts enhanced with growth factors.
Material and methodsThe experiment was carried out in two phases. The first one compared direct suture of a critical defect in the sciatic nerve of ten rats, with the interposition of autologous muscle graft, denatured by heat, in another ten. The second phase compared ten rats with nerve repair using an acellular muscle graft, with injection of 2cc of IGF-1 (10mg/ml mecasermin, Injectable solution) into the acellular graft of another ten.
A clinical and functional follow-up was carried out including, ambulation, footprint measurement, and «Grasping Test». The animals were sacrificed at 90-100 days, and samples obtained for macro- and microscopic studies with toluidine blue, haematoxylin-eosin and Masson's trichrome staining.
ResultsThe first experiment showed the characteristic findings of nerve tissue in muscle graft level sections. The second was an enhancement of the results: post-surgical clinical improvement, early ambulation, decrease in the rate of pressure ulcers in toes, recovery of the footprint, and increasing the percentage of nerve endings in distal sciatic regeneration (47-62%).
ConclusionsIn this study the experimental and clinical possibilities of nerve defect repair by denatured muscle are demonstrated, confirming the suitability of the technique. Furthermore, it confirms our hypothesis with clinical and cellular determinations enriched by the addition of growth factors that promote nerve regeneration.
La finalidad de un injerto nervioso es sustituir un defecto de manera que puedan pasar el máximo número de fibras nerviosas regeneradas hasta sus órganos diana. Millesi et al.1 obtuvieron resultados satisfactorios empleando autoinjertos de nervio safeno, técnica que se convirtió en el gold standard; pero la limitada disponibilidad de tejido nervioso para autoinjerto, así como la incompleta recuperación funcional obtenida en la mayoría de las ocasiones, y los problemas de la zona donante, han hecho buscar otras alternativas.
Keynes et al.2 en 1984 descubrieron que la lámina basal de las células musculares era útil como vía para el paso de axones en regeneración, por acción de la laminina de la lámina basal. Posteriormente, Glasby et al.3 en 1986 consiguieron un abundante paso de axones útiles mediante los canales del endomisio, utilizando músculo esquelético desnaturalizado para reparar los defectos nerviosos, ya que los canales del endomisio son parecidos a los del endoneuro.
Otros autores han continuado con estos estudios. Pereira et al.4 en 1990 comenzaron sus estudios sobre el injerto muscular desnaturalizado como sustituto para las lesiones granulomatosas micobacterianas en nervios periféricos de pacientes con lepra. Brunelli et al.5 en 1993 desarrollaron una investigación experimental en ratas con un injerto de vena (que proporciona una guía para la regeneración de nervios) rellena con músculo esquelético fresco (para evitar el colapso de la vena y servir de apoyo para la regeneración del axón), con resultados parecidos a los injertos de nervio tradicionales. DeFranzo et al.6 en 1994 examinaron el uso de congelación-descongelación del músculo como material de injerto del nervio en ratas, analizando histológicamente la densidad de los axones y su buena mielinización.
Whitworth et al.7 en 1995 presentaron una técnica simple para la incorporación de un depósito de células de Schwann y otros componentes esenciales, en un conducto del nervio; con un marcado efecto sobre la regeneración axonal en defectos de 5cm del nervio ciático del conejo, reparándolos con un injerto de 2-3mm de longitud del nervio autólogo fresco intercalado entre 1cm de injertos musculares. Un año más tarde, estos mismos autores, Whitworth et al.8 publicaron otro artículo en el que desarrollaron diferentes métodos para desnaturalizar los injertos musculares y así potenciar los resultados, ya sea utilizando calor seco en un horno de microondas o por calentamiento en agua destilada estéril. Continuando esta línea de investigación, Martín Ferrero et al.9 en 1995 utilizaron músculo esquelético desnaturalizado por criocongelación, obteniendo buenos resultados en cuanto a regeneración funcional e histológica, con paso de axones al segmento distal del 62% en los nervios oligofasciculares y del 48% en los polifasciculares.
Battiston et al.10 en 2000 describen la reparación nerviosa con injertos de vena rellenada por músculo en defectos de 3cm, longitud crítica en estos animales, y superior a la reparación de 2cm lograda en sus experimentaciones previas. Observaron como a los 6 meses tras la cirugía, el análisis cuantitativo morfométrico de fibras nerviosas mielinizadas muestra un aumento significativo (p<0,05) del número total (29,7% mayor) y de su densidad (18,2% mayor), respecto a las fibras nerviosas de los nervios no operados del grupo control. Concluyen que las fibras musculares, además de impedir el colapso de la vena, representan un buen apoyo para el avance de brotes por medio de las moléculas de adhesión presentes en la lámina basal de las fibras musculares e incrementan la extensión de las neuritas. Por su parte, Oliveira et al.11 en 2004, emplearon el modelo del nervio ciático de la rata para demostrar que no existían diferencias significativas en la morfología y la función de la regeneración con injerto de músculo esquelético y desvitalizado y el nervio convencional, para reparar una lesión segmentaria 5mm.
La descripción del uso clínico de injertos tisulares versus sintéticos fue inicialmente desarrollada por Battiston et al.12 un año más tarde. Los datos clínicos sugerían que los conductos biológicos sencillos monotisulares, de vena o músculo esquelético, mantenían buenas probabilidades de éxito si se utilizaban en defectos de longitud no superior a 2cm. Lo mismo ocurría con los tubos de silicona. Ante una brecha mayor de 30mm, habrían de utilizarse puentes biológicos combinados, de vena más músculo, o vena más nervio. Además, los conductos de ácido poliglicólico bioabsorbible representarían una opción clínica razonable, en determinadas situaciones clínicas, sobre la base de resultados muy alentadores obtenidos hasta esa fecha.
Teniendo en cuenta lo anterior, nos planteamos comparar diferentes métodos de tratamiento del músculo estriado para potenciar sus características como injerto en defectos nerviosos. Hall13 en 1997 examinó los elementos celulares y acelulares que facilitan la regeneración axonal, así como la utilización de injertos musculares acelulares en la reparación de lesiones en el sistema nervioso periférico. Liu et al.14 en 2001 demostraron por tinción inmunohistoquímica para los neurofilamentos y la proteína S-100, que los axones y células de Schwann crecían más rápidamente en los injertos musculares acelularizados químicamente que en la congelación-descongelación empleada para su desnaturalización.
Se han investigado también otras sustancias que podrían favorecer la regeneración del tejido nervioso, tales como los factores de crecimiento neurogénico (NGF), epidérmico (EGF) y derivado de plaquetas (PDGF), con diferentes resultados. Welch et al.15 en 1997 concluyeron que la administración combinada de PDGF e IGF-1 no incrementaba la regeneración del nervio periférico 6 semanas después de la cirugía. Yu et al.16 en 2009 observaron el efecto histológico del NGF, revelando un diámetro axonal, número axones y grosor de la mielina mejor con NGF en los nervios reparados con injerto acelular, en comparación con el injerto acelular solo e injerto acelular con cola de fibrina.
Iniciamos entonces un proyecto de investigación que fue becado con una ayuda a proyectos de investigación de la Fundación SECOT 2010-2012: «Regeneración de las lesiones críticas del nervio periférico con factores de crecimiento. Estudio experimental.» En este proyecto buscamos determinar el mejor método de desnaturalización de injertos musculares, así como saber si el uso añadido de factores de crecimiento (IGF-1) mejora o no la regeneración axonal, comparándolo con los estudios previos de nuestro grupo en los que no se utilizaron los factores de crecimiento.
Material y métodosSe trata de un ensayo clínico controlado, nivel i de evidencia científica. Para ello, empleamos ratas de la raza Wistar, machos, 278g de peso medio. Creamos un defecto crítico de 15mm en el nervio ciático, e intentamos puentearlo con un injerto de músculo. A partir de ahí, realizamos un estudio clínico y biológico, en 2 fases.
Primera faseUtilizamos como grupo control 10 ratas, en las que se creó un defecto crítico en el nervio ciático, reparándolo por sutura directa término-terminal.
Como grupo de casos, se emplean 10 animales en los que se creó un defecto crítico en el mismo nervio ciático (5 patas traseras derechas, 5 izquierdas) que se puenteó con un injerto de músculo autólogo. Fueron anestesiadas con clorhidrato de ketamina (Imalgene®) a dosis de 0,13ml por 100g de peso, y xilacina (Rompun®) a dosis de 0,02ml por 100g de peso, inyectados intraperitonealmente; a continuación, se realizó un abordaje posterior para el nervio ciático.
El injerto se obtuvo de cada rata a partir de un bloque de músculo glúteo mayor, que fue desnaturalizado con calor en un microondas a 250W durante 60s, de forma que el músculo alcanzara una temperatura de entre 60 y 70°C, según el protocolo descrito por Whitworth et al.7
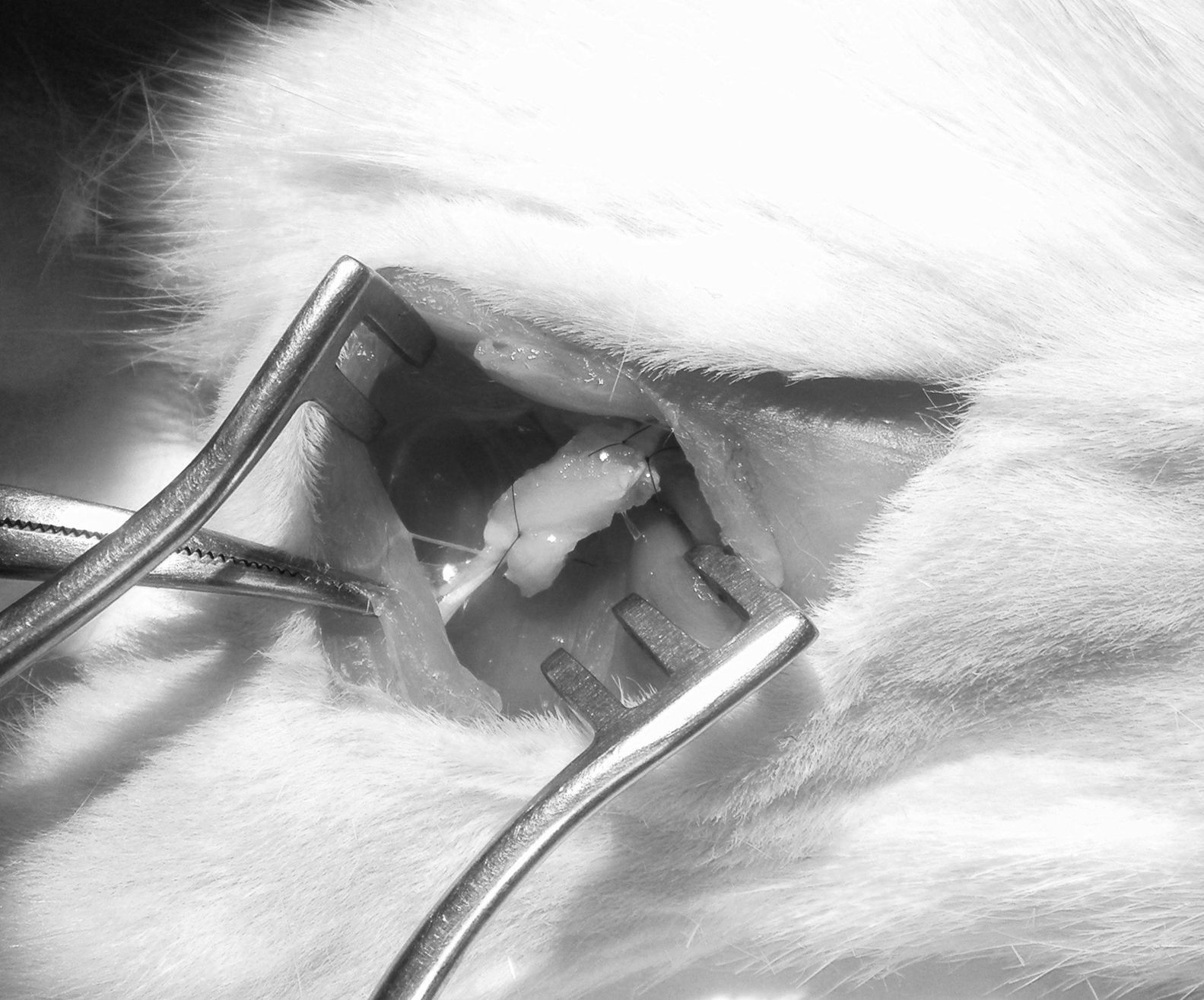
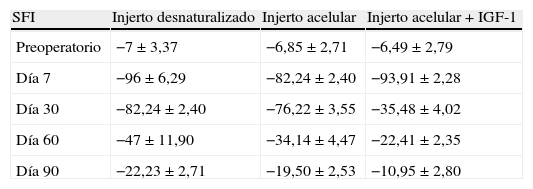
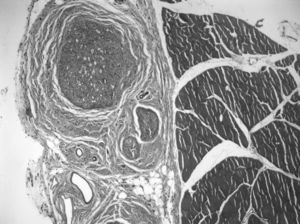
Seguidamente, se practicó un defecto de 15mm en el nervio ciático y se utilizó el autoinjerto obtenido para puentear la lesión crítica del nervio (fig. 1). Se fijó con suturas terminoterminales con monofilamento de 7/0 y se cerró por planos.
Segunda faseSe seleccionaron 20 ratas, machos, de la raza Wistar, de pesos comprendidos entre 250-300g, en los que se descartó la dificultad para la deambulación o dismetría entre las patas. Las 10 primeras se convertirían en controles, en los que se practicó la misma cirugía, pero sin incluir los factores de crecimiento. Las otras 10 completaron todo el protocolo que exponemos a continuación.
A partir de 2 ratas donantes, se obtienen los injertos para todos los animales a estudiar. Se sacrificaron los 2 especímenes según la pauta de finalización del proceso acordado según la Ley de Regularización del uso de animales de experimentación y, se extrajeron sendos bloques musculares de músculo glúteo medio de ambas extremidades. Se reservaron 2 injertos para analizar el proceso de extracción celular seleccionado. Este consistía en 7h en agua destilada, que hay que cambiar 3 veces cada 2-3h; una noche, en un detergente de tritón y 24h en desoxicolato; se lavan en un tampón y se repite todo el proceso; se pasan finalmente a otro tampón y se conservan a 4°C, una vez talladas las piezas17.
Iniciamos el protocolo quirúrgico, practicando anestesia intraperitoneal preoperatoria, con ketamina (75mg/kg) más xilacina (10mg/kg), (Imalgene® 1000 y Rompun®). Por abordaje posterolateral, se expone el nervio ciático. Localizado este, se secciona generando un defecto de 15mm, colocando a modo de puente el bloque muscular acelular con 2 puntos de Prolene 7/0 en cada extremo del mismo, a nivel de epineuro-epimisio. Dentro del injerto, se inyectan 2cc de Increlex® (10mg/ml de mecasermina, en solución inyectable), aportando factores promotores de la regeneración tipo IGF-1. Se sellan las suturan con fibrina (Tissucol®, Baxter, Valencia, España). Se cierra la herida por planos, con reabsorbible en piel.
Cuidados postoperatoriosLas ratas se despiertan de la anestesia a los 20min de finalizar la cirugía, ya introducidas en su jaula definitiva, junto a otra rata en las mismas circunstancias, debido a sus características de animal gregáreo. Portan al despertar un collarete isabelino para evitar la autofagia de la extremidad. Se administraron antibióticos: Calimicina® LA (oxitetraciclina) a dosis de 60mg por cada kg de peso a repetir a las 72h, en inyección subcutánea interescapular, según pauta veterinaria; y analgesia: ibuprofeno 20mg/ml (Dalsy®, Abbott, Madrid) a dosis de 10ml por cada litro de agua de bebida (200mg ibuprofeno/litro de agua de bebida). Las curas de la herida quirúrgica fueron vigiladas hasta el cierre de las mismas.
Método de estudio funcionalLas ratas son pesadas y filmadas cada 2 semanas para grabar los progresos en la deambulación. La recuperación de la función motora se analiza mediante el patrón de marcha. El Índice Funcional Ciático (SFI) es un parámetro útil para evaluar el progreso durante la deambulación: empleamos un túnel de madera para que fuese recorrido por cada rata, dejando marcada su huella en un papel tras pasar por un filtro de tinta. Los valores conseguidos a partir de las huellas se aplicaron en la fórmula propuesta por Bain et al.18; los resultados conseguidos expresan la pérdida funcional en términos de porcentaje: el valor 0 es el que representa la función normal o ausencia de disfunción, y el valor –100 es el que representa la pérdida total de la función (fig. 2).
De Medinaceli et al.19 describieron las siguientes distancias de las patas experimental (E) y normal (N): distancia de la pisada (PL): entre la extremidad del tercer dedo y el calcáneo; anchura de la pisada (TS): entre el primer y el quinto dedo, y la anchura intermedia de la pisada (ITS): entre el segundo y el cuarto dedo, para describir el SFI según la fórmula:
El «Grasping Test» consiste en elevar la rata desde el rabo, permitiendo que se agarre con las patas delanteras a la rejilla; podrán hacerlo si controlan la motilidad de las patas traseras. Se acepta como válido la pinza con 4 dedos y el codo en extensión. Además, nos permite visualizar si le falta algún dedo en la pata operada y si es capaz de estirarlos.Para el estudio funcional, también se completó, posterior al sacrificio y tallaje de las piezas, durante la lectura de los cortes microscópicos, el recuento de los axones mielinizados, valorando la media de las preparaciones según la localización del corte y la opción terapéutica elegida para cada animal. Después, se analizaron los resultados mediante un programa informático con morfometría incorporada (JAVA, Jandel Scientific®).
Las comparaciones estadísticas se hicieron con 2 vías ANOVA utilizando StatView 5.0 software estadístico. Las diferencias entre los valores de p<0,05 fueron consideradas como estadísticamente significativas.
Sacrificio de los animalesLas ratas fueron sacrificadas a los 90-100 días posquirúrgicos, con pesos que rondaban los 450-500g de media. Para ello, recibieron una inyección intracardíaca de pentobarbital sódico (200mg/kg). Se repitió el abordaje de la cirugía, disecando el segmento del nervio ciático que incluía el injerto muscular. De este, se obtuvieron sendas muestras y cortes para preparaciones macro y microscópicas, con tinciones de azul de toluidina, hematoxilina-eosina y tricrómico de Masson. Para completar este estudio, las piezas explantadas, se tallaron y se cortaron en 7 fragmentos, todos diferentes entre ellos en sección de corte y tamaño, pero iguales en todas las piezas, dedicando las pares a inclusión en resina (tinción con azul de toluidina), y los impares para inclusión en parafina y tinción de hematoxilina-eosina y tricrómico de Masson.
ResultadosPrimera faseEl estudio de recuperación funcional muestra cómo los animales recobraron parcialmente la movilidad de la extremidad. Durante el «Grasping Test», 6 de los casos podían extender la pata y los dedos, pero no separar estos. El resto no podía extender ni separar los dedos. Cuatro animales presentaban trastornos tróficos en la extremidad distal intervenida: atrofia de uno o más dedos y úlceras por decúbito. Los 6 restantes presentaban todos los dedos y no tenían úlceras, pero, en general, presentaban amiotrofia de la extremidad intervenida.
Los valores del Índice Funcional Ciático, en el preoperatorio, reflejaban una función normal (SFI: −7±3,37), mientras que a los 7 días postoperatorios (−96±6,29), al mes (−82,24±2,40) y al segundo mes (−47±11,90) esos valores disminuían, lo cual indicaba una pérdida funcional expresiva, y se alcanzaban valores próximos a la normalidad al final del tercer mes (−22,23±2,71).
Macroscópicamente, la zona del injerto muscular aparecía de color blanquecino y fino. Además, en 4 de los animales, el cabo distal estaba degenerado (degeneración lipídica) y con formación de neuroma. Existía correlación entre el aspecto del injerto y la función de la extremidad intervenida, es decir, los injertos cuyo aspecto era de nervio y con un cabo distal menos degenerado se correspondían con extremidades con mayor movilidad y menores alteraciones tróficas.
Microscópicamente, en el cabo proximal podíamos observar axones de tamaño parecido. Se conserva la estructura característica de la sección de un nervio sano: con las típicas fibras mielinizadas de diferentes diámetros distribuidas en fascículos individuales (media del número de fibras mielínicas en cada preparación es 5.865±911). En más del 60% de las muestras, se detectan figuras de degeneración, que son axones que captan más tinción con el azul de toluidina, por desestructuración de la mielina y el axón (degeneración Walleriana: con pérdida avanzada axonal, residuos de mielina, vacuolas y macrófagos fagocitando glicina degenerada y mastocitos). En 2 de los animales, se localizaron cortes con células cebadas, con núcleo y gránulos en el citoplasma, como muestra de la respuesta inmune allí desarrollada.
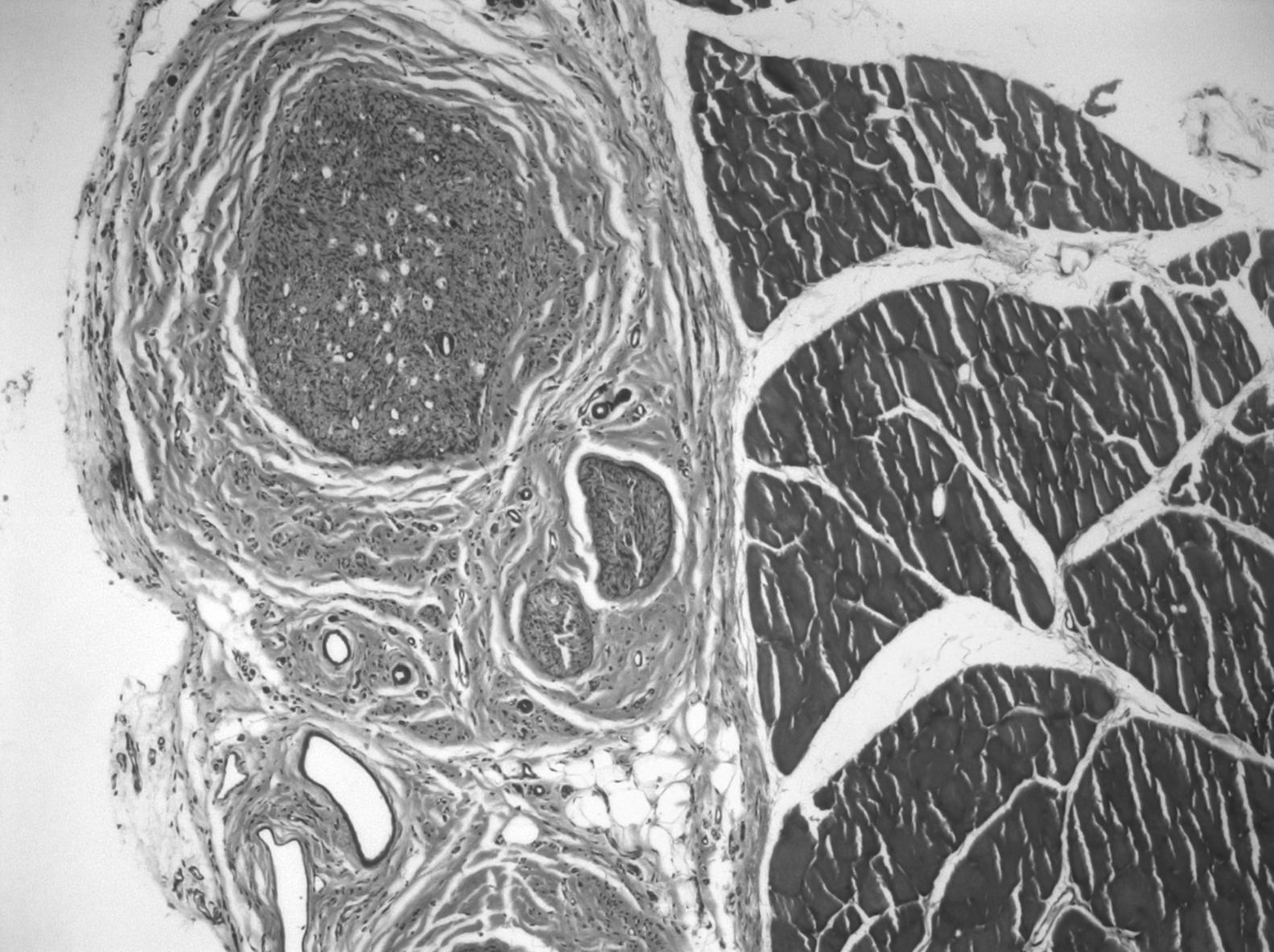
En la zona del injerto, los hallazgos histológicos son más variados. En el 68% de las preparaciones vemos zonas de células musculares y, aposicionado, tejido nervioso, con axones de características morfológicas normales. En 3 de los casos, observamos cortes de interfase músculo-nervio, con una interdigitación de fibras musculares degeneradas y axones. Puede deberse a que es la zona de unión del cabo proximal con el injerto, por la estructura 3D que hace que sea más grande el injerto que el nervio original. Lo más frecuente es encontrar axones de muy diferente tamaño y características histológicas al microscopio de luz (polimorfos), típico de nervio en regeneración, en el espesor del injerto. La media del número de fibras mielínicas en estas preparaciones es 3.519±1.560. Aparecen signos de nervio en proceso de regeneración, avanzando en su crecimiento apoyado sobre el lecho de las células musculares, en el tejido conectivo situado entre ellas: los axones no crecen por dentro del endomisio, sino en su espesor, siguiendo su lámina basal por fuera (fig. 3).
En el cabo distal se observa tejido adiposo, muscular, y zonas de nervio en regeneración, con fibras mielínicas algo más regulares y con más espacio entre ellas (media del número de fibras mielínicas en cada preparación es 2.756±1.156, el 47% de las halladas en el cabo proximal). Las fibras primero se habrían degenerado y después su espacio habría sido invadido por fibras regeneradas: predominio de tejido conectivo con algunos núcleos celulares indiferenciados y pequeños grupos de axones que se encuentran en regeneración. El hallazgo de muchos axones degenerados podría deberse a que estos no encuentran su meta y, por tanto, degeneran. Además, se ven núcleos de células de Schwann cargadas con restos de axones y mielina degenerados, haciendo formas estrelladas y vacuolas, con el típico núcleo central, rodeado periféricamente por axones que forman los cordones de regeneración de Bungner.
Segunda faseEl estudio de recuperación funcional muestra cómo este grupo experimental no presentó úlceras por presión en las patas ni pérdidas digitales, pero en el 80% de los controles se detectó una contractura en flexión digital en la pata afecta; y un 45% de los casos en los que, aunque no extienden los dedos, logran una posición neutra más funcional durante la realización del «Grasping Test».
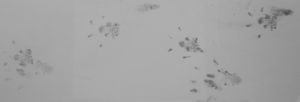
La evaluación del SFI mostró el mismo patrón funcional entre los diferentes grupos estudiados a lo largo del tiempo (preoperatorio y a los 7, 30, 60 y 90 días del postoperatorio). Los valores obtenidos entre 0 y −20, en el período preoperatorio, reflejaban una función normal. Los valores próximos a -100, entre los días 7 y 30 del postoperatorio mostraron una pérdida completa de la función, lo cual indica una ausencia de inervación en este período. Aunque sí que es verdad, que los valores eran más satisfactorios a los 30 días de lo que lo fueron sin el tratamiento de IGF-1. Del día 60 al 90 del postoperatorio, esos valores fueron mejorando, lo que ponía de manifiesto un retorno gradual de la función, hecho que coincide con el período en el que se inicia la reinervación muscular. En el día 90 del postoperatorio, estos valores alcanzaron niveles próximos a la normalidad, característicos de la recuperación funcional posiblemente relacionada con el pico de poliinervación (tabla 1).
Relación de medias aritméticas de los valores del Índice Funcional Ciático para los 3 grupos principales del estudio, según la fecha a la que se realizaron las mediciones de la huella plantar
| SFI | Injerto desnaturalizado | Injerto acelular | Injerto acelular+IGF-1 |
| Preoperatorio | −7±3,37 | −6,85±2,71 | −6,49±2,79 |
| Día 7 | −96±6,29 | −82,24±2,40 | −93,91±2,28 |
| Día 30 | −82,24±2,40 | −76,22±3,55 | −35,48±4,02 |
| Día 60 | −47±11,90 | −34,14±4,47 | −22,41±2,35 |
| Día 90 | −22,23±2,71 | −19,50±2,53 | −10,95±2,80 |
Macroscópicamente, tras el sacrificio de los animales para la extracción de las piezas, llama nuestra atención la excesiva adherencia a planos contiguos, que dificulta la disección, con visualización de un cordón amarillento de estructura tubular y aparentemente homogénea, entre las 2 suturas del injerto, que después tallamos según nuestro protocolo.
Microscópicamente, al analizar los cortes, observamos a nivel del cabo proximal, un nervio de características normales, con su correcta, regular y ordenada distribución fascicular, perfectamente delimitado por sus 3 envolturas, con poco tejido conectivo.
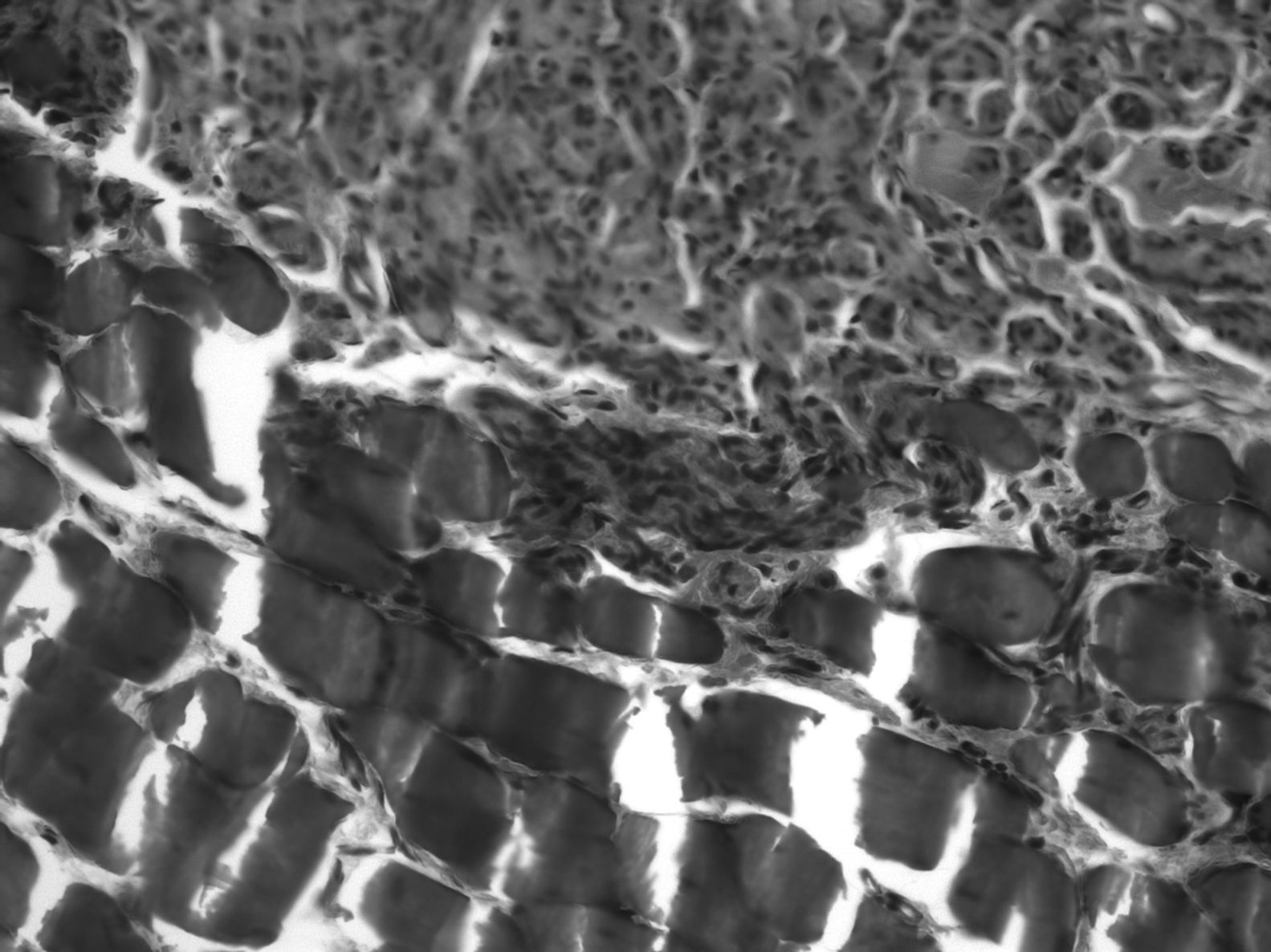
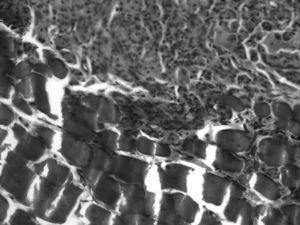
A nivel de la sutura proximal del injerto muscular, en el 80% de los casos, observamos como el nervio regenerado utiliza el músculo a modo de puente sobre el que se apoya para avanzar en sentido distal, con numerosos fascículos nerviosos, pequeños, separados por tejido conjuntivo abundante y multitud de vasos sanguíneos (fig. 4). La media de axones en el segmento proximal de los animales con IGF-1 es 5.740±739, parecido a los 10 controles: 5.651±931.
En la sutura distal del injerto, observamos el nervio con características de regeneración, con fascículos dispersos y de pequeño tamaño, grandes vasos y abundante tejido conjuntivo. Se observan algunas indentaciones de nervio entre las fibras musculares acelulares. La media de axones a nivel del injerto de los animales con IGF-1 es 4.385±938 (paso al injerto del 76% de los axones); en los 10 controles: 4.143±1.030 (73%).
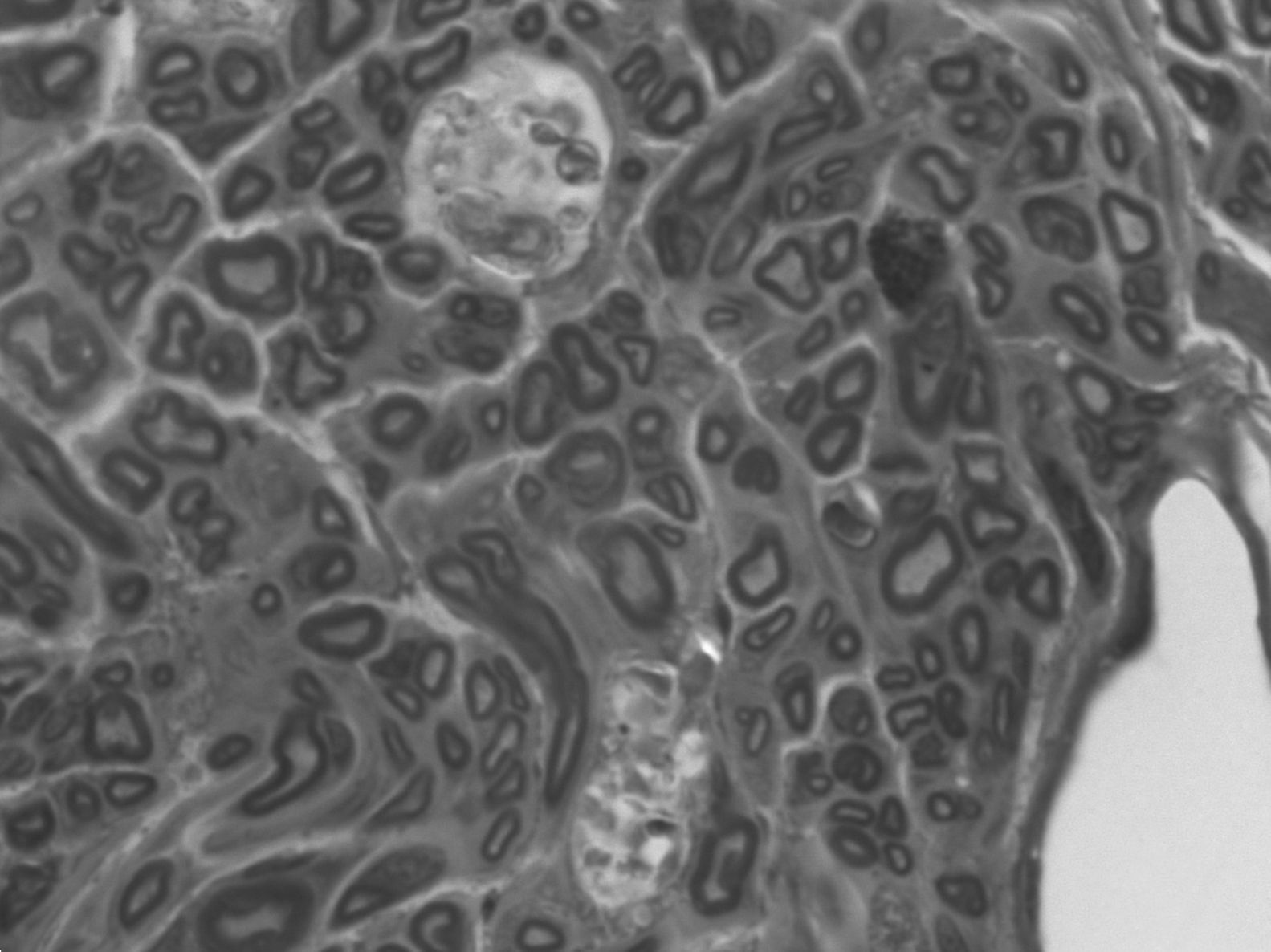
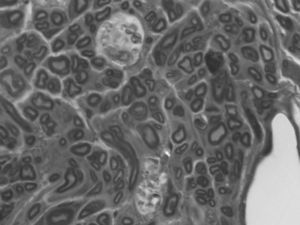
En el cabo distal, no existe una división clara en fascículos. Tiene poco tejido conjuntivo entre las fibras y, sin embargo, el epineuro está bastante desarrollado. El desorden puede estar justificado: las fibras siguen una trayectoria anárquica como corresponde a un nervio regenerado, cuyas fibras están buscando aún su camino. Existe una mayor cantidad de fibras mielinizadas, con un menor diámetro y disposiciones más irregulares que en el grupo sin tratamiento (la media de axones en el cabo distal de los animales con IGF-1 es 3.552±566, 62% de los axones del cabo proximal; media en los controles: 3.183±867, 56%), (fig. 5). La menor densidad axonal y la presencia de fibras con menor diámetro muestran que existen brotes de crecimiento en los axones dañados y que están creciendo a diferente velocidad.
DiscusiónLas lesiones de los nervios periféricos representan una causa mayor de morbilidad y discapacidad en los pacientes afectos, y genera altos costes económicos en una perspectiva global. Se ha estimado que las lesiones del nervio periférico afectan al 2,8% de los pacientes traumatológicos, muchos de los cuales adquieren una discapacidad secundaria de por vida, Noble et al.20. La reparación de los defectos críticos de estos nervios supone un reto para la investigación actual, por la necesidad de descubrir técnicas económica y biológicamente factibles, consecuencia del conflicto generado por el puenteo clásico con nervio autólogo.
Con este proyecto de investigación, hemos intentado avanzar en la línea ya iniciada, en búsqueda de diferentes formas de presentar el injerto muscular como puente en las lesiones críticas nerviosas, y las opciones de las que disponemos para enriquecerlo biológicamente, apoyando nuestro proyecto en las actuales experimentaciones con factores de crecimiento15,16.
En la primera fase de nuestra investigación, conseguimos demostrar que existía paso de axones a través del injerto de músculo estriado y desnaturalizado en microondas, y que las fibras nerviosas se apoyan en la lámina basal de la fibra muscular (endomisio)7. Estos resultados confirman que la técnica elegida es la adecuada, con el hallazgo de tejido de características nerviosas en las muestras biológicas obtenidas del nervio ciático a nivel del injerto muscular aportado.
Vistos estos resultados medianamente satisfactorios, con paso parcial y desorganizado de los axones, trayecto de los axones por fuera de la lámina basal de las fibras musculares, y no por su interior, junto con unos resultados funcionales pobres… nos planteamos un nuevo método de presentar el injerto y enriquecerlo.
Durante la segunda fase de la experimentación, hemos logrado resultados clínicos más satisfactorios, con la recuperación de la marcha en los animales a los que se les practicó un defecto crítico en el nervio ciático, en ambos grupos, tanto con factor de crecimiento como sin él. Hemos observado la aparición de úlceras por presión en los primeros días del postoperatorio de 2 de los controles y varios de ellos con pérdidas digitales; no así en el grupo de casos. Además, la atrofia muscular de la pata operada, que apareció en el 100% de los animales, es más llamativa en el grupo de controles.
Según Varejão et al.21, el SFI representa el método más fiable del análisis de la recuperación funcional, lo cual permite la integración entre los sistemas sensitivo y motor. Los resultados obtenidos en el examen funcional fueron positivos en ambas experimentaciones; aunque se detectaron diferencias a los 30 días de la cirugía en el tratamiento con IGF-1, no resultaron significativas puesto que los valores se igualaron al final del seguimiento.
En cuanto al análisis de los cortes bajo microscopía óptica, los resultados hablan a favor del IGF-1 como promotor de la regeneración axonal, con la objetivación de mayor número de axones mielinizados por campo, mayor densidad de axones y diámetro mayor del nervio a nivel distal. Sí que es verdad que hemos detectado varios animales en los que no localizamos nervio en los cortes centrales, aunque distalmente vemos nervio regenerado, lo que nos hace pensar que podríamos haber perdido tejido durante el talle de los cortes.
A partir del análisis de los resultados obtenidos, podemos afirmar que el músculo acelular que empleamos a modo de injerto constituye un puente útil para el avance de los axones regenerados, quizás por la proximidad estructural de la laminina a las envolturas nerviosas. Así demostramos que las determinaciones celulares en las muestras obtenidas del grupo caso, con factores de crecimiento potenciando la regeneración nerviosa a ese nivel, han superado las obtenidas en el grupo control. Hay 2 casos en los que hemos corroborado el paso de axones entre las fibras musculares del injerto, pero el resto de los animales lo utiliza como vehículo de paso.
Desconocemos la vida media del IGF-1 localmente depositado en el injerto muscular, con nuestro intento por sellarlo dentro con el sellado de fibrina (Tissucol®, Baxter, Valencia, España), colocado a nivel de las suturas. Quizás sí que potencie la regeneración en sus fases iniciales (mejoría del SFI a los 30 días), pero resulte insuficiente para mantenerla a ese nivel, y sean alcanzados los resultados por los controles sin IGF-1 en su meseta de acción (se igualan los resultados funcionales a los 3 meses). Sabemos que varios autores, entre ellos, Kanje et al.22, Sjöberg y Kanje23 y Peter et al.24, han descrito liberaciones pulsátiles o continuas de IGF-1 locales mediante bombas conectadas por catéter desde el abdomen de la rata, con potenciación de los resultados nerviosos funcionales e histológicos tras el sacrificio de los animales.
Surgen nuevas dudas que tendremos que seguir descifrando con las próximas experimentaciones. Algunas de las más destacables serían: el axón utiliza el endomisio para pasar mediante el músculo, ¿pero podría pasar también a través del endomisio intersticial?; la fibrina empleada como sello para nuestras suturas, ¿podría generar más fibrosis y dificultar la disección de las piezas, incluso con pérdida de material?; y como el músculo parece un buen vehículo para el IGF-1, ¿cómo podríamos prolongar la vida media?
Se abre así una nueva línea de investigación en la que trataremos de encontrar el estímulo físico y/o farmacológico para lograr prolongar la supervivencia del factor IGF-1 para potenciar la regeneración nerviosa en defectos críticos del SNP.
ConclusionesLos resultados obtenidos durante la primera fase de la investigación confirman que la técnica elegida es la adecuada, con el hallazgo de tejido de características nerviosas en los cortes y secciones del nervio ciático a nivel del injerto muscular aportado. Durante la segunda experimentación, se confirma nuestra hipótesis demostrando que las determinaciones celulares en las muestras obtenidas del grupo caso, con factores de crecimiento potenciando la regeneración nerviosa a ese nivel, han superado las obtenidas en el grupo control.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A la Fundación SECOT.