La degeneración macular asociada a la edad (DMAE) es la primera causa de ceguera legal en mayores de 50 años en los países desarrollados. Se trata de una enfermedad multifactorial que resulta de la interacción de factores genéticos y ambientales, en la que el único factor de riesgo universalmente admitido es la edad. El impacto socioeconómico de la enfermedad alcanza proporciones colosales si consideramos los elevados costes del tratamiento antiangiogénico disponible, el estricto régimen de revisiones que precisa y la dependencia que origina. La respuesta al tratamiento y los resultados visuales mejoran con el abordaje temprano de las lesiones, por lo que resulta fundamental el diagnóstico de la enfermedad en fases iniciales, basado en el autocontrol con la rejilla de Amsler y en revisiones oftalmológicas periódicas.
Age-related macular degeneration is the leading cause of legal blindness in people over 50 in developed countries. It is a multifactorial disease resulting from the interaction of genetic and environmental factors, and the age is the only worldwide admitted risk factor. The socioeconomic impact of the disease reaches enormous proportions, if we take into account the high cost of the available antiangiogenic therapy, the strict schedule of medical visits that it requires, and the impairment that it gives rise to. The response to treatment and the visual outcomes improve with early management of the retinal lesions, thus the early diagnosis of the disease in its initial phases, based on self-control with an Amsler grid and with regular ophthalmologic assessments, is essential.
La degeneración macular asociada a la edad (DMAE) constituye la primera causa de pérdida visual irreversible en los países desarrollados, en personas por encima de los 50 años. Se trata de un proceso degenerativo que afecta a la porción más externa de la retina (fotorreceptores y epitelio pigmentario), a la membrana de Bruch y a la coriocapilar.
Existe una forma comúnmente denominada maculopatía asociada a la edad (MAE), que incluye todos los cambios que se observan en la mácula relacionados con la edad, sin llegar a afectar la función visual. Por el contrario, el término DMAE implica la pérdida de agudeza visual por la aparición de drusas, atrofia del epitelio pigmentario retiniano o por neovascularización coroidea1.
EpidemiologíaSe estima que la prevalencia global de la DMAE es del 1% en personas entre los 65 y los 74 años, del 5% para el grupo entre 75 y 84 años y del 13% para mayores de 85 años2. Recientemente se ha publicado el primer estudio sobre prevalencia de la DMAE en la población española mayor de 65 años3. La prevalencia total de la maculopatía asociada a la edad alcanzaba el 10,3%, en este estudio, mientras que la prevalencia de la DMAE fue del 3,4%. Los resultados de dicho estudio estiman que puede haber en torno a 255.000 individuos con DMAE en España y alrededor de 773.000 con MAE y, por tanto, en riesgo de progresión a DMAE.
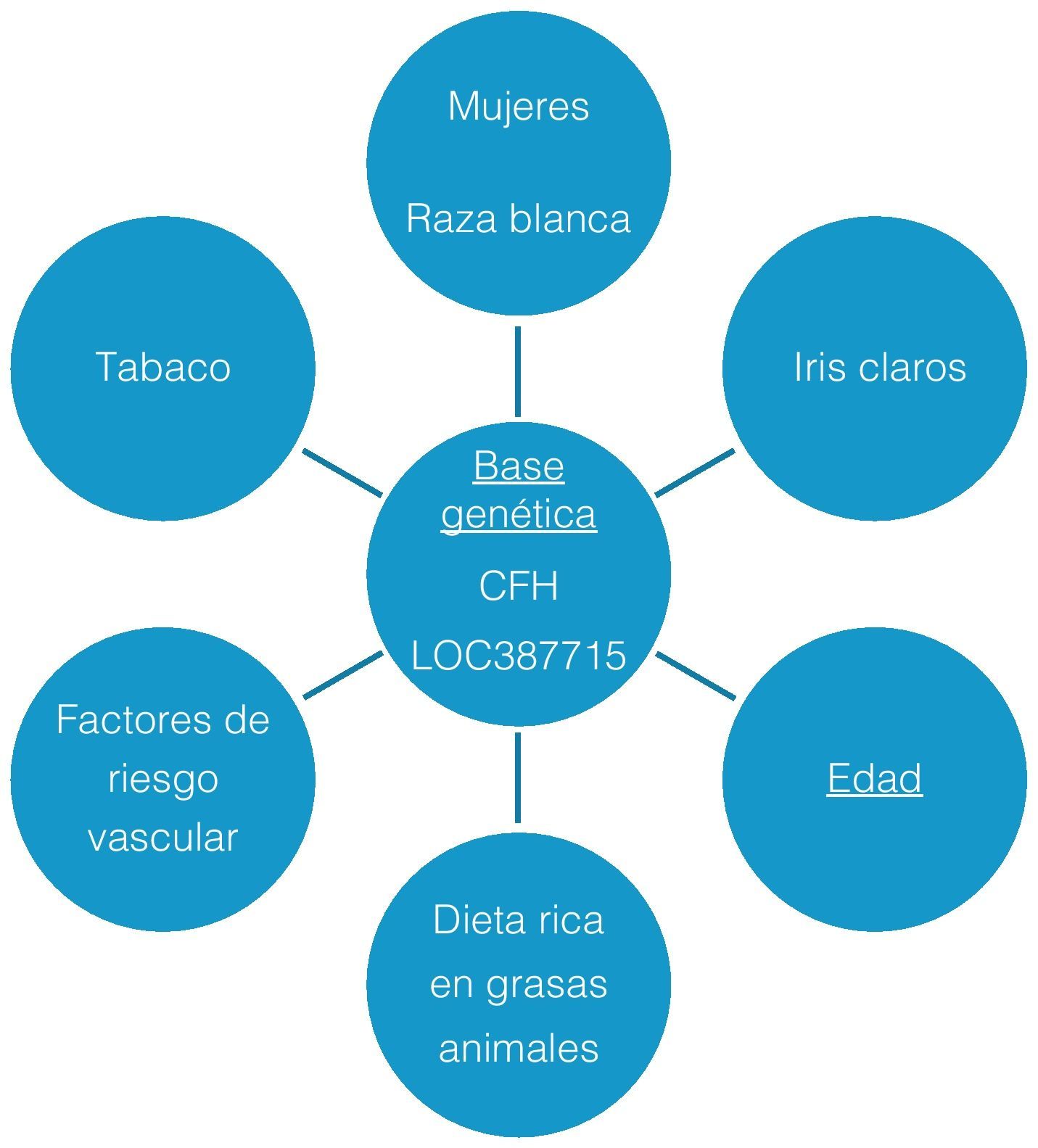
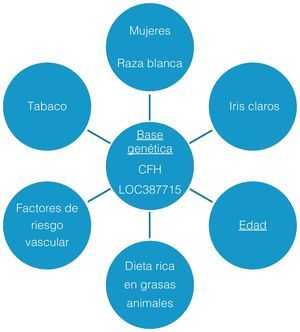
La DMAE es una enfermedad multifactorial con etiología no completamente aclarada que resulta de la interacción de factores genéticos y ambientales (fig. 1). El único factor de riesgo universalmente reconocido es la edad, aunque existen otros factores que se han visto relacionados con un valor diferente dependiendo de los estudios4:
Presenta una mayor prevalencia en raza caucasiana frente a la población de raza negra o hispana. El efecto protector de la melanina coroidea consistiría en absorber los rayos de luz que dañan la retina y actuar, además, como antioxidante.
GéneroSe admite, en general, que las mujeres presentan el doble de riesgo de padecer DMAE que los varones.
Características ocularesLos individuos con iris poco pigmentado presentan un riesgo mayor de padecer DMAE.
Factores genéticosHasta el momento los polimorfismos presentes en dos genes, el CFH y el LOC387715, representan la mayor parte del riesgo atribuible a la DMAE desde el punto de vista genético5. También pueden implicar una peor evolución y respuesta al tratamiento. Se estima que el polimorfismo Y402H en el gen que codifica el factor H del complemento (CFH) puede ser responsable de hasta el 50% del riesgo atribuible, lo que indica que una regulación anómala del sistema del complemento implica una importante susceptibilidad para desarrollar DMAE. En la población española el polimorfismo de riesgo A69S del LOC387715 se asocia con formas avanzadas de DMAE húmeda, pero no con las más precoces.
Factores ambientalesEl consumo de tabaco se asocia con un mayor riesgo de padecer DMAE avanzada tanto la forma neovascular (OR: entre 4,6 a 2,2) como la atrófica (OR: entre 6,65 a 5,32). En fumadores, además, la DMAE aparece en edades más tempranas.
Factores nutricionalesNumerosos estudios apoyan la importancia de los hábitos dietéticos en el riesgo de progresión de la DMAE. Se ha descrito que una dieta rica en luteína, el denominado pigmento visual, reduciría el riesgo de padecer DMAE neovascular en un 40%6. La luteína es un carotenoide, obtenido de las plantas de hoja verde, que se deposita en la retina actuando como filtro biológico de la luz y que es, además, precursora de la zeaxantina teniendo ambas un efecto antioxidante. También se ha descrito un mayor riesgo de progresión de la enfermedad en pacientes con alto consumo de grasas animales, frente al efecto protector de una dieta rica en pescado. Los ácidos grasos omega-3 del pescado forman parte de la membrana celular de los fotorreceptores de la retina y estimulan la síntesis de glutation que presenta un reconocido efecto antioxidante intracelular.
Los suplementos nutricionales de antioxidantes (betacarotenos, vit A, vit C y vit E) y minerales (zinc y cobre), a altas dosis, se han mostrado eficaces para frenar la progresión de la enfermedad hacia formas avanzadas en algunos grupos de pacientes, según el estudio AREDS 1(Age Related Eye Disease Study 1)7. Un segundo estudio en curso, AREDS 2, pretende confirmar la eficacia de los suplementos de luteína/zeaxantina y de los ácidos grasos omega-3, así como el efecto de reducir a la mitad las dosis de zinc y eliminar los betacarotenos del preparado original.
Estos estudios realizados en Estados Unidos deben ser extrapolados con cautela a una población, como la española, con hábitos alimenticios diferentes y en la que dosis menores de antioxidantes podrían obtener un efecto protector similar frente a la DMAE.
Factores cardiovascularesLa teoría vascular de la DMAE establece que la arterioesclerosis y el exceso de lípidos producen un aumento en la resistencia al flujo sanguíneo de la coroides que altera el metabolismo del epitelio pigmentario de la retina (EPR) dando lugar a la aparición de drusas, cambios pigmentarios y DMAE4. Basándose en esos supuestos, se han estudiado los factores de riesgo vascular como hipertensión arterial, colesterol, arterioesclerosis y diabetes, sin que se haya conseguido confirmar, de forma clara, su relación con el desarrollo de DMAE.
EtiopatogeniaLa DMAE incluye cambios provocados por el envejecimiento, además de los producidos por la propia enfermedad. Las alteraciones que se observan de forma habitual con el envejecimiento se atribuyen al estrés oxidativo y a los cambios vasculares propios de la edad. Se considera que en individuos genéticamente predispuestos a padecer DMAE, la interacción de determinados factores ambientales acrecentaría el daño oxidativo sobre el EPR desencadenando una respuesta inflamatoria sobre la membrana de Bruch y la coriocapilar. Dicha inflamación fomentaría la producción de una matriz extracelular anómala que se acumula a nivel de la membrana de Bruch (Drusas) alterando su permeabilidad y reduciendo la difusión de oxígeno, nutrientes y vitamina A desde la coroides hacia el EPR. En respuesta a esta alteración metabólica, el EPR produciría sustancias que estimulan el crecimiento de neovasos coroideos, dando lugar a la forma neovascular de la enfermedad. La alteración irreversible de la homeostasis, a nivel macular, conduce a la muerte celular del EPR con pérdida de la coriocapilar que da lugar a la forma atrófica avanzada de la enfermedad8.
Presentación clínicaClásicamente la DMAE se ha clasificado en dos grandes grupos:
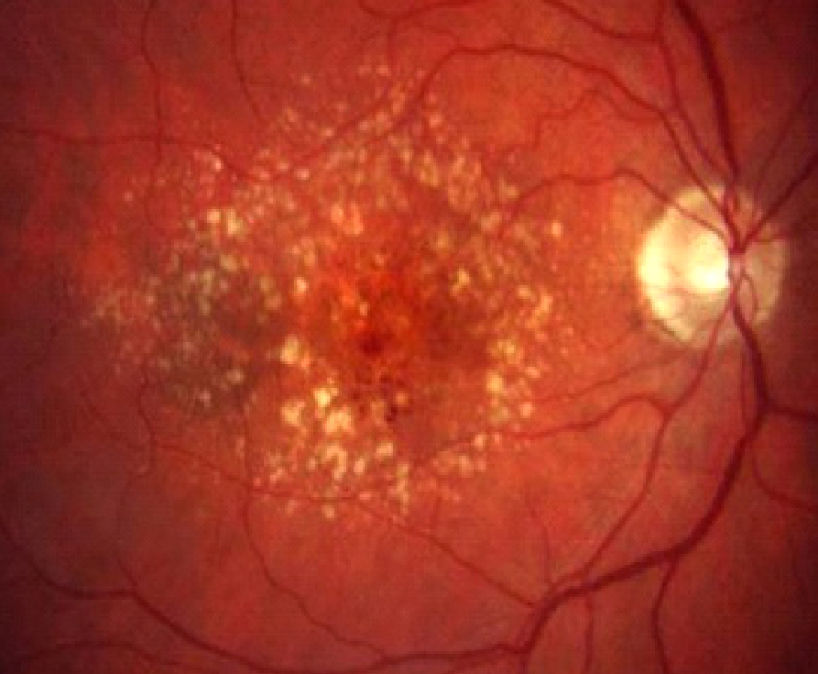
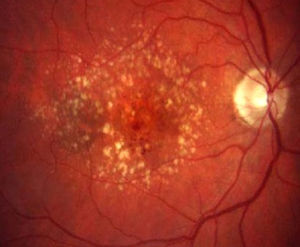
Degeneración macular asociada a la edad atrófica o secaCaracterizada por la presencia de drusas, alteraciones pigmentarias y parches de atrofia coriorretiniana que confluyen, en la forma más avanzada de la enfermedad, formando una placa geográfica.
El dato fundamental de la DMAE atrófica son las drusas y se corresponden con los depósitos anómalos a nivel de la membrana de Bruch y el EPR (fig. 2). Hay que tener en cuenta, que la presencia de drusas duras pequeñas aisladas constituye un hallazgo frecuente en los mayores de 50 años y no se considera DMAE.
Degeneración macular asociada a la edad neovascular o exudativaDefinida por la presencia de neovasos coroideos o de una cicatriz glial resultado de una lesión antigua. La presencia de sangre, exudación lipídica o desprendimientos del EPR nos hacen sospechar la presencia de neovasos coroideos. La relación aproximada entre lesiones neovasculares y atróficas es de 2:1 frente a la creencia tradicional de que la forma atrófica era la más frecuente1.
El grupo de estudio de la enfermedad asociada a la edad (AREDS)7 elaboró una escala de gradación simplificada basada en los hallazgos del fondo de ojo y que permiten identificar a los pacientes con riesgo elevado de progresión:
- -
Categoría 1 o ausencia de no degeneración macular asociada a la edad: presencia de una o varias drusas pequeñas.
- -
Categoría 2 o degeneración macular asociada a la edad precoz: combinación de múltiples drusas pequeñas, algunas drusas intermedias o alteraciones en el EPR.
- -
Categoría 3 o degeneración macular asociada a la edad intermedia: múltiples drusas intermedias, una drusa grande o áreas de atrofia geográfica que no afecten al centro de la fóvea. Implica un alto riesgo de progresión a formas avanzadas de la enfermedad, tanto atrófica como neovascular.
- -
Categoría 4 o degeneración macular asociada a la edad avanzada: atrofia geográfica que afecta la fóvea o cualquier signo de la forma neovascular.
En estadios iniciales, la enfermedad suele ser asintomática y constituye un hallazgo casual en una exploración del fondo de ojo por otro motivo. Con frecuencia, sin embargo, aparece visión borrosa y distorsionada que el paciente refiere como visión torcida (metamorfopsia) o alteración en la percepción del tamaño (micropsia) o del color de las cosas9. Si la enfermedad progresa, la agudeza visual se va reduciendo hasta alcanzar los límites de la ceguera legal (0,1). En las formas avanzadas de la enfermedad el paciente presenta un escotoma o punto ciego dentro del campo visual central que le impide leer, mirar el reloj, marcar números de teléfono o reconocer las caras. En general la forma atrófica disminuye la función visual de forma lenta, a lo largo de los años, mientras que la forma neovascular progresa rápidamente en pocas semanas o meses. El campo visual periférico no se afecta por la enfermedad, en la mayor parte de los pacientes, lo que les permite conservar autonomía en la deambulación y en las tareas que no precisen una visión de detalles, ya que el resto de la retina sana no tiene la capacidad discriminatoria del área macular. Conviene recordar que un reducido grupo de pacientes con DMAE presentan formas de gran tendencia hemorrágica que llegan a comprometer todo el campo de visión. En estadios terminales de la enfermedad pueden aparecer alucinaciones visuales complejas y estereotipadas que el paciente reconoce como irreales (síndrome de Charles Bonnet), pero que no suele manifestar por temor de que se atribuyan a un deterioro mental10.
DiagnósticoDebemos elaborar una cuidadosa historia clínica que recoja los datos sobre la edad, los antecedentes personales y familiares incluyendo los hábitos dietéticos y tóxicos del paciente. Se realiza una exploración oftalmológica básica con especial atención a la medida de agudeza visual, tanto en visión próxima como lejana, y la valoración del grado de metamorfopsia mediante la prueba de Amsler (fig. 3). Se trata de una cuadrícula de líneas negras sobre fondo blanco que se examina con la corrección adecuada para visión próxima, a una distancia de lectura y tapando el ojo no explorado. La rejilla de Amsler nos servirá, posteriormente, para valorar la progresión y la respuesta al tratamiento, además de emplearse como medio de autocontrol del paciente a nivel domiciliario.
El diagnóstico clínico se basa en los hallazgos del fondo de ojo ya mencionados en apartados anteriores. La aparición de drusas, alteraciones pigmentarias o parches de atrofia coriorretiniana es suficiente para establecer el diagnóstico de DMAE atrófica. La presencia de hemorragias, exudación lipídica o levantamiento de la retina neurosensorial o del EPR sugiere la presencia de la forma neovascular de la enfermedad, que normalmente se confirma con alguna prueba complementaria como:
Angiografía fluoresceínicaLa angiografía fluoresceínica (AFG) permite confirmar el diagnóstico de neovasos coroideos, su grado de actividad y su localización respecto a la fóvea, gracias a la difusión de contraste desde los vasos anómalos. También nos permite hacer el diagnóstico diferencial con otras entidades que cursan con hemorragias y exudación lipídica como macroaneurimas y oclusiones vasculares. En las formas atróficas estaría indicado hacer AFG si sospechamos la presencia de una membrana neovascular2.
Angiografía con verde de indocianinaLa angiografía con verde de indocianina (ICG) permite estudiar mejor las membranas neovasculares ocultas y descartar la presencia de pólipos (vasculopatía coroidea polipoidal idiopática) y de proliferación angiomatosa retiniana (RAP), dado que son dos entidades que precisan un enfoque adaptado a sus particularidades clínicas.
AutofluorescenciaRecoge la fluorescencia de la lipofucsina acumulada de forma normal en el EPR con el envejecimiento. Es muy útil en DMAE atrófica delimitando mejor las zonas de atrofia (hipofluorescentes) y revelando las zonas de riesgo de desarrollar atrofia o membrana neovascular (hiperfluorescentes).
Tomografía de coherencia ópticaLa tomografía de coherencia optica (OCT) obtiene cortes tomográficos de la retina en el área macular con una gran resolución, que proporciona imágenes de detalles tan precisos que emulan los de un verdadero corte histológico. Permite, en los casos de DMAE, evaluar la cantidad de fluido intra o subretiniano de forma cualitativa y cuantitativa, por lo que resulta indispensable en el seguimiento de las lesiones exudativas y en la valoración de su respuesta al tratamiento. Permite, además, estimar la integridad de las capas externas de la retina que condiciona la capacidad de recuperación funcional del paciente.
Manejo terapéutico actual de la degeneración macular asociada a la edad atróficaEn la actualidad no existe ningún tratamiento con eficacia clínica demostrada para mejorar o detener la progresión de la forma atrófica de la DMAE.
En la fase inicial de la enfermedad, definida como DMAE precoz con drusas pequeñas o intermedias y alteraciones pigmentarias, no está indicado ningún tratamiento específico. El estudio AREDS 1 no encontró beneficios con el uso de los suplementos combinados de vitaminas antioxidantes y minerales7. Se aconseja una dieta rica en zeaxantina y luteína que aumentan la resistencia de la mácula a los radicales libres y que están presentes en frutas y verduras, pero en mayor concentración en espinacas, brécol, berros, maíz, naranja y yema de huevo. Otras de las recomendaciones dietéticas son el pescado azul y los frutos secos, debido a su alto contenido en ácidos grasos poliinsaturados de cadena larga de la familia del omega-3. De ellos, el ácido docosahexaenoico (DHA) es el que parece más directamente implicado en la prevención de las lesiones retinianas inducidas por la edad11. El manejo de estos pacientes debe incluir la recomendación de abandonar el consumo de tabaco y de realizar autocontroles, con la rejilla de Amsler, que permitan detectar de forma precoz el agravamiento de la enfermedad.
Los casos de DMAE intermedia o de DMAE avanzada en uno de los ojos suponen un alto riesgo de progresión. En estos pacientes el estudio AREDS 1 encontró un claro beneficio con el uso de suplementos nutricionales, que redujeron en un 25% el riesgo de progresión a formas avanzadas7. Varios estudios en curso tratan de investigar una posible relación entre la respuesta a los suplementos y los genotipos de riesgo para DMAE. Es importante destacar, así mismo, que las dosis altas de estos suplementos no están exentas de riesgos. Se ha relacionado el uso de betacarotenos (provitamina A) con el desarrollo de cáncer de pulmón en pacientes fumadores, la vitamina E con el riesgo de fallo cardiaco en pacientes con enfermedades vasculares y el zinc con enteropatía.
Cuando el deterioro visual alcanza los límites de la baja visión (0,3), el paciente presenta incapacidad para actividades de la vida cotidiana, especialmente para la lectura, y debe ser evaluado en unidades especializadas en baja visión que le proporcionen ayudas específicas para aprovechar al máximo su remanente de visión. Se trata, en esencia, de gafas y sistemas ópticos o electrónicos (TV) que aumentan el tamaño del objeto de interés lo suficiente para que supere las dimensiones del escotoma central, o de prismas que desvían la imagen hacia zonas sanas de la retina. Las ayudas visuales requieren un adiestramiento del paciente que le permita interpretar la identidad del objeto (letra, dígito, etc.) viéndolo de forma incompleta. También se fomenta la fijación excéntrica y la utilización de filtros12.
Manejo terapéutico de la degeneración macular asociada a la edad exudativaEl tratamiento de lesiones de naturaleza vascular que afectan la fóvea o sus proximidades, respetando la retina sensorial en la que asientan, constituye un gran reto para la oftalmología moderna. Hasta hace poco más de 10 años solo contábamos con el láser térmico y la cirugía vitreorretiniana como únicas armas terapéuticas frente a la DMAE exudativa, con pésimos resultados dado que, a la larga, dañaban de forma irreversible el área de retina tratada13. A principios del año 2000, la terapia fotodinámica fue el primer intento de tratamiento selectivo que buscaba el cierre de los neovasos coroideos sin dañar la retina suprayacente, aunque solo conseguía enlentecer la progresión de las lesiones en algunos pacientes14.
Los antiangiogénicos han sido la gran revolución en el tratamiento de la DMAE exudativa que permite, por primera vez, cambiar el curso natural de la enfermedad consiguiendo, en algunos casos, mejorar la agudeza visual y mantenerla en la mayoría15. El tratamiento más eficaz, en este momento, es la inyección intravítrea directa de preparados que actúan contra el factor de crecimiento endotelial vascular A (VEGF-A), que es uno de los agentes más importantes involucrados en el estímulo angiogénico. Existen dos fármacos aprobados para el tratamiento de la DMAE exudativa que actúan uniéndose al VEGF-A e impidiendo la unión con sus receptores en la superficie de las células endoteliales16:
Ranibizumab (Lucentis®)Fracción variable del anticuerpo monoclonal anti-VEGF que bloquea todas sus isoformas. Es el tratamiento de elección en DMAE exudativa desde 2006, tras los buenos resultados ofrecidos por los ensayos clínicos MARINA17 y ANCHOR18, que mostraron la estabilización de la visión en el 95% de los pacientes y un incremento significativo de visión hasta en el 40% de los casos, aplicado cada 4 semanas durante dos años. En una revisión completa de la literatura, el fármaco se ha mostrado seguro con un nivel I de evidencia, aunque por sus potenciales efectos sistémicos se contraindica en pacientes con episodio coronario o cirugía gastrointestinal recientes, enfermedad hemorrágica no controlada y en niños o mujeres lactantes19.
Pegaptanib (Macugen®)Aptámero selectivo contra la isoforma 165 del VEGF. Los resultados que ofrecen los ensayos clínicos (VISION), son inferiores en eficacia a los de otros antiangiogénicos y, aunque disminuye el riesgo de pérdida visual en todas las formas de DMAE exudativa, la probabilidad de obtener mejorías significativas de visión es baja (6%). Tiene un buen perfil de seguridad gracias a su selectividad por la isoforma 165, que disminuye los riesgos cardiovasculares20. Fue aprobado en 2004 y actualmente se usa como segunda línea de tratamiento, cuando el ranibizumab está contraindicado. Se aplica cada 6 semanas.
Bevacizumab (Avastin®)Antes de disponer del ranibizumab, Rosenfeld et al. observaron que algunos pacientes con DMAE tratados por cáncer con bevacizumab (Avastin®) sistémico experimentaban un incremento en su agudeza visual. Se trata del anticuerpo monoclonal completo antiVEGF del que procede el ranibizumab e inhibe, por tanto, todas sus isoformas. Tratando de evitar las múltiples complicaciones asociadas al uso intravenoso del bevacizumab (crisis hipertensivas, hemorragias, perforación gastrointestinal, síndrome nefrótico, incidentes aterotrombóticos), decidieron inyectar una pequeña cantidad del fármaco directamente en el vítreo, fuera de indicación, obteniendo resultados preliminares muy satisfactorios21. Desde entonces su uso se extendió por todo el mundo, incluso tras la aprobación del ranibizumab para DMAE, al observarse unos beneficios equiparables con un coste 40 veces menor, a pesar de que no se disponía de estudios que evidenciaran la misma eficacia y seguridad. Recientemente se han publicado los resultados del estudio CATT (Comparation of Age-related macular degeneration Treatment Trial) que, con un diseño adecuado y un año de seguimiento, muestra una eficacia muy similar entre los dos antiangiogénicos, con un coste anual de 13.800$ por cada paciente con ranibizumab y 385$ con bevacizumab, por una media de 7 inyecciones21. Este estudio no ha permitido evidenciar los mismos niveles de seguridad para el bevacizumab, frente a complicaciones sistémicas graves, por lo que se precisan más estudios que faciliten su aprobación por las autoridades sanitarias.
Las complicaciones más frecuentes del tratamiento con antiangiogénicos aparecen a nivel ocular, estando más en relación con la maniobra de inyección intravítrea que con el propio fármaco. Las infecciones intraoculares muestran una baja incidencia según la mayoría de los estudios, incluido el CATT (0,04% con ranibizumab y 0,07% con bevacizumab)22,23, aunque la manipulación que precisa el bevacizumab a partir del vial para uso intravenoso, especialmente fuera del ámbito hospitalario, ha motivado una alerta de la FDA a finales de agosto de este mismo año por el riesgo de infecciones. Otras complicaciones como uveítis, desprendimiento o desgarros retinianos y alteraciones vasculares de la retina aparecen en menos de un 1%.
La limitación de los agentes antiangiogénicos disponibles es su condición de sustancias bloqueadoras y no inhibidoras del VEGF, por lo que su efecto desaparece con el tiempo. Esto nos obligaba a repetir el tratamiento de forma mensual y por tiempo indefinido, en muchos pacientes, aumentando exponencialmente la carga asistencial y los riesgos acumulados por las inyecciones repetidas.
En la actualidad hemos pasado del tratamiento fijo mensual a nuevos protocolos que permitan mantener buenos resultados anatómicos y funcionales con un menor número de visitas y reinyecciones. Se admite, en general, el empleo de una dosis inicial de carga de tres inyecciones (mensuales), seguida de retratamientos en función de la persistencia de fluido en la tomografía de coherencia óptica (OCT), alargando el período de seguimiento hasta encontrar el intervalo más adecuado para cada paciente23. Así hemos pasado de las 12 inyecciones anuales, que proponían los primeros estudios, a una media de entre 5 y 6 inyecciones al año con resultados satisfactorios. Conviene recordar, sin embargo, que los resultados visuales se incrementan con el tratamiento temprano de cualquier signo de actividad24.
VEGF Trap Eye (Aflibercept®)En vías de aprobación se encuentra un nuevo fármaco, el VEGF Trap Eye (Aflibercept®), que extiende su acción antiangiogénica bloqueando el VEGF-A, el VEGF-B y el factor de crecimiento placentrario (PIGF)25, ya que incorpora fragmentos de los dos principales receptores de la familia del VEGF. Este amplio espectro de bloqueo puede ofrecer, a priori, un efecto antiangiogénico más potente, más duradero y menos propenso al desarrollo de resistencias. Los estudios VIEW 1 y 2 han mostrado una eficacia similar al ranibizumab con menor número de inyecciones, por lo que se perfila como una futura alternativa de primera línea.
En casos de resistencia al tratamiento o en formas más agresivas de la enfermedad, como la proliferación angiomatosa retiniana, se plantea cambiar de agente antiangiogénico o tratamientos combinados con terapia fotodinámica.
Conviene recordar que la experiencia mundial en el uso de los fármacos antiangiogénicos, en el ámbito clínico, es tan solo de 6 años y quedan muchas cuestiones por resolver. Desconocemos los efectos de la inhibición del VEGF a largo plazo y debemos aprender a identificar a los no respondedores, además de poner en marcha nuevas dianas terapéuticas y sistemas de liberación sostenida que permitan distanciar los tratamientos sin perder eficacia.
ConclusiónLa DMAE es una enfermedad que afecta de forma devastadora a la visión, reduciendo decisivamente la calidad de vida de los pacientes y con un impacto socioeconómico de enorme magnitud. No existe, en el momento actual, un tratamiento curativo de la enfermedad, aunque los antiangiogénicos se han mostrado eficaces en el control de los síntomas de la neovascularización. El tratamiento temprano resulta básico para reducir el deterioro a largo plazo de la visión y por ello se debe insistir en el autocontrol de los pacientes con la rejilla de Amsler y en ajustar las revisiones al intervalo que nos permita retratar ante mínimos signos de actividad.