La medicina de precisión en oncología podría definirse como la medicina dirigida a dar a los pacientes el mejor tratamiento según su historia clínica, su estado fisiológico y las características moleculares de sus tumores. Con ello se persigue obtener una mayor eficacia del tratamiento con menor toxicidad y menor gasto. Se basa, en parte, en la búsqueda de biomarcadores que nos permitan seleccionar el mejor tratamiento para cada paciente.
El dolor crónico es de difícil manejo porque los procesos en el sistema nervioso que provocan el dolor no están perfectamente identificados. El dolor en estas circunstancias es la expresión de un sistema nervioso que funciona patológicamente. Al igual que en otras enfermedades neurológicas complejas, es muy poco probable que un único biomarcador pueda «capturar» el dolor en su totalidad.
Se suma a todo ello que la forma estándar de evaluar el dolor es con escalas de calificación y cuestionarios basados en síntomas. Tenemos por tanto herramientas de difícil reproductibilidad y que están influenciadas por un espectro de variables subjetivas.
¿Con qué precisión se puede medir el dolor de mañana si es idéntico o diferente al de hoy?, ¿su peor dolor es el mismo que el de alguien con una genética, cultura o ambiente diferente? En la experiencia del dolor influyen varios factores como el estado de ánimo, el contexto sociocultural y el nivel cognitivo. Es por todo ello que la evaluación del dolor es compleja y variable.
Hay que abandonar la visión de que el dolor categorizado como leve, moderado y severo determina la elección terapéutica y evolucionar a un nuevo modelo en el que reconozcamos que la experiencia del paciente con dolor es la consecuencia de múltiples procesos neurobiológicos, cada uno de los cuales ofrece la oportunidad de ser tratado de manera diferente1.
Debemos además desarrollar terapias (farmacológicas, quirúrgicas, físicas y psicológicas) que se dirijan selectivamente a los mecanismos subyacentes y poder evaluar con mayor precisión su eficacia, de manera similar a la evolución que ha experimentado la oncología.
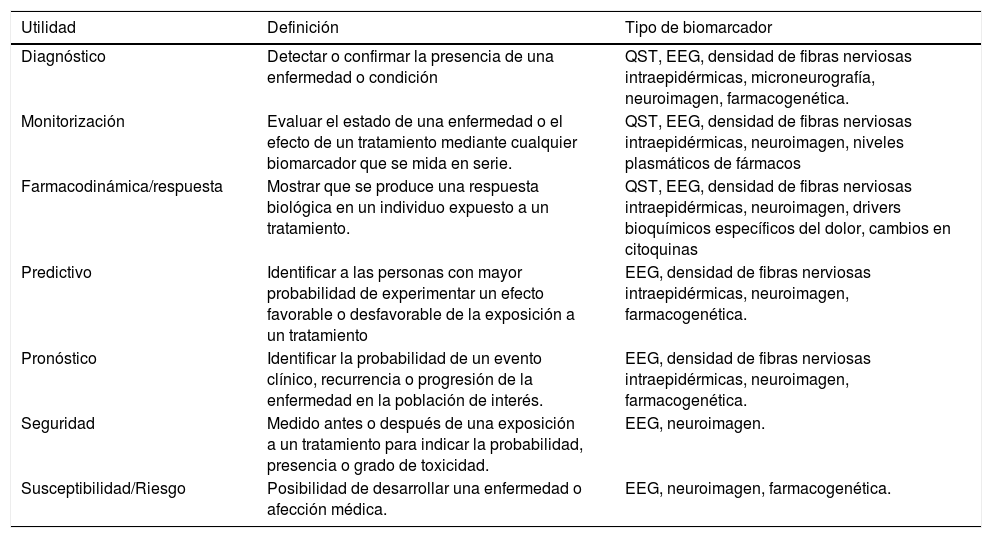
El beneficio de disponer de biomarcadores específicos, sensibles y precisos para el dolor resultaría enorme. Debido a la complejidad del dolor, sería necesaria la combinación de varios de ellos para poder realizar un manejo global y eficaz. Los distintos biomarcadores potenciales del dolor se resumen en la tabla 11–5.
Definiciones de biomarcadores de dolor y ejemplos
| Utilidad | Definición | Tipo de biomarcador |
|---|---|---|
| Diagnóstico | Detectar o confirmar la presencia de una enfermedad o condición | QST, EEG, densidad de fibras nerviosas intraepidérmicas, microneurografía, neuroimagen, farmacogenética. |
| Monitorización | Evaluar el estado de una enfermedad o el efecto de un tratamiento mediante cualquier biomarcador que se mida en serie. | QST, EEG, densidad de fibras nerviosas intraepidérmicas, neuroimagen, niveles plasmáticos de fármacos |
| Farmacodinámica/respuesta | Mostrar que se produce una respuesta biológica en un individuo expuesto a un tratamiento. | QST, EEG, densidad de fibras nerviosas intraepidérmicas, neuroimagen, drivers bioquímicos específicos del dolor, cambios en citoquinas |
| Predictivo | Identificar a las personas con mayor probabilidad de experimentar un efecto favorable o desfavorable de la exposición a un tratamiento | EEG, densidad de fibras nerviosas intraepidérmicas, neuroimagen, farmacogenética. |
| Pronóstico | Identificar la probabilidad de un evento clínico, recurrencia o progresión de la enfermedad en la población de interés. | EEG, densidad de fibras nerviosas intraepidérmicas, neuroimagen, farmacogenética. |
| Seguridad | Medido antes o después de una exposición a un tratamiento para indicar la probabilidad, presencia o grado de toxicidad. | EEG, neuroimagen. |
| Susceptibilidad/Riesgo | Posibilidad de desarrollar una enfermedad o afección médica. | EEG, neuroimagen, farmacogenética. |
QST: prueba sensorial cuantitativa, EEG: electroencefalograma.
No todos serían necesarios, si bien en el manejo rutinario del paciente con dolor utilizaríamos biomarcadores de seguridad y monitorización, en pacientes recién nacidos o con imposibilidad para una correcta comunicación (demencias avanzadas), sería de mayor utilidad un biomarcador de respuesta farmacodinámica3.
Ilusionante es pensar que en un futuro no muy lejano se podrán implementar pruebas radiológicas funcionales como resonancia magnética cerebral funcional utilizando la inteligencia artificial «machine learning» para poder aportar algo más de objetividad en el desarrollo de ensayos clínicos que evalúen el beneficio de las nuevas terapias analgésicas, así como la farmacogenética que nos ayude a seleccionar el mejor tratamiento analgésico y dosificación del mismo de forma paralela o similar al desarrollo de la medicina de precisión en oncología en la últimas décadas. Eso sí, sin olvidar que en la percepción del dolor influyen diversos factores como los ambientales, espirituales y personales difíciles de «medir» con pruebas objetivas y que influyen de forma directa y determinante en la vivencia del dolor.
Si bien en la actualidad deberemos seguir guiando nuestra decisión terapéutica analgésica en función de la valoración subjetiva del paciente, comorbilidades y preferencias del mismo, se abre un horizonte de oportunidades a medio y largo plazo en el que podremos seleccionar con mayor precisión el tratamiento analgésico idóneo para cada tipo de dolor, tipo de paciente y momento concreto en la evolución de su dolor, obteniendo con ello una mayor eficacia, menor toxicidad, optimización de los recursos y lo que es más importante, una mayor satisfacción de los pacientes. Además, en la población anciana sería de especial interés debido a la alta incidencia de dolor, probabilidad de polifarmacia, deterioro fisiológico progresivo de la función renal/hepática y mayor riesgo de interacciones farmacológicas.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesTodos los autores declaran no tener ningún conflicto de intereses.