Entre los principales componentes lipídicos de las membranas celulares se encuentran los glicerofosfolípidos, que se sintetizan en una vía de novo a partir del diacilglicerol (DAG). El perfil lipídico es una característica optimizada asociada con la longevidad animal. En este contexto, hipotetizamos que la tasa de biosíntesis de DAG y, por extensión, de glicerofosfolípidos, guarda una relación con la longevidad de una especie animal.
Material y métodosSe realiza un análisis lipidómico basado en espectrometría de masas del plasma de 11 especies de mamíferos que cubren un rango de longevidad máxima de 3,5 a 120 años. La identificación de especies lipídicas se basa en masa exacta, tiempo de retención y distribución isotópica. Se aplica un test ANOVA para obtener las especies lipídicas diferenciales entre las especies y la correlación de Spearman para establecer su asociación con la longevidad. Los análisis estadísticos se realizaron con el programa SPSS y el software para el análisis metabolómico MetaboAnalyst.
ResultadosEntre las 1.061 especies moleculares lipídicas diferenciales se identifican 47DAG, 14 de los cuales presentan una correlación significativa y negativa con la longevidad animal. El análisis multivariante muestra que solamente con estos 14DAG somos capaces de discriminar una especie animal y su longevidad máxima.
ConclusionesEstos resultados indican que las especies longevas tienen una menor tasa de biosíntesis de novo de glicerofosfolípidos, posiblemente asociada a una menor tasa de recambio de los lípidos de membrana, lo que conllevaría un menor coste energético.
The glycerophospholipids, synthesised from diacylglycerol (DAG), are one of the main lipid components of cell membranes. The lipid profile is an optimised feature associated with animal longevity. In this context, the hypothesis is presented that the DAG biosynthesis rate, and thus, the glycerophospholipids content, is related to animal longevity.
Material and methodsA plasma lipidomic analysis was performed based on the mass spectrometry of 11 mammalian species with a maximum longevity ranging from 3.5 to 120 years. Lipid identification was based on exact mass, retention time, and isotopic distribution. ANOVA test was applied to differentiate the lipids between animal species. The relationship between these lipids and longevity was carried out with a Spearman correlation. Data was analysed using SPSS and MetaboAnalyst.
ResultsAmong the 1,061 different lipid molecular species found between species, 47 were defined as DAG. Interestingly, 14 of them showed a negative correlation with mammalian maximum longevity. Multivariate statistics revealed that 14 DAGs were enough to define mammalian species and their maximum longevity.
ConclusionsData suggest that long-lived mammalian species have a lower rate of glycerophospholipids synthesis through the de novo pathway, possibly associated with a lower rate of membrane lipid exchange, which in turn is related to lower energy expenditure.
La función primaria de los lípidos en los sistemas biológicos es generar membranas. Fue posteriormente durante la evolución que esta propiedad se extendió a nuevas funciones tales como la señalización celular y, más tarde, el almacenamiento de energía. Los lípidos son macromoléculas esenciales para la vida que se encuentran en todos los organismos vivos, constituyendo los elementos centrales de las membranas biológicas. Durante la década de los 70-80 se describió por primera vez que la composición lipídica varia de forma sistemática entre las distintas especies de mamíferos1,2.
Existen evidencias científicas que muestran que la vida aeróbica, y las especies longevas, han evolucionado reduciendo el contenido de aquellos componentes con mayor susceptibilidad de ser dañados oxidativamente, lo que les confiere una mayor estabilidad estructural3. En términos lipídicos, esto se traduce en una disminución del grado de insaturación y, en consecuencia, una mayor resistencia a la oxidación, de las membranas biológicas tisulares en las especies más longevas4–9, incluyendo vertebrados10–13 e invertebrados14–16 de longevidad extrema. Al presentar una longevidad 5 veces mayor de lo esperado por su peso corporal17, los humanos son considerados una especie animal de longevidad extrema y, como tales, comparten las características lipídicas típicas de las especies longevas. En este sentido, se ha observado que los individuos descendientes de nonagenarios tienen membranas eritrocitarias más resistentes a la peroxidación18.
Dado que la mayoría de los estudios se han realizado a nivel tisular, son pocos los trabajos que han determinado las posibles adaptaciones de los lípidos plasmáticos a la longevidad de las especies animales. En un estudio de fisiología comparada publicado recientemente se demuestra que existe un lipidoma plasmático asociado a la longevidad de las especies caracterizado por un menor contenido plasmático de glicerofosfolípidos (GFL) y ácidos grasos libres de cadena larga, mayor resistencia a la oxidación lipídica y menor contenido de productos derivados de la peroxidación lipídica19. En humanos de edad avanzada, se ha descrito un lipidoma plasmático caracterizado por una mayor capacidad antioxidante20,21.
Los estudios ómicos de carácter comparado permiten abordar la evolución del genoma y la expresión genética. Dado que existe una relación bidireccional entre metabolitos y expresión génica, el estudio comparado del metaboloma nos permite definir posibles rutas metabólicas relacionadas con la evolución de los mamíferos. En este sentido, hemos diseñado un estudio de comparada donde analizamos el lipidoma plasmático de 11 especies distintas, abarcando un rango de longevidad máxima (o MLSP, del inglés Maximum lifespan potential) de entre 3,5 y 120 años. Hemos podido definir la existencia de una correlación negativa entre el contenido de diacilglicéridos (DAG) y la MLSP de las especies, que podría explicar el menor contenido de GFL plasmáticos descrito en las especies más longevas, además de definir un modelo capaz de predecir la longevidad animal basándonos en 14DAG plasmáticos.
Material y métodosAnimalesLas especies de mamíferos participantes en el presente estudio cubren un rango de longevidad máxima de 3,5 a 120 años. Todos los especímenes son machos adultos de una edad correspondiente al 15-30% de su longevidad máxima. Así, por ejemplo, la edad de los ratones era de 8 meses, mientras que la de los humanos participantes era de entre 20 y 35 años. En el estudio se incluyen las siguientes especies animales (especie; MLSP en años; tamaño muestral n): ratón (Mus musculus; 3,5; n=6), rata (Rattus norvegicus; 4,5; n=10), cobaya (Cavia porcellus [C. porcellus]; 8; n=12), conejo (Oryctolagus cuniculus [O. cuniculus]; 13; n=10), gato (Felis catus [F. catus]; 20; n=12), perro (Cannis familiaris; 20; n=12), oveja (Ovis aries [O. aries]; 20; n=12), cerdo (Sus scrofa [S. scrofa]; 27; n=12), toro (Bos taurus; 30; n=9), caballo (Equus caballus [E. caballus]; 46; n=12) y humano (Homo sapiens; 120; n=15). Las muestras biológicas de las diferentes especies animales fueron suministradas por Charles River Laboratories España, SA; y las de humanos se obtuvieron de voluntarios sanos. Todas las muestras de sangre se obtuvieron en ayunas (8-12h) mediante punción cardíaca para ratones, de aorta abdominal para las ratas, y por venopunción para el resto de las especies (humanos incluidos), fueron centrifugadas para separar la fracción plasmática y congeladas inmediatamente en nitrógeno líquido, transferidas y almacenadas antes de 4h a −80°C, y utilizadas posteriormente en el análisis lipidómico.
Los protocolos de obtención y uso de muestras biológicas de origen animal fueron aprobados por el Comité Ético de Experimentación Animal de la Universidad de Lleida, mientras que los protocolos humanos lo fueron por el Comité Ético en Investigación Clínica del Hospital Universitario Arnau de Vilanova (de acuerdo con la Declaración de Helsinki). Todos los individuos fueron informados sobre los objetivos y la extensión de la investigación y firmaron un consentimiento informado.
Análisis lipidómicoEl análisis lipidómico se basa en un método descrito previamente19. Con el objetivo de precipitar la proteína, 600μl de acetona fría se añadieron a 200μl de muestra (25μl de plasma y 175μl de tampón fosfato). Posteriormente, las muestras fueron agitadas vigorosamente durante 10s y suavemente a 4°C durante 30min. Seguidamente, las muestras fueron centrifugadas a 1.400rpm durante 10min y el sobrenadante fue evaporado en un Speed Vac (Thermo Fisher Scientific, Barcelona, España). Se añadieron estándares internos representativos de las familias lipídicas, tal y como se describió previamente19. Los lípidos plasmáticos se extrajeron añadiendo metanol:cloroformo:0,7% cloruro potásico (1:2:1, v/v/v). Después de que las muestras fueran agitadas y centrifugadas a 1.400rpm durante 10min, la fracción de cloroformo se separó y evaporó en el Speed Vac (Thermo Fisher Scientific, Barcelona, España). Finalmente, las muestras se resuspendieron en cloroformo:metanol (1:3, v/v) y se inyectaron en el sistema cromatógrafo. Los extractos lipídicos fueron sometidos a espectrometría de masas utilizando la plataforma Agilent LC 1200 series acoplada a un ESI-QTOF-MS/MS 6520 (Agilent Technologies, Barcelona, España). Brevemente, en el método de cromatografía líquida (LC), 2μL de muestra fueron inyectados en una columna de fase reversa (LXBridge C18 column; 2,1×150mm, 3,5μm, Waters Corp., Milford, MA, EE. UU.) equipada con una precolumna de fase reversa (XBridge C18; 2,1×10mm, 3,5μm, Waters Corp., Milford, MA, EE. UU.) a 55°C. El flujo fue de 250μl/min con el solvente A formado por acetato de amonio en metanol-agua (90:10, v/v) y el solvente B por acetato de amonio 5mM en 1-propanol-hexano-agua (79:20:1, v/v/v). El gradiente consistió en 100% solvente A durante 2min, del 0% al 100% en 30min, manteniendo el 100% B durante 3min, volver al 0% B en 20min, y reequilibrar a 0% solvente B durante 4min. Los datos se recogieron en modo TOF de ionización positiva y negativa, y se adquirieron todas las masas en un rango dinámico extendido (2GHz) de 100-3.000m/z, usando N2 como gas nebulizador (5L/min, 350°C). El voltaje del capilar fue de 3.500V, con una velocidad de adquisición de 1scan/s.
La adquisición de datos fue llevada a cabo con MassHunter Data Analyses Software (Agilent Technologies, Barcelona, España) y se utilizó MassHunter Qualitative Analysis Software (Agilent Technologies, Barcelona, España) para obtener las características moleculares de las muestras, tal como se ha descrito anteriormente19. Se utilizó MassHunter Mass Profiler Professional Software (Agilent Technologies, Barcelona, España) para el análisis lipidómico no dirigido a partir del cual se seleccionaron los 14DAG. Finalmente, se utilizó el paquete de R OrbisMet (disponible en http://hdl.handle.net/10609/65305) y el paquete estadístico SPSS/PC para Windows (SPSS, Chicago, IL, EE. UU.) para el análisis de correlaciones, curvas de regresión y análisis multivariante (análisis de componentes principales (PCA, del inglés Principal Component Analyses) y Random Forest).
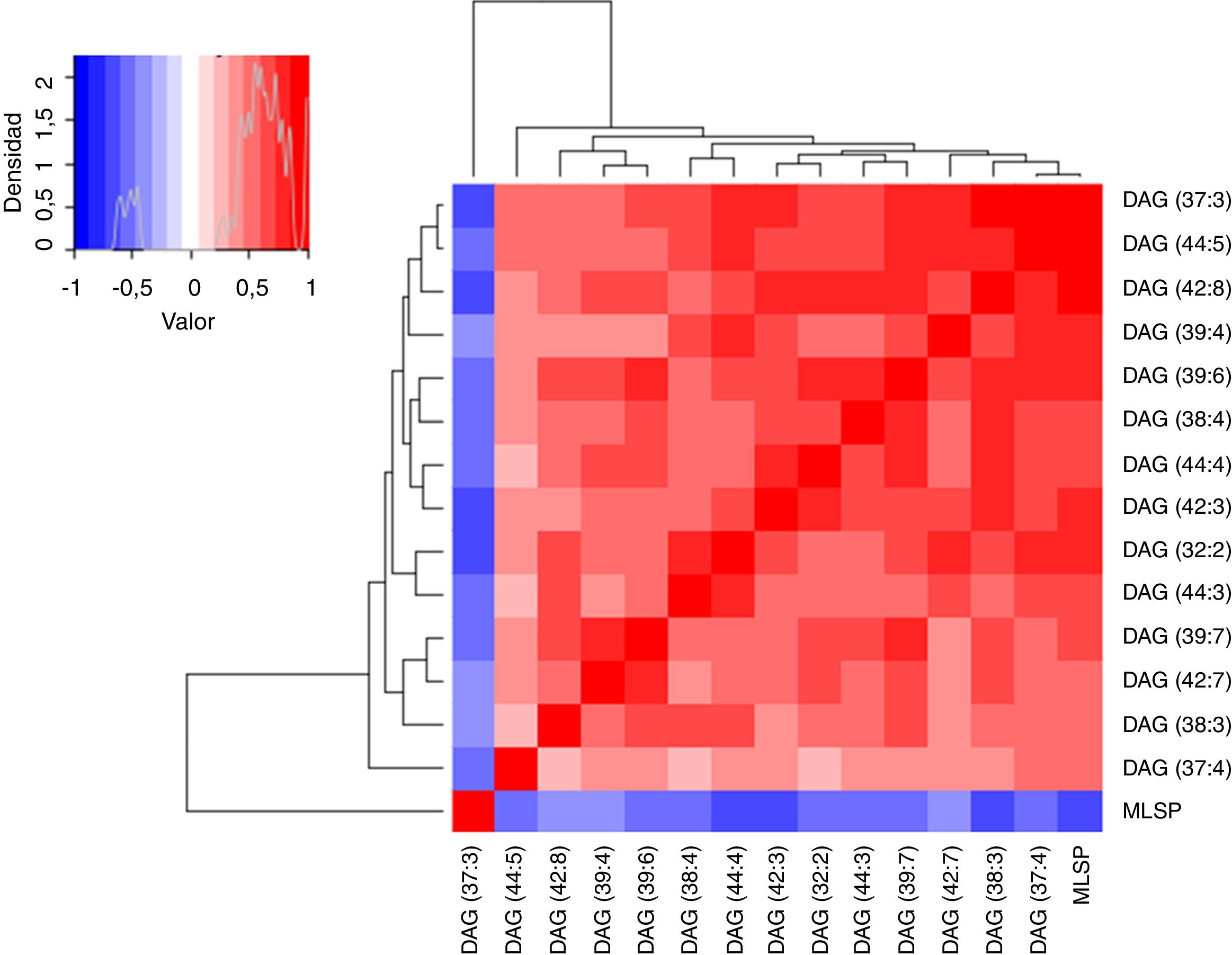
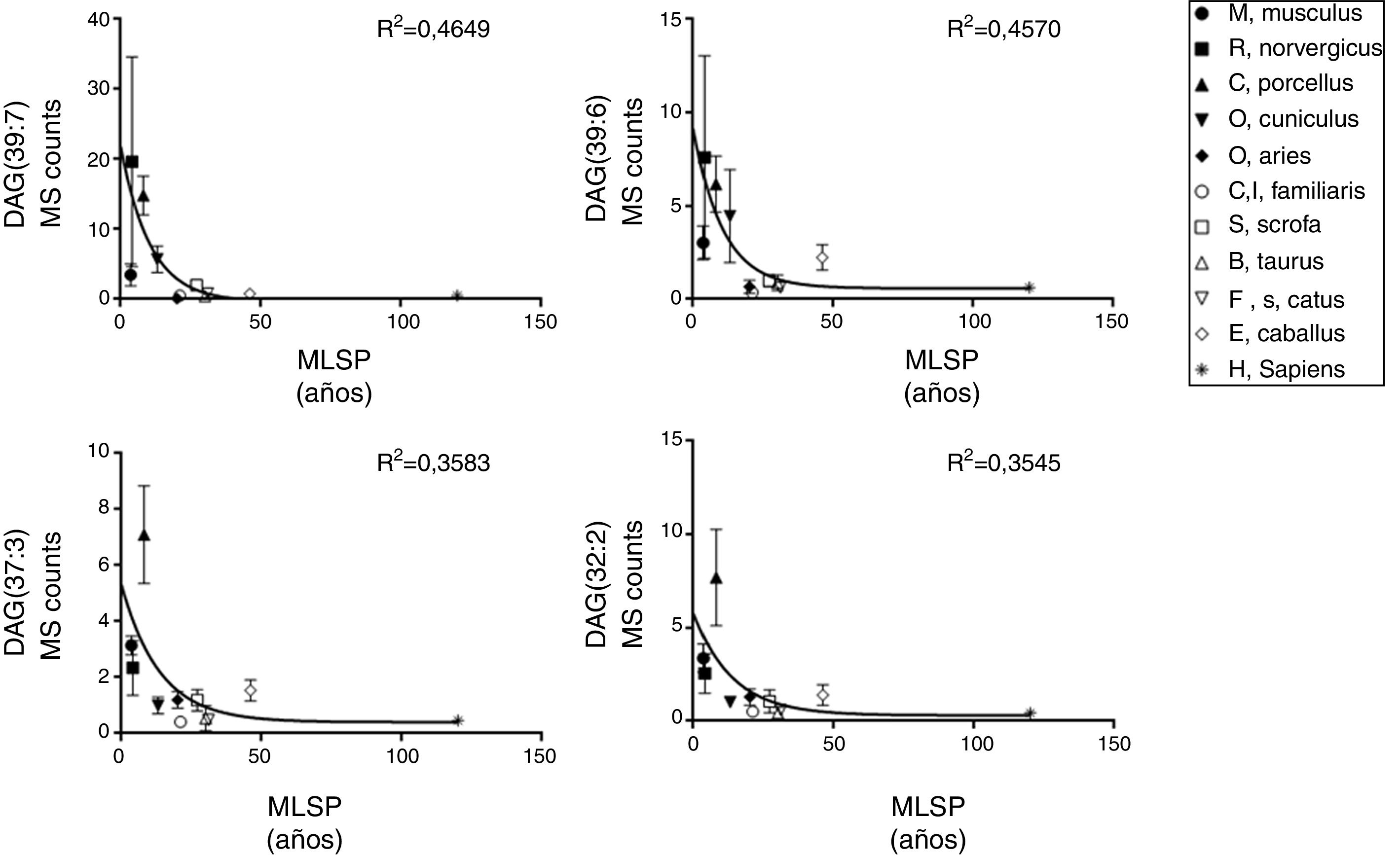
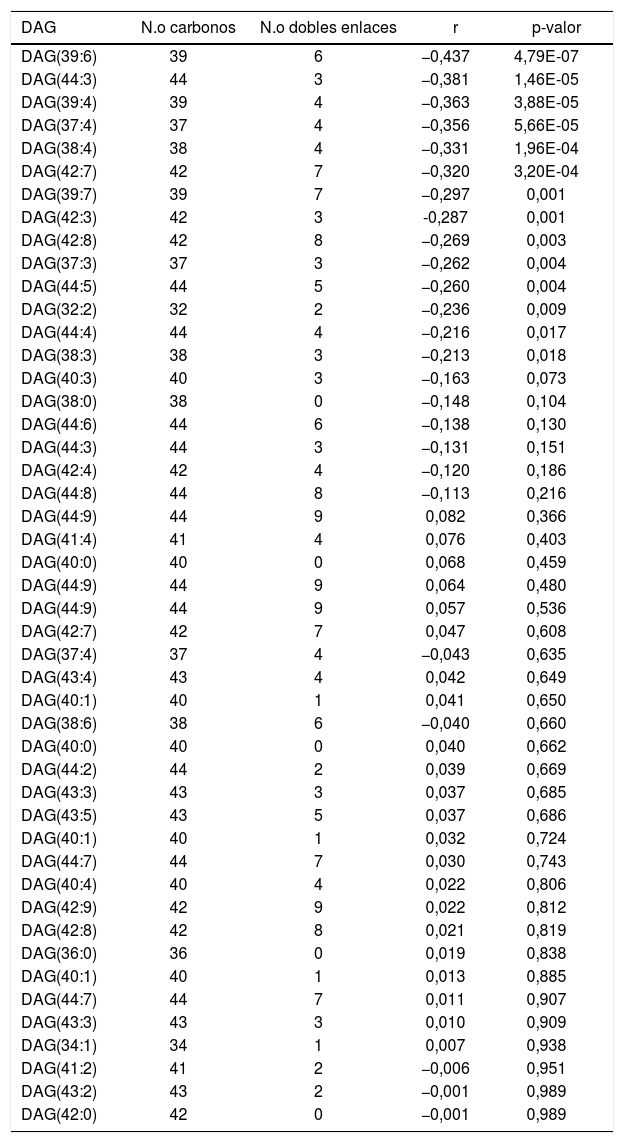
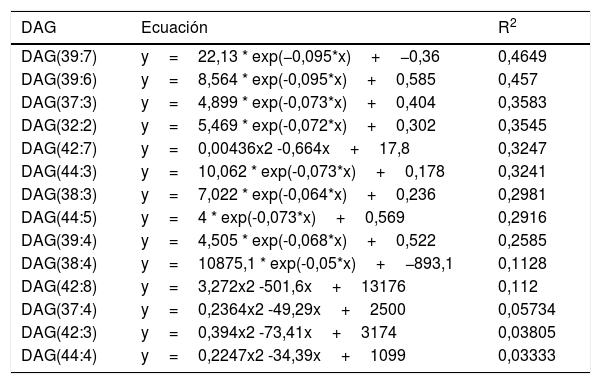
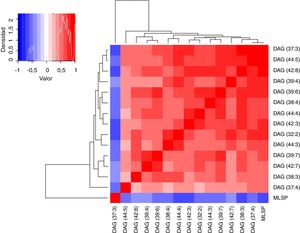
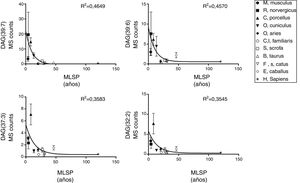
ResultadosRelación entre longevidad máxima y diacilglicéridos plasmáticosSe detectó la presencia de 1.061 lípidos plasmáticos diferenciales entre las especies estudiadas. De los lípidos identificados, 47 eran DAG, y 14 de estos correlacionaban negativamente con la MLSP tras aplicar la correlación de Spearman (r) (tabla 1). El heatmap de la figura 1 muestra el grado de correlación entre los 14DAG y la longevidad máxima (MLSP) de las especies animales. En el análisis de regresión se observó que la relación entre la abundancia de los 14DAG y la MLSP es de tipo exponencial en casi todos ellos (tabla 2). En la figura 2 se muestran gráficamente aquellos DAG que correlacionan negativamente con la longevidad y muestran un mejor ajuste a un modelo exponencial (DAG(39:7): R2=0,46, r=−0,29, p=0,001; DAG(39:6): R2=0,45, r=−0,43, p<0,001; DAG(37:3): R2=0,35, r=−0,26, p=0,004; DAG(32:2): R2=0,35; r=−0,23, p=0,009). Globalmente, estas correlaciones demuestran una disminución progresiva en el contenido de los DAG estudiados conforme aumenta la longevidad máxima en las diferentes especies de mamíferos.
Correlación de Spearman entre los 47DAG identificados y la longevidad máxima
| DAG | N.o carbonos | N.o dobles enlaces | r | p-valor |
|---|---|---|---|---|
| DAG(39:6) | 39 | 6 | −0,437 | 4,79E-07 |
| DAG(44:3) | 44 | 3 | −0,381 | 1,46E-05 |
| DAG(39:4) | 39 | 4 | −0,363 | 3,88E-05 |
| DAG(37:4) | 37 | 4 | −0,356 | 5,66E-05 |
| DAG(38:4) | 38 | 4 | −0,331 | 1,96E-04 |
| DAG(42:7) | 42 | 7 | −0,320 | 3,20E-04 |
| DAG(39:7) | 39 | 7 | −0,297 | 0,001 |
| DAG(42:3) | 42 | 3 | -0,287 | 0,001 |
| DAG(42:8) | 42 | 8 | −0,269 | 0,003 |
| DAG(37:3) | 37 | 3 | −0,262 | 0,004 |
| DAG(44:5) | 44 | 5 | −0,260 | 0,004 |
| DAG(32:2) | 32 | 2 | −0,236 | 0,009 |
| DAG(44:4) | 44 | 4 | −0,216 | 0,017 |
| DAG(38:3) | 38 | 3 | −0,213 | 0,018 |
| DAG(40:3) | 40 | 3 | −0,163 | 0,073 |
| DAG(38:0) | 38 | 0 | −0,148 | 0,104 |
| DAG(44:6) | 44 | 6 | −0,138 | 0,130 |
| DAG(44:3) | 44 | 3 | −0,131 | 0,151 |
| DAG(42:4) | 42 | 4 | −0,120 | 0,186 |
| DAG(44:8) | 44 | 8 | −0,113 | 0,216 |
| DAG(44:9) | 44 | 9 | 0,082 | 0,366 |
| DAG(41:4) | 41 | 4 | 0,076 | 0,403 |
| DAG(40:0) | 40 | 0 | 0,068 | 0,459 |
| DAG(44:9) | 44 | 9 | 0,064 | 0,480 |
| DAG(44:9) | 44 | 9 | 0,057 | 0,536 |
| DAG(42:7) | 42 | 7 | 0,047 | 0,608 |
| DAG(37:4) | 37 | 4 | −0,043 | 0,635 |
| DAG(43:4) | 43 | 4 | 0,042 | 0,649 |
| DAG(40:1) | 40 | 1 | 0,041 | 0,650 |
| DAG(38:6) | 38 | 6 | −0,040 | 0,660 |
| DAG(40:0) | 40 | 0 | 0,040 | 0,662 |
| DAG(44:2) | 44 | 2 | 0,039 | 0,669 |
| DAG(43:3) | 43 | 3 | 0,037 | 0,685 |
| DAG(43:5) | 43 | 5 | 0,037 | 0,686 |
| DAG(40:1) | 40 | 1 | 0,032 | 0,724 |
| DAG(44:7) | 44 | 7 | 0,030 | 0,743 |
| DAG(40:4) | 40 | 4 | 0,022 | 0,806 |
| DAG(42:9) | 42 | 9 | 0,022 | 0,812 |
| DAG(42:8) | 42 | 8 | 0,021 | 0,819 |
| DAG(36:0) | 36 | 0 | 0,019 | 0,838 |
| DAG(40:1) | 40 | 1 | 0,013 | 0,885 |
| DAG(44:7) | 44 | 7 | 0,011 | 0,907 |
| DAG(43:3) | 43 | 3 | 0,010 | 0,909 |
| DAG(34:1) | 34 | 1 | 0,007 | 0,938 |
| DAG(41:2) | 41 | 2 | −0,006 | 0,951 |
| DAG(43:2) | 43 | 2 | −0,001 | 0,989 |
| DAG(42:0) | 42 | 0 | −0,001 | 0,989 |
Heatmap que muestra el grado de correlación entre los 14 diacilglicéridos (DAG) y la longevidad máxima (MLSP). Cada línea del gráfico representa el valor r de cada correlación tras aplicar un test de Spearman, coloreada en una escala entre −1 (azul, mitad izquierda del gráfico que relaciona densidad y valor situado en la parte superior izquierda de la figura) y +1 (rojo, mitad derecha del mismo gráfico), ambos indicando un elevado grado de correlación.
Análisis de regresión no lineal entre el contenido de los 14DAG y la longevidad máxima
| DAG | Ecuación | R2 |
|---|---|---|
| DAG(39:7) | y=22,13 * exp(−0,095*x)+−0,36 | 0,4649 |
| DAG(39:6) | y=8,564 * exp(-0,095*x)+0,585 | 0,457 |
| DAG(37:3) | y=4,899 * exp(-0,073*x)+0,404 | 0,3583 |
| DAG(32:2) | y=5,469 * exp(-0,072*x)+0,302 | 0,3545 |
| DAG(42:7) | y=0,00436x2 -0,664x+17,8 | 0,3247 |
| DAG(44:3) | y=10,062 * exp(-0,073*x)+0,178 | 0,3241 |
| DAG(38:3) | y=7,022 * exp(-0,064*x)+0,236 | 0,2981 |
| DAG(44:5) | y=4 * exp(-0,073*x)+0,569 | 0,2916 |
| DAG(39:4) | y=4,505 * exp(-0,068*x)+0,522 | 0,2585 |
| DAG(38:4) | y=10875,1 * exp(-0,05*x)+−893,1 | 0,1128 |
| DAG(42:8) | y=3,272x2 -501,6x+13176 | 0,112 |
| DAG(37:4) | y=0,2364x2 -49,29x+2500 | 0,05734 |
| DAG(42:3) | y=0,394x2 -73,41x+3174 | 0,03805 |
| DAG(44:4) | y=0,2247x2 -34,39x+1099 | 0,03333 |
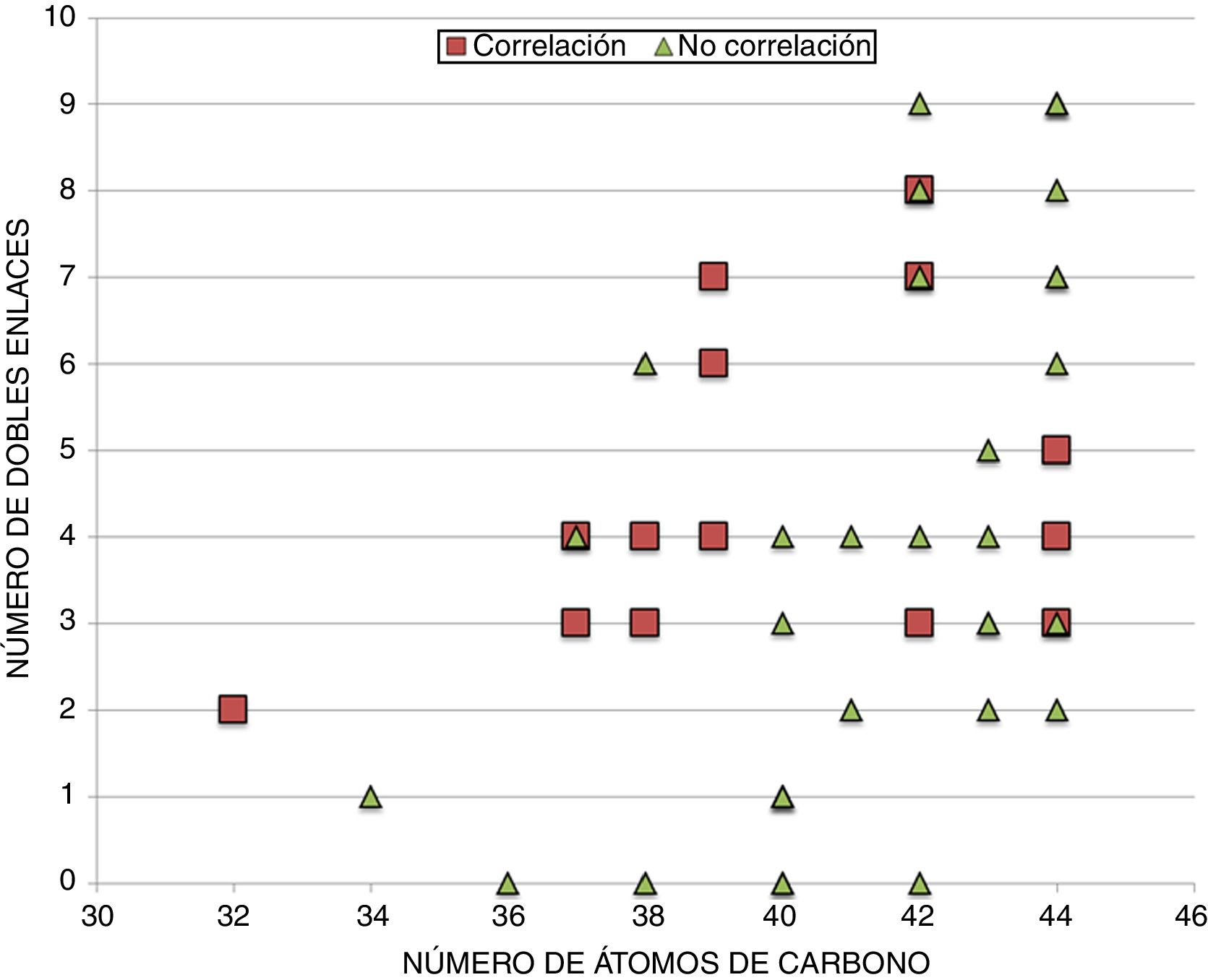
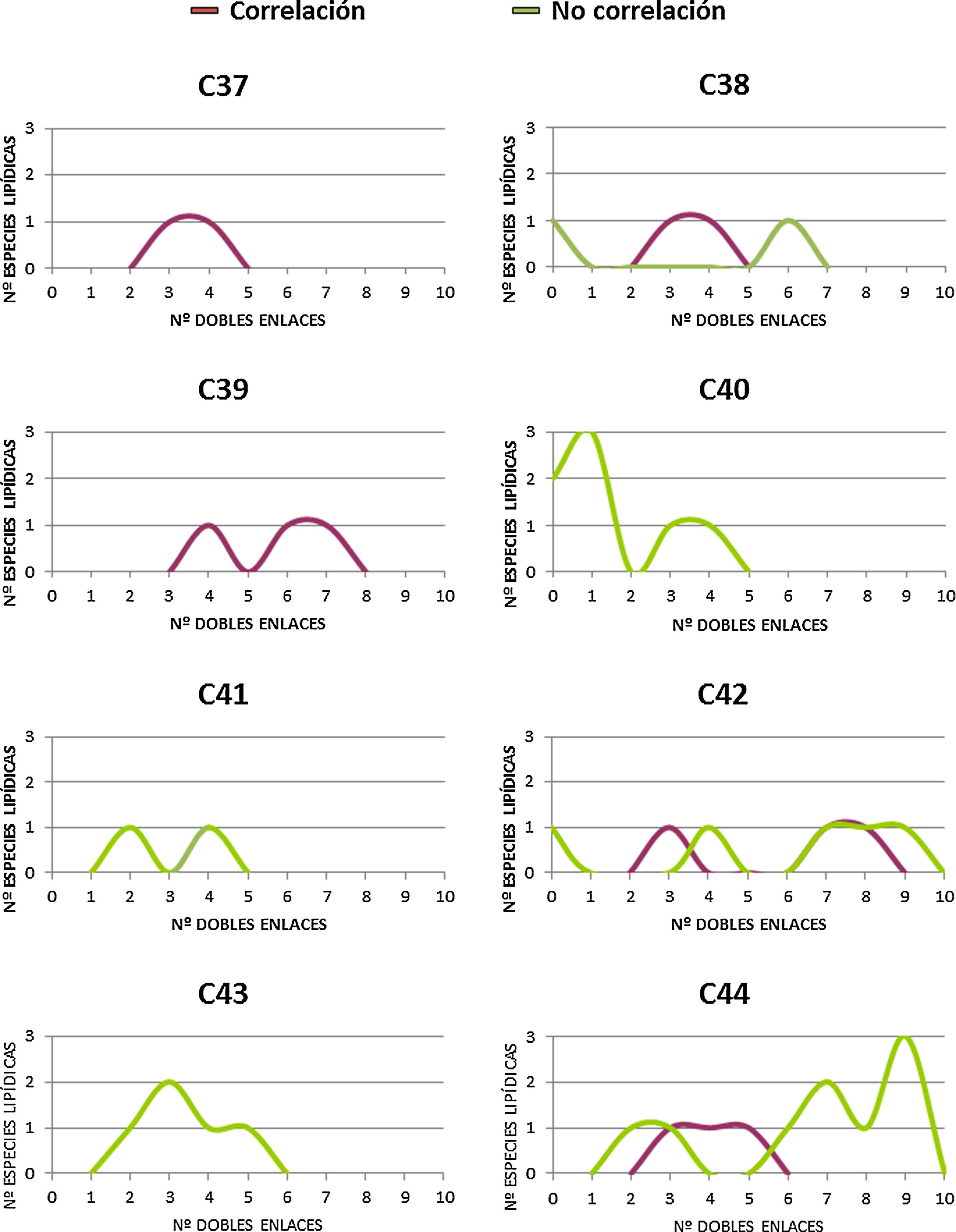
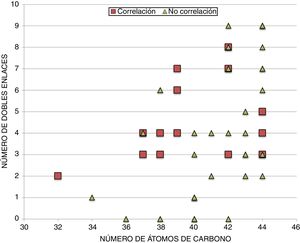
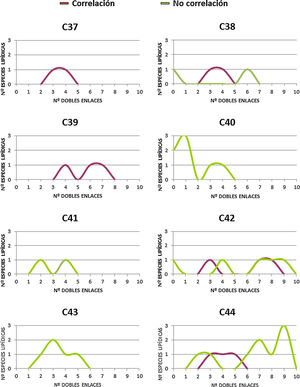
En un intento por discernir si existe alguna particularidad que defina los DAG que correlacionan con la longevidad animal, se procede a realizar una distribución de los mismos, tanto si correlacionan (14 especies lipídicas) como si no (33 especies lipídicas) de acuerdo al número de átomos de carbono y número de dobles enlaces (fig. 3 y figura suplementaria 1). Los resultados, a pesar de no mostrar un patrón claramente diferencial entre aquellos DAG que correlacionan con la longevidad máxima de las especies y los que no, sí que demuestran que i) aquellos que no correlacionan poseen mayoritariamente más de 40 carbonos, y ii) aquellos que correlacionan presentan PUFA en sus cadenas y especialmente con 3 o 4 dobles enlaces.
Relación entre el número de átomos de carbono y el número de dobles enlaces de aquellos DAG identificados, independientemente de su grado de correlación con la longevidad. En cuadrados, las diferentes especies lipídicas de DAG que correlacionan con la longevidad máxima, y en triángulos, aquellas especies lipídicas de DAG que no correlacionan con la longevidad.
Un paso más allá en el establecimiento de un perfil lipídico de DAG que correlacionen con la MLSP sería un análisis dirigido que permita discernir la presencia de ácidos grasos específicos, así como la posición estructural dentro de la molécula (sn-1, sn-2 o sn-3), ya que la identificación efectuada en el análisis no dirigido no permite llegar a este detalle.
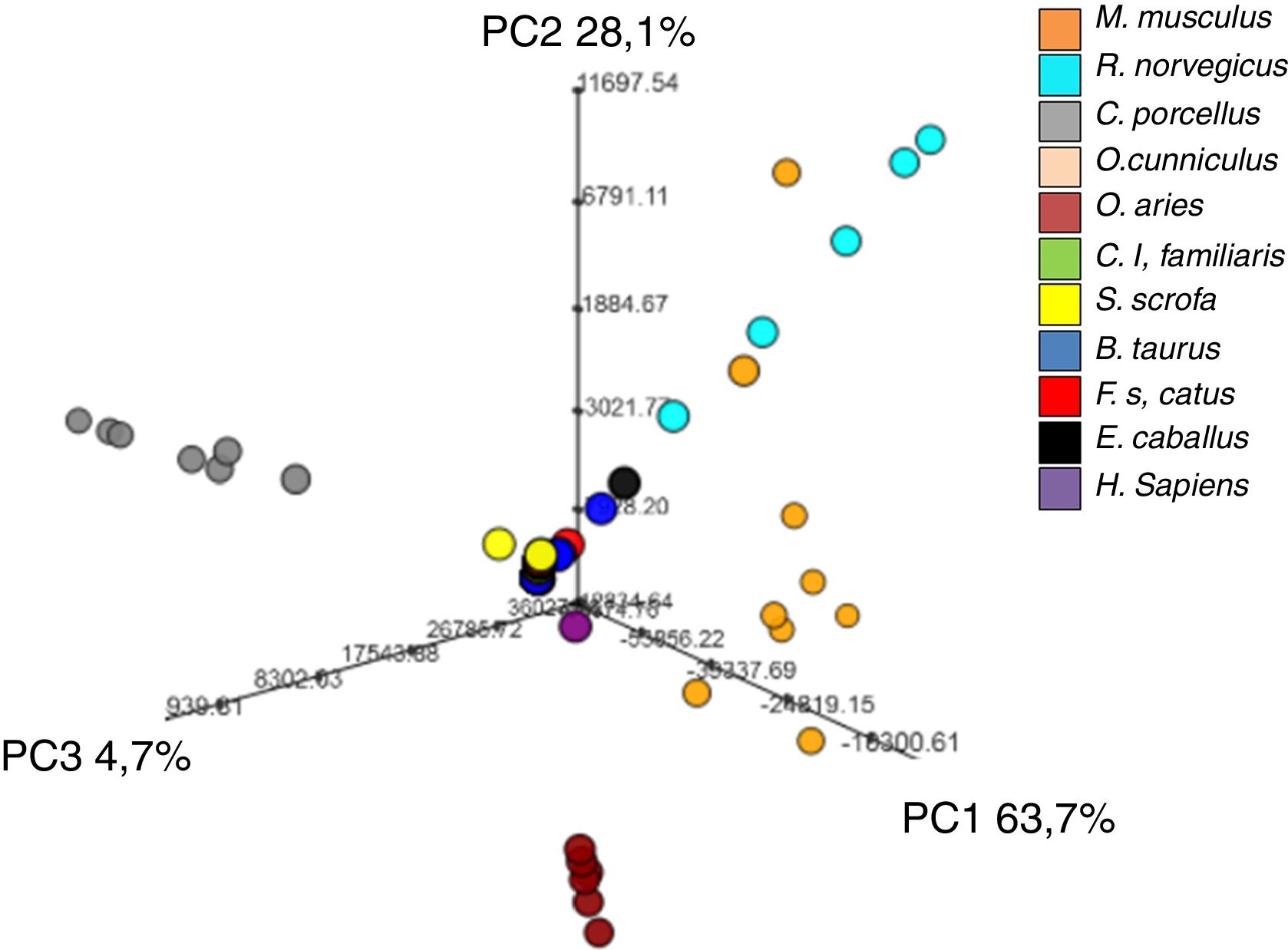
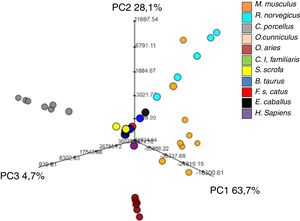
Relación entre el contenido de glicerofosfolípidos plasmáticos y la especie animalEl análisis estadístico multivariante no supervisado, concretamente el PCA revela que, utilizando solo estos 14 DAG, somos capaces de definir especies animales con distinta longevidad, siendo C. porcellus y O. aries los mejor caracterizados (fig. 4).
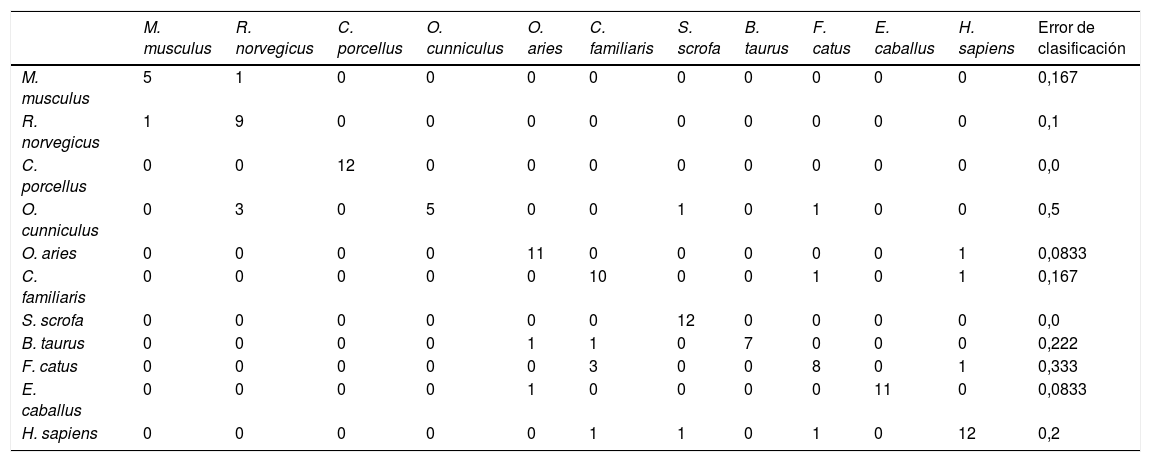
La capacidad de estos 14DAG para definir una especie animal se validó aplicando un análisis de tipo bosques aleatorios (o Random Forest), que reveló un error global de clasificación del 16% (tabla 3). De este modo, con únicamente 14DAG se puede definir la especie animal con una probabilidad de acierto del 84%. Concretamente, este tipo de análisis permitiría clasificar correctamente los individuos de C. porcellus (error de clasificación del 0%), S. scrofa (error de clasificación del 0%), O. aries (error de clasificación del 8.33%) y E. caballus (error de clasificación del 8.33%) pero no sería útil para clasificar el O. cunniculus (error de clasificación del 50%) y F. catus (error de clasificación del 33.3%).
Análisis de bosques aleatorios (Random Forest) entre los 14 DAG y la longevidad máxima
| M. musculus | R. norvegicus | C. porcellus | O. cunniculus | O. aries | C. familiaris | S. scrofa | B. taurus | F. catus | E. caballus | H. sapiens | Error de clasificación | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| M. musculus | 5 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0,167 |
| R. norvegicus | 1 | 9 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0,1 |
| C. porcellus | 0 | 0 | 12 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0,0 |
| O. cunniculus | 0 | 3 | 0 | 5 | 0 | 0 | 1 | 0 | 1 | 0 | 0 | 0,5 |
| O. aries | 0 | 0 | 0 | 0 | 11 | 0 | 0 | 0 | 0 | 0 | 1 | 0,0833 |
| C. familiaris | 0 | 0 | 0 | 0 | 0 | 10 | 0 | 0 | 1 | 0 | 1 | 0,167 |
| S. scrofa | 0 | 0 | 0 | 0 | 0 | 0 | 12 | 0 | 0 | 0 | 0 | 0,0 |
| B. taurus | 0 | 0 | 0 | 0 | 1 | 1 | 0 | 7 | 0 | 0 | 0 | 0,222 |
| F. catus | 0 | 0 | 0 | 0 | 0 | 3 | 0 | 0 | 8 | 0 | 1 | 0,333 |
| E. caballus | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 11 | 0 | 0,0833 |
| H. sapiens | 0 | 0 | 0 | 0 | 0 | 1 | 1 | 0 | 1 | 0 | 12 | 0,2 |
Los DAG son los precursores de la biosíntesis de novo de GFL, incluyendo fosfatidilcolina, fosfatidiletanolamina, fosfatidilserina, fosfatidilinositol, fosfatidilglicerol y cardiolipina22. Los GFL constituyen los principales componentes de las membranas biológicas, y el contenido de estos varía en función del tipo celular y orgánulo23.
Los GFL participan en el mantenimiento de las propiedades estructurales y funcionales de las membranas celulares, así como en diversidad de funciones como el tráfico vesicular y la señalización intracelular22, constituyéndose también en un sustrato biológico determinante de la longevidad de las especies animales. Estudios comparativos entre especies de distinta longevidad muestran una reducción de GFL a nivel tisular8,17,24 y plasmático25,26 que se mantiene en humanos20,21,27,28. Nuestros resultados muestran que el menor contenido de DAG podría explicar, en parte, el menor contenido de GFL en las especies más longevas. Además, el elevado contenido de DAG y GFL documentados en varias condiciones patológicas29,30 refuerzan el posible papel beneficioso de una reducción de dichas especies lipídicas en especies animales longevas.
En este estudio se propone un modelo capaz de discernir entre la longevidad máxima de las especies en base al contenido plasmático de 14DAG con una probabilidad de acierto del 84%. Los GFL constituyen uno de los factores determinantes de la longevidad puesto que representan el 42,5% de las especies lipídicas que correlacionan de forma inversa con la longevidad de los mamíferos, mientras que los glicerolípidos solamente representan el 17,5%19. La existencia de un perfil lipídico específico asociado a la longevidad, capaz de identificar individuos longevos únicamente con 20 especies lipídicas, ya se había descrito anteriormente en humanos28. En este sentido, los resultados obtenidos refuerzan la importancia del lipidoma plasmático como factor clave de la longevidad.
No obstante, siguiendo con la línea de los resultados obtenidos, el contenido plasmático de los DAG no es el único factor que determina la longevidad de las especies. En este sentido, se ha demostrado la existencia de mecanismos moleculares compartidos entre las distintas especies, incluyendo la presencia de membranas más resistentes a la oxidación en especies longevas4,7,8,14,15,31. Además, estudios recientes muestran también la existencia de mecanismos reguladores adicionales de la longevidad específicos de cada especie animal32,33, hecho que dificulta el establecimiento de modelos generales predictivos de la longevidad.
Contribución de los autoresConcepción y diseño del estudio: R. Pamplona.
Recogida de muestras y procedimientos experimentales: N. Mota-Martorell, I. Pradas, M. Jové, A. Naudí y R. Pamplona.
Análisis estadístico e interpretación de los resultados: N. Mota-Martorell, I. Pradas, M. Jové, A. Naudí y R. Pamplona.
Redacción del manuscrito: N. Mota-Martorell, I. Pradas, M. Jové, A. Naudí y R. Pamplona.
Edición del manuscrito: R. Pamplona.
Todos los autores participaron en la revisión crítica del manuscrito y todos los autores leyeron y aprobaron el manuscrito final. Asimismo, todos los autores tuvieron pleno acceso a los datos del estudio y tuvieron la responsabilidad final de la decisión de enviarlo para su publicación.
FinanciaciónEl trabajo ha sido financiado, en parte, por una ayuda del Ministerio Español de Economía y Competitividad (ref. FIS-PI1400328), y por la Generalitat de Catalunya (2017SGR696 y SLT002/00250) a R. Pamplona. El estudio ha sido cofinanciado por los Fondos de la Unión Europea (“Una manera de hacer Europa”).
Conflicto de interesesLos autores declaran no tener conflicto de intereses.
N. Mota-Martorell tiene concedida una beca predoctoral de la Generalitat de Catalunya. I. Pradas tiene concedida una beca predoctoral de la Universitat de Lleida. Nuestro agradecimiento a David Argilés y Maria Rosa Gómez por su soporte técnico.