El ácido zoledrónico se utiliza en el tratamiento de diversas enfermedades, tumorales o no, aunque su uso se asocia con necrosis avascular ósea.
ObjetivoDeterminar un posible efecto protector de diferentes sustancias antioxidantes frente a la inhibición del crecimiento de células epiteliales de próstata humana (PNT2) y en células tumorales de adenocarcinoma transgénico de próstata murina (TRAMP-C1), en tratamientos combinados de ácido zoledrónico junto con radiación ionizante (IR).
Material y métodosMediante un ensayo de viabilidad celular (MTT) se estudia la supervivencia celular de 2 líneas celulares en tratamientos aislados y combinados con ácido zoledrónico y con IR, así como, el efecto de la adición de diferentes sustancias antioxidantes.
ResultadosEl ácido zoledrónico muestra un efecto citotóxico significativo sobre las células PNT2 y TRAMP-C1 (p<0,001). La administración de diferentes sustancias antioxidantes en el tratamiento con ácido zoledrónico presenta un efecto protector sobre las células PNT2 (p<0,001), pero no sobre las células tumorales. Sin embargo, la administración de ácido rosmarínico y apigenina en el tratamiento combinado con ácido zoledrónico junto con IR presenta un efecto protector no solo sobre las células PNT2 (p<0,001), sino también sobre las células TRAMP-C1 (p<0,001).
ConclusiónEl uso de sustancias antioxidantes produce una disminución del efecto citotóxico del ácido zoledrónico sobre las células no tumorales, por lo que podrían ser utilizadas en enfermedades benignas no tumorales. Sin embargo, en un tratamiento combinado con IR, también pueden proporcionar protección a las células tumorales, y reducir de este modo el efecto terapéutico deseado.
Zoledronic acid is used in the treatment of cancer-related diseases, although its use has been associated with avascular osteonecrosis.
AimsTo determine the possible protective effect of a range of antioxidant substances against the inhibition of human prostate epithelial cell growth (PNT2) and transgenic adenocarcinoma mouse prostate tumour cells (TRAMP-C1), in treatments combining zoledronic acid and ionising radiation (IR).
Material and methodCell survival is studied via cell viability assays (MTT) for 2 cell lines in isolated and combined treatments with zoledronic acid and/or IR, as well as the effect of adding 3 antioxidant substances.
ResultsZoledronic acid displays a significant cytotoxic effect over PNT2 and TRAMP-C1 cells (P<.001). The administration of antioxidants together with the zoledronic acid shows a protective effect for normal prostate cells, yet not so for prostate tumour cells. However, the administration of rosmarinic acid and apigenin in treatments combined with zoledronic acid provides a protective effect from the harmful effects of applying ionizing radiation, not only for normal PNT2 cells, but also for tumour cells.
ConclusionThe use of antioxidant substances decreases the cytotoxic effect of zoledronic acid over non-tumour cells, and as such could be used in benign diseases. Furthermore, in the combined treatment using ionising radiation, these antioxidants also produced a protective effect in tumour cells, thus reducing the therapeutic effect sought by combining the treatment with radiation.
El ácido zoledrónico (Z) es un bisfosfonato usado en el tratamiento de la hipercalcemia relacionada con el cáncer1,2, en las complicaciones de las metástasis óseas3,4 y en la osteoporosis posmenopáusica4,5. Es el más potente de los bisfosfonatos nitrogenados4 y actúa sobre los osteoblastos mediante la inhibición de su quimiotaxis, acortando su vida media, disminuyendo su actividad e induciendo apoptosis. También induce efectos antiproliferativos y apoptosis en diferentes líneas celulares a través de la liberación mitocondrial de citocromo C y de la activación de la caspasa-36.
Su utilización en estas aplicaciones médicas se ha relacionado con la aparición de complicaciones a largo plazo, tales como la osteonecrosis maxilar (osteorradionecrosis), especialmente cuando están asociados a la exposición a radiación ionizante (IR) en estructuras de cabeza y cuello o con la realización de implantes o extracciones dentales7.
Varios autores han descrito un efecto de sensibilización del Z con otros agentes quimioterapéuticos3,4,6,8,9. Un posible efecto aditivo también se ha descrito con la IR, siempre y cuando el Z sea administrado antes de la irradiación en células de próstata10, mama11, pulmón12 y mieloma10, lo que ha llevado a proponer su posible aplicación terapéutica en oncología radioterápica10,11.
El presente estudio tiene como objetivo determinar los efectos citotóxicos del Z administrado solo y en combinación con IR sobre las células epiteliales de próstata humana (PNT2) y sobre las células tumorales de próstata murina (TRAMPC-1), así como determinar un posible efecto protector de algunos antioxidantes (ácido carnósico, ácido rosmarínico y apigenina) frente a los efectos citotóxicos del tratamiento conjunto de Z junto con IR.
Material y métodoProductos químicos y reactivosEl Z (Zometa ®) se obtuvo de Novartis Farmacéutica (Barcelona, España) y se administró en diferentes concentraciones (5 y 100%) y en diferentes volúmenes (5-50μl). El RPMI 1640, F10, PHA, DMSO, estreptomicina, penicilina, tampón fosfato salino (PBS) y 3-(4,5-dimetil-2-tiazolil)-2,5-difenil-2H-tetrazolio (MTT) se obtuvieron de Sigma-Aldrich Química SA (Madrid, España). El suero bovino fetal se obtuvo de Gibco (California, EE. UU.). El ácido carnósico y la apigenina se obtuvieron de Furfural Español S.A. (Alcantarilla, Murcia) y el ácido rosmarínico (RO) 95% se obtuvo de Extrasynthese (Genay, Francia).
Efecto citotóxico: test MTTLínea celular y condiciones de cultivoLa línea celular PNT2 utilizada se obtuvo de la European Collection of Cell Cultures (ECACC) de la Health Protection Agency Culture Collection (catálogo n.° 95012613, HPACC, Reino Unido). Estas células se cultivaron en medio RPMI 1640 suplementado con suero bovino fetal (10%) y glutamina (2mM) y estreptomicina más penicilina (100μg/ml y 100 IU/ml, respectivamente). Todos los procesos se han realizado en una cámara Cultair ASB de tipo ii de flujo laminar vertical. Los cultivos de células PNT2 se mantuvieron a 37°C y al 95% de humedad relativa, en atmósfera de 5% CO2, en un Cytoperm Heather. Las células de adenocarcinoma de próstata transgénico de ratón (TRAMP-C1) fueron obtenidas de la American Type Culture Collection (catálogo n.° CRL-2730, EE. UU.), fueron cultivadas en medio Dulbecco's modified Eagle's medium (DMEM)/F12K (1:1). Ambos medios fueron suplementados con suero bovino fetal (10%) y glutamina (2mM) y estreptomicina más penicilina (100μg/ml y 100 IU/ml, respectivamente). Los cultivos celulares se mantuvieron a 37°C y al 95% de humedad relativa, en atmósfera de 5% CO2, en un Cytoperm Heather. Durante todo el estudio se han llevado a cabo pruebas para confirmar la ausencia de Mycoplama spp. El medio de cultivo se cambió cada 2 días o cuando la acidificación era detectada mediante el indicador de pH (rojo fenol). Tras la irradiación, todas las microplacas se incubaron durante 24, 48 o 72h, y no se realizaron cambios del medio de cultivo.
Prueba de MTTPara analizar el efecto citotóxico del Z, IR y antioxidantes sobre la viabilidad celular y sobre la curva de supervivencia de las células PNT2 y TRAMP-C1, se utilizó 3-(4,5- dimethylthiazol-2-yl)-2,5-diphenyl tetrazolium bromide (MTT) para períodos de incubación de 24 y 48 h.
En nuestro estudio, los métodos descritos por Carmichael et al.13,14 y Alley et al.15 se adaptaron a nuestras condiciones de cultivo16. Brevemente, se incubaron los cultivos celulares con 200μl y se dejaron adherir durante 24 h. Después del tratamiento, a las dosis antes mencionadas de Z, antioxidantes e IR, y para los tiempos de incubación mencionados, se añadió el medio suplementado y 50μl de MMT (5mg/ml) a cada pocillo en placas Nunc® de 96 pocillos y se incubaron a 37°C durante 4 h (5% CO2). Después se eliminó cuidadosamente el medio y el MTT no metabolizado y se añadió 100μl de DMSO a cada pocillo para solubilizar el MTT producido por las células cultivadas. Posteriormente, se centrifugó la placa a 90rpm durante 8 min y las placas se leyeron con un espectrofotómetro Multiskan MCC/340P usando 570nm para la lectura y 690nm para las longitudes de onda de referencia. El pocillo de control negativo se utilizó para la línea de base cero. Cada experimento se repitió en 3 ocasiones.
IrradiaciónLas muestras se expusieron a rayos X en un equipo productor de rayos X Andrex SMART 200E instruemt (YXLON International, Hamburgo, Alemania) a 200kV, 4,5mA, FOD 36cm, a temperatura ambiente. Las dosis de radiación se controlaron mediante un dosímetro UNIDOS® Universal Dosimeter con sonda PTW Farme® TW 30010 (PTW-Freiburg, Freiburgo, Alemania) dentro de la cabina de irradiación y la dosis de radiación X se confirmó por medio de dosímetros termoluminiscentes (GR-200®, Conqueror Electronics Technology Co. Ltd, China). Los dosímetros termoluminiscentes fueron suministrados y se midieron en el CIEMAT (Ministerio de Industria y Energía, España).
El análisis estadísticoEl análisis estadístico ha consistido en un análisis de varianza de medidas repetidas. Se llevó a cabo para comparar el porcentaje de células supervivientes en los cultivos con diferentes concentraciones de los diversos compuestos estudiados, complementados con el análisis de la menor diferencia significativa por el análisis de pares y medias. Los análisis se llevaron a cabo por la transformación logarítmica de los datos para cumplir con las condiciones de ANOVA.
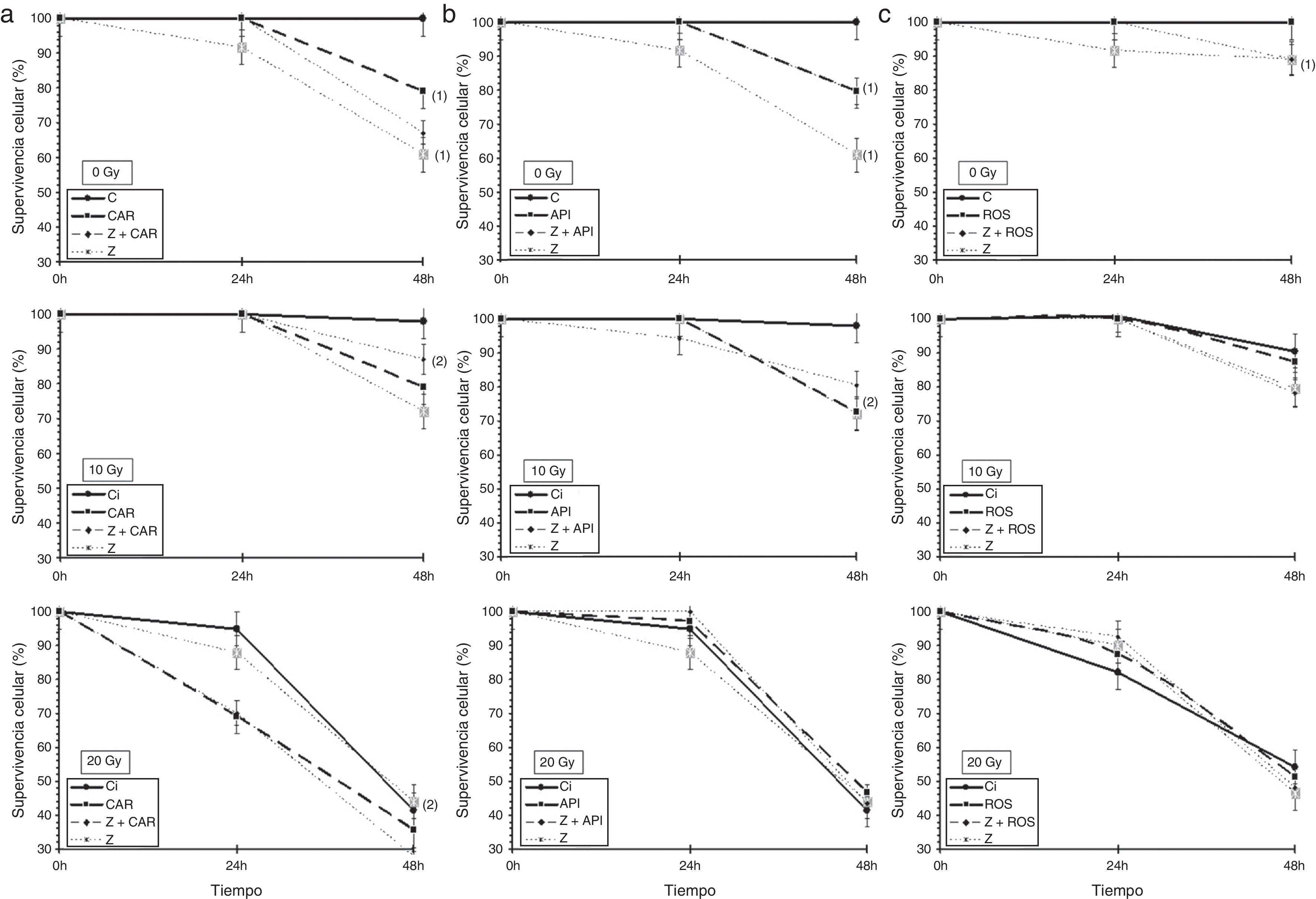
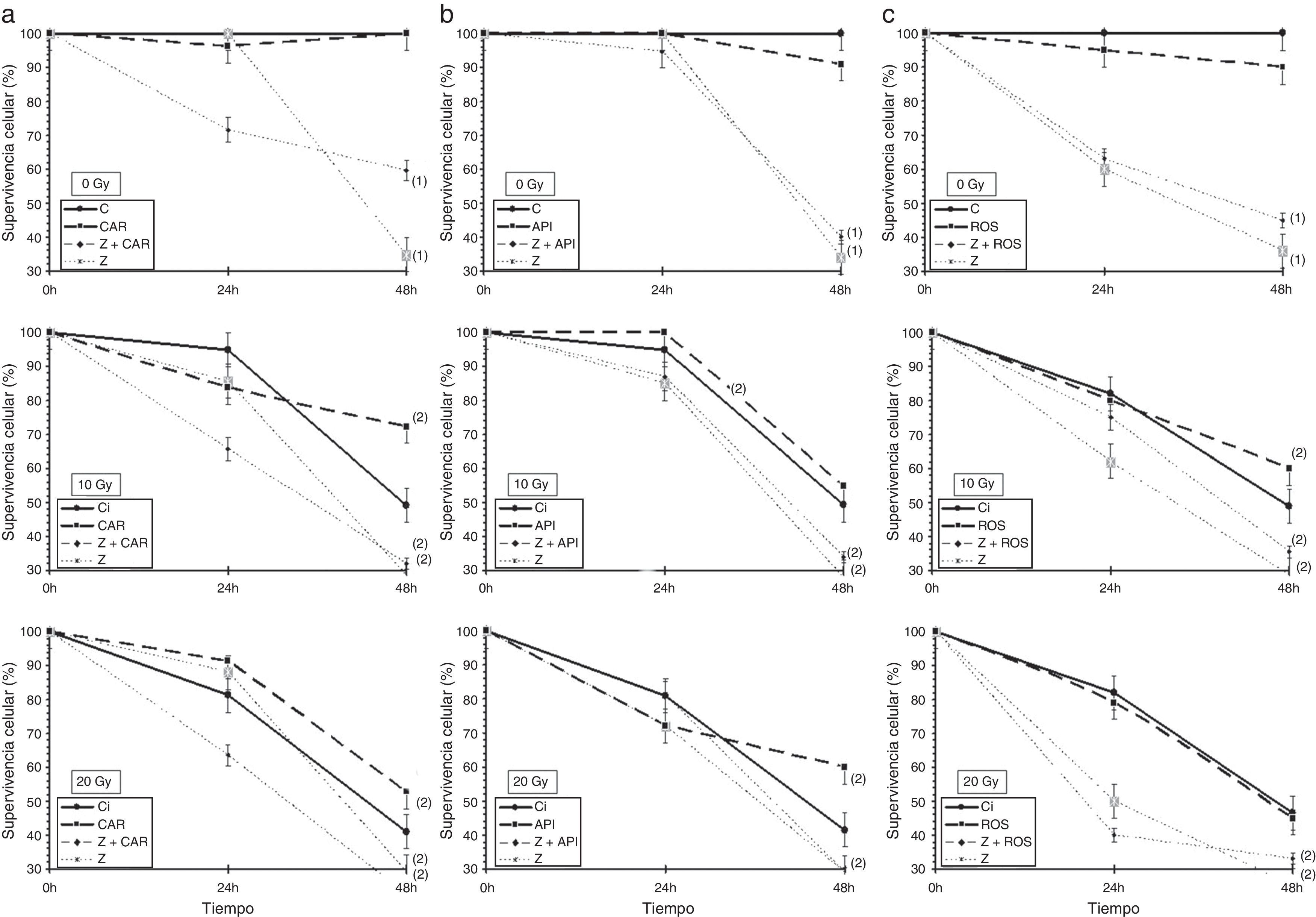
ResultadosLa administración tanto de Z como de rayos X produce la disminución significativa de la supervivencia celular en ambas líneas celulares estudiadas (p<0,001), lo que expresa la capacidad citotóxica de ambos agentes. La administración conjunta de Z junto con rayos X también produce la disminución de la supervivencia celular en ambas líneas celulares, que cuantitativamente es mayor que la administración aislada de dichos agentes (p<0,001) (figs. 1 y 2).
Efecto del ácido zoledrónico sobre la supervivencia celular de las células PNT2 tras 24 y 48h de incubación en el tratamiento combinado con IR (0, 10 y 20Gy de rayos X): a) con la administración de ácido carnósico; b) con la administración de apigenina; c) con la administración de ácido rosmarínico.
Resultados mostrados como media (mas-menos pero como simbolo, no puedo indicarlo aqui) error estándar de 5 resultados independientes.
(1): p<0,001 versus control; (2): p<0,001 versus control irradiado; API: apigenina; C: control; CAR: ácido carnósico; ROS: rosmarínico; Z: 5% ácido zoledrónico.
Efecto del ácido zoledrónico sobre la supervivencia celular de las células TRAMP-C1 tras 24 y 48h de incubación en el tratamiento combinado con IR (0, 10 y 20Gy de rayos X): a) con la administración de ácido carnósico; b) con la administración de apigenina; c) con la administración de ácido rosmarínico.
Resultados mostrados como media (mas-menos pero como simbolo, no puedo indicarlo aqui) error estándar de 5 resultados independientes.
(1): p<0,001 versus control; (2): p<0,001 versus control irradiado; API: apigenina; C: control; CAR: ácido carnósico; ROS: ácido rosmarínico; Z: 5% ácido zoledrónico.
En las células PNT2, la administración del ácido carnósico a los cultivos celulares produce una disminución significativa de la supervivencia celular respecto a las células controles (p<0,001), y pone de manifiesto su citotoxicidad; además, protege frente al daño celular inducido por la IR, aumentado significativamente la supervivencia celular de las células irradiadas respecto a las células controles no irradiadas (p<0,001), pero no presenta diferencias significativas en las células tratadas con Z solo o en combinación con rayos X (fig. 1a).
La administración de apigenina no presenta toxicidad alguna sobre las células PNT2 tratadas y consigue también proteger frente al daño inducido por los rayos X, incrementando significativamente su supervivencia celular (p<0,001), pero tampoco muestra diferencias significativas en la supervivencia celular cuando se administra con Z solo o en combinación con rayos X (fig. 1b).
La administración de ácido rosmarínico a las concentraciones ensayadas tampoco presenta citotoxicidad respecto a las células no tratadas; también aumenta la supervivencia celular en los cultivos irradiados respecto a los controles no irradiados como expresión de su capacidad radioprotectora (p<0,001). Tampoco muestra diferencias significativas en la supervivencia celular cuando se administra conjuntamente con Z solo o en combinación con rayos X (fig. 1c).
En las células TRAMP-C1, la administración del ácido carnósico a los cultivos celulares no presenta diferencias significativas en la supervivencia celular respecto a las células tumorales controles, lo que expresa la ausencia de efecto citotóxico sobre ellas; sin embargo, cuando se añade al tratamiento con Z aumenta significativamente la supervivencia celular de las células TRAMP-C1 tratadas (p<0,001), como expresión de la disminución del efecto citotóxico que el Z presenta ahora sobre las células tumorales. El ácido carnósico también protege del daño celular inducido por los rayos X, al aumentar la supervivencia celular de las células tumorales tratadas con ácido carnósico e irradiadas, respecto a las células tumorales irradiadas (p<0,001). Con las dosis de rayos X más elevadas (20Gy), la administración conjunta de Z más ácido carnósico también muestra un incremento de supervivencia celular respecto a las células tratadas con Z solo (p<0,001) (fig. 1a).
La administración de apigenina no presenta toxicidad alguna sobre las células tumorales tratadas y también protege frente al daño inducido por los rayos X sobre estas células tumorales (p<0,001); sin embargo, con la menor de las dosis de rayos X administradas (10Gy) se determina un incremento de la supervivencia celular en las células tratadas con Z y apigenina respecto a la supervivencia obtenida con el tratamiento de Z solo (p<0,001) (fig. 2b).
La administración de ácido rosmarínico a las concentraciones ensayadas no muestra diferencias significativas con los cultivos tumorales controles, por lo que tampoco presenta citotoxicidad en estas células; aunque aumenta la supervivencia en las células tumorales irradiadas con dosis bajas de rayos X (10Gy) (p<0,001). Sin embargo, en los cultivos irradiados se determina un incremento de la supervivencia celular en las células tumorales tratadas conjuntamente con ácido rosmarínico y Z en comparación con las tratadas solo con Z (p<0,001) (fig. 2c).
DiscusiónNuestro estudio muestra el efecto citotóxico, dependiente de la dosis y del tiempo, del Z en células PNT2 y TRAMP-C1 in vitro. De igual forma, hemos determinado que la administración de Z combinado con un antioxidante puede reducir el estrés oxidativo provocado, disminuyendo así el efecto citotóxico inducido por el Z17. En este sentido, nuestros resultados confirmarían los estudios previos que describen que el Z puede inhibir el crecimiento celular en diferentes células tumorales10–12. Nuestros resultados también muestran una respuesta dosis-dependiente del efecto citotóxico inducido por la IR en las células PNT2 y en las TRAMP-C1, que también ha sido descrita previamente por diferentes autores10–12. Además, también hemos determinado que la administración combinada de Z más IR reduce significativamente la supervivencia en todas las líneas celulares de forma más intensa que los tratamientos aislados de dichos agentes.
Previamente, habíamos descrito efectos sinérgicos entre el Z y la IR que parecen caracterizar al Z con las características de un radiosensibilizante químico muy poderoso18. Otros autores también han señalado un efecto aditivo o sinérgico del Z en combinación con IR en varias líneas tumorales de mama y pulmón11,12, y han recomendado la reducción de la dosis de radioterapia en pacientes oncológicos afectados por estas enfermedades.
El mecanismo sinérgico de Z y IR es actualmente desconocido11. Se ha propuesto que la capacidad de Z para detener las células en la fase G2M o para prolongar la progresión del ciclo celular plantea la posibilidad del Z como un potencial sensibilizador del ciclo celular porque las fases G2 y M son más sensibles que las células dentro de otras fases del ciclo celular11,19, con el aumento de susceptibilidad a la apoptosis de estas células11,20. A pesar de que cualquier agente de radiosensibilización requiere que las células progresen a través del ciclo celular y de su acumulación en la fase G2M, algunos estudios muestran que la apoptosis es un factor de predicción de radiosensibilización. Estos estudios11,20 señalan que la acumulación de células en una fase del ciclo celular sensible a la radiación no confiere automáticamente una mayor sensibilidad a la radiación11. Este sensibilizante también podría deberse a un bloqueo de la señalización de Ras mediante el agotamiento de las reservas celulares de tanto geranilteranil pirofosfato y farnesilpirofosfato11.
Sin embargo, todo lo anterior es compatible con un mecanismo celular de radiosensibilización clásico que el Z podría provocar en las células tratadas. Karabulunt et al. (2010)20 describen que la administración in vivo de Z produce una reducción significativa del glutatión intracelular (GSH) y de la enzima antioxidante gammaglutamato cisteína; un aumento de nitritos y nitratos, que son los productos finales del óxido nítrico, y un aumento significativo de malondialdehído (MDA). Los autores señalan que la administración de Z induce estrés oxidativo en el hígado y disminuye los niveles de antioxidantes intracelulares endógenos, por lo que junto con la administración de Z podría ser clínicamente útil combinarlos con suplementos externos de antioxidantes20.
Todos los efectos descritos son inducidos por la IR y, al administrarse conjuntamente con Z, podrían potenciarse y poner de manifiesto un posible mecanismo que explicaría este efecto radiosensibilizador del Z: a) ambos agentes incrementan el MDA, un producto importante de la peroxidación lipídica, que se genera como resultado de la peroxidación de los ácidos grasos que contienen 3 o más dobles enlaces. El MDA puede reaccionar con las bases de nitrógeno del ADN y es considerado mutagénico, genotóxico y carcionogénico para los cultivos celulares20,21. Esto explicaría el aumento de la citotoxicidad y genotoxicidad observada en nuestro estudio; b) ambos agentes incrementan las especies reactivas derivadas de óxido nítrico y del oxígeno que inhiben las enzimas, fragmentan el ADN, modifican las bases, destruyen los lípidos de membrana y consumen antioxidantes endógenos intracelulares20,22, lo que explicaría el efecto más intenso observado en los tratamientos combinados de Z+IR; c) ambos agentes disminuyen el GSH, el tiol intracelular más importante, que se considera como el radioprotector endógeno por su capacidad para actuar como un nucleófilo en un importante número de reacciones de destoxificación23,24. En radiobiología, la disminución del nivel intracelular de GSH aumenta la sensibilidad a los efectos citotóxicos de la IR, que explica el efecto clásico del mayor radiosensibilizador utilizado en clínica, el cisplatino24, y podría explicar el efecto radiosensibilizador del Z al actuar de una manera similar en los tratamientos combinados con rayos X. En definitiva, los mecanismos de acción descritos en el estrés oxidativo y la formación de radicales libres con la disminución de los niveles endógenos de antioxidantes son mecanismos similares que potenciarían el efecto citotóxico del tratamiento conjunto de Z más IR.
En la actualidad, la capacidad de diferentes sustancias para prevenir el daño citotóxico inducido por la IR se mide en términos de su capacidad para inhibir la actividad de producción de radicales libres. Los efectos antitóxicos son directamente proporcionales a la capacidad antioxidante de las sustancias, aunque también dependen de sus características de biodisponibilidad en el medio biológico25,26. Las sustancias que hemos ensayado son radioprotectores conocidos, cuyo mecanismo de acción consiste en la eliminación de los radicales libres inducidos por IR y la disminución del estrés oxidativo celular25–27.
Los mecanismos de acción que hemos descrito anteriormente implican la inducción de estrés oxidativo intracelular y la formación de radicales libres con una disminución de los niveles endógenos de antioxidantes y que son similares en el Z y en la IR12,28. Los antioxidantes que hemos administrado en nuestro estudio eliminan los radicales libres inducidos durante el tratamiento y actúan como complemento de los niveles de antioxidantes exógenos para reducir el estrés oxidativo celular.
Nuestro estudio muestra que, en todas las células (no tumorales y tumorales de próstata), la administración de antioxidante en el tratamiento combinado con IR+Z proporciona un mayor nivel de protección a las células normales que en las TRAMP-C1 tumorales. Nuestros resultados indican que si el mecanismo de la quimioterapia o el daño celular inducido por RT es a través de la producción de estrés oxidativo con un aumento de los radicales libres, la coadministración de antioxidantes para minimizar el efecto tóxico es evidente, pero este tratamiento también puede conllevar la reducción del efecto tóxico de estos radicales libres en las células tumorales. Tal vez por esta razón, en la actualidad, muchos autores se muestran contrarios a una suplementación indiscriminada de antioxidantes para pacientes oncológicos tratados mediante RT o quimioterapia, ya que han correlacionado un descenso de supervivencia global y el aumento en la recurrencia tumoral en estos pacientes29.
En conclusión, la administración de una sustancia antioxidante junto con un bisfosfonato como el Z produce una disminución mayor de sus efectos tóxicos en las células no tumorales que en las células tumorales y podría ser utilizado en el tratamiento de enfermedades no tumorales. Sin embargo, en un tratamiento combinado con IR, el suplemento antioxidante puede proteger tanto o más a la célula tumoral (TRAMP-C1) que a las células normales (PNT2), disminuyendo así el efecto citotóxico deseado en el tratamiento con IR.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.